文章信息
- 熊娟, 杨成峰, 陈鑫蕊, 汪明霞, 谭文峰
- XIONG Juan, YANG Cheng-feng, CHEN Xin-rui, WANG Ming-xia, TAN Wen-feng
- 氧化铁/水界面Cd吸附研究:CD-MUSIC模型模拟
- The adsorption of Cd to iron oxide/water interface: The CD-MUSIC modeling
- 农业环境科学学报, 2018, 37(7): 1362-1369
- Journal of Agro-Environment Science, 2018, 37(7): 1362-1369
- http://dx.doi.org/10.11654/jaes.2018-0596
文章历史
- 收稿日期: 2018-05-07
- 录用日期: 2018-05-23
镉(Cd)是对人体危害最大的五种重金属元素之一, 常通过污水灌溉、农药化肥施用和大气沉降等人为活动进入土壤[1], 进而通过吸附络合、溶解沉淀等多种反应, 以不同化学形态存在于土壤中。Cd在土壤中的移动性强, 极易在农作物中富集而进入食物链, 威胁人类健康[2-3]。据报道, 我国Cd污染土壤涉及11个省市的25个地区, 仅耕地污染就高达530万hm2[4]。水稻是中国的主要粮食作物之一, 由于我国南方酸性红壤地区受到不同程度Cd污染, 导致近年"镉米"事件频发[5]。
铁氧化物是南方酸性土壤中广泛存在、含量丰富的金属氧化物, 包括水铁矿、针铁矿、赤铁矿、磁铁矿和纤铁矿等。其中针铁矿分布最广泛, 赤铁矿最稳定[6]。氧化铁表面具有大量活性位点和可变电荷, 吸附容量大, 常与Cd形成内圈络合物, 而固定土壤中的Cd[7]。扩展X射线精细结构光谱(EXAFS)表明, Cd主要与氧化铁表面位点形成双齿内圈络合物[8-10]。明确Cd在不同氧化物表面的吸附行为和形态分布特征, 是理解南方酸性土壤中Cd的环境行为的关键。
Cd在氧化铁上的吸附行为和形态分布除与氧化铁理化性质密切相关外, 更依赖于外界环境条件的变化, 且形态分布分析在多数实验室难以实现[11]。表面络合模型, 如电荷分布-多位点络合(CD-MU- SIC)模型不但能描述氧化铁表面的吸附行为和离子形态分布, 还能预测环境条件改变下离子形态的响应特征[7, 12-14]。CD-MUSIC模型已被广泛应用于针铁矿表面Pb2+、Cd2+[7, 15]等阳离子、PO43-、AsO43-、CO3-2[14, 16-17]等阴离子和小分子有机酸[18]的吸附行为、机制等的研究, 并逐渐用于水铁矿、赤铁矿等与无机离子的相互作用等研究领域[19-20]。赤铁矿与针铁矿相比形貌不同, 晶面组成差异也较大, 因而赤铁矿离子吸附的CD-MUSIC模型相关晶体形貌学的物理参数与针铁矿也存在差异。构建赤铁矿吸附Cd的CD-MUSIC模型, 可为深入研究赤铁矿对Cd的吸附特征和机制提供理论支持, 拓展该模型在土壤体系中的应用。
本研究以土壤中常见的针铁矿和赤铁矿为对象, 通过pH边吸附实验明确pH、Cd浓度等环境介质条件对Cd吸附行为的影响, 构建Cd在氧化铁/水界面吸附的CD-MUSIC模型, 揭示不同类型氧化铁Cd吸附差异的原因, 探讨氧化铁表面Cd吸附机制和形态分布特征。运用构建的CD-MUSIC模型模拟不同针/赤比土壤中氧化铁的Cd固定特征以及对环境介质条件变化的响应, 为抑制南方酸性水稻土中Cd的迁移性与生物毒性, 制定有效的修复措施提供理论依据。
1 材料与方法 1.1 氧化铁制备 1.1.1 针铁矿将180 mL 5 mol·L-1 KOH溶液与100 mL 1 mol· L-1 Fe(NO3)3·9H2O溶液在塑料瓶中混合, 并用蒸馏水将其稀释至2 L, 此时悬浮液pH约为12.4。密闭塑料瓶, 70℃下老化3 d, 冷却至室温后离心, 超纯水清洗样品至电导率小于10 μS·cm-1, 冷冻干燥, 过100目筛, 干燥器中储存备用。
1.1.2 赤铁矿分别将500 mL 0.1 mol·L-1 Fe(NO3)3溶液、300 mL 1 mol·L-1 KOH溶液加热到90℃后, 倒入1 L大白瓶中混合均匀, 并置于磁力搅拌器上搅拌。继续添加50 mL 1 mol·L-1 NaHCO3, 均匀混合后, 90℃下老化4 d, 冷却至室温后离心, 超纯水清洗样品至电导率小于10 μS·cm-1, 冷冻干燥, 过100目筛, 干燥器中储存备用。
1.2 性质表征X射线衍射仪(Bruker D8 Advance)鉴定合成氧化铁类型, 制样方法为粉末压片法。扫描电子显微镜(JSM-6390)观察氧化铁形貌。全自动比表面积分析仪(Autosorb-1, Quantachrom)测定氧化铁比表面积(SSA), 测定方法是BET-N2法。
1.3 吸附实验pH边吸附实验研究离子强度0.01 mol·L-1时, pH、Cd浓度对氧化铁Cd吸附的影响, 具体步骤为: (1)将10 g·L-1氧化铁悬浮液置于磁力搅拌器上, 通入高纯N2(>99.999%) 1 h以去除CO2的影响。分别向两组离心管中加入4 mL和10 mL针铁矿与赤铁矿悬浮液、2 mL 0.1 mol·L-1的KNO3溶液、适量已知浓度的Cd(NO3)2溶液和超纯水, 使悬浮液总体积为20 mL。此时, 反应体系氧化铁浓度为2 g·L-1(针铁矿)和5 g· L-1(赤铁矿), 离子强度为0.01 mol·L-1, Cd浓度为0.1、0.2 mmol·L-1(针铁矿)和0.003、0.01、0.03、0.1 mmol· L-1(赤铁矿)。(2)用0.01、0.1 mol·L-1 HNO3和KOH调节悬浮液pH为3.0~9.0, 准确记录消耗的酸碱体积, 并往悬浮液中再次通入高纯N2 10 min。密封离心管, 置于摇床上反应72 h, 反应期间多次用KOH或HNO3溶液调节悬浮液pH至初始设定值。(3)反应结束后, 测定悬浮液pH, 并以测定值作为反应最终pH。悬浮液以12 000 r·min-1转速离心15 min, 上清液过0.22 μm滤膜, 等离子体吸收光谱(ICP)(Vista - mpx, Varian)测定上清液中Cd的浓度。
1.4 CD-MUSIC模型本研究采用CD-MUSIC模型[12-13]模拟Cd在氧化铁/水界面的吸附行为及形态分布特征, 拟合所用软件是ECOSAT[21]。CD-MUSIC模型以针铁矿、赤铁矿的晶体形貌学特征和固/液界面的静电特征为基础, 既考虑了表面位点的多样性和异质性, 也考虑了被吸附离子的空间分布, 拟合不同条件下氧化铁的Cd吸附行为, 分析Cd形态分布特征, 揭示吸附机制。
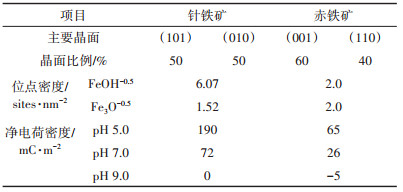
1.4.1 氧化铁表面性质根据与O原子配位Fe原子个数的差异, 将氧化铁表面位点分为三类, 分别是FeOH-0.5、Fe2OH0和Fe3H-0.5, 其中Fe2OH0电荷量为0, 视为惰性位点。不同类型氧化铁组成晶面不同, 表面位点密度也就不同(表 1)。本研究供试针铁矿(101)面和(010)面为主要等效晶面, 其对SSA的贡献分别为50%和50%; FeOH-0.5和Fe3H-0.5的位点密度分别为6.07 sites·nm-2和1.52 sites · nm-2[22]。赤铁矿的主要等效晶面是(001)面和(110)面, 对SSA的贡献分别是60%和40%[23]。其中, (001)面只有Fe2OH0, 是惰性晶面。因此, 赤铁矿活性位点来源于(110)面, FeOH-0.5和Fe3H-0.5的位点密度均为2.0 sites·nm-2[24]。由此可见, 针铁矿与赤铁矿的主要晶面与位点密度显著不同, 不同pH时表面电荷密度相差明显。当pH 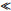
|
随pH变化, 氧化铁表面位点发生质子化或去质子化反应而表面带可变电荷, 其被溶液中的反电荷离子中和, 从而在氧化铁/水界面形成扩散双电层(DDL), 在CD-MUSIC模型中常用扩展的Stern(ES)模型描述。ES模型中共包含三个静电面:氧化铁带电表面称为0-plane; 电解质离子与表面位点形成的外圈络合物位于2/d-plane; Cd在氧化铁/水界面专性吸附形成内圈络合物时, 液相端与Cd配位的O原子则位于1-plane。两两静电面构成静电层, 具有不同的静电电容, 分别为C1(0-与1-plane间), C2(1-与2/ d-plane间)和CT(0-与2/d-plane间), 三者关系如式(1)所示:
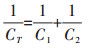 (1)
(1) 运用CD-MUSIC模型拟合氧化铁的Cd吸附数据时, C1和C2是待拟合参数[12]。
1.4.3 电荷分布CD-MUSIC模型认为内圈络合物不是点电荷, 而是具有一定体积的。当络合物在DDL中位置确定时, 所带电荷的空间分布亦能确定。Cd在氧化铁/水界面吸附时, Cd能与表面位点的O原子和溶液中水来源的O原子配位, 所带电荷分配给配位O原子。Cd分配给界面O原子电荷位于0-plane上, 其占比例为电荷分配因子, 用f表示, 剩余电荷(1-f)位于1-plane上。在氧化铁吸附Cd的CD-MUSIC模型拟合时, f是待优化参数[12]。
2 结果与分析 2.1 性质表征图 1是供试针铁矿和赤铁矿的X射线衍射图谱。由图 1可知, 合成样品结晶良好, 其系列衍射峰与α- FeOOH和α-Fe2O3特征衍射峰一致, 且未出现其他物相衍射峰, 说明合成产物是纯相的针铁矿和赤铁矿。
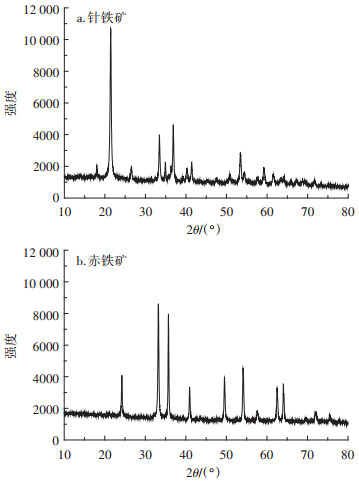
|
| 图 1 针铁矿和赤铁矿的XRD图谱 Figure 1 The XRD pattern of goethite and hematite |
图 2为供试针铁矿和赤铁矿的SEM图。由图 2可知, 供试氧化铁均形貌均一、表面光滑。针铁矿呈细长针状, 长约1~2 μm。赤铁矿呈棱块状, 平均粒径约20 nm。供试针铁矿和赤铁矿的SSA分别是23 m2· g-1和20.5 m2·g-1, 与文献报道值相符[25-26]。

|
| 图 2 针铁矿和赤铁矿的SEM图谱 Figure 2 The SEM pictures of goethite and hematite |
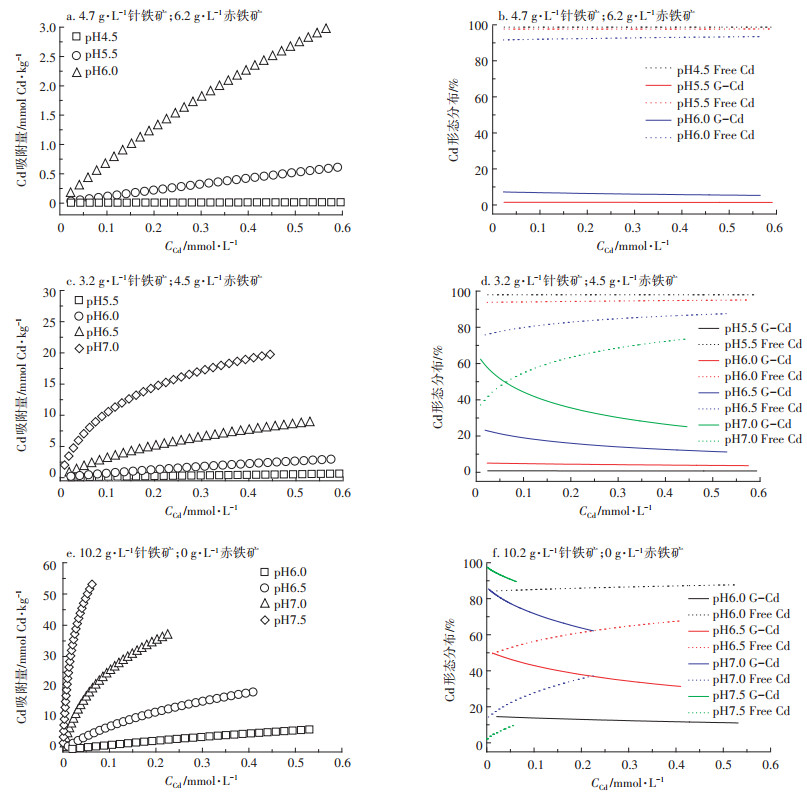
离子强度0.01 mol·L-1时, pH、Cd浓度对针铁矿、赤铁矿的Cd吸附的影响分别如图 3所示。pH较低(针铁矿:pH < 6.5;赤铁矿:pH < 7.0)时, 氧化铁表面位点以质子化为主, 带正电荷的表面位点与Cd相互排斥, 氧化铁表面几乎不吸附Cd。随pH升高, 氧化铁表面位点逐渐去质子化, 带负电荷的位点数增多, 二者之间静电斥力减小, 氧化铁的Cd吸附量和吸附密度均增大。随Cd浓度增大, 氧化铁的Cd吸附量和吸附密度增大。
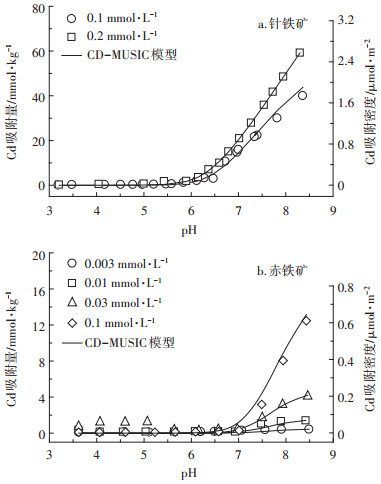
|
| 图 3 氧化铁的Cd吸附 Figure 3 The adsorption of Cd on goethite and hematite |
比较图 3a和图 3b可知, Cd在针铁矿/水界面的吸附量和吸附密度远高于赤铁矿。pH(8.5±0.1)时, 针铁矿Cd的饱和吸附量约60 mmol·kg-1, 是赤铁矿的4.6倍(13 mmol·kg-1); 吸附密度约2.6 μmol·m-2, 是赤铁矿的4.3倍(0.6 μmol·m-2)。Cd吸附密度与氧化铁表面位点密度密切相关。由表 1可知, 针铁矿表面位点密度是7.59 sites·nm-2, 是赤铁矿的1.9倍(4 sites· nm-2), 且针铁矿上Cd的主要吸附位点FeOH-0.5的密度(6.07 sites·nm-2)远高于赤铁矿(2.0 sites·nm-2), 与二者吸附密度差异相符。pH < 7.0时, 针铁矿表面净正电荷密度远高于赤铁矿, pH 9.0时与赤铁矿相近。但是, 针铁矿Cd吸附量急剧增加发生在pH 6.0, 反而小于赤铁矿(pH 7.0)。这是由于FeOH-0.5的平均质子解离常数在7.0~8.0之间, pH 6.0~7.0时部分FeOH-0.5去质子化。针铁矿表面FeOH-0.5的位点密度(6.07 sites·nm-2)远高于赤铁矿(2.0 sites·nm-2), pH 6.0~7.0时其具有更多带负电荷的表面位点, 能吸附更多的Cd。
2.3 CD-MUSIC模型模拟Cd在氧化铁/水界面吸附时, 主要通过配位交换与表面位点形成内圈络合物。根据EXAFS等相关研究结果[8-10], CD-MUSIC模型认为Cd主要以(FeOH)2Cd+1、(FeOH)2CdOH0两种形态吸附在氧化铁表面, 反应方程式如式(2)和式(3)所示:
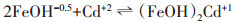 (2)
(2) 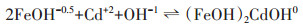 (3)
(3) 氧化铁Cd吸附的CD-MUSIC模型模拟如图 3 (实线)所示, 拟合参数如表 2所示。表面位点质子化时, 质子所带电荷全部位于1-plane上, 亲和常数与氧化铁电荷零点相同。Cd在氧化铁/水界面吸附时, 电荷分配因子是0.55;以式(3)反应吸附时, 羟基电荷位于1-plane上。拟合结果表明, CD-MUSIC模型能准确描述氧化铁表面Cd的吸附行为。针铁矿表面位点的Cd亲和常数(lgKCd)分别是7.3和12.8, 赤铁矿分别是6.1和11.0, 与文献报道值相近[27]。
|
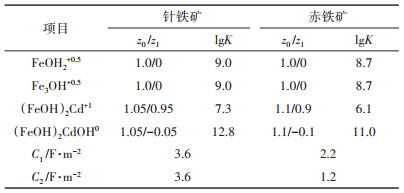
将拟合的CD-MUSIC模型参数重新输入ECOSAT中, 可计算Cd的形态分布特征(图 4)。结果表明Cd主要以(FeOH)2Cd+1和(FeOH)2CdOH0两种形态吸附在氧化铁表面。pH 5.0时, 几乎100%的Cd以(FeOH)2Cd+1形态吸附在氧化铁表面; 随pH升高, (FeOH)2Cd+1所占比例逐渐减少, (FeOH)2CdOH0所占比例增大。Cd浓度对氧化铁表面Cd形态分布的影响不显著。pH 5.0和7.0时, 针铁矿的Cd形态分布与赤铁矿相似, (FeOH)2Cd+1是主要吸附形态。pH 9.0时, 超过80%的Cd以(FeOH)2CdOH0形态吸附在针铁矿表面, 且Cd浓度不影响Cd的形态分布。赤铁矿表面, Cd浓度较低时, (FeOH)2Cd+1是主要的吸附形态。随Cd浓度增大, (FeOH)2Cd+1所占比例减小, (FeOH)2CdOH0所占比例增大, 二者比例逐渐趋于相等(50%)。当Cd浓度约为0.1 mmol · L-1时, (FeOH)2CdOH0所占比例稍高于(FeOH)2Cd+1。
|
| 图 4 氧化铁表面Cd的形态分布 Figure 4 The speciation distribution of Cd for goethite and hematite |
已有研究表明, 水稻土中氧化物结合态是Cd的主要存在方式[28]。氧化铁在南方酸性水稻土中广泛分布且含量丰富, 但其类型和含量与温度、降水等密切相关。已有研究表明, 由南向北, 随温度降低、降雨量减少, 土壤风化程度减弱, 土壤pH逐渐升高, 赤铁矿含量减少, 针铁矿含量增加[29]。土壤组成和环境介质条件的变化会直接影响Cd的吸附行为、机制和形态分布[28]。运用CD-MUSIC模型模拟不同类型土壤和介质环境条件(表 3), 预测分析氧化铁对酸性水稻土中Cd活性的影响, 如图 5所示。
|
| G-Cd:针铁矿吸附的Cd; Free Cd:未被吸附处于溶液中的Cd G-Cd:Goethite-Cd; Free Cd:Cd in solution 图 5 不同水稻土中氧化铁Cd吸附行为(a:砖红壤; c:棕红壤; e:黄棕壤)和形态分布(b:砖红壤; d:棕红壤; f:黄棕壤)的CD-MUSIC模型预测 Figure 5 The prediction of the CD-MUSIC model for the Cd adsorption(a:latosol; c:brown red soil; e:yellow-brown soil)to the iron oxides and the speciation distribution(b:latosol; d:brown red soil; f:yellow-brown soil)in different soil |
从表 3可知, 本研究选择的砖红壤和棕红壤中针/赤比相似, 而黄棕壤中的针/赤比是1, 即赤铁矿含量为0。由南向北, pH逐渐升高, 即砖红壤 < 棕红壤 < 黄棕壤。当土壤受相同程度Cd污染时, CD-MUSIC模型预测表明砖红壤和棕红壤中氧化铁Cd的吸附量远低于黄棕壤(图 5a、图 5c和图 5e, 红色点)。形态分析结果表明, 砖红壤和棕红壤中赤铁矿对Cd的固定无贡献, 极少量的Cd(< 1%)固定在针铁矿表面, 氧化铁几乎不固定Cd。棕黄壤中, 氧化铁对Cd的固定具有重要作用。随着Cd浓度升高, 氧化铁对Cd的固定趋于饱和, 对Cd固定的贡献逐渐减小。
比较不同土壤类型pH 6.0时Cd的吸附行为可知, 氧化铁对Cd的固定相似, 且主要吸附在针铁矿表面, 说明土壤pH < 6.0时赤铁矿含量和针/赤几乎不影响氧化铁对Cd的固定(图 5a、图 5c和图 5e, 蓝色点)。当土壤pH升高, 土壤氧化铁对Cd的固定随之增多, pH>6.0时尤为显著。CD-MUSIC模型形态分析结果表明, 随pH升高, Cd在氧化铁上的吸附增多, 氧化铁固定的Cd主要吸附在针铁矿表面, 赤铁矿对Cd的固定无贡献。由此可知, 土壤中随针铁矿含量增多, 相同环境介质条件下氧化铁对Cd的固定增多。如图 5f所示, pH 6.0时黄棕壤中氧化铁能固定>15%的Cd, 而砖红壤和棕红壤中氧化铁固定的Cd < 1%。综上所述可知, 强酸性的砖红壤和棕红壤中氧化铁对Cd固定的贡献量极小, 黄棕壤中氧化铁能固定较多的Cd。氧化铁固定Cd时, Cd优先吸附在针铁矿表面, 赤铁矿不吸附Cd, 赤铁矿含量和针/赤不影响Cd的固定。pH显著促进氧化铁对Cd的固定, 调节土壤pH是降低土壤Cd活性的有效手段之一。但是, 砖红壤和棕红壤pH较低, 调节pH难以达到预期目的。棕黄壤pH较高, 且针铁矿占比显著高于前二者, 调节pH能急剧降低Cd的活性。
4 结论(1) 氧化铁对Cd的吸附量与吸附密度均随pH升高而升高, 随Pb浓度增大而显著增大。针铁矿表面位点密度是赤铁矿的1.9倍, Cd在针铁矿/水界面的吸附量和吸附密度远高于赤铁矿。
(2) CD-MUSIC模型能够准确模拟Cd在氧化铁/水界面的吸附行为, Cd主要以(FeOH)2Cd+1和(FeOH)2 CdOH0两种形态吸附在氧化铁表面。
(3) pH对Cd形态分布的影响显著, pH < 7.0时, 针铁矿与赤铁矿的Cd形态分布相似, (FeOH)2Cd+1是主要吸附形态; 随pH升高, (FeOH)2CdOH0占比显著增大, 且其在针铁矿中的比例远高于赤铁矿。Cd浓度几乎不影响Cd在氧化铁表面的形态分布。
(4) 强酸性土壤中氧化铁不固定Cd; 弱酸性土壤氧化铁固定较多的Cd, Cd优先吸附在针铁矿表面, 赤铁矿不影响Cd的固定, 调节pH显著促进Cd的固定。
| [1] |
葛芳芳, 王学锋, 付卫静, 等. 我国农耕土壤Cd污染与植物修复现状[J]. 环境保护科学, 2017, 43(5): 105-110. GE Fang-fang, WANG Xue-feng, FU Wei-jing, et al. A review of cadmium polluted agricultural soils and phytoremediation in China[J]. Journal of Environmental Protection Science, 2017, 43(5): 105-110. |
| [2] |
Zhu P, Liang X X, Wang P, et al. Assessment of dietary cadmium exposure:A cross-sectional study in rural areas of south China[J]. Food Control, 2016, 62: 284-290. DOI:10.1016/j.foodcont.2015.10.046 |
| [3] |
Ke S, Cheng X Y, Zhang N, et al. Cadmium contamination of rice from various polluted areas of China and its potential risks to human health[J]. Environmental Monitoring & Assessment, 2015, 187(7): 408. |
| [4] |
刘杨, 张薇, 吉普辉, 等. 沈阳张士灌区六种蔬菜的Cd污染[J]. 生态学杂志, 2011, 30(6): 1229-1233. LIU Yang, ZHANG Wei, JI Pu-hui, et al. Cd pollution of six vegetables in Zhangshi irrigation district of Shenyang[J]. Journal of Ecology, 2011, 30(6): 1229-1233. |
| [5] |
Hu Y, Cheng H, Tao S. The challenges and solutions for cadmium contaminated rice in China:A critical review[J]. Environment International, 2016, 92/93: 515-532. DOI:10.1016/j.envint.2016.04.042 |
| [6] |
李学垣. 土壤化学[M]. 北京: 高等教育出版社, 2001, 55-99. LI Xue -yuan. Soil chemistry[M]. Beijing: Higher Education Press, 2001, 55-99. |
| [7] |
Venema P, Hiemstra T, Van Riemsdijk W H. Multisite adsorption of cadmium on goethite[J]. Journal of Colloid and Interface Science, 1996, 183(2): 515-527. DOI:10.1006/jcis.1996.0575 |
| [8] |
Spadini L, Manceau A, Schindler P W, et al. Structure and stability of Cd2+ surface complexes on ferric oxides:1. Results from EXAFS spectroscopy[J]. Journal of Colloid and Interface Science, 1994, 168(1): 73-86. DOI:10.1006/jcis.1994.1395 |
| [9] |
Collins C R, Ragnarsdottir K V, Sherman D M. Effect of inorganic and organic ligands on the mechanism of cadmium sorption to goethite[J]. Geochimica Et Cosmochimica Acta, 1999, 63(19): 2989-3002. |
| [10] |
Randall S R, Sherman D M, Ragnarsdottir K V, et al. The mechanism of cadmium surface complexation on iron oxyhydroxide minerals[J]. Geo-chimica Et Cosmochimica Acta, 1999, 63(19/20): 2971-2987. |
| [11] |
Mota A M, Correia dos Santos M M. Trace metal speciation of labile chemical species in natural waters:Electrochemical methods[M]. Metal speciation and bioavailability in aquatic systems, Chichester: John Wiley & Sons, 1995, 205-258.
|
| [12] |
Hiemstra T, Van Riemsdijk W H. A surface structural approach to ion adsorption:The charge distribution(CD)model[J]. Journal of Colloid and Interface Science, 1996, 179(2): 488-508. DOI:10.1006/jcis.1996.0242 |
| [13] |
Hiemstra T, Venema P, Van Riemsdijk W H. Intrinsic proton affinity of reactive surface groups of metal(Hydr)oxides:The bond valence principle[J]. Journal of Colloid and Interface Science, 1996, 184(2): 680-692. DOI:10.1006/jcis.1996.0666 |
| [14] |
Antelo J, Avena M, Fiol S, et al. Effects of pH and ionic strength on the adsorption of phosphate and arsenate at the goethite-water interface[J]. Journal of Colloid and Interface Science, 2005, 285(2): 476-486. DOI:10.1016/j.jcis.2004.12.032 |
| [15] |
谈波. 针铁矿、赤铁矿对铅的吸附及其CD-MUSIC模型拟合[D]. 武汉: 华中农业大学, 2012. TAN Bo. The adsorption of Pb binding to the goethite and hematitle with the CD-MUSIC modeling[D]. Wuhan: Huazhong Agricultural University, 2012. |
| [16] |
Hiemstra T, Barnett M O, Van Riemsdijk W H. Interaction of silicic acid with goethite[J]. Journal of Colloid and Interface Science, 2007, 310(1): 8-17. DOI:10.1016/j.jcis.2007.01.065 |
| [17] |
Hiemstra T, Rahnemaie R, Van Riemsdijk W H. Surface complexation of carbonate on goethite:IR spectroscopy, structure and charge distribution[J]. Journal of Colloid and Interface Science, 2004, 278(2): 282-290. DOI:10.1016/j.jcis.2004.06.014 |
| [18] |
Filius J D, Hiemstra T, Van Riemsdijk W H. Adsorption of small weak organic acids on goethite:Modeling of mechanisms[J]. Journal of Colloid and Interface Science, 1997, 195(2): 368-380. DOI:10.1006/jcis.1997.5152 |
| [19] |
Gustafsson J P, Tiberg C, Edkymish A, et al. Modelling lead(Ⅱ)sorption to ferrihydrite and soil organic matter[J]. Environment Chemistry, 2011, 8(5): 485-492. DOI:10.1071/EN11025 |
| [20] |
Tiberg C, Sjostedt C, Persson I, et al. Phosphate effects on copper(Ⅱ) and lead(Ⅱ)sorption to ferrihydrite[J]. Geochimica Et Cosmochimica Acta, 2013, 120(120): 140-157. |
| [21] |
Keizer M, Van Riemsdijk W H. ECOSAT[Z]. Department of environmental science, subdepartment soil science and plant nutrition. Wageningen, The Netherlands: Wageningen Agricultural University, 1998.
|
| [22] |
Lützenkirchen J, Boily J F, Gunneriusson L, et al. Protonation of different goethite surfaces:Unified models for NaNO3 and NaCl media[J]. Journal of Colloid and Interface Science, 2008, 317(1): 155-165. DOI:10.1016/j.jcis.2007.08.055 |
| [23] |
Barrón V, Torrent J. Surface hydroxyl configuration of various crystal faces of hematite and goethite[J]. Journal of Colloid and Interface Science, 1996, 177(2): 407-410. DOI:10.1006/jcis.1996.0051 |
| [24] |
Venema P, Hiemstra T, Weidler P G, et al. Intrinsic proton affinity of reactive surface groups of metal(Hydr) oxides:Application to iron (Hydr)oxides[J]. Journal of Colloid and Interface Science, 1998, 198(2): 282-295. DOI:10.1006/jcis.1997.5245 |
| [25] |
Schwertmann U, Friedl J, Stanjek H. From Fe(Ⅲ)ions to ferrihydrite and then to hematite[J]. Journal of Colloid and Interface Science, 1999, 209(1): 215-223. DOI:10.1006/jcis.1998.5899 |
| [26] |
Boily J F, Lützenkirchen J, Balmès O, et al. Modeling proton binding at the goethite(α-FeOOH)-water interface[J]. Colloids and Surfaces A Physicochemical & Engineering Aspects, 2001, 179(1): 11-27. |
| [27] |
Ponthieu M, Juillot F, Hiemstra T, et al. Metal ion binding to iron oxides[J]. Geochimica Et Cosmochimica Acta, 2006, 70(11): 2679-2698. DOI:10.1016/j.gca.2006.02.021 |
| [28] |
齐雁冰, 黄标, DarilekJ L, 等. 氧化与还原条件下水稻土重金属形态特征的对比[J]. 生态环境, 2008, 17(6): 2228-2233. QI Yan-bing, HUANG Biao, Darilek J L, et al. The comparison of the metal speciation distribution of the paddy soil under the oxidizing and reducing conditions[J]. Ecology and Environment, 2008, 17(6): 2228-2233. |
| [29] |
Liu F, Xu F L, Li X Y, et al. The types of crystalline iron oxides and phosphate adsorption in soils with variable charge[J]. Pedosphere, 1994, 4(1): 36-45. |
 2018, Vol. 37
2018, Vol. 37