文章信息
- 汪鹏, 王静, 陈宏坪, 周东美, 赵方杰
- WANG Peng, WANG Jing, CHEN Hong-ping, ZHOU Dong-mei, ZHAO Fang-jie
- 我国稻田系统镉污染风险与阻控
- Cadmium risk and mitigation in paddy systems in China
- 农业环境科学学报, 2018, 37(7): 1409-1417
- Journal of Agro-Environment Science, 2018, 37(7): 1409-1417
- http://dx.doi.org/10.11654/jaes.2018-0453
文章历史
- 收稿日期: 2018-04-08
- 录用日期: 2018-04-24
2. 中国科学院南京土壤研究所, 南京 210008
2. Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China
镉(Cadmium,Cd)是人体有害元素。Chaney[1]提出了“土壤-植物屏障(Soil plant barrier)”概念,把元素在土壤-植物系统中的移动性划分为四类,Cd被划分到最高等级:即容易通过食物链对人体产生高风险的元素。Cd被国际癌症研究机构(IARC)归为人体致癌物质(第一类)[2]、被美国有毒物质与疾病登记机构(US ATSDR)列为优先控制的污染物第7位[3]。Cd在人体内滞留的半衰期长达10~33年,因此人体Cd含量有累积效应,随着年龄的增长而增加[2]。长期暴露不仅会导致不可逆的慢性肾脏疾病、骨质矿化,还与肺癌、内膜癌、膀胱癌和乳腺癌风险的增加有显著的统计学关系[4]。痛痛病,又称“疼痛病”,是1950年发生在日本富山县的世界最早的Cd中毒事件,起因主要是当地居民长期食用Cd污染稻米。
近30年工业化导致我国南方部分地区农田土壤Cd污染问题严重。据2014年全国土壤污染状况调查公报显示,我国耕地点位Cd污染超标率排在第一,高达7.0%[5]。农田土壤Cd污染已经成为普遍存在的农业环境问题。土壤Cd污染时常会导致稻米Cd含量超标,尤其在我国南方部分地区,大米Cd超标比较严重,危害农产品安全和人体健康。稻米是我国人口的主粮,稻米食用占我国人群Cd摄入量的56%[6]。鉴于Cd暴露对人体健康的风险,有必要降低人体Cd慢性暴露的风险,但是降低到何种程度,是否存在安全阈值目前并不是很明确。本文综述了人体Cd摄入量水平及主要贡献,鉴于食用大米是人体Cd摄入量的主要来源,本文重点综述了稻田系统控制稻米Cd积累的生物地球化学过程和水稻Cd积累的分子机制。并基于这些认识,提出一系列稻米Cd积累阻控的农艺和育种措施。
1 人体Cd摄入量是否存在安全阈值?国际粮农组织(FAO)和世界卫生组织(WHO)食品添加剂联合专家委员会(JECFA)早在1989年为降低人体Cd暴露风险,推荐了人体Cd的每周可耐受摄入量(Provisional tolerable weekly intake,PTWI),规定单位千克体质量每周摄入Cd不超过7 μg,相当于单位千克体质量每月不超过30 μg[7]。这个限量值的建立是基于肾脏Cd浓度为100~200 μg·g-1水平,这时对应的尿液Cd浓度(UCd)为5~10 μg·g-1肌酐(Creatinine)。然而流行病学研究结果显示,即使当UCd为2.5μg·g-1肌酐时也能导致肾脏功能受损,基于这些结果,JECFA在2010年将人体Cd每月耐受摄入量从30 μg降到每月25 μg[8]。欧洲食品安全局(EFSA)在2009年根据一项针对瑞士女性UCd与人体Cd摄入量之间关系的研究,建议PTWI应该降低到单位千克体重摄入Cd每周不超过2.5 μg,即单位体重每月不超过10.7 μg,这个值在2011年EFSA官方文件中被确认[4]。该值旨在经过50年暴露,95%的人群UCd低于1 μg·g-1肌酐[9]。许多国家人群Cd摄入量已经非常接近EFSA建议值,对于中国、日本、孟加拉等一些亚洲国家以及欧洲国家的一些Cd摄入高风险人群(如婴儿和儿童),Cd摄入量已经超过这个水平[10]。虽然EFSA推荐值旨在控制UCd低于1 μg·g-1肌酐,但仍有一些研究报道当UCd低于0.5 μg·g-1肌酐也能导致肾功能受损[11]。因此,美国有毒物质与疾病登记处(ATSDR)用UCd < 0.5 μg·g-1肌酐作为目标值,推导出的单位千克体质量每月不超过3.0 μg[12]。世界大多数国家的人群Cd摄入量都超过这个限量值[10]。近期《环境健康展望》上一篇综述比较了2004年到2009年的流行病学研究结果,也对当前Cd摄入量安全阈值的可靠性表示担忧[13]。由此可以看出,人体Cd摄入量安全阈值可能并不存在,因此人体Cd摄入量应该尽可能地降低。世界大多数国家人群都有可能正在面临着由于Cd摄入带来的健康风险。
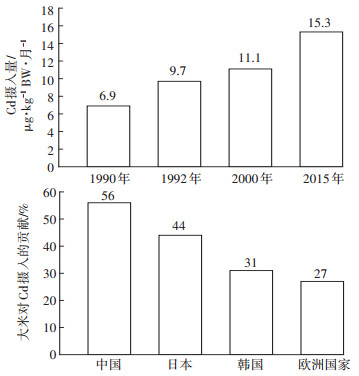
2 食用大米是我国人群Cd摄入量的主要来源我国人群Cd平均摄入量逐年递增(图 1)。Song等[6]在2015年调查了全国31个省、自治区市场上228 687份食品中Cd的浓度,根据2002年全国营养和健康调查的膳食数据,计算出了我国人群Cd平均摄入量,当前成年人单位体质量每月平均Cd摄入量为15.3μg,为JECFA 2010年推荐值的61.2%。相比于1990年我国成年人Cd摄入量(仅为6.9 μg·kg-1 BW·月-1),增加了1.2倍,年增速为0.27 μg·kg-1 BW。如果按照这个增速,预计35年后,我国人群Cd的摄入量会达到JECFA推荐值。这种趋势十分令人担忧,因此有必要采取措施来降低我国人群Cd的摄入量。
|
| 图 1 我国人群Cd平均摄入量以及大米对我国和其他国家Cd摄入量的贡献 Figure 1 Dietary Cd intake of Chinese general populations as a function of year and the contribution from consumption of rice for Chinese, Japan, South Korea and Europe |
相比于水产品和动物来源的食品,植物来源的食品中Cd浓度虽然不是很高,但由于食用量大,因此植物来源食品是我国人群Cd摄入的主要来源,其中大米为主要贡献者,平均占56%(图 1),大米贡献南北差异较大,对南方人群贡献占65%,对北方人群贡献占38%,其次是面粉(12%)和叶菜(11%)[6]。在日本,大米贡献占44%,蔬菜和海藻占16%,鱼与海鲜类产品占11%(UNEP,2008)。在欧洲,谷物和谷类食品贡献占27%,蔬菜类占16%,块茎类食物占13%(EFSA,2008)。由于亚洲国家人群大米食用量大,因此Cd摄入量(6.9~17 μg · kg-1 BW·月-1)普遍要比美国(4.6μg·kg-1 BW·月-1)及欧洲国家(5.2~9.1 μg·kg-1 BW·月-1)人群高[7]。
儿童是Cd暴露高风险群体,1~10岁儿童Cd摄入量是成年人的1.5~2倍,这主要是由于儿童单位千克体质量摄取的食物量较成人大[4, 6, 8]。因此,有必要对婴儿和儿童食品中Cd的含量标准重新修订,尤其是以大米为原料的婴儿和儿童食品。欧盟在2015年曾对婴儿和儿童食品中As的含量进行修订,提议把以大米为原料的婴儿和儿童食品中无机砷含量标准降至0.1 mg·kg-1,该提案于2017年起正式生效。到目前为止,对婴儿和儿童食品中Cd含量的限量还没有特殊限定。Cd的平均摄入量在性别之间差异不显著,但需要指出的是女性较男性更易受到Cd的危害。在日本Jinzu流域被确诊的166例“痛痛病”病人中163例为有多次生育的妇女[9]。这主要是因为妇女身体经常缺铁,从而导致对食物中Cd的吸收效率较男性高[10]。身体缺铁会导致Fe2+转运蛋白,如二价金属转运蛋白1(Divalent metal transport,MDT1)和ZRT-、IRT-类蛋白8(ZIP8)表达上调,而这类蛋白也被研究证实为介导人体Cd2+吸收的主要蛋白[11-12]。
3 我国南方部分地区大米Cd含量超标情况严重我国市售大米Cd含量超过国家大米Cd限量标准(0.2 mg·kg-1)比例在2.2%~10%左右[14-16],但南方部分地区有相当一部分大米Cd含量超过1 mg·kg-1(镉大米),有些稻米Cd含量甚至高达4~5 mg·kg-1,超标形势异常严峻(表 1)。总体而言,南方地区稻米Cd超标率在23%左右,在污染较为严重的省份如湖南、广东和广西,稻米超标率高达60%~88%[14, 17]。根据全国大米市场调查数据,体质量60 kg左右的成人每日Cd摄入量为11~39 μg,南方人群Cd摄入量是北方的1.8~2.8倍(表 1)。不论是北方还是南方,都需要百年以上,才会使长期摄入大米导致的人体Cd累积剂量达到2.6 g(即:50%人群出现Cd中等毒害症状)[13](表 1)。但在南方污染严重的区域,农民长期食用当地Cd污染大米,成人每日Cd摄入量高达142~214μg,则出现中等Cd毒害症状仅需要33~50年,对于一些高暴露人群,假如每日都摄入同样数量的Cd,则仅需4.7~8.3年就能达到Cd中等毒害水平(体内累积2.6 g Cd),10~20年就能达到半数病人出现“痛痛病”等严重毒害症状(体内累积3.8 g Cd),15~30年就可能达到Cd致死剂量5.4 g。
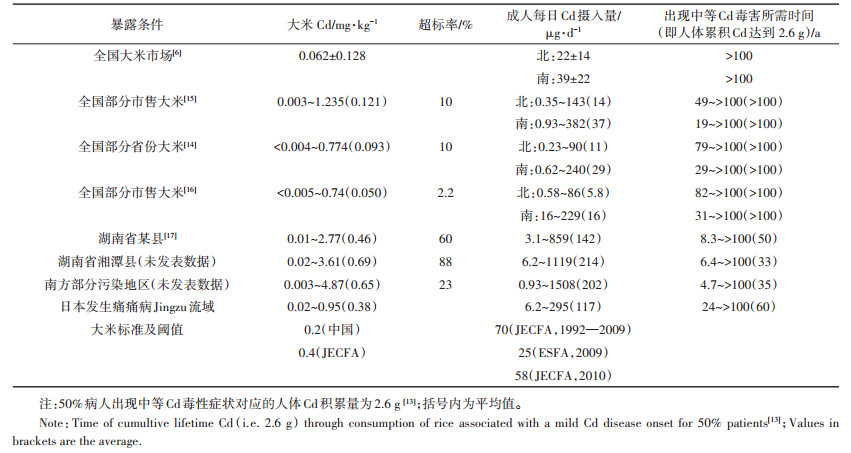
|
南方稻米Cd含量易超标主要存在以下几个方面原因:首先,过去的30年工业活动导致农田Cd污染严重。相比于1990年土壤普查,土壤Cd含量在华北、东北和西部地区增加了10%~40%,在南方和沿海地区增幅超过50%(国土资源部,2014)。在湖南省,土壤Cd背景值含量从1990年至今,由0.08 mg·kg-1增至0.5~0.6 mg·kg-1,增加了6~8倍[18]。除了矿业活动直接导致农田土壤Cd污染外,Cd污染灌溉水对土壤Cd的贡献同样不容忽视,尤其在南方双季稻地区,灌溉水中Cd可能是农田土壤Cd积累的主要来源[19]。假设灌溉水中含Cd 0.1~40 μg·L-1,通过灌溉每年向每公顷农田输入1~400 g Cd,高于大气沉降Cd输入(0.4~25 g·hm-2·a-1)[19]。其次,南方土壤大部分偏酸性,通常pH较低的土壤Cd生物有效性较高。据估计,土壤pH每降低1个单位,土壤Cd的生物有效性增加1.5倍[20]。在过去的30年,氮肥的过量施用和大气酸沉降,导致我国土壤酸化严重[21-22],湖南省将近50%的稻田土壤pH≤5.5。在湖南长沙-株洲-湘潭地区,相比于1980年,土壤pH在过去30年下降接近1个单位(酸化速度为每年0.031单位)。土壤严重酸化势必会加重稻米Cd含量的超标。再次,籼稻作为南方主栽品种是导致南方稻米Cd含量过高的另一原因。籼稻Cd积累能力普遍较粳稻强[23-24]。但即使是籼稻品种之间,稻米Cd积累能力也有较大的差异[25],这为通过种植Cd低积累品种从而降低Cd在稻米中的积累提供了可能。
4 影响稻田土壤Cd生物有效性的生物地球化学过程土壤性质和一些生物地球化学过程影响土壤Cd的生物有效性,进而也会影响稻米Cd的积累。在众多土壤性质中,土壤pH经常被发现在统计学上是土壤孔隙水Cd含量最为重要的影响因子之一,甚至时常比土壤总Cd含量对土壤孔隙水Cd含量的影响要大[26-27]。含Cd矿物的溶解度通常随着pH增加而减少,这是碱性土壤Cd生物有效性时常偏低的主要原因[20]。土壤pH也能影响土壤固相表面Cd的吸附,从而影响Cd的生物有效性。因此能影响稻田土壤pH的农艺添加措施都能间接影响到土壤Cd生物有效性及农作物对Cd的吸收。例如,过量施用NH4+ -N能导致土壤酸化[21-22, 28],从而增加土壤溶液中Cd浓度和作物Cd积累[29-31]。相反,通过添加碱性物料,例如石灰、生物炭,能降低Cd的生物有效性与稻米Cd的积累[22, 32]。
稻田土壤氧化还原状况是影响土壤Cd化学形态和溶解度的另一个重要因素。稻田有着特有的氧化-还原交替的水分变化规律,例如在水稻营养生长阶段的淹水淹育,分蘖后期的排水控制无效分蘖,以及在籽粒灌浆期的排水烤田。稻田这种还原-氧化交替对Cd的生物有效性有着重要的影响。在淹水阶段,微生物碳呼吸导致溶解氧快速消耗,氧化还原电位(Eh)降低,随后土壤NO3-、Fe(Ⅲ)/Mn(Ⅲ/Ⅳ)氧化物、SO42-以及CO2等作为电子受体相继被还原[33]。当土壤Eh降至100 mV时,SO42-开始被微生物还原,还原产生的HS-、S2-等能与Cd形成不溶的CdS沉淀或与Fe、Zn硫化物形成共沉淀,这个过程通常能导致土壤孔隙水中Cd浓度低于0.1 μg·L-1 [20]。这种难溶性硫化物的产生以及淹水导致土壤pH升高是酸性水稻土在淹水条件下Cd溶解性较低的主要原因。到目前为止,这种CdS纯矿物或与Fe、Zn硫化物形成共沉淀的可能性在实际田间污染土壤中还没有被证实。在碱性石灰性土壤,Cd的溶解度较低,主要是由于过高的CO32-/HCO3-能导致CdCO3(Otavite)形成,另外还可能以表面吸附或进入内部的形式与CaCO3(Calcite)共沉淀[34]。虽然稻田持续淹水能降低孔隙水中Cd浓度,但是在稻田后期排干的过程中,O2又重新进入土壤,含Cd硫化物快速氧化又会重新释放Cd2+和SO42-,同时也会释放出Zn2+和Fe2+。利用纯矿物体系的研究结果表明,不同硫化物氧化速率存在差异,CdS氧化速度要比ZnS快,Cd的释放速率取决于Cd/Zn和Cd/Fe比例[35-36],但在实际稻田土壤中,对含Cd的硫化物氧化动态的认识还不清楚。在厌氧条件下,纯CdS矿物理论上能存在于还原性的沉积物[37-38],然而在实际的淹水稻田里,纯CdS产生的可能性较小[35-36],主要是因为在实际条件下,Cd的浓度相对于Zn或Fe浓度要低至少2个数量级。因此,Cd更易与Zn、Fe等硫化物形成共沉淀[20, 35]。例如在闪锌矿(Sphalerite,ZnS)中Zn被Cd同晶置换率高达4 mol%,被Fe同晶置换能高达20 mol%[39]。在土壤排干氧化过程中,Fe2+氧化、水解过程释放质子导致土壤pH降低,这又进一步提高了稻田排干过程的Cd的生物有效性[40]。硫化物氧化和土壤pH降低是导致稻田土壤氧化阶段Cd生物有效性大幅度增加的两个主要因素,这个时期对应的是水稻抽穗至成熟阶段,也是稻米Cd积累较高的主要原因。我们近期研究发现,稻米大约90%的Cd主要是在稻田排水氧化阶段积累的。我国稻田土壤类型众多,不同土壤氧化阶段Cd释放速率差异较大,导致这样Cd活性差异的机制目前不是很清楚,猜测可能跟还原阶段Cd形成的硫化物共沉淀类型以及Cd占的比例有关。
锰(Mn)氧化物具有很强的氧化能力和吸附能力,也能影响Cd的生物有效性与水稻Cd吸收。一方面,土壤中高含量的Mn氧化物能影响到Fe和S的生物地球化学过程,例如延迟Fe氧化物的还原溶解,这能提高Fe氧化物对Cd的吸附容量;另一方面,Mn氧化物还原溶解会释放过量的Mn2+进入土壤溶液,这会抑制水稻根系对Cd2+的吸收(见水稻Cd吸收和转运的分子机制部分)。在氧化阶段,Mn2+又会重新氧化形成Mn氧化物,Mn氧化物具有很强的吸附能力,又会吸附更多的Cd2+。稻田排干过程Mn2+重新氧化对Cd生物有效性的影响程度目前仍然不是很清楚。
5 水稻Cd吸收与转运的分子机制水稻籽粒积累Cd主要有以下三个主要过程:(1)根系吸收、液泡区隔化、木质部装载以及随后根到地上部的转运;(2)水稻茎节中微管组织之间重新分配与向穗中运输;(3)通过韧皮部从叶片到籽粒的重新分配与运输[41-43]。一般认为从根向地上部转运过程是地上部Cd积累以及韧皮介导Cd向籽粒运输的主要限制步骤[44]。在稻谷籽粒灌浆和成熟阶段,大量的Cd会通过木质部运输到节部的韧皮部,导致Cd更容易向上一个节运输和最终进入籽粒。水稻在营养生长阶段叶片中积累的Cd又会重新通过韧皮部转移至节中,随后Cd又会重新分配,部分Cd又会重新转运至籽粒[41]。但在实际情况下,从叶片重新转运的Cd占稻米Cd积累的比例可能并不是很高。
Cd主要是通过搭便车的形式,利用必需元素转运蛋白被植物吸收。水稻OsNramp5(Natural resis-tance-associated protein 5)是水稻根系吸收Mn2+的膜转运蛋白,也被发现是水稻根系吸收Cd2+的主要途径[45-47]。OsNramp5转运蛋白位于根外皮层和内皮层细胞质膜上,并且呈外侧极性分布[45]。敲除和敲低OsNramp5能显著降低地上部和籽粒中Mn与Cd含量[45]。Ishikawa等[47]从辐射诱变的水稻群体里筛选到了3株籽粒Cd很低的植株,并发现OsNramp5是这3株低Cd表型的突变基因。田间试验结果也表明,这些突变株籽粒中Cd积累含量极低;研究还发现,虽然突变株Mn含量也比野生型低,但未对突变株生长和稻谷产量产生负面影响[47]。通过CRIS-PR/Cas9敲除OsNramp5也能显著降低籽粒Cd浓度,并且未发现稻谷产量受损[48]。虽然这些研究未发现OsNramp5突变株减产,但有些研究报道突变株Mn吸收能力减少导致缺Mn和减产的现象[45, 49],因此在Mn有效性较低的土壤,田间应用OsNramp5突变株有待进一步验证。已有研究报道其他转运蛋白如OsN-ramp1,OsIRT1(Iron-regulated transporter 1)和OsIRT2也能介导Cd2+吸收[50-51],但它们贡献要远比OsNramp5低[45]。
Cd被OsNramp5等蛋白吸收转运进入体内,随后径向向木质部运输,这个过程会受根细胞液泡的区隔化限制。水稻不同品种茎叶和籽粒Cd含量存在着基因型差异[23, 25, 52-54],并且发现这些差异与木质部Cd浓度有着很好的相关性,因此认为Cd从根向地上部转运是茎叶和籽粒Cd积累的关键过程[44]。Ueno等[55]和Miyadate等[56]相对独立地克隆到一个控制Cd地上部积累的基因,该基因编码P1B-type ATPase3转运蛋白基因OsHMA3。这个转运蛋白位于液泡膜上,能把细胞质中Cd转运到液泡中储存,因此能限制Cd向木质部的径向运输[55-56]。籼稻品种Cd积累量偏高主要是由于存在OsHMA3功能缺失的等位基因。因此,沉默OsHMA3会增强Cd向地上部转运,而过表达OsHMA3能进一步降低低Cd品种的籽粒Cd含量[55-56]。最近我们也在粳稻品种中发现了一类新型的OsHMA3功能缺失的等位基因,这是导致粳稻一些品种Cd积累较高的主要原因[57]。同样,其他植物HMA3的同源基因可能会有同样的作用,例如,功能退化的AtHMA3等位基因被发现是拟南芥不同品种叶片Cd浓度自然变异的主要因素[58];SpHMA3被发现在Cd/Zn超积累植物伴矿景天(Sedum plumbizincicola)Cd解毒过程中起关键作用[59]。
Cd被水稻根系吸收后,一部分会被OsHMA3的同源蛋白OsHMA2向韧皮部转运。OsHMA2转运蛋白在根中定位于中柱鞘细胞的质膜上,在节上定位于扩大和扩散维管束的木质部导管伴胞和韧皮部薄壁细胞上[60-62]。在根中,OsHMA2负责从质外体向原生质体运输Zn和Cd,从而能提高通过韧皮部途径运输的Cd[60]。OsHMA2突变能显著抑制营养生长阶段Cd从根向地上部转运[60-62]。在节中,OsHMA2主要负责把Cd和Zn向韧皮部装载,有利于向上一节和圆锥花序分配[60]。通过转座子插入扰乱OsHMA2功能,也能降低叶和籽粒Cd浓度[60-62]。最近,Luo等[63]发现了编码一个植物防御素类蛋白基因CAL1,该蛋白定位于根内皮层和木质部薄壁细胞上,能通过螯合Cd并跨细胞膜分泌到胞外的方式,将Cd从细胞质中卸载出来,进入木质部中参与长途转运。这一过程有利于调控Cd在叶片等营养器官的积累,屏蔽了螯合态Cd再次跨膜进入韧皮部向水稻籽粒的再分配过程[63]。Os-LCT1(Low-affinity cation transport)是已被报道能介导水稻节中Cd从木质部向韧皮部运输的转运蛋白[64]。OsLCT1定位于节上扩大和扩散维管束外围细胞上。敲低OsLCT1能导致籽粒Cd含量降低50%以上[64]。这些水稻Cd吸收、转运以及最终籽粒Cd积累的关键基因和转运蛋白的发现为低Cd积累的水稻品种筛选和遗传育种提供了重要的理论依据。
6 稻田Cd污染阻控的措施为了降低稻米Cd的含量,Bolan等[65]和Zhao等[19]研究者提出了一系列的农艺和育种策略,包括减少稻田土壤Cd的输入、对已污染的土壤降低其Cd的生物有效性、筛选和培育Cd低积累水稻品种以及Cd污染土壤的修复。
鉴别和减少农田Cd污染源是阻控土壤污染的第一步。我国南方土壤Cd污染严重的区域基本都是矿业活动比较密集的地区,矿业活动导致大量Cd进入周边的农田和水体。因此在一些污染严重的地区,需要通过严格监控和严格执行环境保护法阻止土壤Cd污染进一步扩大。
一系列农艺措施能降低土壤Cd的生物有效性。通过水分管理调控土壤Eh被认为是相对容易、成本较低的阻控措施。保持稻田处在淹水状态,尤其是在水稻灌浆结实阶段,通常能降低土壤Cd的有效性和籽粒Cd的含量[66-68]。但值得一提的是,保持长期淹水却增加了土壤As的有效性和稻米As的含量[66-67, 69]。土壤Cd生物有效性受土壤pH影响较大,能增加土壤pH的农业措施,例如添加石灰和生物炭,均能有效地降低土壤Cd的生物有效性[22, 70]。土壤Zn/Cd比例也被认为是调控Cd硫化物氧化速率的方式。鉴于不同土壤Zn/Cd比例差别很大,能否在实际稻田系统中,通过控制土壤Zn/Cd比例来降低Cd的生物有效性有待进一步研究。
对水稻Cd吸收与转运分子机制的解析为阻抗农田Cd污染提供了一个相对科学理性的方式。一方面能培育稻米Cd含量安全的水稻品种,另一方面还能通过秸秆等部位高积累Cd的水稻品种来移除土壤Cd。一个经典的例子就是种植OsNramp5突变体,在Cd污染的土壤上籽粒Cd的含量仅0.01~0.03 mg · kg-1[47]。同样,通过CRISPR/Cas9敲除OsNramp5能降低籽粒Cd的含量,能从野生型的0.33~2.9 mg·kg-1降至 < 0.05 mg·kg-1[48]。在田间条件下,过表达OsHMA3、敲除或敲低OsHMA2、OsLCT1也能降低籽粒Cd的含量[55, 60-61, 64]。因此寻找OsNramp5、OsHMA2、OsLCT1功能缺失的等位基因也能为选育低Cd积累的水稻品种提供一种方式,因为这些等位基因很容易通过育种工程整合到当前的主栽品种基因组中。然而需要指出的是,这些基因也参与了植物必需元素的吸收与转运,它们的功能缺失虽能减少稻米Cd的积累,但也能潜在降低籽粒中必需营养元素如Mn、Fe、Zn的含量。因此,理想的状态是通过基因编辑技术精心设计这些转运蛋白,去改造OsNramp5获取一些对Mn吸收专一的变异体,即:仅能转运Mn不能转运Cd。另外在不改变专一性的前提下,通过转基因的方法调控转运蛋白基因表达也是一种成功的方式。例如,过表达OsHMA3能导致籽粒Cd大幅度下降,而且并不影响水稻产量以及Fe、Zn的含量[55]。考虑稻米Zn、Fe浓度相对其他作物偏低,生物强化这两种元素也被认为能降低人体Cd吸收,这就是所谓的“营养降Cd”[71]。
植物修复被认为是低成本和环境友好的修复污染土壤的方法。对于Cd污染的农田土壤,鉴于土壤Cd的绝对浓度较低,而且移动性较强,植物修复可能是一种可行的方法,需要克服一系列技术难点[19]。在温室和小尺度的田间种植Cd/Zn超积累植物东南景天(Sedum alfredii)、伴矿景天(Sedum plumbizincicola)已被报道用于土壤Cd的修复[72-73]。但由于播种、杂草防除、疾病控制以及收获等面临着一些困难,超积累作物在大尺度稻田土壤上可能并不是一种合适的方法[74]。利用Cd高积累的籼稻品种,通过秸秆积累提取方式来达到修复Cd污染农田的目的[74]。从这方面看,利用OsHMA3功能缺失的等位基因的水稻品种可能更适用于这个目的[55, 57]。另外,可以通过增强土壤Cd有效性的农艺措施来增加作物提取修复Cd的效率。
7 研究问题与展望我国农田土壤Cd污染已经是一个普遍的环境问题,危害农产品安全和人体健康。我国近十年来针对土壤重金属污染的热点问题也开展了不少研究工作,打下一定科学理论和技术研发基础,但在以下几个方面有待加强研究:
(1)稻米主产区农田Cd源解析与污染特征认识不够清楚,工业活动、农业添加、大气沉降、地质背景等不同途径对农田土壤Cd与农产品Cd的贡献的研究相对缺乏,只有认清贡献,才能有效地切断污染源头。
(2)污染地区与Cd相关的流行病学研究不足,鉴于我国南方部分地区大米Cd含量超标情况不容乐观,长期食用Cd污染粮食势必会导致健康问题,这方面的研究亟需开展。
(3)我国稻田土壤类型众多,不同土壤中Cd在氧化阶段释放速率差异明显,其机制不是很清楚,因此需要深入研究控制土壤Cd生物有效性及从土壤向水稻迁移的关键生物地球化学过程与主控因素,解析生物过程与非生物过程的贡献与作用机制。
(4)在水稻自然变异群体里,筛选控制水稻Cd吸收与转运的优异等位基因,开展Cd低积累水稻品种筛选与育种工作;另外可通过基因工程改造OsNramp5、OsHMA2和OsLCT1等转运蛋白的专一性或过表达OsHMA3等基因,培育一批Cd积累低且其他矿质营养元素积累并不受影响的水稻品种;培育一批既能在生产上满足籽粒Cd含量安全,又能在修复上秸秆部位高Cd积累的“既生产又修复”的水稻品种。
(5)一些措施例如水分管理、种植低积累水稻品种、提高土壤pH等能有效降低稻米Cd的积累,但是Cd与As是一对矛盾体,对于Cd与As复合污染土壤,这些措施在降低Cd的同时,不可避免地增加了稻米As的积累,目前关于农田土壤Cd、As复合污染阻控研究相对不足,要进一步加强。
| [1] |
Chaney R L, Oliver D P. Sources, potential adverse effects and remediation of agricultural soil contaminants[C]. Contaminants and the Soil Environment in the Australasia-Pacific Region, 1996: 323-359.
|
| [2] |
Sharma A K. Evaluation of certain food additives and contaminants: Seventy-third report of the Joint FAO/WHO Expert Committee on Food Additives[R]. FAO/WHO, 2012.
|
| [3] |
Cheremisinoff N P. 1. Agency for toxic substances and disease registry (ATSDR)[M]//John W, Sons I. Pollution control handbook for oil and gas engineering. 2016: 83-93.
|
| [4] |
Authority E F S. Cadmium dietary exposure in the European population[J]. Efsa Journal, 2012, 10(7): 2551-2588. |
| [5] |
环境保护部, 国土资源部. 全国土壤污染状况调查公报[J]. 中国环保产业, 2014, 36(5): 10-11. Department of Environmental Protection, Ministry of Land and Resources. National soil pollution survey report[J]. China Environmental Protection Industry, 2014, 36(5): 10-11. |
| [6] |
Song Y, Wang Y, Mao W F, et al. Dietary cadmium exposure assessment among the Chinese population[J]. PloS One, 2017, 12(5): e0177978. DOI:10.1371/journal.pone.0177978 |
| [7] |
Wang P, Kopittke P M, McGrath S, et al. Cadmium transfer from soil to plants and its potential risk to human health[M]//Singh B R, McLaughlin M J, Brevik E C. The nexus of soils, plants, animals and human health. Catena: Schweizerbart, 2017: 138-147.
|
| [8] |
UNEP(United Nations Environment Programme). Draft final review of scientific information on cadmium[EB/OL]. (2008-11)(2018-05-16). http://www.unep.org/hazardoussubstances/Portals/9/Lead_Cadmium/docs/Interim_reviews/Final_UNEPCadmium_review_Nov_2008.pdf.
|
| [9] |
Nogawa K, Sakurai M, Ishizaki M, et al. Threshold limit values of the cadmium concentration in rice in the development of itai-itai disease using benchmark dose analysis[J]. Journal of Applied Toxicology, 2017, 37(8): 962-966. DOI:10.1002/jat.v37.8 |
| [10] |
Nordberg G F, Nogawa K, Nordberg M, et al. Chapter 23-cadmium. In handbook on the toxicology of metals[M]. Third Edition. , Academic Press, 2007, 445-486.
|
| [11] |
Gunshin H, Mackenzie B, Berger U V, et al. Cloning and characterization of a mammalian proton-coupled metal-ion transporter[J]. Nature, 1997, 388(6641): 482-488. DOI:10.1038/41343 |
| [12] |
Dalton T P, He L, Wang B, et al. Identification of mouse SLC39A8 as the transporter responsible for cadmium-induced toxicity in the testis[J]. Proceedings of the National Academy of Sciences of the Unitated States of America, 2005, 102(9): 3401-3406. DOI:10.1073/pnas.0406085102 |
| [13] |
Inaba T, Kobayashi E, Suwazono Y, et al. Estimation of cumulative cadmium intake causing Itai-itai disease[J]. Toxicology Letters, 2005, 159(2): 192-201. DOI:10.1016/j.toxlet.2005.05.011 |
| [14] |
Chen H, Tang Z, Wang P, et al. Geographical variations of cadmium and arsenic concentrations and arsenic speciation in Chinese rice[J]. Environmental Pollution, 2018, 238: 482-490. DOI:10.1016/j.envpol.2018.03.048 |
| [15] |
Zhen Y H, Cheng Y J, Pan G X, et al. Cd, Zn and Se content of the polished rice samples from some Chinese open markets and their relevance to food safety[J]. Journal of Safety and Environment, 2008, 8: 119-122. |
| [16] |
Qian Y Z, Chen C, Zhang Q, et al. Concentrations of cadmium, lead, mercury and arsenic in Chinese market milled rice and associated population health risk[J]. Food Control, 2010, 21(12): 1757-1763. DOI:10.1016/j.foodcont.2010.08.005 |
| [17] |
Du Y, Hu X F, Wu X H, et al. Affects of mining activities on Cd pollution to the paddy soils and rice grain in Hunan Province, Central South China[J]. Environmental Monitoring & Assessment, 2013, 185(12): 9843-9856. |
| [18] |
中国环境监测. 中国土壤元素背景值[M]. 北京: 中国环境科学出版社, 1990, 331-337. China National Environmental Monitoring Centre. Background values of soil elements in China[M]. Beijing: China Environmental Science Press, 1990, 331-337. |
| [19] |
Zhao F J, Ma Y, Zhu Y G, et al. Soil contamination in China:Current status and mitigation strategies[J]. Environmental Science & Technology, 2015, 49(2): 750-759. |
| [20] |
Alloway B J. Heavy metals in soils:Trace metals and metalloids in soils and their bioavailability[M]. Springer, 2013, 283-311.
|
| [21] |
Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5968): 1008-1010. DOI:10.1126/science.1182570 |
| [22] |
Zhu H H, Chen C, Xu C, et al. Effects of soil acidification and liming on the phytoavailability of cadmium in paddy soils of central subtropical China[J]. Environmental Pollution, 2016, 219: 99-106. DOI:10.1016/j.envpol.2016.10.043 |
| [23] |
Ueno D, Kono I, Yokosho K, et al. A major quantitative trait locus controlling cadmium translocation in rice(Oryza sativa)[J]. New Phytologist, 2009, 182(3): 644-653. DOI:10.1111/nph.2009.182.issue-3 |
| [24] |
Sun L, Xu X X, Jiang Y R, et al. Genetic diversity, rather than cultivar type, determines relative grain Cd accumulation in hybrid rice[J]. Frontiers in Plant Science, 2016, 7: 1407. |
| [25] |
Duan G L, Shao G S, Tang Z, et al. Genotypic and environmental variations in grain cadmium and arsenic concentrations among a panel of high yielding rice cultivars[J]. Rice, 2017, 10(1): 9. DOI:10.1186/s12284-017-0149-2 |
| [26] |
Boekhold A E, Vanderzee S. Significance of soil chemical heterogeneity for spatial-behavior of cadmium in field soils[J]. Soil Science Society of America Journal, 1992, 56(3): 747-754. DOI:10.2136/sssaj1992.03615995005600030012x |
| [27] |
Degryse F, Smolders E, Parker D R. Partitioning of metals(Cd, Co, Cu, Ni, Pb, Zn)in soils:Concepts, methodologies, prediction and applications:A review[J]. European Journal of Soil Science, 2009, 60(4): 590-612. DOI:10.1111/ejs.2009.60.issue-4 |
| [28] |
Uri N D. Environmental considerations in the fertilizer use decision[J]. Environmental Geology, 1998, 34(2): 103-110. |
| [29] |
Zaccheo P, Crippa L, Pasta V D M. Ammonium nutrition as a strategy for cadmium mobilisation in the rhizosphere of sunflower[J]. Plant and Soil, 2006, 283(1): 43-56. |
| [30] |
Jalloh M A, Chen J, Zhen F, et al. Effect of different N fertilizer forms on antioxidant capacity and grain yield of rice growing under Cd stress[J]. Journal of Hazardous Materials, 2009, 162(2): 1081-1085. |
| [31] |
Wei S H, Li Y M, Zhou Q X, et al. Effect of fertilizer amendments on phytoremediation of Cd-contaminated soil by a newly discovered hyperaccumulator Solanum nigrum L[J]. Journal of Hazardous Materials, 2010, 176(1): 269-273. |
| [32] |
Houben D, Evrard L, Sonnet P. Mobility, bioavailability and pH-dependent leaching of cadmium, zinc and lead in a contaminated soil amended with biochar[J]. Chemosphere, 2013, 92(11): 1450-1457. DOI:10.1016/j.chemosphere.2013.03.055 |
| [33] |
Borch T, Kretzschmar R, Kappler A, et al. Biogeochemical redox processes and their impact on contaminant dynamics[J]. Environmental Science & Technology, 2009, 44(1): 15-23. |
| [34] |
Khaokaew S, Chaney R L, Landrot G, et al. Speciation and release kinetics of cadmium in an alkaline paddy soil under various flooding periods and draining conditions[J]. Environmental Science & Technology, 2011, 45(10): 4249-4255. |
| [35] |
Barrett K A, McBride M B. Dissolution of zinc-cadmium sulfide solid solutions in aerated aqueous suspension[J]. Soil Science Society of America Journal, 2007, 71(2): 322-328. DOI:10.2136/sssaj2006.0124 |
| [36] |
Livera J D, McLaughlin M J, Beak D, et al. Release of dissolved cadmium and sulfur nanoparticles from oxidizing sulfide minerals[J]. Soil Science Society of America Journal, 2011, 75(3): 842-854. DOI:10.2136/sssaj2010.0019 |
| [37] |
Morse J W, Luther G W. Chemical influences on trace metal-sulfide interactions in anoxic sediments[J]. Geochimica et Cosmochimica Acta, 1999, 63(19): 3373-3378. |
| [38] |
Lee F Y, Kittrick J A. Elements associated with the cadmium phase in a harbor sediment as determined with the electron beam microprobe[J]. Journal of Environmental Quality, 1984, 13(3): 337-340. |
| [39] |
Vaughan D J, Craig J R. Mineral chemistry of metal sulfides[M]. Cambridge University Press, 1978, 203-215.
|
| [40] |
Fulda B, Voegelin A, Kretzschmar R. Redox-controlled changes in cadmium solubility and solid-phase speciation in a paddy soil as affected by reducible sulfate and copper[J]. Environmental Science & Technology, 2013, 47(22): 12775-12783. |
| [41] |
Clemens S, Aarts M G M, Thomine S, et al. Plant science:The key to preventing slow cadmium poisoning[J]. Trends in Plant Science, 2013, 18(2): 92-99. DOI:10.1016/j.tplants.2012.08.003 |
| [42] |
Clemens S, Ma J F. Toxic heavy metal and metalloid accumulation in crop plants and foods[J]. Annual Review of Plant Biology, 2016, 67(1): 489. DOI:10.1146/annurev-arplant-043015-112301 |
| [43] |
Uraguchi S, Fujiwara T. Rice breaks ground for cadmium-free cereals[J]. Current Opinion in Plant Biology, 2013, 16(3): 328-334. DOI:10.1016/j.pbi.2013.03.012 |
| [44] |
Uraguchi S, Mori S, Kuramata M, et al. Root-to-shoot Cd translocation via the xylem is the major process determining shoot and grain cadmium accumulation in rice[J]. Journal of Experimental Botany, 2009, 60(9): 2677-2688. DOI:10.1093/jxb/erp119 |
| [45] |
Sasaki A, Yamaji N, Yokosho K, et al. Nramp5 is a major transporter responsible for manganese and cadmium uptake in rice[J]. Plant Cell, 2012, 24(5): 2155-2167. DOI:10.1105/tpc.112.096925 |
| [46] |
Ishimaru Y, Takahashi R, Bashir K, et al. Characterizing the role of rice NRAMP5 in manganese, iron and cadmium transport[J]. Scientific Report, 2012, 2: 286. DOI:10.1038/srep00286 |
| [47] |
Ishikawa S, Ishimaru Y, Igura M, et al. Ion-beam irradiation, gene identification, and marker-assisted breeding in the development of low-cadmium rice[J]. Proceedings of the National Academy of Sciences of the Unitated States of America, 2012, 109(47): 19166-19171. DOI:10.1073/pnas.1211132109 |
| [48] |
Tang L, Mao B G, Li Y K, et al. Knockout of OsNramp5 using the CRISPR/Cas9 system produces low Cd-accumulating indica rice without compromising yield[J]. Scientific Reports, 2017, 7(1): 14438. DOI:10.1038/s41598-017-14832-9 |
| [49] |
Yang M, Zhang Y Y, Zhang L J, et al. OsNRAMP5 contributes to manganese translocation and distribution in rice shoots[J]. Journal of Experimental Botany, 2014, 65(17): 4849-4861. DOI:10.1093/jxb/eru259 |
| [50] |
Nakanishi H, Ogawa I, Ishimaru Y, et al. Iron deficiency enhances cadmium uptake and translocation mediated by the Fe2+ transporters OsIRT1 and OsIRT2 in rice[J]. Soil Science & Plant Nutrition, 2006, 52(4): 464-469. |
| [51] |
Takahashi R, Ishimaru Y, Senoura T, et al. The OsNRAMP1 iron transporter is involved in Cd accumulation in rice[J]. Journal of Exper-imental Botany, 2011, 62(14): 4843-4850. DOI:10.1093/jxb/err136 |
| [52] |
He J Y, Zhu C, Ren Y F, et al. Genotypic variation in grain cadmium concentration of lowland rice[J]. Journal of Plant Nutrition and Soil Science, 2006, 169(5): 711-716. DOI:10.1002/(ISSN)1522-2624 |
| [53] |
Arao T, Ae N. Genotypic variations in cadmium levels of rice grain[J]. Soil Science & Plant Nutrition, 2003, 49(4): 473-479. |
| [54] |
Pinson S R M, Tarpley L, Yan W, et al. Worldwide genetic diversity for mineral element concentrations in rice grain[J]. Crop Science, 2015, 55(1): 294-311. DOI:10.2135/cropsci2013.10.0656 |
| [55] |
Ueno D, Yamaji N, Kono I, et al. Gene limiting cadmium accumulation in rice[J]. Proceedings of the National Academy of Sciences of the Unitated States of America, 2010, 107(38): 16500-16505. DOI:10.1073/pnas.1005396107 |
| [56] |
Miyadate H, Adachi S, Hiraizumi A, et al. OsHMA3, a P-1B-type of ATPase affects root-to-shoot cadmium translocation in rice by mediating efflux into vacuoles[J]. New Phytologist, 2011, 189(1): 190-199. DOI:10.1111/j.1469-8137.2010.03459.x |
| [57] |
Yan J L, Wang P T, Wang P, et al. A loss-of-function allele of OsHMA3 associated with high cadmium accumulation in shoots and grain of Japonica rice cultivars[J]. Plant, Cell & Environment, 2016, 39(9): 1941-1954. |
| [58] |
Chao D Y, Silva A, Baxter I, et al. Genome-wide association studies identify heavy metal ATPase3 as the primary determinant of natural variation in leaf cadmium in Arabidopsis thaliana[J]. PloS Genetics, 2012, 8(9): e1002923. DOI:10.1371/journal.pgen.1002923 |
| [59] |
Liu H, Zhao H, Wu L, et al. Heavy metal ATPase 3(HMA3)confers cadmium hypertolerance on the cadmium/zinc hyperaccumulator Sedum plumbizincicola[J]. New Phytologist, 2017, 215(2): 687-698. DOI:10.1111/nph.2017.215.issue-2 |
| [60] |
Yamaji N, Xia J, Mitaniueno N, et al. Preferential delivery of zinc to developing tissues in rice is mediated by P-type heavy metal ATPase OsHMA2[J]. Plant Physiology, 2013, 162(2): 927-939. DOI:10.1104/pp.113.216564 |
| [61] |
Takahashi R, Ishimaru Y, Shimo H, et al. The OsHMA2 transporter is involved in root-to-shoot translocation of Zn and Cd in rice[J]. Plant Cell and Environment, 2012, 35(11): 1948-1957. DOI:10.1111/j.1365-3040.2012.02527.x |
| [62] |
Satohnagasawa N, Mori M, Nakazawa N, et al. Mutations in rice(Oryza sativa)heavy metal ATPase 2(OsHMA2)restrict the translocation of zinc and cadmium[J]. Plant and Cell Physiology, 2012, 53(1): 213-224. DOI:10.1093/pcp/pcr166 |
| [63] |
Luo J S, Huang J, Zeng D L, et al. A defensin-like protein drives cadmium efflux and allocation in rice[J]. Nature Communications, 2018, 9(1): 645. DOI:10.1038/s41467-018-03088-0 |
| [64] |
Uraguchi S, Kamiya T, Sakamoto T, et al. Low-affinity cation transporter(OsLCT1)regulates cadmium transport into rice grains[J]. Proceedings of the Natinal Academy of Sciences of the Unitated States of America, 2011, 108(52): 20959-20964. DOI:10.1073/pnas.1116531109 |
| [65] |
Bolan N S, Makino T, Kunhikrishnan A, et al. Chapter four:Cadmium contamination and its risk management in rice ecosystems[J]. Advances in Agronomy, 2013, 119(47): 183-273. |
| [66] |
Arao T, Kawasaki A, Baba K, et al. Effects of water management on cadmium and arsenic accumulation and dimethylarsinic acid concentrations in Japanese rice[J]. Environmental Science & Technology, 2009, 43(24): 9361-9367. |
| [67] |
Xu X Y, McGrath S P, Meharg A A, et al. Growing rice aerobically markedly decreases arsenic accumulation[J]. Environmental Science & Technology, 2008, 42(15): 5574-5579. |
| [68] |
Hu P, Huang J, Ouyang Y, et al. Water management affects arsenic and cadmium accumulation in different rice cultivars[J]. Environ Geochem Health, 2013, 35(6): 767-778. DOI:10.1007/s10653-013-9533-z |
| [69] |
Li R Y, Stroud J L, Ma J F, et al. Mitigation of arsenic accumulation in rice with water management and silicon fertilization[J]. Environmental Science & Technology, 2009, 43(10): 3778-3783. |
| [70] |
Wang M E, Yang Y, Chen W P. Manganese, zinc, and pH affect cadmium accumulation in rice grain under field conditions in Southern China[J]. Journal of Environmental Quality, 2018, 47(2): 306-311. DOI:10.2134/jeq2017.06.0237 |
| [71] |
Chaney R L. Chaptar two-Food safety issues for mineral and organic fertilizers[M]//Advances in agronomy. Elsevier Science & Technology, 2012: 51-116.
|
| [72] |
Li Z, Wu L H, Hu P J, et al. Repeated phytoextraction of four metalcontaminated soils using the cadmium/zinc hyperaccumulator Sedum plumbizincicola[J]. Environmental Pollution, 2014, 189: 176-183. DOI:10.1016/j.envpol.2014.02.034 |
| [73] |
Yang X E, Long X X, Ye H B, et al. Cadmium tolerance and hyperaccumulation in a new Zn-hyperaccumulating plant species(Sedum alfredii Hance)[J]. Plant and Soil, 2004, 259(1): 181-189. |
| [74] |
Murakami M, Nakagawa F, Ae N, et al. Phytoextraction by rice capable of accumulating Cd at high levels:Reduction of Cd content of rice grain[J]. Environmental Science & Technology, 2009, 43(15): 5878-5883. |
 2018, Vol. 37
2018, Vol. 37