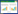文章信息
- 邹丽娜, 戴玉霞, 邱伟迪, 张舒, 赵佳伟, 唐先进, 施积炎, 徐建明
- ZOU Li-na, DAI Yu-xia, QIU Wei-di, ZHANG Shu, ZHAO Jia-wei, TANG Xian-jin, SHI Ji-yan, XU Jian-ming
- 硫素对土壤砷生物有效性与水稻吸收的影响研究
- Effect of sulfur on the bioavailability of arsenic in soil and its accumulation in rice plant(Oryza sativa L.)
- 农业环境科学学报, 2018, 37(7): 1435-1447
- Journal of Agro-Environment Science, 2018, 37(7): 1435-1447
- http://dx.doi.org/10.11654/jaes.2018-0837
文章历史
- 收稿日期: 2018-05-28
- 录用日期: 2018-06-10
2. 上海科翎检验技术有限公司, 上海 200123;
3. 浙江工业大学环境学院, 杭州 310032
2. Shanghai Keling Analytical Technology Co., Ltd, Shanghai 200123, China;
3. College of Environment, Zhejiang University of Technology, Hangzhou 310032, China
砷(As)是环境中无处不在的有毒类金属。土壤中的As主要是由地质和人为活动产生,人类活动包括金属开采和冶炼,含As农药、除草剂、木材防腐剂、食品添加剂等的使用,以及As污染水灌溉。美国环境保护署(EPA)将As列为有效的人类致癌物,并且是造成严重健康问题的主要原因[1-2]。粮食作物,特别是水稻,是世界上一半人口的主食,也是As的主要来源[3-4]。在孟加拉国、印度、中国、韩国和泰国等亚洲国家,由于水稻具有从土壤和灌溉用水中吸收As的特殊能力,而使从大米饮食中摄入As的量显著增加[5-7]。因此,As从土壤迁移到植物系统是一个值得关注的严重问题。
硫(S)是土壤中重要的生源要素,在调节植物生长和发育方面扮演着重要角色。近年来,我国部分地区土壤缺S逐渐严重,硫素成为继氮、磷、钾之后的第四大肥料,在农业中的应用逐渐被重视[8]。硫进入稻田土壤后可以影响土壤氧化还原电位(Eh)、pH等,主要是由于无机硫从-2价到+6价的氧化还原状态的改变[9],进而影响重金属的氧化还原过程。硫素添加对环境中As的迁移转化的影响目前已有一些研究。有研究表明,地下水中硫酸盐还原产生的硫化物可以固定As或者与铁共同作用固定As,表明硫酸盐可以有效调控地下水的As污染[10]。Li等[11]利用同位素分析发现地下水中硫酸盐和As浓度具有较好的相关关系,推断硫酸盐在As的形态转化过程中发挥了重要作用。在稻田土壤中,由于存在丰富的铁(Fe),S、Fe和As的生物地球化学循环更为复杂[12]。有研究对不同浓度水溶态Fe、As条件下,FeS及As2S3存在比例进行了研究,结果表明,As可以与H2S形成As2S3沉淀,而当溶液中的Fe2+浓度较高时,可以将产生的H2S消耗掉,从而减少As与H2S之间的反应[13]。此外,S和Fe的氧化还原产物也会介导非生物的As氧化还原。因此,S、Fe存在的情况下,As的形态及移动性受到了很多因素的影响,其化学及微生物机制由于其复杂性并没有完全清楚。
因此,本试验通过对添加As污染土壤施加硫素,采集全生育期土壤溶液和成熟期水稻植株样品,分析硫素添加对As移动性及生物有效性的影响,最终考察硫素添加对水稻吸收和累积As的影响。
1 材料与方法 1.1 供试土壤与实验设计本实验供试土壤为添加As的污染土,土壤采自浙江省湖州市安吉县水稻土表层(0~20 cm),该土壤本底As浓度为(20.26±2.15)mg·kg-1。在土壤中添加50 mg·kg-1的As(以Na3AsO4的形式),采用喷雾法将Na3AsO4·12H2O溶液喷洒至土壤中,使得重金属溶液与土壤混合均匀,保持20%的添加水量,再将土壤放至人工气候室(相对湿度60%~70%,白天25 ℃ 16 h,夜晚20 ℃ 8 h)老化一个月,保持恒定的湿度和温度,经老化后的土壤待用。土壤为粉砂质粘壤土,老化后土壤的pH 4.83,有机质5.23%,总As 69.01 mg·kg-1,总Fe 22.5 g·kg-1。
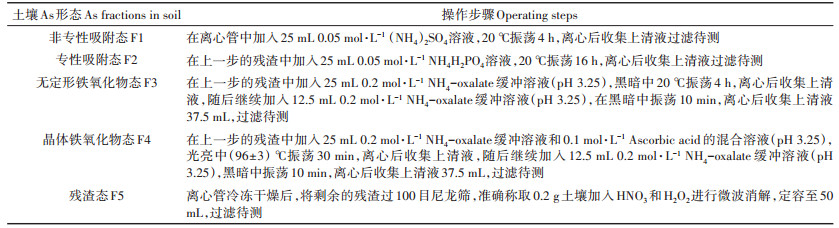
本试验采用聚氯乙烯(PVC)桶(高30 cm×直径13 cm)进行水稻种植,每个桶中装有一个根际袋(300目,高15 cm×直径8 cm),用于区分根际与非根际土壤。每桶土称重2.5 kg(以干重记)。设3种硫素处理:对照(CK)、单质硫(S)、硫酸钠(NS),添加浓度为0、50、150 mg·kg-1,以CK、50S、150S、50NS及150NS表示。硫素以固体形式在培养最初采用逐级扩大法添加在土壤中,充分混匀后装入种植桶。每种施肥处理均分别设置不种苗对照及灭菌对照,每个处理设置3个重复。灭菌处理中添加了0.07%的NaN3溶液,NaN3作为一种呼吸抑制剂可以抑制微生物活动。在每个桶的中部土壤5 cm深处分别埋入一个自制的土壤溶液采样器,包括一根硅胶软管,底部连接一个白玉气石,培养示意图如图 1。在整个实验过程中保持采样器位置不动,从而保证无扰动的原位采样。种植水稻的处理在根际袋中埋入自制土壤溶液采样器。全部处理安装完成后,在土壤中添加了含底肥的去离子水,底肥氮磷钾的施入量分别为P2O5[Ca(H2PO4)2]0.5 g·kg-1,N[CO(NH2)2]和K2O(KCl)各0.2 g·kg-1。保持淹水高度约5 cm。待处理平衡一周后,进行水稻幼苗的移栽,并且每天补充水分。
|
| A:水稻种植处理;B:不种苗对照及灭菌对照 A:rice cultivation treatments, B:bulk control and sterilization control 图 1 水稻培养示意图 Figure 1 Diagram of rice cultivation |
水稻植株培养:水稻种子采用中早39号(浙江省勿忘农集团有限公司),用自来水冲洗后,去除空壳,将剩余的种子于30% H2O2中消毒15 min,然后用去离子水洗净。将种子置于湿润的纱布上进行发芽,发芽两周后挑选长势相当的幼苗放入营养液中培养。在人工气候室中培养3周后,进行水稻移栽。
土壤溶液采集:根据实验采用蠕动泵进行分段采样,采集的土壤溶液过0.45 μm的滤膜,每采集9 mL土壤溶液,加入1 mL 0.5 mol·L-1的盐酸溶液,以酸化土壤溶液。取样时间为一周一次,持续采集10周,并将采集液立刻避光冷藏,-20 ℃冰箱保存,防止高温下土壤溶液中的物质氧化。
土壤采集:小心地取出根际袋,取下粘附在根上的土壤作为根际土。无植物处理作为非根际土,灭菌处理作为无生物对照。避开土壤溶液取样器所在位置。先取一袋土,在自封袋中混合均匀后,分成两份,置于-70 ℃冰箱待测。
水稻样品采集:收获水稻根、茎、叶、穗。水稻根部用自来水将泥土冲洗干净后再用去离子水洗净。水稻生长特征测量包括生物量、植物株高。将水稻用吸水纸擦去表面水后测量鲜重。用毫米尺测量水稻株高。用不锈钢剪刀将水稻分成根、茎、叶、穗几部分,于-70 ℃冰箱保存待测。
1.3 样品分析土壤溶液中的Fe:在采集土壤溶液的同时,迅速取适量过0.45 μm滤膜的土壤溶液,采用邻菲罗啉比色法进行Fe(Ⅱ)的测定。分别加入5 mL 1 mol·L-1的乙酸钠及0.1%的邻菲罗啉溶液,显色30 min后定容至50 mL,在510 nm吸光度下测定。在溶液中加入10%盐酸羟胺溶液,显色定容测定总Fe,以此得到Fe(Ⅲ)含量。
土壤溶液中的As:采用原子荧光分光光度计法(AFS-9130,Beijing Jitian Instrument Company,China)测定土壤溶液中的总As。分别选取幼苗期(2W)、分蘖期(4W)、抽穗期(7W)、成熟期(10W)的土壤溶液进行As形态的测定。利用高效液相色谱与电感耦合等离子质谱(HPLC-ICP-MS NEXION300XX,PerkinElmer,Inc.,USA)进行测定。流动相为8 mmol·L-1(NH4)2HPO4和8 mmol·L-1 NH4NO3(pH=6.2)的缓冲溶液。
土壤中As的连续提取:As连续提取方法主要用于提取非专性吸附态(F1)、专性吸附态(F2)、无定形铁氧化物态(F3)、晶体铁氧化物态(F4)及残渣态(F5)As[14]。准确称取1.000 g冷冻干燥后过100目筛的土壤于50 mL离心管中,具体操作如表 1。提取后,采用原子荧光分光光度计测定不同As形态的含量。
根表胶膜提取液:根表胶膜采用ACA法进行提取[15]。称取适量鲜根,分别放入100 mL锥形瓶,向锥形瓶中加入ACA溶液,包括40 mL 0.3 mol·L-1柠檬酸钠、5 mL 10%乙酸钠及3 g抗坏血酸。在室温下(20~25 ℃)低速振荡3 h,将浸提液定容到100 mL容量瓶中,并用去离子水冲洗根3次,过滤待测。采用ICPOES(Icap 6300,Thermo,USA)进行As、Fe和S的测定。浸提后的根105 ℃杀青30 min,65 ℃烘箱中烘干至恒质量,称干质量。将水稻根研磨后待用。
植物样品中的总As:将冷冻干燥后的各部分植物磨成粉末,称取0.2 g植物样品于聚四氟乙烯消解管中,分别加入5 mL HNO3、1 mL HF和1 mL 30%H2O2,采用微波消解仪(MARS6,CEM Microwave Technology Ltd.,USA)进行消解,消解程序如下:1600 W条件下通过15 min加热至210 ℃,在此温度下保持30 min,然后15 min降温。消解的样品采用去离子水定容至25 mL,过滤后采用电感耦合等离子质谱(ICP-MS NEXION300XX,PerkinElmer,Inc.,USA)测定As含量。加入标准物质[GBW07603(GSV-2)国家标准物质中心]进行消解质量控制,标准物质中的As含量为(1.25±0.15)mg·kg-1,分析得到的As含量为(1.32±0.01)mg·kg-1。
1.4 数据分析利用SPSS 22.0软件进行单因素方差分析(ANO-VA),处理样品以及对照中不同数值之间的显著性差异分析通过Least significant difference(LSD)检测法进行测定。图表中的数据均为3个平行的平均值±标准差。
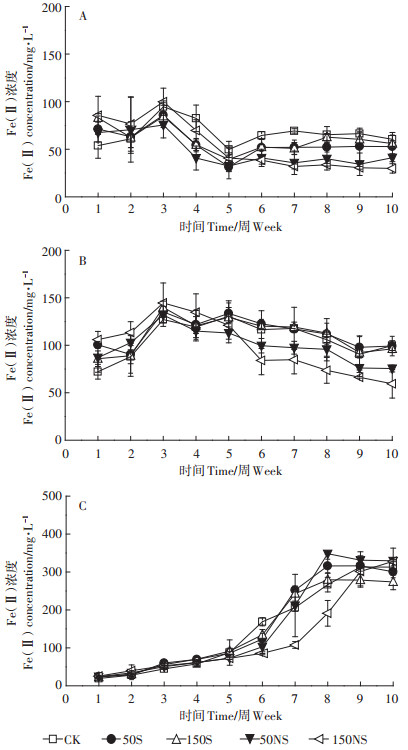
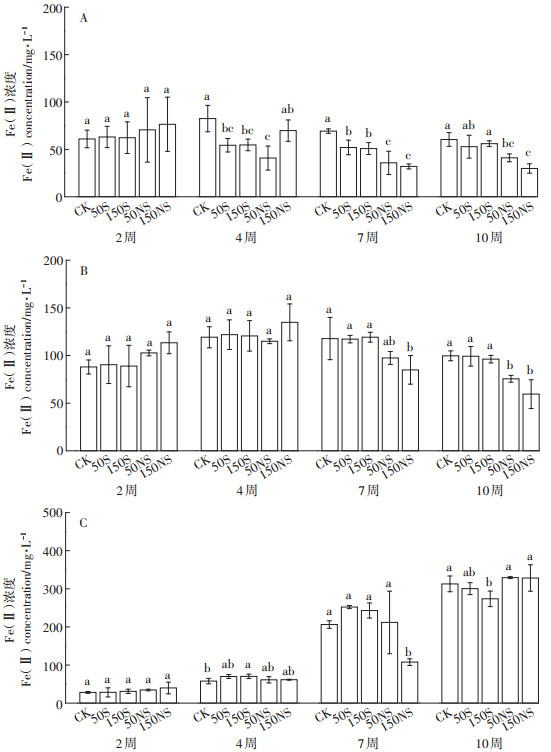
2 结果与分析 2.1 不同形态硫素对土壤溶液中Fe的影响在实验过程中,所有处理均未检出Fe(Ⅲ)。在土壤溶液中,淹水开始的前3周,Fe(Ⅱ)浓度在所有处理中都呈上升趋势。图 2A显示了5个处理下根际土壤溶液中Fe(Ⅱ)浓度的变化。根际土壤溶液中Fe(Ⅱ)的浓度变化可以分为3个阶段:前3周Fe(Ⅱ)的浓度有一定程度的增加;3~5周时Fe(Ⅱ)浓度降低;5~10周为稳定阶段。从第3周开始,CK处理土壤溶液中的Fe(Ⅱ)相对其他处理均较高,不同形态硫素的添加降低了根际土壤溶液中Fe(Ⅱ)的浓度。结合图 3A发现,从分蘖期(4W)开始,随着硫素的添加,Fe(Ⅱ)均有一定程度的降低,抽穗期(7W)时,硫素添加均显著降低了土壤溶液中Fe(Ⅱ)的浓度。成熟期(10W)硫酸钠的添加显著降低土壤溶液中的Fe(Ⅱ)。图 2B显示了非根际土壤中Fe(Ⅱ)浓度的变化。与根际土壤溶液类似,非根际土壤前3周Fe(Ⅱ)的浓度有一定程度的增加;随后Fe(Ⅱ)浓度呈现一个曲折下降的过程,并趋于平稳。5周以后,50NS及150NS处理下Fe(Ⅱ)均低于CK处理,而50S及150S处理仍与CK处理相似。结合图 3B可以看出,幼苗期(2W)和分蘖期(4W)硫素的添加均对Fe(Ⅱ)的浓度没有显著影响,而随着淹水时间的增加,不同浓度硫酸钠的添加显著降低了土壤溶液中Fe(Ⅱ)的含量,并且浓度越高,影响越大。总体来说,土壤溶液根际非根际变化趋势类似。图 2C显示了灭菌处理土壤溶液中Fe(Ⅱ)的变化趋势,与不灭菌处理相比,呈现较大的差异。在整个培养过程中,前期土壤溶液中的Fe(Ⅱ)浓度呈现上升趋势,而在最后阶段处于稳定趋势。结合图 3C可以发现,不同形态的硫素在灭菌处理下,变化趋势有一些差别。相比CK来说,150S处理Fe(Ⅱ)浓度先上升后下降,而150NS处理Fe(Ⅱ)浓度先下降后上升。
|
| 误差限是三个重复的平均标准差。下同 Error bars indicate the standard deviation of the mean(n=3). The same below 图 2 整个水稻生长过程土壤溶液中溶解态Fe(Ⅱ)的变化(A:根际;B:非根际;C:灭菌) Figure 2 The Fe(Ⅱ)concentration of soil pore water under different treatments(A:rhizosphere, B:bulk, C:sterilization) |
|
| 小写字母表示相同时间不同处理间的显著性(P < 0.05) Lowercase letters indicate the significance among the different treatments over the same period(P < 0.05) 图 3 土壤溶液中不同生育期Fe(Ⅱ)的变化(A:根际;B:非根际;C:灭菌) Figure 3 The Fe(Ⅱ)concentration of soil pore water under different treatments during the rice growing stage(A:rhizosphere, B:bulk, C:sterilization) |
整个培养时期土壤溶液中根际、非根际、灭菌处理溶解态As的变化如图 4所示。根际土壤溶液各个处理变化较不同,整个过程呈波动变化(图 4A)。CK处理大致呈现先减少后增加并逐渐稳定的趋势。硫素的添加均在一定程度上降低了土壤溶液中总As的含量,其中50S与CK的变化趋势相似,而其他处理呈现大致的先减少后上升再减少的趋势。结合图 5A可以发现,150S处理在4个不同时期均显著降低了土壤溶液中的溶解态As。幼苗期后,硫素的添加显著降低了土壤溶液中的溶解态总As,并且150 mg·kg-1的添加量与50 mg·kg-1相比显著降低,存在一个剂量效应。图 4B显示了非根际土壤溶液中As的变化,CK处理呈现先升后降的变化趋势,硫素添加后一定程度上降低了非根际土壤溶液中溶解态As的浓度。硫素添加的处理呈现先降低,随后升高,后期又降低的趋势。结合图 5B,在幼苗期和成熟期,硫素的添加并没有显著影响As,而在中间时期(分蘖期和抽穗期),硫素的添加显著降低了土壤溶液中的As。总体来说,非根际土壤溶液中的总As稍高于根际土。灭菌处理下的As与Fe(Ⅱ)的变化趋势一致,呈显著上升的趋势(图 4C),硫素的添加反而在抽穗期显著增加了土壤溶液中的As(图 5C)。
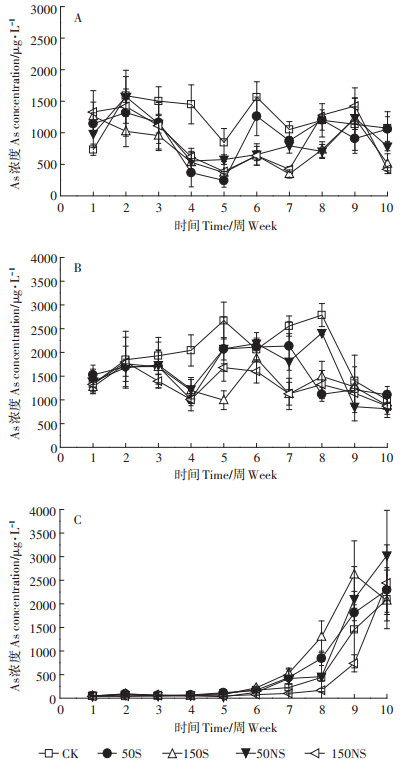
|
| 图 4 整个水稻生长过程土壤溶液中溶解态总As的变化(A:根际;B:非根际;C:灭菌) Figure 4 The total As concentration of soil pore water under different treatments(A:rhizosphere, B:bulk, C:sterilization) |
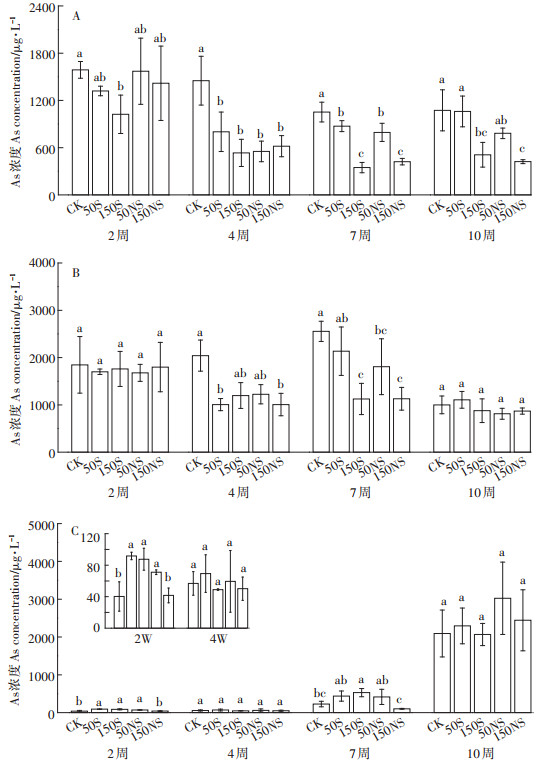
|
| 小写字母表示相同时间不同处理间的显著性(P < 0.05) Lowercase letters indicate the significance among the different treatments over the same period(P < 0.05) 图 5 土壤溶液中不同生育期总As的变化(A:根际;B:非根际;C:灭菌) Figure 5 The total As concentration of soil pore water under different treatments during the rice growing stage(A:rhizosphere, B:bulk, C:sterilization) |
在植物种植过程中,植物优先选择吸收土壤溶液中游离态的As,并且不同形态As对植物造成的毒害不同,所以土壤溶液中As的含量和形态反映了其对植物的有效性和毒性,在一定程度上决定了As在植物中的累积。在本实验中,测定了4个不同生育期土壤溶液中的As形态,As(Ⅲ)和As(Ⅴ)的含量随着生育期的延续呈现出不同的变化规律。图 6显示了根际、非根际及灭菌处理中的As形态变化。根际、非根际环境下,不同处理均主要以As(Ⅲ)为主,其含量达到了总As的75.7%~93.5%。如图 6A所示,根际土壤溶液中,硫素对As(Ⅲ)的影响与对总As的影响类似,在幼苗期后,高浓度单质硫和硫酸钠的添加显著降低了土壤溶液中的As(Ⅲ)。硫素的添加在水稻生长前期降低了土壤溶液中As(Ⅴ)的浓度,而在水稻生长后期影响减小。根际土壤溶液中的有机As占总As的1.5%~12.8%,硫素的添加一定程度上促进了As(Ⅲ)向As(Ⅴ)和有机As的转化。非根际土壤溶液中,As形态变化与根际土壤溶液相似(图 6B)。所有处理幼苗期As(Ⅲ)的占比均高于其他时期,在低硫处理时(50 mg·kg-1),随着培养时间的增加,As(Ⅲ)的占比呈现出先下降后上升的趋势,而高硫处理时(150 mg· kg-1),As(Ⅲ)呈下降趋势。2周后,有机As的含量有一定的上升。灭菌处理中,2周时土壤溶液中的As浓度较低,主要以As(Ⅴ)为主,并且基本没有有机As出现(图 6C);随着培养时间的增加,土壤溶液中As(Ⅲ)的含量逐渐增加,到10周时各个处理中As(Ⅲ)均达到94%,有机As也有一些出现。硫素处理在灭菌条件下对土壤溶液中As形态的变化影响较小。
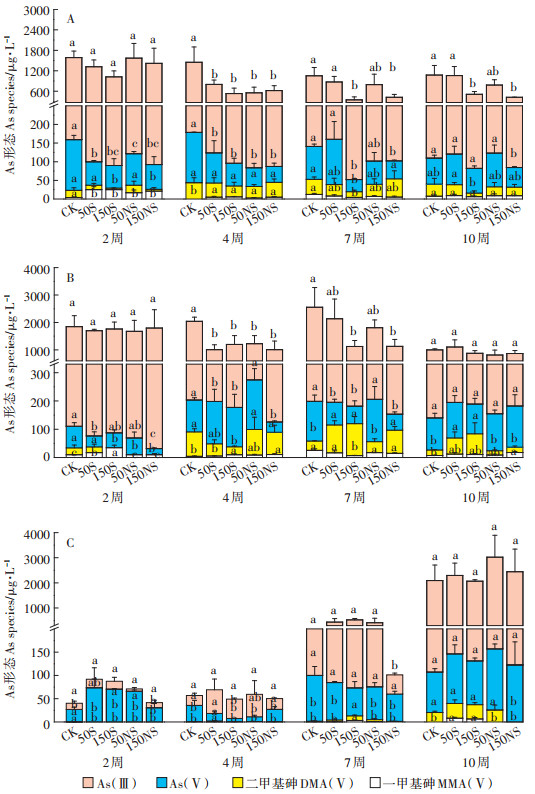
|
| 小写字母表示各形态在相同时间不同处理间的显著性(P < 0.05) Lowercase letters indicate the significance among the different treatments over the same period of each specie(P < 0.05) 图 6 土壤溶液中不同生育期As形态的变化(A:根际;B:非根际;C:灭菌) Figure 6 The As species of soil pore water under different treatments during the rice growing stage(A:rhizosphere, B:bulk, C:sterilization) |
不同硫素处理下,土壤五步提取As含量及其比例如图 7所示。因供试土壤为添加As的污染土壤,大部分的As主要以非专性吸附态、专性吸附态、无定形铁氧化物态的形式存在,约占总As的70%左右(图 7)。其中无定型铁氧化物态As占总As的比例最高,大约在30.3%~43.9%。在根际土壤中(图 7A和图 7B),50S处理下土壤As化学形态变化较小,而150S、50NS及150NS处理下,土壤中的非专性吸附态、专性吸附态、无定形铁氧化物态、晶体铁氧化物态As均显著降低,而残渣态As显著升高,表明在根际土壤中,硫素的添加降低了生物有效性利用度较高的几种形态,促进了As向稳定态的转化。在非根际土壤中(图 7C和图 7D),硫素的添加一定程度降低了土壤中的非专性吸附态、专性吸附态As和残渣态As,显著增加了无定形铁氧化物态、晶体铁氧化物态As。与根际土壤相比,硫素的添加一定程度活化了残渣态As,使其向无定形铁氧化物态、晶体铁氧化物态As转化。在灭菌土壤中(图 7E和图 7F),随着硫素的添加,非专性吸附态As显著增加,这与根际、非根际土壤的变化趋势相反,专性吸附态As显著降低。低浓度硫素的添加降低了无定形铁氧化物态,而高浓度与CK类似。
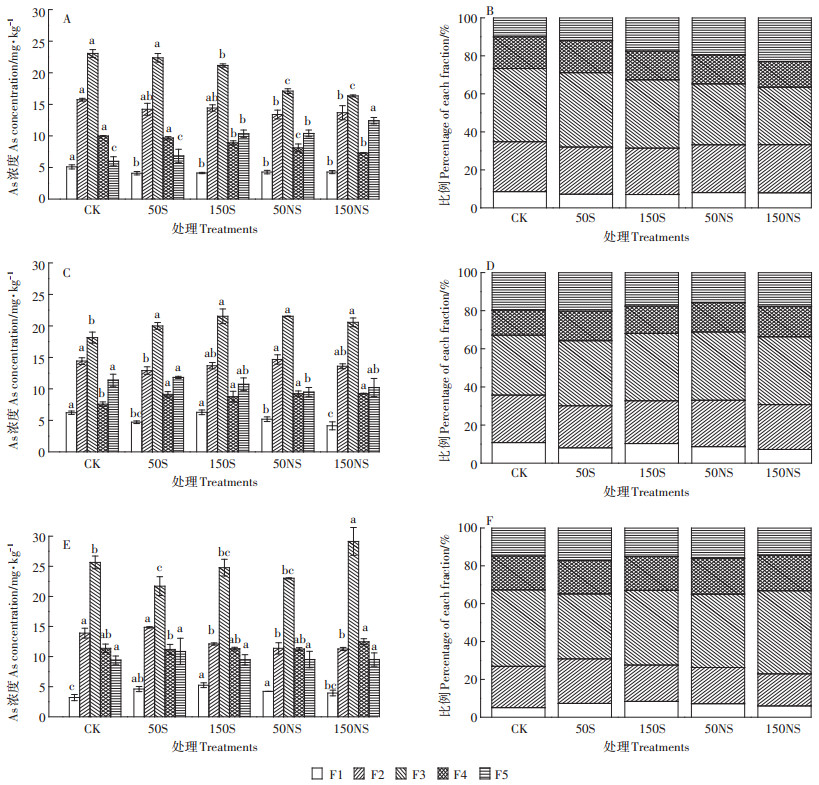
|
|
不同字母表示同一种形态As含量在不同处理间具有显著差异(P < 0.05)。 F1:非专性吸附态;F2:专性吸附态;F3:无定形铁氧化物态;F4:晶体铁氧化物态及;F5:残渣态 Different letters indicate the significance among the different treatments over the same rice part(P < 0.05). F1:non-specifically sorbed As, F2:specifically sorbed As, F3:amorphous iron oxide-bound As, F4:crystalline iron oxide-bound As, F5:residual As 图 7 不同形态硫素对不同处理土壤As化学形态的影响(A:根际砷含量;B:根际比例图;C:非根际砷含量;D:非根际比例图;E:灭菌砷含量;F:灭菌比例图) Figure 7 Distribution of As fractions in soil treated with different S(A:rhizosphere As concentration, B:rhizosphere As percentage, C:bulk As concentration, D:bulk As percentage, E:sterilization As concentration, F:sterilization As percentage) |
硫素添加对水稻生长具有一定的影响(图 8)。图 8A显示了硫素添加对水稻株高的影响,可以看出,硫素的添加对水稻地下部分的株高没有显著影响,而地上部分的高度均显著增加,150S和150NS处理分别使水稻地上部分的高度比CK增加了18.3%和10.7%,一定程度上促进了水稻地上部分的增长。硫素的添加对水稻鲜重具有一定的促进作用(图 8B)。低浓度硫素的添加没有显著影响水稻根的鲜重,而高浓度硫素的添加显著增加了水稻根的鲜重,分别增加了31.6%(150S)和21.2%(150NS)。对水稻地上部鲜重来说,低浓度的硫素有一定的促进作用但没有达到显著水平,而高浓度硫素的添加显著增加了地上部鲜重,分别增加了18.5%(150S)和26.3%(150NS)。硫素的添加也显著增加了稻谷的产量。
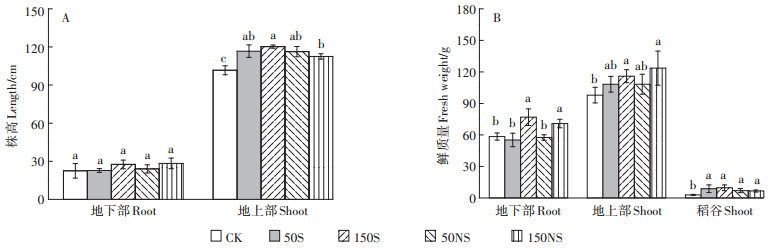
|
| 不同字母表示同一部位处理组之间具有显著差异(P < 0.05) Different letters indicate the significance among the different treatments over the same rice part(P < 0.05) 图 8 不同形态硫素对水稻株高和鲜质量的影响(A:水稻株高;B:水稻鲜重) Figure 8 The length and fresh weight of rice plant treated with different S(A:length, B:fresh weight) |
图 9为不同土壤中硫素添加后水稻各部位中As累积的情况。在所有处理中,水稻根部的As含量最高。不同部位水稻As的累积量排序大致为根 > 叶 > 茎 > 谷壳 > 米粒。硫素添加对水稻根As的累积没有显著影响。单质硫的添加显著降低了水稻茎中As的累积,降低了28.8%(150S),而硫酸钠的添加没有显著影响。硫素添加显著降低了水稻叶中As的累积,并且硫酸钠的添加使水稻叶和茎的累积量发生了改变,CK处理中叶 > 茎,而硫酸钠处理中叶≈茎。硫素的添加并没有对谷壳中的As产生影响。高浓度硫素的添加显著增加了水稻米粒中的As,高浓度的硫素处理下,水稻米粒中的As均达到1.72 mg·kg-1。
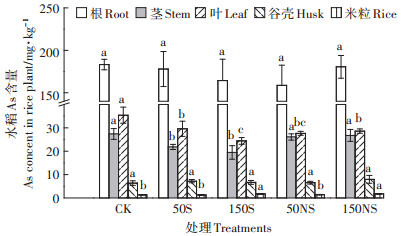
|
| 不同字母表示同一部位处理组之间具有显著差异(P < 0.05) Different letters indicate the significance among the different treatments over the same rice part (P < 0.05) 图 9 不同形态硫素对水稻不同部位As的影响 Figure 9 As accumulation in different part of rice plant treated with different S |
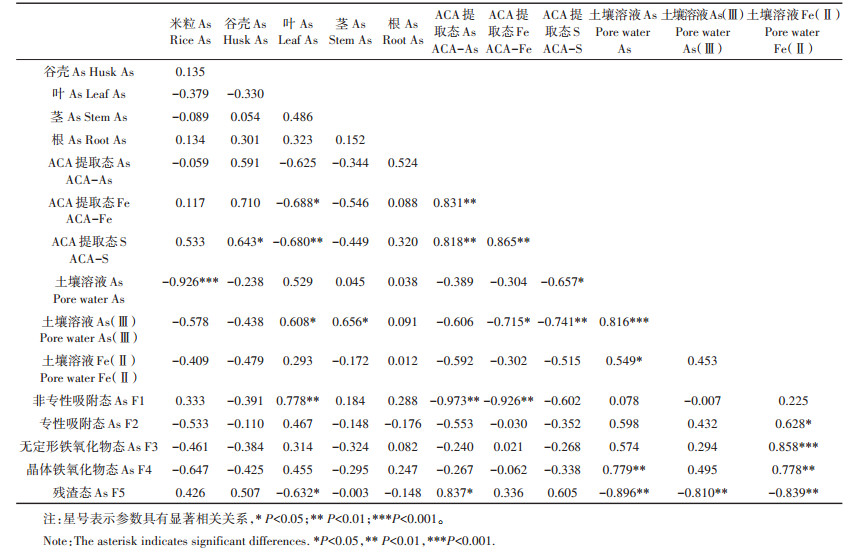
根表胶膜采用ACA提取法进行提取,根表胶膜提取液中As、Fe和S的含量如表 2所示。单质硫的添加显著增加了根表胶膜ACA提取态Fe的含量,硫酸钠的添加增加了ACA提取态Fe的含量但没有达到显著水平。不同硫素的添加均显著增加了ACA提取态As,根据表 3可以发现,水稻根表胶膜ACA提取态As和ACA提取态Fe呈极显著正相关(r=0.831,P < 0.01)。硫素的添加显著增加了根表胶膜中的ACA提取态S,并且ACA提取态S与ACA提取态As(r=0.818,P < 0.01)和ACA提取态Fe(r=0.865,P < 0.01)均呈极显著正相关。
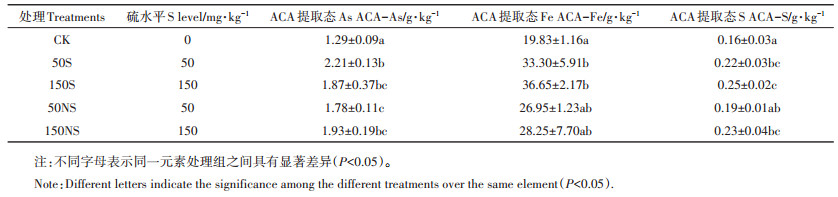
|
|
将根际土壤溶液、根际土壤化学形态与水稻吸收As进行相关性分析,考察影响水稻As吸收的因素。如表 3所示,根表胶膜中的ACA提取态Fe和ACA提取态S均与水稻叶片中的As显著负相关。土壤溶液中的As也与水稻As吸收有一定的相关关系,土壤溶液中的总As与水稻米粒中的As显著负相关,As(Ⅲ)与水稻茎和叶中的As显著正相关。土壤中As的化学形态与水稻吸收As及土壤溶液中As和Fe(Ⅱ)的移动性也具有一定的显著相关关系。
3 讨论在添加As的污染土壤中,水稻培养初期,土壤溶液中的Fe(Ⅱ)浓度无论是灭菌还是不灭菌都有一个增加的过程,可能是土壤淹水后Eh降低造成的Fe还原溶出,这是一个非生物因素主导的过程。当最初还原释放的Fe(Ⅱ)达到一定浓度时又被氧化形成矿物沉积,或者与土壤溶液中的还原态S沉淀固定,在水稻土中形成一个铁的氧化还原循环。而灭菌处理中,Fe(Ⅱ)不断升高最终稳定,是土壤中的Fe还原溶出的过程。与非根际相比,相同处理下根际土壤溶液中的Fe(Ⅱ)浓度更低,可能是根际富氧环境进一步抑制了Fe还原,促进了根表胶膜的形成。硫素的添加不同程度降低了土壤溶液中的Fe(Ⅱ)。在土壤溶液中,Fe(Ⅲ)和SO42-竞争电子受体,虽然Fe(Ⅲ)的氧化还原电位略大于SO42-[16],但Fe(Ⅲ)主要以铁矿物的形式存在,减少了与微生物的接触,而硫素的添加使土壤溶液中SO42-的浓度增加,因此SO42-的电子竞争能力稍强[17]。
水稻种植的前6周灭菌处理中溶出的As均较低,而非灭菌处理As浓度较高,表明这个过程是微生物介导的As还原溶出过程。而后随着淹水时间的增加,灭菌条件下添加的As开始溶出,这与Fe(Ⅱ)的变化趋势是一致的。一方面可能是非生物作用的Fe还原溶出释放了吸附的As,另一方面可能是随着时间的增加,灭菌效果降低,从而导致微生物介导的As溶出。根际土壤溶液中的As整体低于非根际,一方面是由于水稻对土壤溶液中As的吸收,另一方面可能是根际富氧环境促进了As氧化,使其沉淀固定。硫素的添加与Fe(Ⅱ)的变化规律类似,也不同程度降低了土壤溶液中的As,特别是硫酸钠的添加,这一结果与前人的研究结果相似。Jia等[18]发现淹水稻田土壤中硫酸盐的添加降低了土壤溶液中的As。高浓度硫酸盐的添加降低了土壤溶液中的As[13]。可能是硫酸盐的还原限制了水溶态As的累积[19]。Fe和S的氧化还原转化可以形成次级矿物[如Fe(Ⅱ)和Fe(Ⅲ)氢氧化物、FeAsO4、FeS、As2S3],将溶液中的As固定,硫化物通过还原含As的铁氧化物,产生氧化态S和可溶解的Fe(Ⅱ),并释放出As[19]。这部分释放出的As又将被重新吸附形成新的铁矿物,或形成As-S复合物,从而降低As的移动性[20]。单质硫处理与硫酸钠处理的主要差别在于相同添加浓度下,硫酸钠处理中的SO42-浓度更高,单质硫向SO42-的转化需要较长的时间[9],因此硫酸钠处理降低效果更显著。
在淹水条件下,土壤具有厌氧、氧化还原电位低等特点,土壤溶液中的As(Ⅲ)、As(Ⅴ)及少量甲基砷同时存在,并且以As(Ⅲ)为主[21]。土壤溶液中的As和Fe(Ⅱ)呈显著正相关关系(r=0.549,P < 0.05),表明Fe(Ⅲ)和As(Ⅴ)还原促进了土壤中As(Ⅲ)的释放。在我们的研究中,硫素的添加一定程度上降低了根际、非根际土壤溶液中的As(Ⅲ)和As(Ⅴ)。一方面可能是硫素的添加促进了硫铁矿物的形成,增加了其对As(Ⅴ)的吸附,另一方面大量As(Ⅲ)的存在可能与还原态S形成砷硫化物。这与土壤溶液中Fe(Ⅱ)、As(Ⅲ)浓度及pH有关,Fe(Ⅱ)和土壤中的As竞争微生物硫还原产生的H2S,Fe(Ⅱ)浓度较高时会先与S还原产生的H2S反应,形成硫铁化合物[13]。土壤溶液中的As(Ⅲ)、Fe(Ⅱ)及硫化物的含量与吸附As的Fe(Ⅲ)氢氧化物的还原溶解速率及硫酸盐还原速率有关,并且都是由微生物介导的[22]。相关微生物的作用机制还需进一步研究。
土壤中的总As并不能代表土壤中As的有效性,因此采用顺序提取方法来衡量As在土壤中的有效性[14]。在土壤中,非专性吸附态、无定型铁氧化物态和晶体铁氧化物态As均与土壤溶液中的Fe(Ⅱ)显著正相关,其中晶体铁氧化物态As与土壤溶液中的As也显著正相关,表明这些形态在培养过程中并不稳定,是Fe还原溶解的主要部分,而残渣态As与土壤溶液中的As和Fe(Ⅱ)呈显著负相关关系,表明在添加As的污染土壤中仅残渣态为As稳定态。硫素的添加显著降低了根际土壤中的非稳定态,降低了根际As有效态。
有一些研究表明,硫素添加可以缓解重金属对植物生长的影响,促进植物生长[23-24],这与我们的研究结果一致,硫素添加显著增加了植物株高和水稻鲜重。但也有部分研究表明硫素的添加对水稻干重没有显著影响[9],甚至在高浓度硫素添加条件下会降低水稻根长[25],这可能与土壤中的As含量有关。硫素添加缓解As对植物生长的原因包括硫素添加可以促进植物内还原型谷胱甘肽(GSH)的形成,通过形成As-植物螯合肽复合物将其固定在植物液泡中,增加植物对重金属的耐性[26]。此外,硫素的添加降低了土壤中As的有效性及土壤溶液中的As(Ⅲ),从而缓解了As对植物毒性。
硫素的添加降低了水稻地上部(茎、叶)对As的累积,然而过量的硫素添加反而增加了米粒中的As,并且米粒中的As与土壤溶液中的As显著负相关。有研究表明,随土壤中As移动性的增加,米粒中的As并不会增加,硫素的添加可能影响土壤溶液中As的移动性,但是稻米中As的累积可能与根际硅的有效性有关[27]。这也表明,在不同土壤中施用硫素效果并不同,可能造成籽粒中As的增加,对农产品安全造成威胁。硫素的添加促进了水稻根表胶膜的形成,增加了As在根际环境和水稻根表的固持[28],这与我们的研究中水稻根表胶膜随硫素的添加而增加是一致的,并且根表胶膜是As主要累积部位。硫素促进根表胶膜形成的原因可能是硫在淹水稻田环境中被还原成S2-,而S2-可以还原Fe3+增加根际环境中的Fe2+,根际环境中Fe2+的含量是影响铁膜形成的重要原因之一。本研究中,随着硫素的添加,根际土壤溶液中Fe(Ⅱ)浓度降低也可能是因为大量Fe(Ⅱ)在根表氧化形成铁膜。
4 结论(1)对比灭菌处理和不灭菌处理,发现在添加As的污染土壤中微生物介导的还原溶出和非生物介导的还原溶出均存在,影响了土壤溶液As和Fe(Ⅱ)的移动性。
(2)硫素的施用一定程度上降低了根际、非根际土壤溶液中的As和Fe(Ⅱ),降低了As的移动性;土壤溶液中的As(Ⅲ)和As(Ⅴ)也有一定程度的降低;硫素的添加显著降低了根际土壤中As有效态;相同硫含量的硫酸钠比单质硫的影响更显著。
(3)硫素的施用促进了水稻生长,增加了水稻产量,并且一定程度上降低了水稻地上部(茎、叶)对As的累积,但过量硫素的施用可能增加籽粒中的As含量。
| [1] |
Martinez V D, Vucic E A, BeckerSantos D D, et al. Arsenic exposure and the induction of human cancers[J]. Journal of Toxicology, 2011, 2011(5): 431287. |
| [2] |
Sahoo P K, Kim K. A review of the arsenic concentration in paddy rice from the perspective of geoscience[J]. Geosciences Journal, 2013, 17(1): 107-122. DOI:10.1007/s12303-013-0004-4 |
| [3] |
Banerjee M, Banerjee N, Bhattacharjee P, et al. High arsenic in rice is associated with elevated genotoxic effects in humans[J]. Scientific Report, 2013, 3(7): 2195. |
| [4] |
Fahad S, Hussain S, Saud S, et al. A biochar application protects rice pollen from high-temperature stress[J]. Plant Physiology and Biochemistry, 2015, 96: 281-287. DOI:10.1016/j.plaphy.2015.08.009 |
| [5] |
Mondal D, Polya D A. Rice is a major exposure route for arsenic in Chakdaha block, Nadia district, West Bengal, India:A probabilistic risk assessment[J]. Applied Geochemistry, 2008, 23(11): 2987-2998. DOI:10.1016/j.apgeochem.2008.06.025 |
| [6] |
Zhao F J, Mcgrath S P, Meharg A A. Arsenic as a food chain contaminant:Mechanisms of plant uptake and metabolism and mitigation strategies[J]. Annual Review of Plant Biology, 2010, 61(1): 535-539. DOI:10.1146/annurev-arplant-042809-112152 |
| [7] |
Bakhat H F, Zia Z, Fahad S, et al. Arsenic uptake, accumulation and toxicity in rice plants:Possible remedies for its detoxification:A review[J]. Environmental Science and Pollution Research, 2017, 24(10): 1-17. |
| [8] |
孙丽娟, 段德超, 彭程, 等. 硫对土壤重金属形态转化及植物有效性的影响研究进展[J]. 应用生态学报, 2014, 25(7): 2141-2148. SUN Li-juan, DUAN De-chao, PENG Cheng, et al. Influence of sulfur on the speciation transformation and phyto-availability of heavy metals in soil:A review[J]. Chinese Journal of Applied Ecology, 2014, 25(7): 2141-2148. |
| [9] |
Hu Z Y, Zhu Y G, Li M, et al. Sulfur(S)-induced enhancement of iron plaque formation in the rhizosphere reduces arsenic accumulation in rice(Oryza sativa L.)seedlings[J]. Environmental Pollution, 2007, 147(2): 387-393. DOI:10.1016/j.envpol.2006.06.014 |
| [10] |
Kirk M F, Holm T R, Park J, et al. Bacterial sulfate reduction limits natural arsenic contamination in groundwater[J]. Geology, 2004, 32(11): 953. DOI:10.1130/G20842.1 |
| [11] |
Li M D, Wang Y X, Li P, et al. δ34S and δ18O of dissolved sulfate as biotic tracer of biogeochemical influences on arsenic mobilization in groundwater in the Hetao Plain, Inner Mongolia, China[J]. Ecotoxicology, 2014, 23(10): 1958-1968. DOI:10.1007/s10646-014-1310-y |
| [12] |
Huang J H. Impact of microorganisms on arsenic biogeochemistry:A review[J]. Water Air and Soil Pollution, 2014, 225(2): 1848. DOI:10.1007/s11270-013-1848-y |
| [13] |
Burton E D, Johnston S G, Kocar B D. Arsenic mobility during flooding of contaminated soil:The effect of microbial sulfate reduction[J]. Environmental Science and Technology, 2014, 48(23): 13660-13667. DOI:10.1021/es503963k |
| [14] |
Wenzel W W, Kirchbaumer N, Prohaska T, et al. Arsenic fractionation in soils using an improved sequential extraction procedure[J]. Analytica Chimica Acta, 2001, 436(2): 309-323. DOI:10.1016/S0003-2670(01)00924-2 |
| [15] |
Gao M X, Hu Z Y, Wang G D, et al. Effect of elemental sulfur supply on cadmium uptake into rice seedlings when cultivated in low and excess cadmium soils[J]. Communications in Soil Science and Plant Analysis, 2010, 41(8): 990-1003. DOI:10.1080/00103621003646071 |
| [16] |
Mcbride M B. Environmental chemistry of soils[M]. Oxford: Oxford University Press, 1994.
|
| [17] |
Cummings D, Snoeyenbos-West O, Newby D, et al. Diversity of Geobacteraceae species inhabiting metal-polluted freshwater lake sediments ascertained by 16S rDNA analyses[J]. Microbial Ecology, 2003, 46(2): 257-269. DOI:10.1007/s00248-005-8002-3 |
| [18] |
Jia Y, Bao P, Zhu Y G. Arsenic bioavailability to rice plant in paddy soil:Influence of microbial sulfate reduction[J]. Journal of Soils and Sediments, 2015, 15(9): 1960-1967. DOI:10.1007/s11368-015-1133-3 |
| [19] |
Saalfield S L, Bostick B C. Changes in iron, sulfur, and arsenic speciation associated with bacterial sulfate reduction in ferrihydrite-rich systems[J]. Environmental Science and Technology, 2009, 43(23): 8787-8793. DOI:10.1021/es901651k |
| [20] |
Wilkin R T, Wallschläger D, Ford R G. Speciation of arsenic in sulfidic waters[J]. Geochemical Transactions, 2003, 4(1): 1. DOI:10.1186/1467-4866-4-1 |
| [21] |
Jia Y, Huang H, Sun G X, et al. Pathways and relative contributions to arsenic volatilization from rice plants and paddy soil[J]. Environmental Science and Technology, 2012, 46(15): 8090-8096. DOI:10.1021/es300499a |
| [22] |
O'Day P A, Vlassopoulos D, Root R, et al. The influence of sulfur and iron on dissolved arsenic concentrations in the shallow subsurface under changing redox conditions[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(38): 13703-13708. DOI:10.1073/pnas.0402775101 |
| [23] |
Yang J, Liu Z, Wan X, et al. Interaction between sulfur and lead in toxicity, iron plaque formation and lead accumulation in rice plant[J]. Ecotoxicology and Environmental Safety, 2016, 128: 206-212. DOI:10.1016/j.ecoenv.2016.02.021 |
| [24] |
Fan J L, Hu Z Y, Ziadi N, et al. Excessive sulfur supply reduces cadmium accumulation in brown rice(Oryza sativa L.)[J]. Environmental Pollution, 2010, 158(2): 409-415. DOI:10.1016/j.envpol.2009.08.042 |
| [25] |
Dixit G, Singh A P, Kumar A, et al. Reduced arsenic accumulation in rice(Oryza sativa L.)shoot involves sulfur mediated improved thiol metabolism, antioxidant system and altered arsenic transporters[J]. Plant Physiology and Biochemistry, 2016, 99: 86-96. DOI:10.1016/j.plaphy.2015.11.005 |
| [26] |
Zou L N, Zhang S, Duan D C, et al. Effects of ferrous sulfate amendment and water management on rice growth and metal(loid)accumulation in arsenic and lead co-contaminated soil[J]. Environmental Science and Pollution Research, 2018, 25(9): 8888-8902. DOI:10.1007/s11356-017-1175-8 |
| [27] |
Yang Y P, Zhang H M, Yuan H Y, et al. Microbe mediated arsenic release from iron minerals and arsenic methylation in rhizosphere controls arsenic fate in soil-rice system after straw incorporation[J]. Environmental Pollution, 2018, 236: 598-608. DOI:10.1016/j.envpol.2018.01.099 |
| [28] |
Liu W J, Zhu Y G, Smith F A, et al. Do phosphorus nutrition and iron plaque alter arsenate(As)uptake by rice seedlings in hydroponic culture?[J]. New Phytologist, 2010, 162(2): 481-488. |
 2018, Vol. 37
2018, Vol. 37