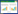文章信息
- 李海龙, 李香真, 聂三安, 李云云, 郑朝元, 王果
- LI Hai-long, LI Xiang-zhen, NIE San-an, LI Yun-yun, ZHENG Chao-yuan, WANG Guo
- 水分管理对Cd-Pb-Zn污染土壤有效态及水稻根际细菌群落的影响
- Effects of two flooding methods on bio-available Cd-Pb-Zn contents of contaminated paddy soil and bacteria community in rice rhizosphere
- 农业环境科学学报, 2018, 37(7): 1456-1467
- Journal of Agro-Environment Science, 2018, 37(7): 1456-1467
- http://dx.doi.org/10.11654/jaes.2018-0726
文章历史
- 收稿日期: 2018-06-01
- 录用日期: 2018-06-25
2. 中国科学院成都生物研究所环境与应用重点实验室, 环境微生物四川省重点实验室, 成都 610041
2. Key Laboratory of Environmental and Applied Microbiology, Chengdu Institute of Biology, Chinese Academy of Sciences, Chengdu 610041, China
水分管理是农业水稻生产的一项重要农艺措施。在重金属污染的农田上,不同的水分条件能够显著影响水稻对重金属如镉(Cd)的吸收和富集[1]。例如,连续淹水能有效降低水稻对Cd的吸收[2],这主要是由于在长期淹水的条件下,一方面Cd2+与Fe2+竞争吸附作用降低水稻对Cd2+吸收富集,另一方面还原条件下形成的S2-与Cd2+形成CdS从而降低Cd2+有效性[3],或者淹水条件下促进了Cd向残渣态的转化[4]。而干湿交替管理,通过频繁的土壤还原和氧化过程的转换,直接影响土壤有机质和矿物结构[5-6],并且氧化还原过程的循环也可以促进土壤重金属如铅和镍的矿化过程,从而降低它们在土壤中的移动性[7-8]。可见,水分管理措施可以影响土壤中重金属的移动性以及形态转化。
微生物活动在土壤物质循环和离子迁移等方面起重要作用[9],对于重金属污染的土壤,王秀丽等[10]通过调查Cd、Pb、Zn和Cu复合污染土壤微生物群落结构发现,重金属污染对于土壤细菌数量和群落结构均有影响。随着重金属污染程度的增加,能够显著降低土壤中细菌的数量[11]。这表明土壤中重金属的含量对细菌群落结构和数量均有抑制性。近年来,土壤中细菌群落和重金属形态之间的关系逐渐引起学者们的重视。Somenahally等[12]发现,长期淹水能够有效提高土壤中铁还原细菌(地杆菌和厌氧粘细菌)的相对丰度,促进了淹水环境下土壤中铁、锰矿物的溶解,进而释放出与铁锰矿物相结合的重金属离子。这说明微生物群落丰度的变化也能够影响重金属的形态转化。
水稻根际区直接受根系分泌物和微生物过程的影响[13-14],所以根际区土壤pH环境、氧气含量、养分分布都不同于非根际土壤[15]。此外,近期研究报道也发现,水稻的根际和非根际细菌群落存在差异性,根表是植物吸收养分、重金属元素的重要通道。因此相比于非根际区,根际区中土壤微生物、理化性质的变化更能影响水稻对于重金属的吸收[16]。当前,针对水稻不同生长期根际区微生物的变化,以及在重金属胁迫下的微生物群落产生哪些动态响应还不明确。
因此,本文研究了在长期淹水和干湿交替两种水分方式下,Cd-Pb-Zn复合污染的农田土壤上水稻不同生长时期水稻根际土壤性质、细菌群落组成和结构的变化以及细菌群落与土壤环境因子之间的关系。
1 材料与方法 1.1 试验材料本研究供试的土壤来自于福建省三明市尤溪县某矿区附近的农田土壤(经度:118°15'17.91″,纬度:26°14' 40.17″),该区域土地长期使用矿区的废水浇灌。土壤基本理化性质如表 1所示,Cd、Pb、Zn含量均显著高于限定标准(GB 15618—1995),为典型的Cd-Pb-Zn复合污染的土壤。试验的水稻品种为常规粳稻(台粳9号),由莆田农科所提供。
盆栽试验于2015年7月至2015年11月在福建农林大学盆栽房中进行。试验共有两个处理组分别为整个生长期淹水(CF)和干湿交替(IF)。每个处理重复3次。具体为:准备6个相同规格(内径25 cm,高24 cm)用75%的医用酒精简易灭菌的塑料桶。每一个塑料桶加7.5 kg风干土样,再添加尿素(2.1 g)、NH4H2PO4(1.2 g)、K2SO4(2.1g)作为基肥与土壤混匀。所有处理组使用去离子水淹水,水层保持3~5 cm,稳定平衡3 d后用来种植水稻。
水稻种子用30%的双氧水消毒30 min,用去离子水冲洗干净后在湿润的石英砂中发芽。一周后将发芽的水稻转移到无重金属污染的土壤继续培养28 d。水稻幼苗于7月4日进行移栽,每盆5株。连续淹水处理:在水稻整个生长时期,保证盆中有3~5 cm的水层。干湿交替处理:水稻移栽后,先保持淹水状态(1~2 cm淹水水层),然后自然蒸发,等到土壤表面有明显的土壤裂纹,再进行下一次的淹水循环。
1.3 样品采集在水稻生长的分蘖期(移栽60 d)和成熟期进行土壤样品采集。根际土壤的收集,采用经典的抖根法。用铲子将水稻根系尽可能完整的取出,先将根系上多余的土壤抖掉,残留在根系的土壤进行回收;然后将根系转移到灭菌的离心管中,加入适量的超纯水(18.2 MΩ·cm-1),5100×g下离心10 min,去掉管子中植物根系,倒掉管子中的上清溶液,固体部分冷冻干燥即为根际土壤。采集的根际土壤样品分为两份:一份用于DNA的提取,另外一份用于土壤有效态的提取。
1.4 测定方法土壤Cd、Pb、Ni和Zn的总量测定采用王水(硝酸/盐酸=1:3,V/V)微波消解法,消煮过程用标准土样(GSS-2,国家物质中心)作为质量控制[17];土壤有效S、Cd、Pb、Ni和Zn采用0.01 mol·L-1 CaCl2溶液,以1:5土液比浸提[18-19]。Cd、Pb、Ni和Zn含量用电感耦合等离子体质谱仪(ICP-MS,Nex-ION300X,Perkin Elmer)测定;SO42-含量由离子色谱仪(Themo Scientific X2100)测定;土壤pH(土:水=1:2.5)用pH计(Mettler-Seven Compact)测定;土壤机械组成采用激光粒度仪(BT-9300ST)测定;有效N含量采用碱解蒸馏法;有效磷采用Olsen法,由紫外分光光度计(TU-1810)测定。土壤有效N、P和S的测定添加标准土壤样品(GBW07416a ASA-5,国家物质中心)作为质量控制。
1.5 土壤DNA提取及高通量测序分析土壤DNA的提取使用的是试剂盒Power soil isolation kit(MO BIO Laboratories,Inc.)提取后的DNA浓度和质量由超微量紫外分光光度计(Thermo Fisher Scientific NanoDrop 2000c)测定。
微生物的引物采用细菌通用引物515F(5'-GT-GCCAGCMGCCGCGGTAA - 3')和909R(5'- CCCC-GYCAATTCMTTTRAGT-3'),V4区作为细菌群落的特异识别区。PCR扩增反应采用25 μL体系,包括:1μL的DNA模板;1.5 mmol·L-1 MgCl2溶液,1 μmol·L-1的引物;1×PCR缓冲液和0.5U的ExTaq(TaKaRa,Shiga,Japan)。扩增条件设置:94 ℃预变性3 min,94 ℃变性30 s,56 ℃退火60 s,72 ℃延伸60 s,30个循环。将PCR产物用1.2%浓度的琼脂糖纯化,采用擎科凝胶DNA回收试剂盒,根据测得DNA的浓度,每个样品采集100 μg DNA混样,高通量测序工作委托中国科学院大学成都生物研究所完成。基于IlluminaMiseq测序平台进行16SrRNA基因的测序工作。原始DNA序列利用QIIME(V 1.7.0)软件去除嵌合体,将序列重新优化,相似性达到97%以上的优化序列划分到同一个可操作分类单元(OUT,Operational Taxonomic Units)。
1.6 统计分析数据分析和图形均由Sigmaplot 12.50和SPSS 19.0软件完成,各处理之间的差异分析采用(One-way ANOVA)单因素方差分析,P < 0.05表示显著差异。
2 结果 2.1 水分管理对于细菌群落多样性的影响水分管理对水稻根际细菌群落α多样性指数的影响如表 2所示。Chao1指数表征的是种群丰度,Chao1数值越大表明细菌群落丰富度越高;Shannon指数表征的是群落多样性,Shannon数值越大表明细菌群落多样性越高。由分析结果可知,在水稻分蘖期,CF处理盆栽中Chao1、Shannon与OUT数值均高于IF处理,其中Chao1指数增加达显著水平(P < 0.05),这说明在该时期淹水条件下,根际细菌群落丰富度、多样性均高于干湿交替条件的根际土壤。到了成熟期,两种水分管理下细菌群落Shannon与OUT数值均有增加,CF处理盆栽Chao1指数降低,而IF处理三类指数均有明显的增加,这也使得两种条件对细菌群落α多样性影响差异不明显。
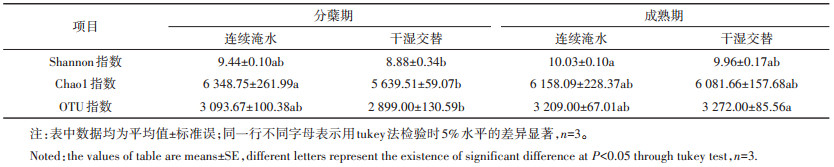
细菌群落结构组成差异性比较,将有读数的OTU按照不同的水分处理进行主成分分析(Principal Component Analysis)。图 1分别表示两种水分管理在水稻分蘖期(A)和成熟期(B)的细菌群落结构。图A和图B通过降维分析分别解释了81.02%和81.18%菌群结构差异,其中分蘖期第一变量轴和第二变量轴分别解释60.34%和20.69%菌群结构差异;成熟期群落结构,第一变量轴和第二变量轴分别解释63.06%和18.16%菌群结构变异。由图 2可知,在水稻分蘖期,连续淹水和干湿交替两种水分条件下,所有处理距离明显,表明土壤OTU组成差异较大,水分管理对群落结构影响差异明显;成熟期,IF处理菌群结构变动较大,而菌群结构受水分管理影响并不明显。说明水分管理对细菌群落结构的影响主要表现在分蘖期。
|
| 图 1 主成分分析(Principal Component Analysis)水稻分蘖期和成熟期两种水分管理对根际细菌群落结构的影响 Figure 1 Effects of flooding regime on bacteria community structure at rice tillering and repining stage through Principal Component Analysis |
|
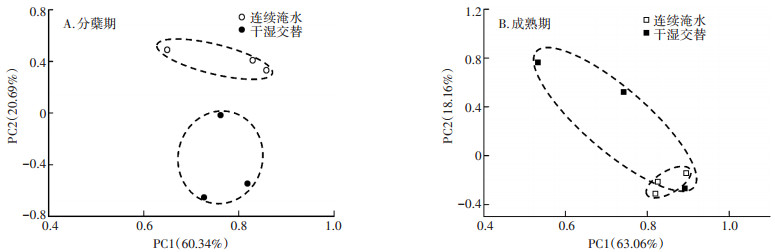
| 图中*表用tukey法检验时5%水平的差异显著,n=3 The * marked represent the existence of significant difference at P < 0.05 through tukey test, n=3 图 2 水分管理对主要细菌群落纲分类单元(%)相对丰度的影响 Figure 2 Effects of flooding regime on bacteria community relative(%)abundance at class taxa level |
两种水分管理措施对细菌群落(门水平)相对丰度的影响见表 3。所有处理的土样(共12个)通过高通量测序分析发现,该土壤细菌群落主要由15个门类组成(相对丰度 > 0.1%的细菌群落)。其中,变形菌门(Proteobacteria)的相对丰度所占比例最高为(33.28±1.64)%~(55.69±0.47)%,是土壤中绝对的优势菌门。其次,绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、酸酐菌门(Acidobacteria)、厚壁菌门(Firmicutes)、泉古菌门(Crenarchaeota)、芽单胞菌门(Gemmatimonadetes)和蓝菌门(Cyanobacteria)的相对丰度在所有处理中均在1%以上,是构成细菌群落的主要菌门。由表 3分析结果可知,在水稻分蘖期,IF盆栽土壤变形菌门(Proteobacteria)相对丰度显著低于CF处理,而厚壁菌门(Firmicutes)的相对丰度显著高于CF处理;在成熟期,IF盆栽土壤变形菌门(Proteobacteria)的相对丰度显著低于CF处理,而芽单胞菌门(Gemmatimonadetes)的相对丰度显著高于CF处理。从水稻分蘖到成熟期,对CF处理而言,变形菌门(Proteobacteria)的相对丰度呈显著降低趋势,而绿弯菌门(Chloroflexi)和绿菌门(Chlorobi)的相对丰度呈显著增加趋势;对IF处理而言,厚壁菌门(Firmicutes)相对丰度呈显著降低趋势,绿弯菌门(Chloroflexi)的相对丰度呈显著增加趋势。
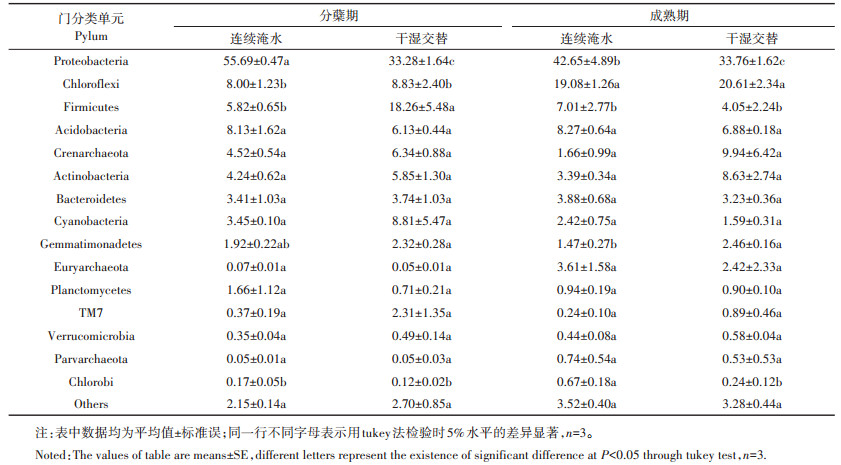
|
基于土壤中主要细菌门类(相对丰度均大于1%),在纲分类单元上,水分调控对细菌群落结构的影响如图 2所示(相对丰度低于0.1%和未命名的细菌群落未在图中展示),将细菌门类菌纲个数小于3的归类为other。本研究观察到28个主要细菌纲类,水分调控对土壤中的δ变形菌纲(Deltaproteobacte ria)、γ变形菌纲(Gammaproteobacteria)、酸杆菌纲(Acidobacteriia)、芽孢杆菌纲(Bacilli)和芽单胞菌纲(Gemmatimonadetes)群落的相对丰度影响达到显著水平(P < 0.05)。具体如下,在水稻分蘖期,CF盆栽土壤的γ变形菌纲相对丰度显著高于IF处理,而芽孢杆菌纲的相对丰度显著低于IF处理;到了水稻成熟期,CF盆栽土壤中δ变形菌纲的相对丰度显著高于IF处理,芽单胞菌纲(Gemmatimonadetes)的相对丰度显著低于IF处理。
受水分管理表现差异显著的5个细菌纲类,在科分类单元上细菌群落丰度组成如图 3所示。在δ变形菌纲(Deltaproteobacteria)下,连续淹水处理,粘球菌科(Myxococcaceae)、地杆菌科(Geobacteraceae)和脱硫弧菌科(Desulfovibrionaceae)相对丰度明显高于干湿交替处理,且在水稻分蘖期,脱硫弧菌科相对丰度淹水处理(0.45%)与干湿交替处理(0.01%)差异最大。到成熟期,地杆菌科相对丰度淹水处理(4.74%)与干湿交替处理(0.65%)差异最大;粘球菌相对丰度淹水处理(4.27%)与干湿交替处理(1.72%)差异明显。在γ变形菌纲(Gammaproteobacteria)下,在连续淹水处理,肠杆菌科(Enterobacteriaceae)和莫拉菌科(Moraxellaceae)平均相对丰度分别是3.57%和2.05%,明显高于干湿交替处理0.82%和0.07%。芽孢杆菌纲(Bacilli)下的Planococcaceae群落丰度差异主要表现在水稻分蘖期,干湿交替处理(10.91%)明显高于淹水处理(0.61%)。酸杆菌纲(Acidobacteriia)下Koribacteraceae丰度差异表现在水稻成熟期,淹水处理(2.09%)高于干湿交替处理(1.19%)。芽单胞菌纲(Gemmatimonadetes)下的Gemmatimonadaceae群落在水稻分蘖期和成熟期丰度分别是0.02%和0.04%,均高于干湿交替处理的两个时期(0.003%和0.005%)。
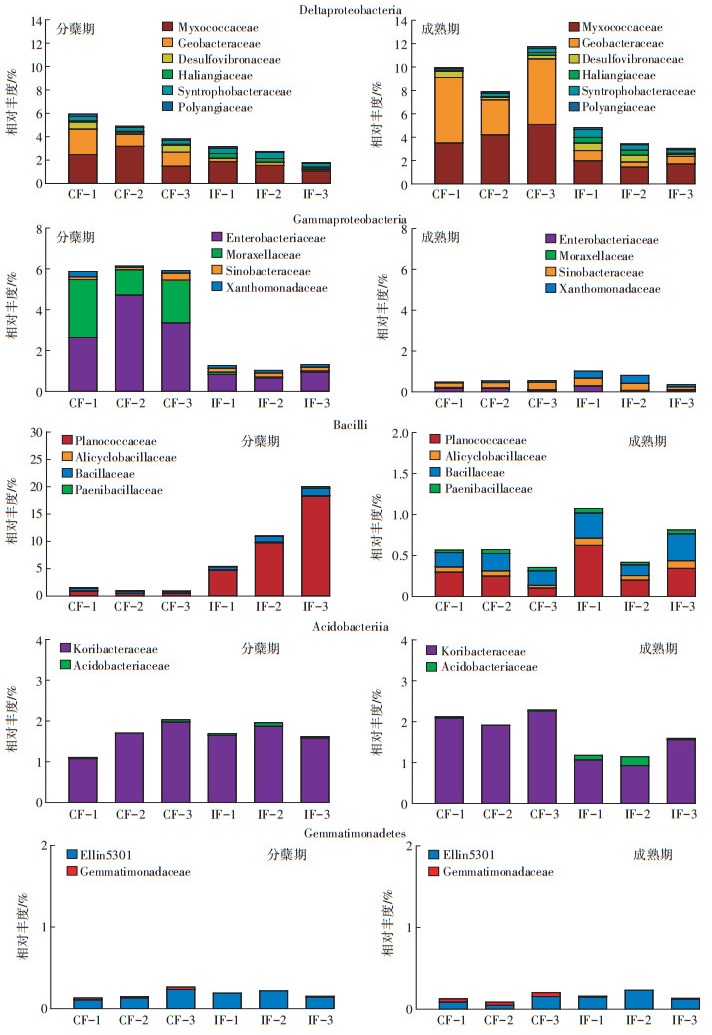
|
| 图中CF表示连续淹水盆栽,IF表示干湿交替盆栽,数字表示同一处理三个平行 F means continous flooding plots; IF means intermittent flooding plots, number means three replication 图 3 不同水分条件下对细菌群落在科分类单元(%)相对丰度的组成 Figure 3 Bacteria community structure at family taxa level(%)under different soil moisture |
两种水分管理措施对土壤pH、养分(有效N、P、S)和有效重金属(CaCl2提取态Cd、Pb、Zn和Ni)的影响见图 4。从图 4看出,成熟期土壤pH显著高于分蘖期(P < 0.05),但水分管理并没有显著影响土壤pH。在分蘖期和CF相比,IF处理显著降低土壤有效N的含量(P < 0.05),而在成熟期CF和IF处理对土壤有效N含量的影响不显著。无论是水稻分蘖期还是成熟期,IF处理均显著增加了土壤有效P的含量(P < 0.05)。和有效N、P不同,成熟期土壤有效S的含量显著高于分蘖期(P < 0.05),而两种水分管理没有显著影响土壤有效S的含量。
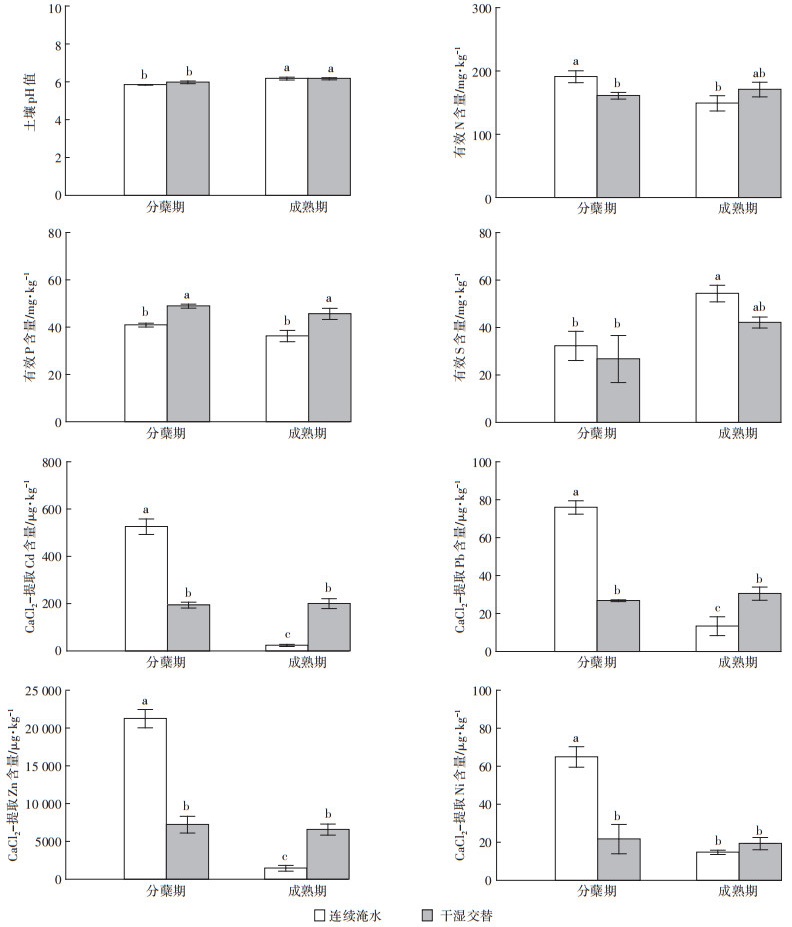
|
| 不同字母表示用tukey法检验时5%水平的差异显著,n=3 Different letters means the existence of significant difference at P < 0.05 through tukey test, n=3 图 4 水分管理对水稻两个生育时期土壤理化性质的影响 Figure 4 Effects of flooding regime on soil physical and chemical properties at rice two growth stages |
本研究用CaCl2浸提的重金属含量代表土壤中重金属的有效性。水分管理对CaCl2浸提的重金属含量与水稻生长时期有很大的相关性。具体为:在水稻分蘖期和CF相比,IF处理显著降低了CaCl2浸提的Cd、Pb、Zn、Ni的含量(P < 0.05)。而在成熟期,和CF处理相比,IF处理则显著增加了CaCl2浸提的Cd、Pb和Zn的含量。此外,就CF处理而言,成熟期Cd、Pb、Zn、Ni的有效性显著低于分蘖期(P < 0.05)。而IF处理,Cd、Pb、Zn、Ni的有效性在水稻生长不同时期没有显著变化。
2.4 细菌群落和土壤理化性质相关关系通过科分类单元相对丰度的细菌群落与土壤理化性质的相关性分析,结果如表 4所示,Geobacteraceae和Gemmatimonadaceae群落丰度和土壤有效P含量有显著负相关性,Planococcaceae群落丰度和土壤有效P含量有显著正相关性,说明土壤中P的有效性是影响该细菌群落的关键因素;此外,Enterobacteriaceae和Moraxellaceae群落丰度和土壤有效Cd、Pb、Zn和Ni含量均有显著正相关性,与此同时,两个细菌群落和土壤pH均呈显著负相关性,和有效N含量呈现显著正相关性。
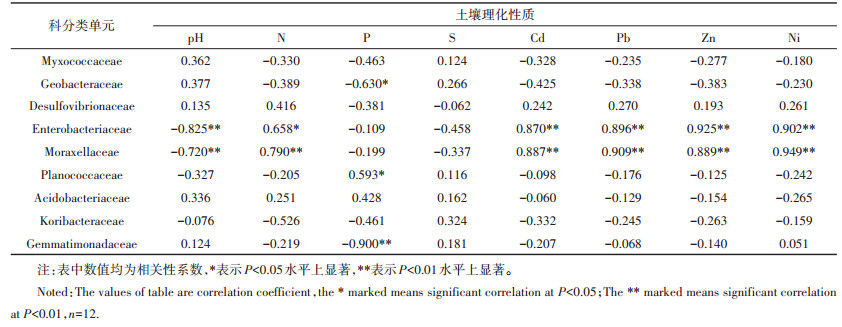
|
本研究发现,水分管理对土壤理化性质的影响显著。在水稻分蘖期,淹水处理土壤重金属有效量(0.01 mol·L-1 CaCl2浸提)明显高于干湿交替处理,通过相关性分析发现,土壤有效硫含量与土壤有效Cd(r= -0.700,P < 0.05)、Pb(r=-0.600,P=0.051)、Zn(r=-0.827,P < 0.05)、Ni(r=-0.791,P < 0.05)含量有明显负相关性,说明土壤有效硫的增加可以显著抑制重金属有效性[20],这与前人研究的结果相一致。而在分蘖期,水分管理对土壤有效S含量影响差异不显著,这表明水分条件通过S元素对重金属的固定差异不显著。此外,淹水环境提高土壤中地杆菌科(Geobacteraceae)群落丰度。地杆菌科是典型铁还原细菌群落,且普遍存于铁还原环境中[21-22]。在属水平上,淹水土壤中,粘球菌科下的厌氧粘细菌属(Anaeromyxobacter)和地杆菌科下地杆菌属(Geobacter)的相对丰度1.86%和1.46%明显高于干湿交替处理0.90%和0.23%,说明在水稻分蘖期,淹水土壤存在丰富的铁还原功能的细菌群落[23-24],表明长期淹水促进Fe(Ⅲ)化合物作为电子受体还原为Fe(Ⅱ)化合物[25],导致土壤中含铁矿物的溶解并释放金属元素到土壤溶液中[12, 26-27]。大量Fe(Ⅱ)离子释放到土壤溶液中,与Cd2+等离子竞争土壤表面吸附位点,促进重金属离子释放进入土壤溶液[28]。到了成熟期,淹水处理土壤重金属有效量明显低于干湿交替处理,这是由于在植稻后期,Fe/Mn氧化物的还原溶解渐渐减弱,而重金属硫化物的沉淀作用居主导所致。可以看出,长期淹水可以显著降低土壤Cd、Zn、Pb、Ni有效量,这一结果已经有大量研究报道[3, 29-30]。与此同时,我们还发现,在整个水稻生长期,干湿交替处理的土壤有效P含量显著高于淹水处理。而早期的研究发现水分管理对土-砂联合体系的有效P含量影响并不明显[31];但是孙国红等[32]通过两年农田红壤土的盆栽试验研究发现连续淹水有效P含量显著高于干湿交替处理的土壤。这说明土壤中有效P的含量可能不仅与水分管理相关,还受到土壤类型影响。此外,土壤pH值是影响重金属有效性的一个重要因素,普遍认为土壤pH值的升高能够降低土壤重金属(如:Cd、Zn、Pb、Ni等)的有效性,但是有研究发现:土壤中的P含量对于pH环境有强烈的干扰性,甚至有效Cd含量和pH值出现正相关[33],这反映出土壤pH值改变并不一定会造成Cd形态的相应改变[34],因此可以推知在本研究中不同水分条件下,土壤重金属有效性的变化受到多因素的影响。
通过对细菌群落α多样性(Chao1指数,Shannon指数和OTU)分析发现,在水稻分蘖期,菌群的丰度和多样性受水分条件影响明显,且种群丰富度变化差异显著;到水稻成熟期,两种水分管理下α多样性指数接近。Foulquier等[35]通过调查野外湿地菌群结构发现,不同水分条件并不会显著影响菌群多样性和OTU丰富度。侯海军等[36]关于田间水分管理对稻田细菌群落结构和丰富度影响的研究发现,不同水分条件对细菌群落多样性影响差异不显著。这说明土壤水分条件并不是影响细菌群落α多样性差异的关键因素。土壤中重金属污染程度与细菌群落的丰度和数量有密切关系。有研究报道,土壤重金属(如Pb、Ni等)含量的增加可以提高土壤细菌数量和丰富度[37-38],这与本研究观察到的结果相一致。说明水稻分蘖期细菌群落α多样性变动和土壤理化性质的差异性有关。
对于细菌群落结构和相对丰度的分析发现,细菌群落的OTU组成在水稻分蘖期受到水分条件影响差异明显,而到成熟期菌群在两种水分条件下OTU结构趋势相近。这主要是来之γ变形菌纲和芽孢杆菌纲群落变化,与干湿交替处理相比,淹水处理下,肠杆菌科(Enterobacteriaceae)和莫拉菌科(Moraxellaceae)相对丰度分别提高了4.37倍和30.7倍,这些菌群的丰度变化与土壤有效Cd、Zn、Pb、Ni含量和土壤pH、有效N含量均有显著相关性。Gati在2017年发表的研究发现,肠杆菌科(Enterobacteriaceae)群落含有多种转运蛋白,对Zn2+毒性的浓度有耐受和体内平衡作用,并且通过ZntB蛋白转运吸收[39]。本研究发现分蘖期淹水环境促进土壤中Zn2+的释放,有助于肠杆菌科群落的新陈代谢活动,促进其相对丰度的显著提高,而后期随着Zn有效性的降低,群落丰度也随着显著降低。莫拉菌科(Moraxellaceae)与肠杆菌科群落的相对丰度变化相一致,但目前针对该群落对重金属敏感性研究还鲜有报道,而莫拉菌科(Moraxellaceae)下不动杆菌属(Acinetocter sp.)菌群,在早期研究也发现该群落对Ni,Pb,Zn的液态环境有耐受性[40-41]。而干湿交替处理下Planococcaceae群落相对丰度比淹水处理的提高了17.77倍,关于Planococcaceae群落研究少有报道,本研究发现土壤有效磷含量与该菌群丰度呈正相关。到水稻成熟期,主要的细菌群落结构差异来自δ变形菌纲(Deltaproteobacteria),在淹水环境下地杆菌科(Geobacteraceae)和粘球菌(Myxococcaceae)也比干湿交替处理的相对丰度提高7.27倍和2.48倍,其中土壤有效P含量是影响地杆菌科群落丰度的关键因子,这是因为磷酸盐固定铁离子为Fe3PO4化合物,降低地杆菌科菌群对Fe的利用性,进而降低该细菌群落的生物活性[42]。
4 结论(1)长期淹水能够显著降低土壤有效Cd,Pb,Zn和Ni的含量,而干湿交替对其含量无显著影响,且干湿交替能够维持土壤较高的有效P含量。
(2)水分管理措施本身不会对根际细菌群落α多样性造成显著影响,而土壤理化性质的差异和水分条件的交互影响是造成细菌群落α多样性变动的主要原因。
(3)在分蘖期肠杆菌科(Enterobacteriaceae)和莫拉菌科(Moraxellaceae)丰度变化主要受土壤重金属有效性的影响,Planococcaceae群落变动受土壤有效P的影响;在水稻成熟期,地杆菌科(Geobacteraceae)主要是受到土壤P的有效性影响。
| [1] |
Hu P, Li Z, Yuan C, et al. Effect of water management on cadmium and arsenic accumulation by rice(Oryza sativa L.)with different metal accumulation capacities[J]. Journal of Soils and Sediments, 2013, 13(5): 916-924. DOI:10.1007/s11368-013-0658-6 |
| [2] |
Reid, Robert J, Rodda. Examination of the role of iron deficiency response in the accumulation of Cd by rice grown in paddy soil with variable irrigation regimes[J]. Plant & Soil, 2013, 371(1/2): 219-236. |
| [3] |
纪雄辉, 梁永超, 鲁艳红, 等. 污染稻田水分管理对水稻吸收积累镉的影响及其作用机理[J]. 生态学报, 2007, 27(9): 3930-3939. JI Xiong-hui, LIANG Yong-chao, LU Yan-hong, et al. The effect of water management on the mechanism and rate of uptake and accumulation of cadmium by rice growing in polluted paddy soil[J]. Acta Ecologica Sinica, 2007, 27(9): 3930-3939. |
| [4] |
Zhu Q H, Huang D Y, Liu S L, et al. Flooding-enhanced immobilization effect of sepiolite on cadmium in paddy soil[J]. Journal of Soils & Sediments, 2012, 12(2): 169-177. |
| [5] |
Kögel-Knabner I, Amelung W, Cao Z, et al. Biogeochemistry of paddy soils[J]. Geoderma, 2010, 157(1): 1-14. |
| [6] |
Cheng Y Q, Yang L Z, Cao Z H, et al. Chronosequential changes of selected pedogenic properties in paddy soils as compared with non-paddy soils[J]. Geoderma, 2009, 151(1): 31-41. |
| [7] |
Antimladenovi S, Frohne T, Kresovi M, et al. Biogeochemistry of Ni and Pb in a periodically flooded arable soil:Fractionation and redox-induced (im)mobilization[J]. Journal of Environmental Management, 2017, 186(Pt 2): 141. |
| [8] |
Li Z, Wu L, Zhang H, et al. Effects of soil drying and wetting-drying cycles on the availability of heavy metals and their relationship to dissolved organic matter[J]. Journal of Soils and Sediments, 2015, 15(7): 1510-1519. DOI:10.1007/s11368-015-1090-x |
| [9] |
Paul E A. Soil Microbiology, Ecology, and Biochemistry[M]. New York: Acadmic Press, 2015.
|
| [10] |
王秀丽, 徐建民, 姚槐应, 等. 重金属铜、锌、镉、铅复合污染对土壤环境微生物群落的影响[J]. 环境科学学报, 2003, 23(1): 22-27. WANG Xiu-li, XU Jian-min, YAO Huai-ying, et al. Effects of Cu, Zn, Cd and Pb compound contamination on soil microbial community[J]. Journal of Environmental Sciences, 2003, 23(1): 22-27. |
| [11] |
李小林, 颜森, 张小平, 等. 铅锌矿区重金属污染对微生物数量及放线菌群落结构的影响[J]. 农业环境科学学报, 2011, 30(3): 468-475. LI Xiao -lin, YAN Sen, ZHANG Xiao-ping, et al. Response of microbe quantity and actinomycetes community of heavy metal contaminated soils in lead-zinc mine[J]. Journal of Agro-envrionment Science, 2011, 30(3): 468-475. |
| [12] |
Somenahally A C, Hollister E B, Yan W, et al. Water management impacts on arsenic speciation and iron-reducing bacteria in contrasting rice-rhizosphere compartments[J]. Environmental Science & Technology, 2011, 45(19): 8328. |
| [13] |
Philippot L, Raaijmakers J M, Lemanceau P, et al. Going back to the roots:the microbial ecology of the rhizosphere[J]. Nature Reviews Microbiology, 2013, 11(11): 789-799. DOI:10.1038/nrmicro3109 |
| [14] |
Li X Z, Rui J P, Mao Y J, et al. Dynamics of the bacterial community structure in the rhizosphere of a maize cultivar[J]. Soil Biology & Biochemistry, 2014, 68(2014): 392-401. |
| [15] |
Singh B K, Millard P, Whiteley A S, et al. Unravelling rhizosphere-microbial interactions:opportunities and limitations[J]. Trends in Microbiology, 2004, 12(8): 386-393. DOI:10.1016/j.tim.2004.06.008 |
| [16] |
Edwards J, Johnson C, Santosmedellín C, et al. Structure, variation, and assembly of the root-associated microbiomes of rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(8): 911-20. DOI:10.1073/pnas.1414592112 |
| [17] |
Wang M Y, Chen A K, Wong M H, et al. Cadmium accumulation in and tolerance of rice(Oryza sativa L.)varieties with different rates of radial oxygen loss[J]. Environmental Pollution, 2011, 159(6): 1730-1736. DOI:10.1016/j.envpol.2011.02.025 |
| [18] |
Houba V J D, Novozamsky I, Lexmond T M, et al. Applicability of 0.01 M CaCl2 as a single extraction solution for the assessment of the nutrient status of soils and other diagnostic purposes[J]. Communications in Soil Science & Plant Analysis, 1989, 21(19/20): 2281-2290. |
| [19] |
Sullivan T S, Mcbride M B, Thies J E. Soil bacterial and archaeal community composition reflects high spatial heterogeneity of pH, bioavailable Zn, and Cu in a metalliferous peat soil[J]. Soil Biology & Biochemistry, 2013, 66(11): 102-109. |
| [20] |
Pan Y, Bonten L T C, Koopmans G F, et al. Solubility of trace metals in two contaminated paddy soils exposed to alternating flooding and drainage[J]. Geoderma, 2016, 261: 59-69. DOI:10.1016/j.geoderma.2015.07.011 |
| [21] |
Holmes D E, Finneran K T, O'neil R A, et al. Enrichment of members of the family geobacteraceae associated with stimulation of dissimilatory metal reduction in uranium-contaminated aquifer sediments[J]. Applied & Environmental Microbiology, 2002, 68(5): 2300-2306. |
| [22] |
Islam F S, Gault A G, Boothman C, et al. Role of metal-reducing bacteria in arsenic release from Bengal delta sediments[J]. Nature, 2004, 430(6995): 68-71. DOI:10.1038/nature02638 |
| [23] |
朱超, RateringS, 曲东, 等. 短期淹水培养对水稻土中地杆菌和厌氧粘细菌丰度的影响[J]. 生态学报, 2011, 31(15): 4251-4260. ZHU Chao, Stefan Ratering, QU Dong, et al. Effects of short-term flooding on Geobacteraceae app. and Anaeromyxobacter app. abundance in paddy soil[J]. Acta Ecologica Sinica, 2011, 31(15): 4251-4260. |
| [24] |
Holmes D E, O'neil R A, Vrionis H A, et al. Subsurface clade of Geobacteraceae that predominates in a diversity of Fe(Ⅲ)-reducing subsurface environments[J]. Isme Journal, 2007, 1(8): 663-677. DOI:10.1038/ismej.2007.85 |
| [25] |
Brennan E W, Lindsay W L. The role of pyrite in controlling metal ion activities in highly reduced soils[J]. Geochimica Et Cosmochimica Acta, 1996, 60(19): 3609-3618. DOI:10.1016/0016-7037(96)00162-7 |
| [26] |
Davranche M, Bollinger J C, Bril H. Effect of reductive conditions on metal mobility from wasteland solids:An example from the Mortagnedu-Nord site(France)[J]. Applied Geochemistry, 2003, 18(3): 383-394. DOI:10.1016/S0883-2927(02)00075-6 |
| [27] |
郭京霞, 冯莲莲, 张起佳, 等. 不同钙质钝化剂对稻田土壤溶液中Cd浓度的影响[J]. 农业环境科学学报, 2017, 36(10): 1984-1991. GUO Jing-xia, FENG Lian-lian, ZHANG Qi-jia, et al. Effects of limestone, slaked lime and dolomite on cadmium concentration in the solution of paddy rice soils[J]. Journal of Agro-environment Science, 2017, 36(10): 1984-1991. DOI:10.11654/jaes.2017-1030 |
| [28] |
Fulda B, Voegelin A, Kretzschmar R. Redox-controlled changes in cadmium solubility and solid-phase speciation in a paddy soil As affected by reducible sulfate and copper[J]. Environmental Science & Technology, 2013, 47(22): 12775-12783. |
| [29] |
刘昭兵, 纪雄辉, 彭华, 等. 水分管理模式对水稻吸收累积镉的影响及其作用机理[J]. 应用生态学报, 2010, 21(4): 908-914. LIU Zhao-bing, JI Xiong-hui, PENG hua, et al. Effects and action mechanisms of different water management modes on rice Cd absorption and accumulation[J]. Chinese Journal of Applied Ecology, 2010, 21(4): 908-914. |
| [30] |
田桃, 曾敏, 周航, 等. 水分管理模式与土壤Eh值对水稻Cd迁移与累积的影响[J]. 环境科学, 2017, 38(1): 343-351. TIAN Tao, ZENG Min, ZHOU Hang, et al. Effects of different water managements and soil Eh on migration and accumulation of Cd in rice[J]. Environmental Science, 2017, 38(1): 343-351. |
| [31] |
陈丽娜, 柳晓娟, 刘文菊, 等. 水分管理模式对水稻根区砷铁磷动态变化规律的影响[J]. 水土保持学报, 2009, 23(1): 93-98. CHEN Li-na, LIU Xiao-juan, LIU Wen-ju, et al. Dynamics of As, Fe and P concentrations in the rhizosphere of rice plants growing under three water regimes[J]. Journal of Soil and Water Conservation, 2009, 23(1): 93-98. |
| [32] |
孙国红, 李剑睿, 徐应明, 等. 不同水分管理下镉污染红壤钝化修复稳定性及其对氮磷有效性的影响[J]. 农业环境科学学报, 2015, 34(11): 2105-2113. SUN Guo -hong, LI Jian-rui, XU Ying -ming, et al. Effects of water managementon cadmium stability and nitrogen and phosphorus availability in cadmium polluted red soil after immobilization remediation[J]. Journal of Agro-envrionment Science, 2015, 34(11): 2105-2113. DOI:10.11654/jaes.2015.11.010 |
| [33] |
陈苗苗, 徐明岗, 周世伟, 等. 不同磷酸盐对污染土壤中镉生物有效性的影响[J]. 农业环境科学学报, 2011, 30(2): 255-262. CHEN Miao-miao, XU Ming-gang, ZHOU Shi-wei, et al. Effect of different phosphate on bio-availability of cadmium in contaminated soil[J]. Journal of Agro-environment Science, 2011, 30(2): 255-262. |
| [34] |
Karaca A. Effect of organic wastes on the extractability of cadmium, copper, nickel, and zinc in soil[J]. Geoderma, 2004, 122(2/3/4): 297-303. |
| [35] |
Foulquier A, Volat B, Neyra M, et al. Long-term impact of hydrological regime on structure and functions of microbial communities in riverine wetland sediments[J]. Fems Microbiology Ecology, 2013, 85(2): 211-226. DOI:10.1111/femsec.2013.85.issue-2 |
| [36] |
侯海军, 张文钊, 沈建林, 等. 水分管理对稻田细菌丰度与群落结构的影响[J]. 生态环境学报, 2016, 25(9): 1431-1438. HOU Hai-jun, ZHANG Wen-zhao, SHENG Jian-lin, et al. Effect of water management on soil bacterial abundance and community in the rice paddy field[J]. Ecology and Environmental Science, 2016, 25(9): 1431-1438. |
| [37] |
杨菊云. 根系分泌物对苔草铁膜形成及铅胁迫下对根际环境的影响[D]. 南昌: 南昌大学, 2014. YANG Ju-yun. Impacte of root exudates of Carex cinerascens on iron plaque formation and the rhizosphere under lead stress[D]. Nanchang: Nanchang University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10403-1014055822.htm |
| [38] |
路桃香, 高天鹏, 薛林贵, 等. 金川矿区重金属污染对土壤微生物分布的影响[J]. 环境科学与技术, 2016(9): 37-44. LU Tao-xiang, GAO Tian-peng, XUE Lin-gui, et al. Effect of heavy metal on the distribution of microbial community in Jinchuan Mining Area[J]. Environmental Science & Technology, 2016(9): 37-44. |
| [39] |
Gati C, Stetsenko A, Slotboom D J, et al. The structural basis of proton driven zinc transport by ZntB[J]. Nature Communications, 2017, 8(1): 1313. DOI:10.1038/s41467-017-01483-7 |
| [40] |
Zhang H, Hu X, Lu H. Ni(Ⅱ)and Cu(Ⅱ)removal from aqueous solution by a heavy metal-resistance bacterium:Kinetic, isotherm and mechanism studies[J]. Water Science & Technology, 2017, 76(4): 859-868. |
| [41] |
朱静, 张志东, 宋素琴, 等. 辐射污染区土壤中耐重金属细菌的分离及其多样性[J]. 环境科学与技术, 2013(12): 29-32. ZHU Jing, ZHANG Zhi-dong, SONG Su-qin, et al. Diversity investigation of heavy metal resistant bacteria isolated from radiation-polluted soil[J]. Environmental Science & Technology, 2013(12): 29-32. |
| [42] |
王媛媛. 磷酸盐对水稻土中异化铁还原菌丰度和群落结构的影响[D]. 杨凌: 西北农林科技大学, 2014. WANG Yuan-yuan. Effect of phosphate on abundance and community structure of disimilatory iron -reducing in paddy soil[D]. Yangling: Northwest A & F University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10712-1014430798.htm |
 2018, Vol. 37
2018, Vol. 37