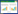文章信息
- 曹健, 陈喆, 吴箐, 吴灼浩, 董汉英, 姚爱军, 仇荣亮, 王诗忠, 何尔凯, 汤叶涛
- CAO Jian, CHEN Zhe, WU Qing, WU Zhuo-hao, DONG Han-ying, YAO Ai-jun, QIU Rong-liang, WANG Shi-zhong, HE Er-kai, TANG Ye-tao
- 基施钢渣及生物炭结合水分管理阻控水稻镉砷吸收研究
- Mitigation of cadmium and arsenic in rice plant by soil application of steel slag and/or biochar with water management
- 农业环境科学学报, 2018, 37(7): 1475-1483
- Journal of Agro-Environment Science, 2018, 37(7): 1475-1483
- http://dx.doi.org/10.11654/jaes.2018-0719
文章历史
- 收稿日期: 2018-06-01
- 录用日期: 2018-06-19
2. 中山大学环境科学与工程学院, 广州 510275;
3. 广东省环境污染控制与修复技术重点实验室, 广州 510275;
4. 中山大学-致胜土壤环境修复研究中心, 广东 东莞 523000
2. School of Environmental Science and Engineering, Sun Yat-Sen University, Guangzhou 510275, China;
3. Guangdong Provincial Key Lab of Environmental Pollution Control and Remediation Technology, Guangzhou 510275, China;
4. The Joint Soil Remediation Research Center of Sun Yat-Sen University and Topcent Enviro Group LTD, Dongguan 523000, China
水稻是我国的主要粮食作物。由于矿山开采和金属冶炼活动产生的酸性矿山废水排放到矿区及周边农田,使大片农田土壤受到了严重污染,食用受污染的稻米已成为人体摄入多种重金属的重要途径[1-3]。2014年公布的全国土壤污染状况调查公报显示,我国耕地污染点位超标率达19.4%,其中,镉(Cd)和砷(As)是主要的2种无机污染物。因此,我国稻田Cd和As的安全利用已关系到国计民生,对稻米Cd和As的有效阻控技术的研发已上升为战略需求。
单独降低稻米Cd或稻米As的研究已有大量报道[3-5],但如何同时阻控稻米中Cd和As的污染却鲜有研究。事实上,在干湿交替的稻田土壤环境中由于Cd和As的化学行为与生物有效性的变化相反,使得稻米Cd和As同时阻控成为一个科学难题[6]。土壤在好氧条件下,Cd容易溶解到土壤溶液中,As易以As (Ⅴ)吸附固定于铁锰氧化物/氢氧化物当中;而在淹水条件下,土壤易形成厌氧环境,Cd易形成CdS沉淀导致其有效性显著降低,As因铁锰氧化物溶解而释放到土壤溶液中并被还原成易被水稻吸收As (Ⅲ) [1, 7]。大量研究表明,水稻抽穗期前后六周持续性淹水能有效抑制稻米中Cd的积累,而好氧灌溉方式可降低稻米中As的含量,但它们都难以达到同时抑制稻米中Cd和As含量的目的[6, 8]。
以CaO、Fe2O3、SiO2为主要成分的炼钢副产物钢渣能够降低土壤中Cd和As的生物有效性[9-11],但采用钢渣同时阻控水稻Cd和As积累的系统研究鲜有见闻。此外,一方面,我们的科学假设认为施加过量的富钙、高铁、丰硅材质的钢渣可能会造成土壤板结等不良影响,但将适量钢渣与生物炭混合施加到土壤中则很可能会改善作物生长的土壤环境[12];另一方面,生物炭具有较大的比表面积和高的阳离子交换量,对多种金属离子都具有较好的吸附作用[13],应该也会对阻控水稻富集Cd和As有益处。
因此,本研究通过室内土柱实验和野外田间实验,考虑田间水分管理方式和钢渣及生物炭施加处理方式,系统研究水分管理和钢渣生物炭对水稻Cd和As的调控效果并探讨相关阻控机制。
1 材料与方法 1.1 供试土壤与改良剂本研究包括2个实验:室内土柱实验和田间小区实验。室内土柱实验供试土壤采自广东中部某县铅锌矿区周边污染稻田,采集足量0~15 cm表层土壤,装袋运回实验室,经土块破碎、拣出碎石残根、自然阴干后,用研钵研磨过10目筛备用。同时选取该地原位污染稻田用于田间小区试验。
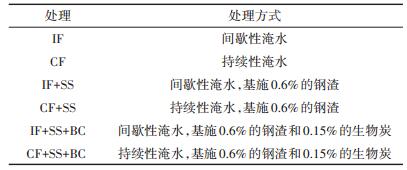
所用钢渣材料从市场购买,生物炭购自浙江泽可生物有限公司,经农业部肥料质量监督检验测试中心检验,符合《NY 525—2002有机肥料》和《GB 18877— 2002有机-无机复混肥料》标准。供试土壤、钢渣和生物炭基本理化性质见表 1。
|
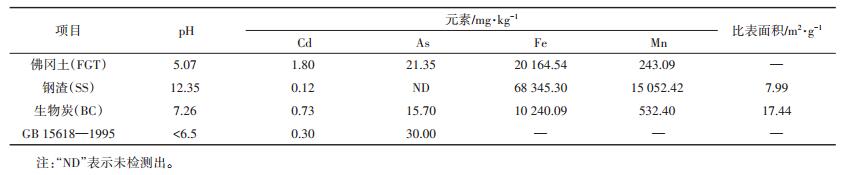
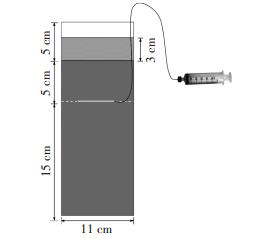
本实验采用自制PVC土柱装置(图 1),土柱内管直径为11 cm,高度为25 cm,底部密封不透水,逐渐往柱内填土至20 cm,使土壤容重为0.974 g·cm-3,淹水平衡两周后,将泥土倒出与改良剂混匀再填入柱内,并在土层高度为15 cm处水平放置土壤溶液采样器(RHIZON FLEX,19.21.26F型取样器,取样头长5 cm,尼龙加固丝,PVC/PE延长管长30 cm,阴性接头,可连接注射器)取样头,延长管贴着管壁伸到外面。
|
| 图 1 自制土柱装置 Figure 1 The soil column device |
实验共设计6种处理(表 2),每种处理3个重复,分别是IF、CF、IF+SS、CF+SS、IF+SS+BC、CF+SS+BC (IF:intermittent flooding,间歇性淹水;CF:continuous flooding,持续性淹水;SS:steel slag,钢渣;BC:biochar,生物炭)。用去离子水对土壤进行淹水管理(共40 d),CF处理始终保持淹水高度在3~5 cm之间,IF处理每次加水至3 cm,待其自然落干后继续加水至3 cm,如此往复;钢渣和生物炭的施加量分别为6 mg·kg-1和1.5 mg·kg-1(钢渣的施用量参考前期研究结果[14];生物炭施用量参考所购生物炭用量说明书)。
供试土壤、钢渣和生物炭的pH用pH计测定(水土比2.5:1);土壤样品、钢渣、生物炭经王水消解后,其Cd和As总量采用ICP-MS测定;钢渣、生物炭比表面积采用BET法测定。土壤pH、Eh用便携式pH、Eh计在土层5 cm深度处测试,土壤溶液中As、Fe、Mn用ICP-OES测定,Cd用AAS测定,Fe2+用邻菲罗啉分光光度法测定,SO42-用铬酸钡分光光度法测定。土壤pH、Eh的测试及土壤溶液的采集在实验的前两周每2 d一次,第3~7周则每4 d采集一次。
1.3 野外田间实验 1.3.1 供试品种田间实验供试水稻品种为籼型三系杂交水稻天优998,种子播种一个月后于2015年4月11日移苗到田间小区中,水稻成熟后2015年7月15日收获,早稻全生育期共计125 d。
1.3.2 实验设计实验共设计了7种处理,每种处理3个重复,分别是:IF、CF、A、CF+SS、A+SS、CF+SS+BC、A+SS+BC(A:aerobic,好氧灌溉)。IF、CF和A 3种不同水分管理方式[6-7]仅在水稻孕穗初期至成熟前期实施,水稻其他生长时期按照当地灌溉方式管理(幼苗期、分蘖期进行淹水管理,分蘖盛期至孕穗初期晒田,成熟末期晒田)。IF和CF处理方式与土柱实验相同,A即适度对土壤进行灌溉,保持土壤75%的湿润条件;SS和BC的施加量与土柱实验一致(按上层表土0~15 cm质量计算)。
1.3.3 采样与分析田间实验土壤pH由pH计测定(水土比2.5:1),Eh用便携式Eh计在土壤5 cm深度处测定;水稻成熟期采集整株水稻,根/茎/叶/壳/糙米分离烘干后,用硝酸高氯酸(5:1)消解,As含量采用ICP-OES和ICPMS测定,Cd含量采用ICP-OES和AAS测定。
1.4 统计方法数据统计分析由Microsoft Excel 2013以及SPSS 20软件完成,数据的绘图用Origin 8.0完成。采用One-way ANOVA法(P < 0.05)进行方差分析,Duncan法(P < 0.05)进行显著性多重比较分析,Pearson系数(P < 0.05)法进行相关性分析。
2 结果与分析 2.1 水分管理和钢渣/生物炭对土壤pH、Eh的影响如图 2,土柱实验中,IF和CF处理土壤pH在淹水后10 d逐渐上升,随后趋于稳定。土壤施加钢渣、钢渣生物炭改良剂,显著提高了土壤pH值。土柱实验施加钢渣、钢渣生物炭的处理(IF+SS、CF+SS、IF+SS+ BC、CF+SS+BC)均使土壤pH值显著高于未施加改良剂的处理(IF、CF),10 d后pH基本稳定在7.5左右,在第40 d时IF+SS、IF+SS+BC较IF处理的pH分别提高了27.2%、24.3%,CF+SS、CF+SS+BC较CF处理的pH分别提高了18.4%、14.0%。
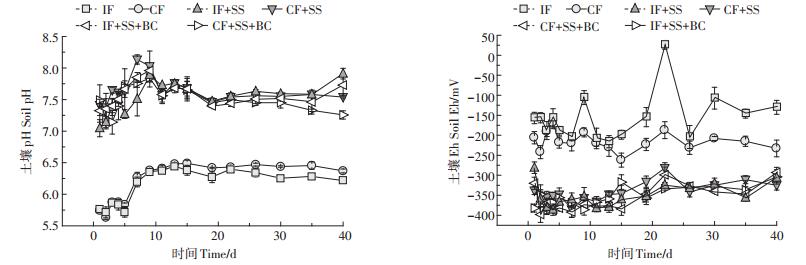
|
| 图 2 水分管理和钢渣/生物炭对土壤pH/Eh的影响 Figure 2 The effect of water management and steel slag/biochar to soil pH、Eh |
土壤Eh变化受到水分管理和钢渣生物炭的显著影响。IF中受土柱内水分含量变化的影响,土壤Eh在IF处理下随时间延长呈间歇性变化(图 2)。当柱内淹水高度为3 cm时,土壤Eh可降到-208 mV,而柱内水分降至最低水平时土壤Eh可升至26.1 mV;与IF处理相比,CF处理土壤Eh相对稳定,始终保持在- 262~-168.6 mV范围内。土壤混入钢渣、钢渣生物炭的处理(IF+SS、CF+SS、IF+SS+BC、CF+SS+BC),土壤Eh在土柱实验全过程中基本小于-300 mV。
在田间实验中,水稻在关键生育期采用间歇性淹水、持续性淹水和好氧灌溉3种水分管理方式。A处理土壤Eh为123.4 mV,CF处理土壤Eh降至-205.5 mV (图 3)。而在好氧灌溉和持续性淹水管理方式下,施加钢渣、钢渣生物炭可导致土壤Eh依次降低。
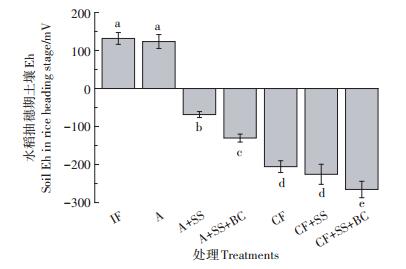
|
| 不同小写字母表示处理间差异显著(P < 0.05)。下同 图 3 水分管理和钢渣、生物炭对水稻抽穗期土壤Eh的影响 Figure 3 The effect of water management and steel slag/biochar on soil Eh in rice heading stage |
土壤环境中Cd和As的生物有效性受水分条件变化的影响极大。事实上,土壤淹水改变土壤氧化还原电位的过程,也是土壤环境氧化还原体系发生改变的过程,当土壤淹水、氧气消耗完后,微生物分解有机质过程依次以NO3-、Mn (Ⅳ)、Fe (Ⅲ)、SO42-、CO2作为最终电子受体,并随之产生N2、Mn(Ⅱ)、Fe(Ⅱ)、H2S、CH4释放到土壤溶液中,这些变化会导致Cd和As在土壤溶液中的含量增加或减少。土柱试验中土壤溶液Fe/Mn/Fe2+/SO42-/Cd/As含量受水分管理和钢渣/生物炭的影响如图 4。
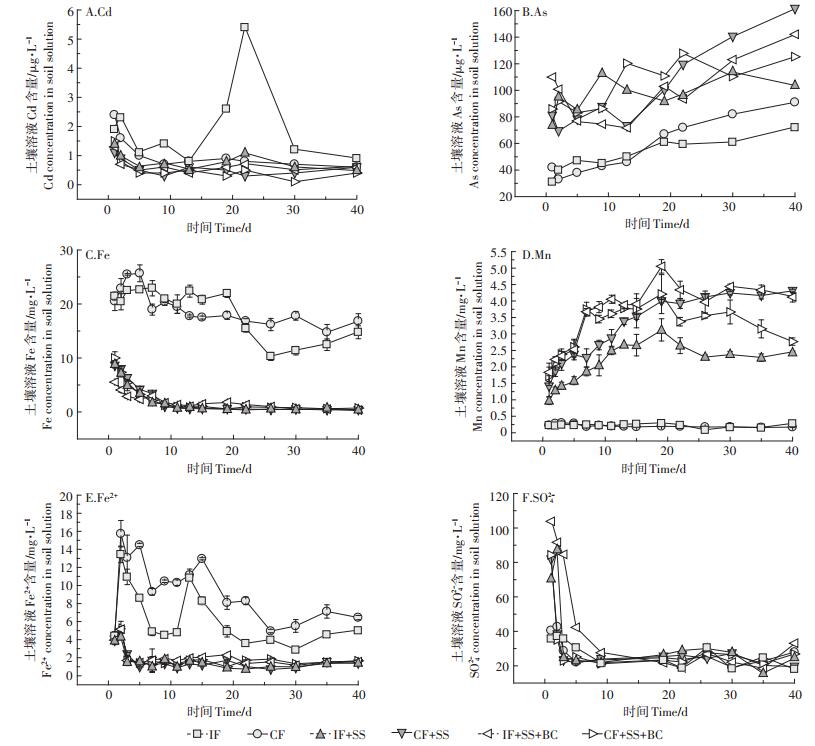
|
| 图 4 水分管理和钢渣/生物炭对土壤溶液Cd/As/Fe/Mn/Fe2+/SO42-含量的影响 Figure 4 The effect of water management and steel slag/biochar on Cd/As /Fe/Mn/Fe2+/SO42-concentration in soil solution |
未施加改良剂处理的土壤溶液中Cd含量受土柱内水分含量变化的影响非常大,CF处理土壤溶液中Cd含量在实验开始后9 d由2.4 μg·L-1下降到0.7 μg· L-1,随后30 d稳定在0.6~0.9 μg·L-1之间,而IF处理在淹水时期土壤溶液Cd含量降低,但在第20 d左右受土柱水分下降到土壤表层的影响,土壤溶液中Cd含量显著上升,达到5.4 μg·L-1。施加钢渣、钢渣生物炭后,土壤溶液中Cd的含量显著降低,且受水分含量变化的影响较小。IF+SS、CF+SS、IF+SS+BC、CF+SS+ BC处理土壤溶液中Cd含量都在土柱实验开始后5 d迅速降低,达到0.5 μg·L-1左右,随后趋于稳定。
土壤溶液As含量受到水分条件的显著影响,在CF处理0~40 d过程中,As在土壤溶液中的含量由42 μg·L-1持续增加到91 μg·L-1;而IF处理的同期过程,土壤溶液中As含量在前段淹水过程持续增加,而在第20 d左右因土柱水层降低到土壤表层以下使土壤Eh显著升高,缓解了土壤溶液中As含量的持续增长。土壤基施钢渣、钢渣生物炭的处理IF+SS、CF+SS、IF+SS+BC、CF+SS+BC),土壤溶液中As的含量明显增加,并且随着时间的增加呈现逐渐增加的趋势。
土壤溶液中Fe含量在IF处理的前20 d稳定在20.0~22.9 mg·L-1之间,当在22 d土壤达到好氧条件时,土壤溶液中Fe含量显著下降,并于第26 d达到最低值10.3 mg·L-1;在CF处理中,土壤溶液中Fe含量先在5 d内增加,达到最高值26.7 mg·L-1,随后缓慢降低,最后稳定在14.7~17.8 mg·L-1之间。土壤基施钢渣及生物炭处理(IF+SS、CF+SS、IF+SS+BC、CF+SS+BC)土壤溶液中Fe含量由最初的5.5~10.0 mg·L-1在10 d内迅速下降到1.0 mg·L-1左右,之后基本保持稳定。
土壤溶液中Mn的含量在IF和CF处理下基本趋于一致,始终在0.30 mg·L-1以下。但IF处理在第22 d土壤达到好氧条件时,土壤溶液中Mn的含量出现了下降,并于第26 d达到最低值0.079 mg·L-1。土壤基施钢渣及生物炭处理(IF+SS、CF+SS、IF+SS+BC、CF+ SS+BC)土壤溶液中Mn的含量显著上升。
土壤溶液中SO42-含量随着淹水的进行逐渐下降,基施钢渣及生物炭处理显著提高了土壤溶液中初始SO42-浓度,但在10 d之后与未施加改良剂处理(IF、CF)趋于平行。
2.3 水分管理和钢渣/生物炭对稻谷产量和水稻体内Cd、As积累的影响早稻种植天优998品种,与当地种植方式IF相比较,CF、A、CF+SS、A+SS、CF+SS+BC和A+SS+BC处理的产量分别增加或减少了4.6%、- 10.1%、13.5%、27.5%、31%、35.8%(图 5)。由此可见,不管是何种水分管理,施加钢渣或钢渣生物炭都能够有效增加水稻的产量,其中尤以钢渣加生物炭增长显著。
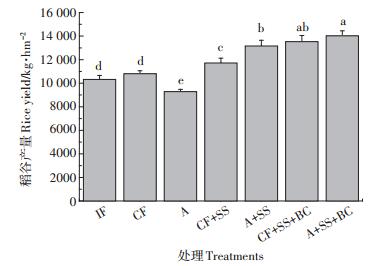
|
| 图 5 水分管理和钢渣/生物炭对水稻产量的影响 Figure 5 The effect of water management and steel slag/biochar on rice yield |
Cd在水稻各器官的浓度大小表现为根>茎>叶>糙米,As在水稻各器官的浓度大小表现为根>叶>茎>糙米(表 3)。在IF、CF、A、CF+SS、A+SS、CF+SS+BC和A+SS+BC 7种处理中,根、茎、叶、糙米中Cd和As含量的相关性如表 4,糙米Cd与根Cd、叶Cd显著正相关(P < 0.05),与茎Cd呈极显著正相关(r=0.965,P < 0.01),此外,糙米Cd还与根As、茎As、糙米As显著负相关(P < 0.05);糙米As与根As极显著正相关(r= 0.920,P < 0.01),与茎As显著正相关(r=0.851,P < 0.05),此外糙米As还与茎Cd、叶Cd呈极显著负相关关系(P < 0.01)。
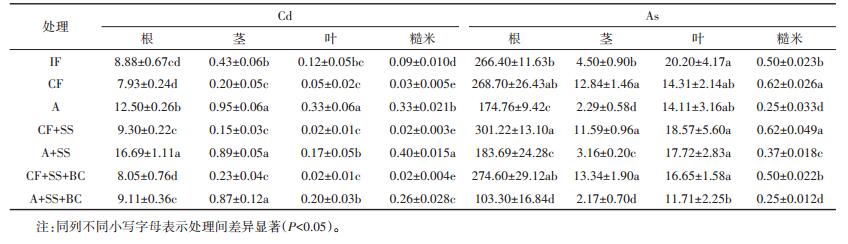
|
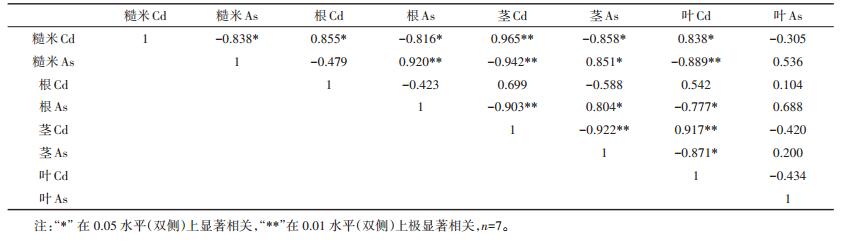
|
水稻成熟后,糙米中Cd和As在不同水分管理和土壤改良方式下的积累量也有显著不同(图 6)。与IF处理下种植的水稻相比,水稻关键生育期(孕穗初期至成熟前期)CF处理糙米中的Cd浓度降低了65.6%,As浓度增加了25%,A处理下种植的水稻糙米Cd浓度增加了263.3%,As浓度减少了50%。
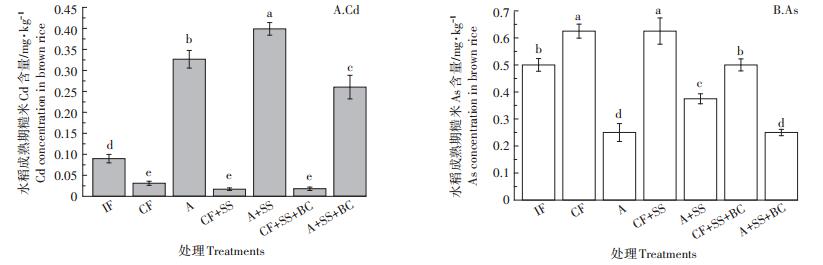
|
| 图 6 水分管理和钢渣/生物炭对糙米Cd和As的阻隔效果 Figure 6 Mitigation of water management and steel slag/biochar on brown rice Cd, As |
水稻关键生育期持续性淹水管理条件下,基施钢渣(CF+SS)种植的水稻糙米Cd含量下降45.2%,As没有明显变化,基施钢渣、生物炭种植(CF+SS+BC)的水稻糙米Cd含量降低了41.9%,As下降了20%;在好氧灌溉方式下,基施钢渣(A+SS)种植的水稻糙米Cd含量增加了22%,As增加了50%,基施钢渣、生物炭(A+SS+BC)种植的水稻糙米Cd含量下降了20.1%,As含量无明显变化。
3 讨论 3.1 水分管理和钢渣/生物炭对Cd、As生物有效性的影响机制水分管理和钢渣/生物炭施加会影响铁在土壤中的形态变化,而铁在土壤环境中的溶解沉淀和形态变化,又会显著影响As和Cd的生物有效性和迁移毒性[15-16],因此关注土壤环境中铁的形态变化尤为重要。当稻田土壤处于淹水还原状态时,三价铁氧化物会经历一个还原溶解的过程,同时土壤溶液中二价铁的浓度将会增加,当土壤Eh进一步降低时,亚铁离子可能会以FeCO3、Fe3(PO4)2·8H2O等沉淀存在,或以铁硫化合物,如FeS和FeS2等沉淀存在;当有氧气存在时,这些亚铁矿物又会被氧化为三价铁及其氧化物[17]。
Fe在土壤溶液中主要存在两种形态:Fe2+和Fe3+。土柱实验中(图 4、表 5),土壤溶液中Fe2+含量在持续性淹水灌溉条件下比在间歇性淹水条件下高,且IF处理下,Fe2+占总Fe含量的比例基本低于50%,IF处理下铁主要以Fe3+为主;而CF处理中,Fe2+占总Fe含量的比例大部分超过50%或接近50%,溶液中以Fe2+为主。当土壤加入钢渣、钢渣生物炭后,4种处理(IF+ SS、CF+SS、IF+SS+BC和CF+SS+BC)下土壤溶液中的Fe2+含量都在7 d左右降低到一个相对稳定的水平,由于总Fe的含量在这个过程也急剧下降,因此在9~40 d时间段,土壤溶液中Fe2+趋近于总Fe含量。
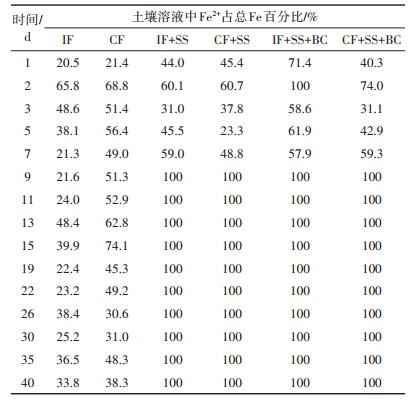
|
钢渣中所含的Fe主要以Fe2O3存在[9],当土壤混入含有大量Fe元素的钢渣后,土壤pH上升到7.0~8.0范围,Eh下降到-300 mV以下,IF+SS、CF+SS、IF+SS+ BC和CF+SS+BC 4种处理土壤溶液中的总Fe和Fe2+都显著下降,由此可见钢渣中的Fe在碱性厌氧条件下难溶于水,并且溶液中的Fe有可能被钢渣吸附沉淀[9, 18],或因强还原条件而形成FeS、FeCO3等沉淀物。
土柱实验中,CF处理的Eh始终保持在-168.6~ -262 mV范围,而pH则由5.74升高到6.37,在这种条件下,土壤溶液中Cd含量有效降低,As的含量持续增加,此外土壤溶液中SO42-在CF处理条件下显著降低,可能是因为在持续厌氧环境下Cd与H2S反应生成难溶性CdS沉淀物[19-21],而As可能是由于在厌氧环境下,铁氧化物溶解,使得吸附在铁氧化物上的As(Ⅴ)溶解到土壤溶液中,并在微生物的作用下被还原成活性更强的As (Ⅲ) [22]。
与持续性淹水不同,IF处理柱内水分含量会因为蒸发而逐渐下降。当IF处理水分含量下降到一个极小值时(22 d左右),Eh上升到26.1 mV,土壤溶液中Fe和Mn含量下降,As的溶解得到缓解,而Cd显著性上升。在这个过程,土壤溶液中Fe、Mn被氧化形成铁锰氧化物沉淀,部分溶解于土壤溶液中的As(Ⅴ)吸附在这些沉淀物上[23],而CdS则被氧化变成CdSO4溶解到土壤溶液中。
钢渣已被证明在水溶液中对Cd和As都具有极强的吸附能力[18, 24],钢渣中所含的Ca可大量溶解于溶液中,在碱性条件下形成无定形的CaCO3,As可与这种CaCO3共沉淀或吸附在钢渣中的铁氧化物中[11, 25];而对Cd的沉淀作用,主要是由于溶液pH提高到大于8情况下,Cd2+与OH-形成Cd(OH)2沉淀[18]。土柱实验研究在土壤持续性淹水和间歇性淹水条件下施加钢渣、钢渣生物炭后都显著改变了土壤的pH和Eh,IF+SS、CF+SS、IF+SS+BC、CF+SS+BC这4种处理在整个实验期间pH在7.00~8.00之间,Eh在-300 mV以下,Cd在土壤溶液中含量极低,而As在溶液中的含量较高。当pH小于8.00时,Cd在溶液中一般以Cd2+和Cd(OH)+存在[18],故可知施加钢渣的4种处理溶液中Cd含量极低并非是与OH-结合生成Cd(OH)2沉淀,而更有可能是由于强还原条件下生成了稳定的CdS沉淀物,另外有研究发现碱性条件下水稻土长期淹水,Cd主要与碳酸盐形成沉淀物质[26],因此Cd也可能是以CdCO3的形态发生沉淀的。土壤施加钢渣处理没有降低As的溶解,反而增加了其在土壤溶液中的含量,可能是在强厌氧条件下,As(Ⅴ)被还原成具有强活性As (Ⅲ)的作用。
3.2 水分管理和钢渣/生物炭对水稻吸收Cd、As的影响田间水分管理会改变Cd和As在土壤环境中的形态并影响其生物有效性,继而影响水稻对它们吸收量的大小。田间实验在水稻孕穗初期至水稻成熟前期运用了间歇性淹水、持续性淹水和好氧灌溉3种水分管理方式,与IF处理下种植的水稻相比,CF处理糙米中的Cd浓度降低了65.6%,As浓度增加了25%,A处理种植的水稻糙米Cd浓度增加了263.3%,As浓度减少了50%,由此可见水稻孕穗初期至水稻成熟前期(55~88 d)之间是水稻Cd和As吸收的关键时期。
田间实验研究发现,与CF处理相比,CF+SS处理土壤pH由5.01提高到6.33,Eh变化不大,水稻糙米Cd含量下降45.2%,As含量没有明显变化。显然,田间实验结果稻米对As的积累与土柱实验As生物有效性的变化不相一致,这主要是因为水稻是一种能够在根系分泌氧气的植物,缓解了钢渣降低土壤Eh的作用。CF+SS+BC处理与CF处理相比,糙米Cd含量降低了41.9%,As含量下降了20%,Eh、pH的变化同单独加钢渣相同,由此可见,生物炭的施加能够起到降低稻米As含量的效果。
而水稻关键生育期在好氧灌溉方式下生产的稻米,A、A+SS和A+SS+BC 3种处理方式下都无法抑制水稻吸收Cd,使得3种处理中稻米Cd含量都超过食品安全国家标准(GB 2762—2012)。与A处理相比,A+SS处理孕穗期土壤pH由5.02上升到7.85,Eh由123.4 mV下降到-68.6 mV,水稻糙米Cd含量增加了22%,As含量增加了50%。稻米Cd含量增加可能是由于添加钢渣使土壤呈还原条件状态(-68.6 mV)导致的,还原过程会使Cd从铁锰氧化物溶解出来,土壤溶液中增加的Fe2+和Mn2+还会和Cd2+竞争吸附位点,从而导致土壤溶液中的Cd2+增加[27];稻米As含量的增加则是因为铁锰氧化物溶解,As失去附着物后溶解出来,As (Ⅴ)被还原成As (Ⅲ),使As在土壤溶液中的含量增加,迁移活性变强[1]。A+SS+BC与A处理相比,糙米Cd含量下降了20.1%,As含量无明显变化。土壤施加钢渣、生物炭后呈强还原环境(-130.4 mV),土壤溶液中SO42-可能被还原成S2-并与Cd2+形成CdS沉淀物,或由于CO32-与Cd2+形成CdCO3沉淀物,导致土壤溶液中Cd2+减少[7, 27],而生物炭的吸附作用和溶解性Ca的共沉淀作用缓解了As在还原条件下的释放[25]。
4 结论(1) Cd和As在水稻体内各组织中的分布存在明显负相关关系,难以同时阻控它们在稻米中的积累。
(2) 基施钢渣/生物炭能够有效提高土壤pH并降低Eh,降低Cd在土壤溶液中的含量,但在好氧灌溉条件下仍无法抑制其向稻米中的迁移。
(3) 持续性淹水条件和间歇性灌溉措施均会增加As在土壤溶液中的含量,基施钢渣生物炭亦难以对As进行吸附,反而会增强As在土壤环境中的活性。
(4) 持续性淹水条件下基施钢渣生物炭对水稻Cd和As同时阻控的效果最好,这或可作为水稻Cd、As同时阻控的有效手段之一。
| [1] |
Zhao F J, Mcgrath S P, Meharg A A. Arsenic as a food chain contaminant:Mechanisms of plant uptake and metabolism and mitigation strategies[J]. Annu Rev Plant Biol, 2010, 61: 535-59. DOI:10.1146/annurev-arplant-042809-112152 |
| [2] |
Zhao F J, Ma Y, Zhu Y G, et al. Soil contamination in China:Current status and mitigation strategies[J]. Environmental Science & Technology, 2015, 49(2): 750-759. |
| [3] |
Newbigging A M, Paliwoda R E, Chris Le X. Rice:Reducing arsenic content by controlling water irrigation[J]. J Environ Sci(China), 2015, 30: 129-131. DOI:10.1016/j.jes.2015.03.001 |
| [4] |
Sebastian A, Prasad M N V. Cadmium minimization in rice:A review[J]. Agronomy for Sustainable Development, 2013, 34(1): 155-173. |
| [5] |
Mahar A, Wang P, Li R, et al. Immobilization of lead and cadmium in contaminated soil using amendments:A review[J]. Pedosphere, 2015, 25(4): 555-568. DOI:10.1016/S1002-0160(15)30036-9 |
| [6] |
Arao T, Kawasaki A, Baba K, et al. Effects of water management on cadmium and arsenic accumulation and dimethylarsinic acid concentrations in Japanese rice[J]. Environmental Science & Technology, 2009, 43(24): 9361-9367. |
| [7] |
Nakamura K, Katou H. Arsenic and cadmium solubilization and immobilization in paddy soils in response to alternate submergence and drainage[M]. Boca Raton: CRC Press, 2012.
|
| [8] |
Hu P J, Li Z, Yuan C, et al. Effect of water management on cadmium and arsenic accumulation by rice(Oryza sativa L.)with different metal accumulation capacities[J]. Journal of Soils and Sediments, 2013, 13(5): 916-924. DOI:10.1007/s11368-013-0658-6 |
| [9] |
Navarro C, Díaz M, Villa-García M A. Physico-chemical characterization of steel slag. Study of its behavior under simulated environmental conditions[J]. Environmental Science & Technology, 2010, 44(14): 5383-5388. |
| [10] |
Qiu H, Gu H H, He E K, et al. Attenuation of metal bioavailability in acidic multi-metal contaminated soil treated with fly ash and steel slag[J]. Pedosphere, 2012, 22(4): 544-553. DOI:10.1016/S1002-0160(12)60039-3 |
| [11] |
Oh C, Rhee S, Oh M, et al. Removal characteristics of As(Ⅲ)and As (Ⅴ)from acidic aqueous solution by steel making slag[J]. J Hazard Mater, 2012, 213-214: 147-155. DOI:10.1016/j.jhazmat.2012.01.074 |
| [12] |
Beesley L, Moreno-Jimenez E, Gomez-Eyles J L, et al. A review of biochars' potential role in the remediation, revegetation and restoration of contaminated soils[J]. Environ Pollut, 2011, 159(12): 3269-3282. DOI:10.1016/j.envpol.2011.07.023 |
| [13] |
Zhang X K, Wang H L, He L Z, et al. Using biochar for remediation of soils contaminated with heavy metals and organic pollutants[J]. Environmental Science and Pollution Research, 2013, 20(12): 8472-8483. DOI:10.1007/s11356-013-1659-0 |
| [14] |
Gu H H, Qiu H, Tian T, et al. Mitigation effects of silicon rich amendments on heavy metal accumulation in rice(Oryza sativa L.)planted on multi-metal contaminated acidic soil[J]. Chemosphere, 2011, 83(9): 1234-1240. DOI:10.1016/j.chemosphere.2011.03.014 |
| [15] |
Neubauer S, Emerson D, Megonigal J. Microbial oxidation and reduction of iron in the root zone and influences on metal mobility[M]. Hoboken: John Wiley and Sons, 2008.
|
| [16] |
Tufano K J, Reyes C, Saltikov C W, et al. Reductive processes controlling arsenic retention:Revealing the relative importance of iron and arsenic reduction[J]. Environmental Science & Technology, 2008, 42(22): 8283-8289. |
| [17] |
Borch T, Kretzschmar R, Kappler A, et al. Biogeochemical redox processes and their impact on contaminant dynamics[J]. Environmental Science & Technology, 2009, 44(1): 15-23. |
| [18] |
Duan J, Su B. Removal characteristics of Cd(Ⅱ)from acidic aqueous solution by modified steel-making slag[J]. Chemical Engineering Journal, 2014, 246: 160-167. DOI:10.1016/j.cej.2014.02.056 |
| [19] |
Bingham F, Page A, Mahler R, et al. Cadmium availability to rice in sludge-amended soil under "flood" and "nonflood" culture[J]. Soil Science Society of America Journal, 1976, 40(5): 715-719. DOI:10.2136/sssaj1976.03615995004000050030x |
| [20] |
Chaney R, Ryan J A, Li Y, et al. Phyto-availability and bio-availability in risk assessment for cadmium in agricultural environments[J]. Sources of Cadmium in the Environment, 1996, 49-78. |
| [21] |
De Livera J, Mclaughlin M J, Hettiarachchi G M, et al. Cadmium solubility in paddy soils:Effects of soil oxidation, metal sulfides and competitive ions[J]. Sci Total Environ, 2011, 409(8): 1489-1497. DOI:10.1016/j.scitotenv.2010.12.028 |
| [22] |
Purakayastha T J. Detoxification of heavy metals:Microbial remediation of arsenic contaminated soil[M]. Verlag Berlin Heidelberg: Springer, 2011.
|
| [23] |
Masscheleyn P H, Delaune R D, Patrick Jr W H. Effect of redox potential and pH on arsenic speciation and solubility in a contaminated soil[J]. Environmental Science & Technology, 1991, 25(8): 1414-1419. |
| [24] |
Kanel S R, Choi H, Kim J-Y, et al. Removal of arsenic(Ⅲ)from groundwater using low-cost industrial by-products-blast furnace slag[J]. Water Quality Research Journal of Canada, 2006, 41(2): 130-139. DOI:10.2166/wqrj.2006.015 |
| [25] |
Camacho J, Wee H Y, Kramer T A, et al. Arsenic stabilization on water treatment residuals by calcium addition[J]. J Hazard Mater, 2009, 165(1/2/3): 599-603. |
| [26] |
Khaokaew S, Chaney R L, Landrot G, et al. Speciation and release kinetics of cadmium in an alkaline paddy soil under various flooding periods and draining conditions[J]. Environ Sci Technol, 2011, 45(10): 4249-4255. DOI:10.1021/es103971y |
| [27] |
Fulda B, Voegelin A, Kretzschmar R. Redox-controlled changes in cadmium solubility and solid-phase speciation in a paddy soil as affected by reducible sulfate and copper[J]. Environ Sci Technol, 2013, 47(22): 12775-12783. DOI:10.1021/es401997d |
 2018, Vol. 37
2018, Vol. 37