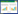文章信息
- 朱丹丹, 周启星
- ZHU Dan-dan, ZHOU Qi-xing
- 功能纳米材料在重金属污染水体修复中的应用研究进展
- A review on the removal of heavy metals from water using nanomaterials
- 农业环境科学学报, 2018, 37(8): 1551-1564
- Journal of Agro-Environment Science, 2018, 37(8): 1551-1564
- http://dx.doi.org/10.11654/jaes.2017-1581
文章历史
- 收稿日期: 2017-11-17
- 录用日期: 2018-02-01
水体重金属污染一直以来受到广泛的关注。重金属污染主要来自于蓄电池、化石燃料、冶金、矿山、金属电镀产业、农药以及化肥等行业[1]。常见的重金属有汞、铬、铅、砷、锌、铜、镍等。重金属具有富集性,难降解以及分布广等特性。重金属通过生物富集作用进入人体内,会对人体健康造成严重的危害,如引起高血压、抑郁、自身免疫障碍疾病,严重者会致癌、对身体功能器官造成损害甚至会导致死亡[2]。20世纪50年代,水俣病(Hg中毒)和骨痛病(Cd中毒)就是重金属所引起的重大污染事件,这在全世界引起了极大的恐慌,人们开始对重金属污染给予极大的关注,并加大力度治理重金属污染。
目前,水体重金属污染的治理方法主要有:化学沉淀法、电化学法、离子交换、超滤、吸附及膜处理技术等,其中吸附技术因其操作简单、去除率高、适用性强、吸附剂可重复利用以及成本低等优点而被广泛应用[3-4]。吸附剂作为吸附技术中不可或缺的一部分,它的选取十分重要,一个好的吸附剂应该具备比表面积大、吸附速率快和达到平衡时间短的优点。纳米材料起源于20世纪70年代,它是指三维空间中至少有一维为纳米尺寸(1~100 nm)或由它们为基本单元组成的材料[5]。由于纳米材料的纳米尺寸效应,纳米材料的表面与界面效应、小尺寸效应、量子尺寸效应与宏观量子隧道效应都会发生变化。纳米晶体粒表面原子数与总原子数之比随粒径变小而急剧增大,这使纳米材料表面拥有很多活性位点,因此纳米材料的吸附活性很强[6-7]。纳米材料因其比表面积大、吸附活性强、溶解速率快等优点而作为热门吸附剂。
纳米材料由于上述优点被广泛应用于水中重金属的去除研究。目前,关于去除水中重金属的纳米材料吸附剂研究有很多,例如碳纳米管,纳米零价铁、金属氧化物、聚合物纳米材料以及各种改性纳米材料。汪婷等[8]利用纳米四氧化三铁去除水中的Pb(Ⅱ)和Cr(Ⅲ)。本文主要综述了纳米材料在水体重金属污染修复领域的应用,并对其去除机理、优缺点以及影响其去除重金属的因素进行了归纳总结。
1 去除重金属的常见纳米材料 1.1 铁基纳米材料 1.1.1 纳米零价铁纳米零价铁最早问世于20世纪90年代,因其高比表面积、高还原性以及高活性而被广泛关注。纳米零价铁为零价,易被氧化,活性较高,是很好的还原剂;纳米零价铁为纳米级尺寸,比表面积很大;纳米零价铁有磁性,容易分离,因此被广泛应用于水中重金属的去除研究[9-10]。
Kanel等[11]研究发现纳米级的零价铁能快速高效地去除水中As(Ⅴ),其反应速率常数是普通零价铁的1000倍左右,因此,纳米零价铁是一种高效去除地下水中As(Ⅴ)的纳米材料。纳米零价铁虽然可以高效去除重金属,但是它易团聚、不稳定、易氧化而且会造成二次污染,因此,其发展受到了限制。为了克服上述问题,开始在纳米零价铁表面增加官能团或者将其附着在稳定剂上进行改性。其一,在纳米零价铁表面掺杂第二种金属来避免其表面氧化。例如Yan等[12]在纳米零价铁中掺杂Pd来防止其表面氧化,以此来提高其活性。研究发现纳米零价铁附着在活性炭上(NZVI/AC)对Cr(Ⅵ)的去除几乎可以达到100%,而且还可以减少在水中的损失[13]。其二,在纳米零价铁中增加稳定剂来防止其团聚。例如Kanel等[14]用聚丙烯酸作为稳定剂对纳米零价铁进行改性,以此来提高纳米零价铁的稳定性。
另外,利用孔结构的材料作为纳米零价铁的载体可以提高其分散性以及防止其表面氧化。Lv等[15]将纳米零价铁与多壁碳纳米管合成复合物用于水中Cr的去除,纳米零价铁颗粒分散在多壁碳纳米管表面或者孔内,从而利用多壁碳纳米管的高比表面积以及孔结构特性来克服纳米零价铁易被氧化以及易团聚的难题,同时多壁碳纳米管的加入还提高了纳米零价铁去除Cr的效率。Shi等[16]利用孔结构的膨润土对纳米零价铁进行改性来克服纳米零价铁易被氧化以及易团聚的难题,并且利用膨润土改性过的纳米零价铁对电镀废水中的Cr、Pb和Cu的去除高达90%以上。Dong等[17]利用生物炭比表面积大、结构稳定而且容易获得等特性将其作为纳米零价铁的负载体来提高纳米零价铁的分散性,其次生物炭表面大量的含氧官能团提高了纳米零价铁与生物炭合成的复合材料的吸附性能,复合材料对Cr(Ⅵ)的去除效率比单一的纳米零价铁更高。另外,相关研究表明海泡石拥有特殊的表面特性和化学稳定性并且成本较低,因此将海泡石作为纳米零价铁的载体来去除地下水中的Cr(Ⅵ)和Pb(Ⅱ),研究发现它不仅改善了纳米零价铁的团聚性能而且能高效去除地下水中的很多重金属[18]。
1.1.2 铁氧化物铁氧化物制备简单、成本低,其中磁性铁氧化物还具有易分离特性,因而将其应用于水处理领域去除重金属的研究很多。铁氧化物主要有三种,带磁性的Fe3O4和γ-Fe2O4,以及不带磁性的α-Fe2O3。Shipley等[19]合成了磁铁矿纳米颗粒,并将其用于水(水中含磷酸盐和碳酸盐)中砷的去除,研究发现在磷酸盐和碳酸的存在下,磁铁矿纳米颗粒仍然能够将水中的砷去除。Roy等[20]合成了磁赤铁矿纳米管用来去除水中Cu2+、Zn2+和Pb2+,它被认为是很有前景的一种磁性纳米吸附剂。Karami[21]还将磁铁矿制备成棒状结构,用于去除水中的重金属离子(例如Fe2+、Pb2+、Zn2+、Ni2+、Cd2+和Cu2+)。此外,对铁氧化物进行改性来提高铁氧化物的性能以及对水中重金属的去除效率也被广泛研究。Ge等[22]利用3-氨基丙基三乙氧基硅烷以及丙烯酸和巴豆酸的共聚物对Fe3O4纳米颗粒进行改性并用于水中Pb2+、Zn2+、Cd2+和Cu2+的去除,改性提高了Fe3O4纳米颗粒的分散性,并且研究表明改性之后的Fe3O4纳米颗粒对Cu2+的去除比未改性之前高一倍左右。
1.1.3 硫化铁FeS因其独特的分子结构以及表面化学性能[Fe(Ⅱ)和S(-Ⅱ)作为电子供体使FeS成为重要的还原剂]在重金属修复领域起很重要的作用[23]。Liu等[24]将制备的FeS用于水中Hg2+的修复研究,研究结果表明0.4 g·L-1的FeS在20 min内对1 mmol·L-1的Hg2+溶液的去除率高达100%(pH为5.6),其中77%是通过共沉淀反应去除,23%是吸附作用。FeS对水中As(Ⅲ)同样具有高效的去除效率,Gallegos等[25]研究发现0.1~40 g·L-1的FeS悬浮液在pH为5~10的条件下可以高效地去除浓度为1.3×10-5 mol·L-1的As(Ⅲ)。因为FeS独特的性能,FeS还常用于水中Ni、Cr、U(Ⅵ)等的去除研究[26-27]。
1.2 碳基纳米材料 1.2.1 碳纳米管碳纳米管是一维碳纳米材料,主要由呈六边形排列的碳原子构成一层或数层的同轴管。碳纳米管具有很大的比表面、很高的光密度、高介孔与中空结构,并且碳纳米管与污染物分子之间的作用力很强[28]。因此,碳纳米管作为吸附剂被广泛应用于水污染中处理重金属。Di等[29]研究发现碳纳米管对水中Cr(Ⅵ)有很高的去除效率以及吸附容量,碳纳米管在溶液pH为7.5时对水中Cr(Ⅵ)吸附容量最高(吸附容量为20.56 mg·g-1)。由于纯碳纳米管对重金属的吸附容量不够高,而且没有选择性,因此对碳纳米管进行改性被广泛研发。Wang等[30]用硝酸对碳纳米管进行处理(处理时间分别为1、2、6、10 h)并将其用于去除水中Pb(Ⅱ),研究发现经过硝酸处理的碳纳米管比未经硝酸处理的碳纳米管吸附容量大,而且随着处理时间的增长吸附容量变大直到6 h后趋于稳定,研究结果表明酸处理6 h后,碳纳米管的吸附容量为91 mg·g-1,而未经酸处理的碳纳米管的吸附容量仅为7.2 mg·g-1;经过硝酸处理之后在碳纳米管的末端以及缺陷部位形成了很多含氧官能团,这有利于碳纳米管对Pb(Ⅱ)的去除。Li等[31]研究发现经过H2O2、KMnO4和HNO3处理的碳纳米管对Cd(Ⅱ)的吸附是未处理碳纳米管的2~10倍,这是因为经过H2O2、KMnO4和HNO3处理过后碳纳米管表面多了含氧官能团。
除了对碳纳米管进行酸处理之外,还可以对碳纳米管进行嫁接官能团来提高其吸附容量。例如Chen等[32]通过向碳纳米管表面嫁接聚丙乙烯来提高碳纳米管对Co(Ⅱ)的去除率。向碳纳米管表面嫁接3-巯基丙基三乙氧基硅烷、2-乙烯基吡啶、氨基和硫醇基等官能团同样能提高碳纳米管对水中重金属的去除率[33-35]。用金属氧化物对碳纳米管进行改性也是提高碳纳米管重金属去除率的一种方法。很多研究将铁氧化物[36]、铝氧化物[37]和锰氧化物[38]等用于碳纳米管的改性。Ntim等[39]将铁氧化物和碳纳米管复合用于水中As(Ⅲ)和As(Ⅴ)的去除,研究结果发现复合物比单一的碳纳米管的去除效率高出近100倍。
1.2.2 石墨烯石墨烯是由碳原子以sp2杂化方式而形成的蜂窝状平面薄膜,是厚度仅有一个原子层厚度的二维碳材料,它是除金刚石外所有碳晶体的基本组成单元,其中sp2杂化是由同一层的一个s轨道与3个p轨道中的两个形成,是一种比较常见的轨道杂化方式。石墨烯二维延展性很好、比表面积很大且表面含有很多含氧官能团,可以很好地捕捉金属离子,并且可以作为优良的改性载体而合成性能优良的复合材料。因此,石墨烯在环境领域也得到了广泛的关注,例如水中重金属的污染处理。
虽然石墨烯对水中重金属的去除有优势,但因其难以从水中分离,以及单纯石墨烯对重金属的去除率较低,因此很多学者都是将石墨烯进行改性之后再用于水中重金属的去除。将石墨烯与磁性纳米颗粒(如Fe3O4、Fe2O3等)合成复合材料可以使其从水中分离开。Zhu等[40]用热分解法将核壳结构的Fe2O3负载在石墨烯上合成磁性石墨烯复合物(MGNCs),并将其用于水中Cr(Ⅵ)的去除,研究表明磁性石墨烯不仅去除效率提高,而且可以快速将其从水中分离开。Chen课题组[41-42]将Fe3O4纳米颗粒与石墨烯复合用来去除水中Co(Ⅱ)和Cu(Ⅱ),研究表明,此复合物对重金属的去除效率高,并且可以快速从水中分离开。在石墨烯表面嫁接一些聚合物来固定金属离子也可以达到去除水中重金属的目的。Madadrang等[43]在石墨烯表面嫁接乙二胺四乙酸(EDTA)聚合物合成EDTA-石墨烯,用于水中Pb(Ⅱ)去除,研究结果表明嫁接EDTA后对水中Pb(Ⅱ)的去除率提高了,并且此复合物还可以重复利用,避免了二次污染。Liu等[44]在石墨烯表面嫁接新型的胸腺嘧啶来提高对水中Hg(Ⅱ)的去除。Zou等[45]将石墨烯与Mn3O4耦合形成三维空间结构来提高对Sb(Ⅲ)和Sb(Ⅴ)的去除。
1.2.3 活性炭活性炭是碳基材料里面很常见的一种吸附剂,活性炭具有孔结构、大比表面而且成本较低而受到广泛应用,也是商业化很高的一种吸附剂。目前,有人将活性炭用于水中重金属的去除研究,例如对Pb、Cu、Cr、Cd、Zn等的去除。从理论研究来说,活性炭对重金属的吸附效果并不是很好。因此,很多人对活性炭的改性进行了研究以此来提高活性炭的吸附效果。Yao等[46]利用硝酸对活性炭进行改性后用于水中Pb(Ⅱ)的去除,FTIR测试结果表明硝酸改性之后的活性炭表面的含氧官能团增加了。Ge等[47]通过在活性炭表面嫁接丙烯酸合成活性炭复合材料,表面改性之后活性炭对Cd(Ⅱ)的去除率达到98.5%,而且去除效率也很高。
1.3 纳米金属氧化物 1.3.1 锰氧化物及其改性复合物纳米级锰氧化物拥有多晶型结构及较高的比表面积,因此有很高的吸附性能[48]。Zhang等[49]制备了柱状Al2O3改性的p-MnO2将其用于水中Pb(Ⅱ)的去除(制备过程见图 1),并与δ-MnO2和Al2O3进行吸附性能对比,研究发现,改性之后的p-MnO2比表面积变大,吸附效果更好,吸附曲线符合双吸附模型,而δ-MnO2和Al2O3均符合Freundlich模型;并且在其他离子存在的情况下,柱状Al2O3改性的p-MnO2对Pb(Ⅱ)的吸附具有选择性。Bo等[50]通过水热法合成了内核为MnO2外层为Mg-Al的纳米材料,并将其用于水中Pb(Ⅱ)的去除,研究发现0.05 g纳米材料在pH为4的室温下对浓度为50 mg·L-1的Pb(Ⅱ)溶液去除率为96.73%,其吸附符合二级动力学模型,因此锰氧化物对水中Pb(Ⅱ)有很高的去除率。Gheju等[51]将MnO2用于水中Cr(Ⅵ)的去除,研究结果显示,MnO2对Cr(Ⅵ)的去除在1 h之后达到平衡,其去除效率会随着酸度的增加而提高,温度升高对吸附过程起到负面影响,而且在HCO3-、SO42-和H2PO4-离子的存在下吸附过程受到了抑制,研究结果说明MnO2对Cr(Ⅵ)的去除机理主要是静电吸附和特异性吸附。Mallakpour等[52]用化学超声法合成了聚乙烯醇(PVA)/α-MnO2-硬脂酸复合膜用于水中Cd(Ⅱ)的去除,研究结果表明PVA/α-MnO2-硬脂酸复合膜是去除水中Cd(Ⅱ)的一种性能极好的吸附剂,吸附动力学符合二级动力学方程。
铝氧化物也是去除水中重金属的一种传统吸附剂,主要包括α-Al2O3和γ-Al2O3两种氧化物形式。单一的铝氧化物去除机制为吸附,而且去除效率低,因此,后来很多研究集中在铝氧化物的改性。例如利用化学或物理的方式将含有某些供体原子的官能团(如,双硫腙、1,10-菲咯啉、2,4-二硝基苯肼)连在铝氧化物表面,以此来改善铝氧化物对重金属的吸附性能[53-55]。其去除机制主要是这些官能团极易与金属离子形成络合物,从而达到去除重金属的目的。例如,Afkhami等[56]研究发现2,4-二硝基苯肼(DNPH)在十二烷基硫酸钠包裹的铝氧化物表面进行改性可以提高对水中Pb(Ⅱ)、Cd(Ⅱ)、Cr(Ⅲ)、Co(Ⅱ)、Ni(Ⅱ)和Mn(Ⅱ)的去除效率。Zhang等[57]用铁氧化物纳米颗粒沉积在花型铝氧化物表面进行改性,制备出单分散性的γ-Al2O3/Fe(OH)3纳米花复合物,研究发现铁氧化物纳米颗粒的改性提高了纳米复合物的比表面积和孔体积,从而提高了复合物表面吸附点位的密度,因此对水中As(Ⅴ)和Cr(Ⅵ)有很高的去除率,同时他们还在材料表面增加了大量的羟基官能团,羟基可以作为螯合位点将氧的孤对电子给予金属离子从而形成配位键,因此可以进一步提高对As(Ⅴ)和Cr(Ⅵ)的去除率。Jazi等[58]利用有机物来改性SiO2-Al2O3以此来提高Pb(Ⅱ)和Cd(Ⅱ)的去除效率。此外,Mahmoud等[59]用红棓酚作为螯合剂制备了不同类型的杂化有机-无机铝氧化物研究地下水Cr(Ⅲ)、Fe(Ⅲ)、Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)的去除,研究发现杂化有机-无机铝氧化物对水中重金属离子有很高的去除能力和选择性。研究者常用有机物在氧化铝表面嫁接官能团来改性其去除重金属离子的能力,改性之后的氧化铝通过配位键吸附和离子交换来去除水中重金属。
1.3.3 TiO2众所周知,TiO2是典型的n-型半导体,当小于385 nm的波长照射二氧化钛时,价带电子受到激发会向导带跃迁,因此会形成电子(e-)-空穴(h+)对,所形成的电子具有还原反应,能还原具有高还原电位的重金属离子;空穴具有氧化反应,能无选择性地氧化有机污染物;另外,空穴遇到水会产生强氧化的·OH,·OH进一步与污染物发生氧化反应(例如有机物)。TiO2光催化降解有机污染物的研究报道很多,目前有研究发现TiO2也可以与重金属离子发生光催化还原反应,以此来修复水体中重金属污染。例如,Cai等[60]研究了TiO2中空小球对Cr(Ⅵ)的去除影响,结果显示在光照下,TiO2中空小球能将高毒的Cr(Ⅵ)还原为低毒的Cr(Ⅲ)。Zhao等[61]将TiO2纳米颗粒附着在氧化还原石墨烯表面,制备了rGO-TiO2纳米复合物,用于研究水中Cr(Ⅵ)的去除,研究结果与Cai相似,光照下,rGO-TiO2纳米复合物将高毒的Cr(Ⅵ)还原为低毒的Cr(Ⅲ),这主要是因为TiO2高的光催化活性,rGO降低了TiO2的电子-空穴重组,提高了还原效率。
TiO2也会作为吸附剂来去除水中重金属,例如,Luo等[62]研究了TiO2对铜冶炼废水中砷的去除,研究结果显示TiO2的高吸附容量和化学稳定性可以降低污水中重金属浓度而且不会产生污泥,这个结果适用于全球铜冶炼行业。Maleki等[63]用聚酰胺-胺树枝状大分子改性后的TiO2来吸附去除工业污水中的重金属(如Cu2+、Pb2+和Cd2+),研究结果表明所制备的吸附剂对工业污水中的重金属具有很好的吸附效果,经过大分子改性之后,吸附点位增加了,吸附性能提高。
1.3.4 其他氧化物除上述常见金属氧化物外,ZnO也常被用来作为吸附剂高效去除水中重金属。Modwi等[64]制备Cu掺杂ZnO来去除水中Pb(Ⅱ),研究发现该纳米材料对水中Pb(Ⅱ)有很高的吸附性能。Ma等[65]利用新的方法合成了ZnO/PbS异质结构纳米材料用于去除水中Pb(Ⅱ),此纳米材料可以有效避免二次污染。Sun等[66]研究了CeO2微球对水中Cr(Ⅵ)的去除,结果显示CeO2微球对Cr(Ⅵ)的去除率可达到94%。Cui等[67]通过超声方法制备MgO纳米片来吸附水中硒离子,研究结果显示MgO纳米片对水中Se(Ⅳ/Ⅵ)有很高的去除率。
1.4 聚合物纳米材料聚合物纳米材料最早是为凝胶色谱而开发使用的[68]。它拥有巨大的比表面积、完美的机械强度、可控的表面化学成分以及孔径结构,并且它可再生[69]。因此,聚合物纳米材料又被用于药物传递、光学和水处理[70-71]。聚合物纳米材料对重金属的去除具有选择性,但是它吸附容量较低。因此,聚合物纳米材料常与其他颗粒结合来去除水中重金属,以使其性能更优化。Kumar等[72]通过悬浮聚合合成聚合物,并在聚合过程中掺杂Fe和Al双金属,合成的复合物用于去除水中As(Ⅴ)和F离子。他们研究了不同掺杂比例对水中As(Ⅴ)和F离子去除的效果。研究发现铁掺杂在聚合物中可以提高As(Ⅴ)的去除效率,铝掺杂在聚合物中可以提高F离子去除效率,而两者同时掺杂在聚合物中可以同时提高水中As(Ⅴ)和F离子的去除效率。Wei等[73]利用污泥中细胞外聚合物(EPS)来去除水中Cu2+和Zn2+。他们分别对从活性污泥、厌氧颗粒污泥和厌氧絮凝污泥中提取的聚合物进行了研究。研究发现,Cu2+比Zn2+更容易被吸附;从厌氧颗粒污泥中提取的EPS比从活性污泥和厌氧絮凝污泥中提取的EPS活性更强。聚合物纳米材料虽然可以去除水中重金属,但是它还面临着一些挑战,例如去除重金属的选择性以及回收成本等。因此,聚合物纳米材料的研究任重而道远。
1.5 壳聚糖类纳米材料壳聚糖又称脱乙酰甲壳素,是一种由几丁质脱乙酰作用而得到的一种聚合物。壳聚糖表面含有活性羟基和氨基,这些活性基团作为活性结合点位可以通过静电吸引力与重金属结合,因此,壳聚糖对重金属具有很高的吸附性。但是,壳聚糖因为酸稳定性低,机械强度不足、热稳定性低、传质阻力小并且孔隙率和比表面积较低而使其应用受到限制。因此,对壳聚糖的改性研究克服了这些问题,提高了水中重金属的去除率。因为纳米材料具有小尺寸效应,因此很多研究将壳聚糖和纳米材料结合来进行改性。Liu等[74]将纳米零价铁包覆于壳聚糖(CS-nZVI)中用于去除水中Cr(Ⅵ),其去除机理主要是壳聚糖的高吸附性以及纳米零价铁的高还原性,纳米零价铁可以将Cr(Ⅵ)还原为毒性较低的Cr(Ⅲ)。Vaishnavi等[75]制备壳聚糖-磁铁矿纳米复合材料用于去除水中Cr(Ⅵ),壳聚糖-磁铁矿纳米复合材料对Cr(Ⅵ)的吸附效率比单纯壳聚糖的吸附效率高出4倍。Mallakpour等[76]用碳酸钙纳米颗粒改性壳聚糖来提高其热稳定性、疏水性能以及去除Cu(Ⅱ)和Cd(Ⅱ)的效率。
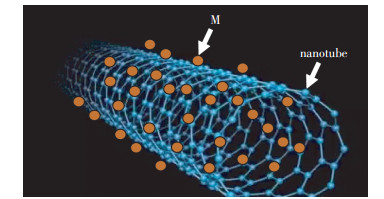
2 纳米材料去除重金属机理 2.1 物理吸附作用吸附作用是纳米材料去除水中重金属的主要方式。纳米材料因比表面积大而具有很高的吸附效率。纳米材料对水中重金属的吸附作用分为物理吸附和化学吸附。物理吸附主要是纳米材料通过分子间的作用力(如范德华力、静电引力等)来吸附重金属。例如具有大比表面的碳纳米管主要通过范德华力与静电吸引力等分子间的作用力将重金属离子固定在碳纳米管表面,从而达到去除重金属的结果,机理见图 2。Li等[41]研究发现石墨烯与Fe3O4复合纳米材料去除水中Cu(Ⅱ)的机制主要也是通过物理吸附作用。Gheju等[51]研究发现MnO2去除水中Cr(Ⅵ)主要是通过静电吸附以及特异性吸附,吸附曲线符合伪二阶吸附模型。Chen课题组[41-42]研究发现Fe3O4纳米颗粒与石墨烯复合物去除水中Co(Ⅱ)和Cu(Ⅱ)的机理主要是石墨烯及Fe3O4纳米颗粒的共吸附作用,其吸附过程是吸热和自发的,并且吸附曲线遵循Langmuir等温线,吸附机制见图 3。
|
| 图 2 碳纳米管去除重金属机理图(M为重金属离子) Figure 2 The possible mechanisms of heavy metal ion removal by nanotubes (M is heavy metal ion) |
|
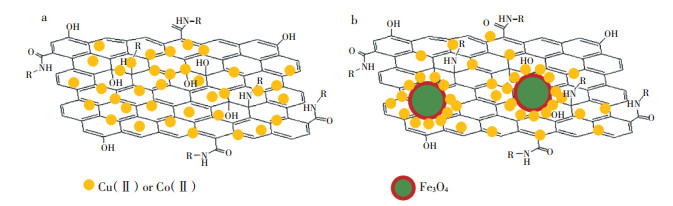
| 图 3 氧化石墨烯(a)及GO/Fe3O4(b)去除水中Cu(Ⅱ)或Co(Ⅱ)的机理图 Figure 3 The adsorption mechanisms on graphene(a)and GO/Fe3O4(b) |
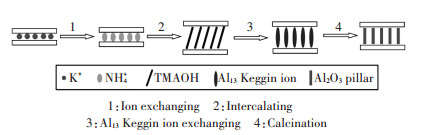
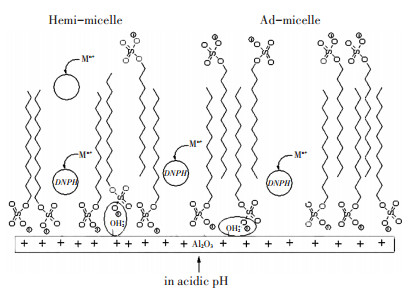
化学吸附是通过电子转移或电子对共用形成化学键或表面配位化合物等方式产生的吸附。能与重金属离子发生化学吸附的纳米材料表面常含有羟基、氨基、羧基等官能团,这些官能团能与重金属离子形成螯合物,或者可以与重金属离子形成离子键与共价键,从而达到去除重金属的效果。Mallakpour等[52]用聚乙烯醇(PVA)将α-MnO2进行表面羟基改性来研究水中Cd(Ⅱ)的去除,因为PVA含有羟基,羟基可以作为螯合位点将氧的孤对电子给予Cd(Ⅱ)金属离子从而形成配位键,以此达到去除水中Cd(Ⅱ)的目的,去除机制见图 4。Afkhami等[56]研究发现2,4-二硝基苯肼(DNPH)改性的铝氧化物可以提高水中Pb(Ⅱ)、Cd(Ⅱ)、Cr(Ⅲ)、Co(Ⅱ)、Ni(Ⅱ)和Mn(Ⅱ)的去除效率主要是因为纳米铝氧化物表面的2,4-二硝基苯肼可以与金属离子形成配合物,从而对重金属离子去除率较高,机理见图 5。壳聚糖聚合物表面的活性羟基和氨基也可以和水中重金属离子形成配合物来去除水中重金属离子。Vaishnavi等[75]研究发现壳聚糖-磁铁矿纳米复合材料去除水中Cr(Ⅵ)的机理主要是:(1)壳聚糖表面带正电的氨基团作为金属的活性结合位点与带负电的重铬酸根离子[Cr(Ⅵ)主要以Cr2O72-、HCrO4-、CrO42-和HCr2O7-的形式存在于水溶液中]产生静电吸引;(2)Cr(Ⅵ)与Fe3O4表面吸附的H+发生离子交换,去除机理图见图 6。一般来说物理吸附以及化学吸附在纳米材料去除重金属离子的吸附过程可能会同时存在。
具有还原性质的纳米材料去除多价重金属的过程中常伴随着氧化还原反应的发生。例如毒性较高Cr(Ⅵ)常被还原为毒性较低的Cr(Ⅲ)。纳米零价铁是零价,活性高,是很好的还原剂,因此,纳米零价铁去除水中重金属离子的机制除了吸附作用还有还原作用。Qu等[13]将纳米零价铁负载在活性炭纤维(ACFnZVI)上来去除水中Cr(Ⅵ),研究发现ACF-nZVI纳米复合物的去除机制有:(1)活性炭纤维以及纳米零价铁的物理吸附作用;(2)纳米零价铁的还原作用。反应体系中,纳米零价铁表面的电子与Cr(Ⅵ)发生反应生成Cr(Ⅲ),然后生成的Cr(Ⅲ)吸附在ACF-nZVI纳米复合物表面去除,其中活性炭纤维充当电子转移介质。Han等[77]研究发现零价铁与零价铝的混合物(ZVI/ZVAl)用于处理废水中的Cr(Ⅵ)、Cd2+、Ni2+、Cu2+和Zn2+的去除机理主要有四种作用方式:(1)ZVI/ ZVAl对重金属的还原作用是主要的去除机制,ZVAl可以还原五种重金属离子,ZVI只能还原Cr(Ⅵ)以及Cu2+;(2)ZVI/ZVAl通过吸附作用去除重金属离子;(3)重金属离子可以形成氢氧化物沉淀,通过共沉淀的方式去除;(4)可以通过电子转换去除,去除机制见图 7。FeS结构中Fe(Ⅱ)和S(-Ⅱ)作为电子供体使FeS成为重要的还原剂,在去除重金属离子过程中发挥重要作用。例如Hyun等[27]制备FeS去除水中U(Ⅵ)的机理主要就是FeS的还原作用。
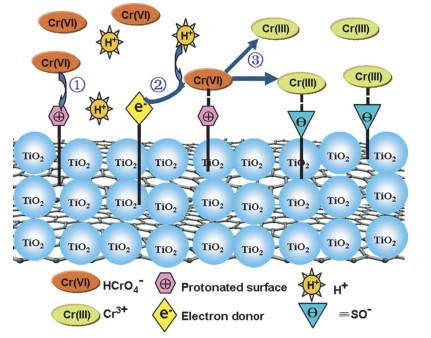
TiO2作为重要的光催化剂,在光照的条件下,价带的电子受到激发会向导带跃迁,因此会形成电子(e-)-空穴(h+)对,所形成的电子具有还原反应,能还原具有高还原电位的重金属离子,例如TiO2可以将Cr(Ⅵ)还原为Cr(Ⅲ)。其去除机理为:大于TiO2禁带能级的光能照射到TiO2表面,使TiO2价带里的电子受到激发而跃迁到导带,跃迁至导带的电子会将Cr(Ⅵ)还原为毒性较低的Cr(Ⅲ),机理示意图见图 8。Zhao等[61]研究发现TiO2纳米颗粒与氧化还原石墨烯复合而成的rGO-TiO2纳米复合物在光照下可以将高毒的Cr(Ⅵ)还原为低毒的Cr(Ⅲ),这主要归功于TiO2高的光催化活性,rGO降低了TiO2的电子-空穴重组,提高了还原效率,其去除机理分三步:(1)Cr(Ⅵ)通过静电作用力附着在rGO-TiO2纳米复合物的表面;(2)通过光照在rGO-TiO2纳米复合物的表面产生的电子与Cr(Ⅵ)发生还原反应生成Cr(Ⅲ);(3)Cr(Ⅲ)通过rGO-TiO2纳米复合物质子化表面与Cr(Ⅲ)的静电斥力或者rGOTiO2纳米复合物表面负的去质子化表面与Cr(Ⅲ)的静电引力释放到水溶液中,去除机理图见图 9。

|
| 图 8 二氧化钛光催化还原Cr(Ⅵ)机理 Figure 8 Proposed mechanism of Cr(Ⅵ) photocatalytic reduction and removal by TiO2 |
纳米材料对水中重金属的去除机理除上述的吸附作用以及还原作用外,还有共沉淀去除机理。Han等[77]研究发现纳米零价铁与零价铝的混合物在去除废水中的Cr(Ⅵ)、Cd2+、Ni2+、Cu2+和Zn2+的过程可与重金属离子形成氢氧化物沉淀,从而达到去除重金属的目的。Liu等[78]将纳米零价铁与Mg(OH)2合成一种新型纳米材料用于去除水中Pb(Ⅱ),研究发现Pb(Ⅱ)可与水中OH-生成Pb(OH)2通过共沉淀的方式去除,其去除过程见公式1~5,其机理图见图 10。Liu[24]等研究发现,FeS主要通过共沉淀的方式去除水中Hg2+[共沉淀方式为FeS+xHg2+⇌xFe2+(HgxFe1-x)S(0 < x≤1)]。
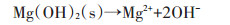 (1)
(1)  (2)
(2) 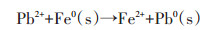 (3)
(3)  (4)
(4) 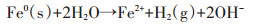 (5)
(5) 一般来说,去除水中重金属的去除机理是多种去除机制共同作用所致,例如,Han等[77]研究发现零价铁与零价铝的混合物去除水中的Cr(Ⅵ)、Cd2+、Ni2+、Cu2+和Zn2+的去除机制包括还原过程、吸附过程、氢氧化物沉淀以及电子转换。Liu等[78]研究发现纳米零价铁与Mg(OH)2合成的新型纳米材料去除水中Pb(Ⅱ)的机制不仅有共沉淀,还有Pb(Ⅱ)被纳米零价铁还原的过程以及Pb(Ⅱ)被吸附的过程。Liu等[74]研究发现纳米零价铁包覆于壳聚糖(CS-NZVI)中去除水中Cr(Ⅵ)的去除机理包括壳聚糖的高吸附性以及纳米零价铁的高还原性。
3 影响纳米材料去除重金属的因素 3.1 溶液pH值溶液pH值是影响纳米材料去除水中重金属的因素之一。溶液pH值不同,纳米材料对重金属的去除效率也不同,其去除机理也会有所不同。Dong等[17]研究发现纳米零价铁改性的生物炭去除水中Cr(Ⅵ)的去除效率会因pH的不同而不同,pH为5时去除效率为35.3%,pH为9时仅为17.6%,而且随着pH值升高去除效率会降低,因此酸环境有助于重金属的去除,这是因为在一系列的还原反应中都有H+的参与(反应式如下),另一方面,低pH下,纳米材料表面带正电,增强了纳米材料与Cr(Ⅵ)的静电吸引力。Roy等[20]研究发现磁铁矿纳米管对Cu2+、Zn2+和Pb2+的去除率会随pH的升高而升高,然后趋于稳定,这是因为高pH环境会让金属离子以氢氧化物的形式沉淀下来;另外,高pH环境有利于吸附剂表面的去质子化,去质子化的加强会使吸附剂表面负电荷点位增加,从而增强了吸附剂表面与Cu2+、Zn2+和Pb2+的吸附,而低pH环境下正电荷点位较多,因此吸附剂表面与Cu2+、Zn2+和Pb2+存在排斥力,从而降低了去除效率。Di等[29]研究发现碳纳米管对Cr(Ⅵ)的去除效率在pH低于7.5时去除率可达90%以上,在pH=8时迅速下降,这是因为pH低于7.5时,碳纳米管表面带正电荷,对带负电荷的Cr(Ⅵ)去除率较高,在pH高于7.5时,碳纳米管表面带负电荷,以此会和Cr(Ⅵ)形成斥力,从而降低Cr(Ⅵ)的去除效率。因此,pH是影响纳米材料去除重金属离子的一个重要因素。
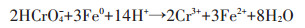 (1)
(1)  (2)
(2) 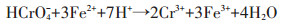 (3)
(3) 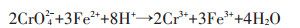 (4)
(4)  (5)
(5) 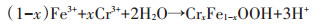 (6)
(6) 重金属离子浓度不同,相同条件下纳米材料对其吸附效果也会不同。Lv等[15]研究发现,在相同实验条件下,纳米零价铁与碳纳米管的复合纳米材料对Cr(Ⅵ)的去除效率会随着Cr(Ⅵ)浓度的增高而降低[Cr(Ⅵ)浓度范围为10~60 mg·L-1],这是因为固定量的复合材料表面的活性点位是固定的,因此随着Cr(Ⅵ)浓度的升高复合材料的去除效率会下降。Dong等[17]研究发现纳米零价铁改性的生物炭去除水中Cr(Ⅵ)的去除效率会随着Cr(Ⅵ)浓度的不同而不同,研究发现Cr(Ⅵ)浓度为2~10 mg·L-1时,单位去除容量随着Cr(Ⅵ)浓度的升高而升高,Cr(Ⅵ)浓度为10~40 mg·L-1时,单位去除容量随着Cr(Ⅵ)浓度的升高而降低,这是因为Cr(Ⅵ)是一种强氧化剂,也是一种nZVI的钝化剂,当Cr(Ⅵ)离子接近铁粒子时,nZVI会被氧化并失去其还原能力,从而导致单位去除能力下降。
3.3 吸附时间一般来说,吸附初始阶段,纳米材料对重金属离子的去除率会随着时间的增加而增加,当达到吸附平衡之后,去除效率就不再变化。Chen等[32]研究发现聚丙乙烯改性的碳纳米管去除Co(Ⅱ)的去除效率在30 min之前会随着时间的上升而升高,到30 min达到最大值,之后趋于平稳,这是因为纳米材料的吸附点位和重金属离子的浓度是固定的,当吸附点位达到饱和后,纳米材料与重金属离子就不会再有作用。Lv等[15]研究发现纳米零价铁与碳纳米管的复合纳米材料对Cr(Ⅵ)的去除效率刚开始会随着时间的增加而增高,继而达到最大值趋于平稳。Li等[41]研究四氧化三铁与石墨烯复合物对水中Cu(Ⅱ)的去除效率随时间的变化,研究结果与上述的结果相似,刚开始复合物对Cu(Ⅱ)的去除效率随时间的增长而升高,随后趋于平稳达到平衡。
3.4 温度在纳米材料去除水中重金属时,溶液的温度会对去除效率产生影响。Wang等[79]研究发现当温度从15 ℃升高至25 ℃时,纳米零价铁与石墨烯复合物对As(Ⅲ)和As(Ⅴ)的去除率逐渐升高,随着温度的进一步升高,去除效率开始降低,这可能是因为温度升高时离子的迁移速率会增大,或者是温度高于30 ℃时表面络合与静电作用力降低。Ge等[47]研究发现在反应温度为303.2~333.2 K时,丙烯酸改性的活性炭复合材料对Cd(Ⅱ)的吸附容量随温度的升高而升高。Zhao等[80]研究发现在温度为293.15~333.15 K时,β-MnO2对Pb(Ⅱ)的去除率随着温度的升高而升高,这可能是因为整个吸附过程为吸热反应,温度升高有助于吸热反应的发生。
3.5 纳米材料的影响纳米材料浓度大小会对重金属离子的去除产生影响,一般会随着纳米材料的浓度增高去除效率会升高。例如Gupta等[81]研究了改性多壁碳纳米管的用量对Hg(Ⅱ)去除的影响,结果发现随着改性多壁碳纳米管用量的增加,Hg(Ⅱ)的去除率也会逐渐增加,这是因为Hg(Ⅱ)浓度固定的情况下,纳米材料用量增加,其表面活性点位也会增加。Xu等[82]也发现β-MnO2对Pb(Ⅱ)的去除率随着β-MnO2浓度的升高而升高。纳米材料的表面性质会对重金属的去除机理产生影响,例如纳米材料中含有活性较高的零价纳米颗粒或者还原性较高的材料时,这些纳米材料对重金属的去除常伴随着还原反应,Han等[77]研究发现零价铁与零价铝的混合物对水中重金属的去除机制主要有还原过程、吸附过程、氢氧化物沉淀以及电子转换。
FeS作为一种重要的还原剂,FeS及其复合物对重金属的去除也常伴随还原反应[23]。纳米材料表面含有有机物以及羧基、氨基或羟基官能团时,其去除机制常伴随有化学配位反应或者表面络合反应。如Mallakpour等[52]制备的聚乙烯醇(PVA)/α-MnO2-硬脂酸复合膜对水中Cd(Ⅱ)的去除机制主要是因为PVA含有的羟基作为螯合位点与金属离子形成的配位键,因此,其去除机理主要是螯合和离子交换。纳米材料晶型也会对水中重金属去除有影响。Xu等[82]将α-MnO2、β-MnO2和γ-MnO2三种晶型的MnO2用于水中Hg0的去除,研究发现相同条件下,γ-MnO2对水中Hg0的去除性能高于β-MnO2,而α-MnO2对水中Hg0的去除性能又高于γ-MnO2。Liu等[74]制备纳米零价铁包覆于壳聚糖(CS-nZVI)用于去除水中Cr(Ⅵ),其去除机理主要是壳聚糖表面的氨基与重金属离子的络合作用以及纳米零价铁的高还原性。
3.6 其他影响因素除了上述影响纳米材料去除重金属的因素外,还有离子强度、其他离子共同存在等的影响。离子强度表示溶液中背景电解质的浓度,会影响双层的厚度和界面电位,进而影响材料与吸附物质的结合。根据Hayes和Leckie的理论,电解质浓度对吸附的影响可以反映吸附类型。当背景电解质对吸附影响大时,可预测为β面吸附,否则为ο面吸附。Lv等[15]研究表明离子强度从0增加至0.05时,纳米零价铁与碳纳米管的复合纳米材料对Cr(Ⅵ)的去除效率会逐渐升高,推断为β面吸附,随着离子强度继续升高至0.1,纳米零价铁与碳纳米管的复合纳米材料对Cr(Ⅵ)的去除效率降低,这是因为Cl-的竞争吸附;此外Lv等[15]研究还发现在其他阴离子存在的情况下,会降低复合纳米材料对Cr(Ⅵ)的去除效率。Chen等[32]研究发现离子强度对聚丙乙烯改性的碳纳米管去除Co(Ⅱ)的影响与pH有关,在低pH下,不论离子强度多少,聚丙乙烯改性的碳纳米管对Co(Ⅱ)都表现出了弱亲和力,高pH下,聚丙乙烯改性的碳纳米管对Co(Ⅱ)的去除不会随着离子强度的改变而改变,只有在pH值5.5~8.0时,Co(Ⅱ)的去除率才会随着离子强度的升高而降低。Zhao等[80]研究发现β-MnO2对Pb(Ⅱ)的去除率不受离子强度的影响,对pH的依赖性较强,因此其吸附机理是表面络合而不是离子交换。Zhang等[49]研究发现在离子强度较低的情况下,增加共离子浓度可以增强柱状Al2O3改性的p-MnO2对水中Pb(Ⅱ)的去除。
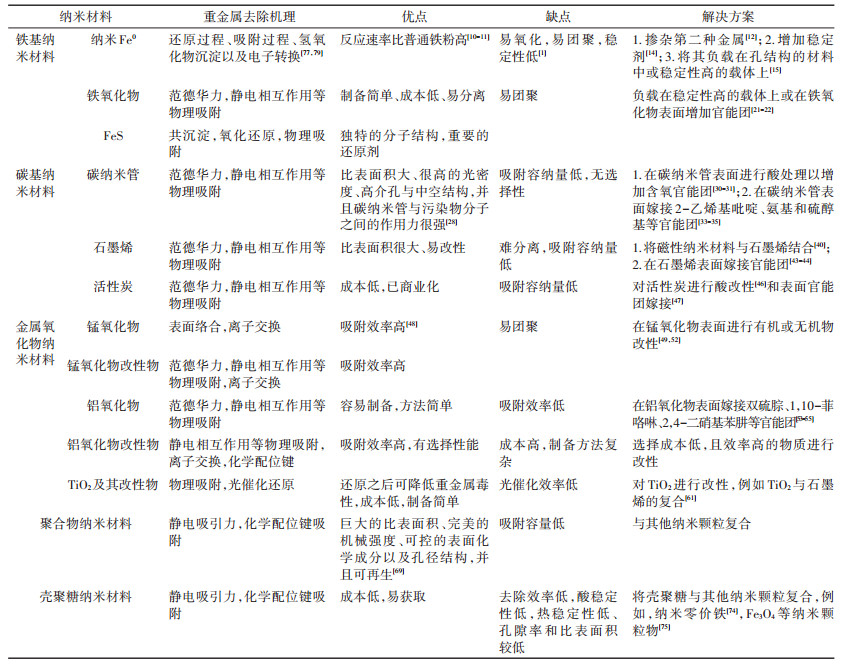
表 1为文中所述几种纳米材料的优缺点以及去除重金属的机理对比。从表 1中可以看出,纳米材料对重金属的去除机理主要是范德华力,静电相互作用等物理吸附,表面嫁接有机物官能团时会伴随化学配位吸附或离子交换,表面用单质金属改性后会伴随还原反应。单一的纳米材料去除效率低或者没有选择性,因此对纳米材料的改性是解决这个问题的方法。从表 1中还可以看出,改性纳米材料制备方法复杂,成本较高,不适用于工程应用。因此,如何降低纳米材料的成本,简化制备纳米材料的程序,并且提高去除重金属的效率是今后的研究热点。
|
纳米材料比表面积大,表面活性位点多,因此对水中重金属具有很高的吸附效率。但是,纳米材料颗粒小,容易团聚和氧化,需要将其进行改性或者与其他材料进行复合,这无疑增加了材料制备的成本以及修复重金属的时间及经济成本,因此,目前纳米材料的研究大多还是在实验室范围内,实际工程范围内的应用还存在很多局限性。
根据国内外纳米材料对重金属污染去除的研究现状和动态,未来纳米材料修复水体重金属污染应从以下几个方面展开:
(1)充分利用纳米材料比表面积大、去除效率高等特点,加大经济高效的纳米材料的研究以替代目前商业中效率低的吸附剂;
(2)开展纳米材料的生态环境安全研究,以及建立纳米材料使用标准,避免在使用纳米材料修复污染环境的同时又带来新的污染问题;
(3)目前纳米材料的制备方法相对繁琐,原材料费用较高,应大力研究制备简单、成本较低的纳米材料来应用于水中重金属的修复;
(4)实验研究方面,可大力开展重金属与有机物或多种重金属联合吸附的研究;
(5)可将纳米材料去除重金属与其他重金属修复联合使用,将纳米材料的优点与其他方法的优点结合起来。纳米材料是一个新兴领域,其在实际应用中的优点不容小觑,因此只要坚持研究,克服纳米材料在应用中的难点,纳米材料就会有广阔的应用前景。
| [1] |
Zou Y, Wang X, Khan A, et al. Environmental remediation and application of nanoscale zero-valent iron and its composites for the removal of heavy metal ions:A review[J]. Environmental Science & Technology, 2016, 50(14): 7290-7304. |
| [2] |
Tang W W, Zeng G M, Gong J L, et al. Impact of humic/fulvic acid on the removal of heavy metals from aqueous solutions using nanomaterials:A review[J]. Science of the Total Environment, 2014, 468: 1014-1027. |
| [3] |
马垚, 于飞, 马杰. 石墨烯/有机物复合吸附剂的设计及其在水处理中的应用[J]. 化学进展, 2017, 29(6): 582-592. MA Yao, YU Fei, MA Jie. Design of graphene/organic composite adsorbent and its application in water treatment[J]. Process in Chemistry, 2017, 29(6): 582-592. DOI:10.7536/PC170125 |
| [4] |
Pan B, Pan B, Zhang W, et al. Development of polymeric and polymerbased hybrid adsorbents for pollutants removal from waters[J]. Chemical Engineering Journal, 2009, 151(1): 19-29. |
| [5] |
Vunain E, Mishra A K, Mamba B B. Dendrimers, mesoporous silicas and chitosan-based nanosorbents for the removal of heavy-metal ions:A review[J]. International Journal of Biological Macromolecules, 2016, 86: 570-586. DOI:10.1016/j.ijbiomac.2016.02.005 |
| [6] |
Nogueira V, Lopes I, Rocha-santos T, et al. Toxicity of solid residues resulting from wastewater treatment with nanomaterials[J]. Aquatic Toxicology, 2015, 165: 172-178. DOI:10.1016/j.aquatox.2015.05.021 |
| [7] |
Adeleye A S, Conway J R, Garner K, et al. Engineered nanomaterials for water treatment and remediation:Costs, benefits, and applicability[J]. Chemical Engineering Journal, 2016, 286: 640-662. DOI:10.1016/j.cej.2015.10.105 |
| [8] |
汪婷, 高滢, 金晓英, 等. 纳米四氧化三铁同步去除水中的Pb (Ⅱ)和Cr (Ⅲ)离子[J]. 环境工程学报, 2013, 7(9): 3476-3482. WANG Ting, GAO Ying, JIN Xiao-ying, et al. Simultaneous removal of Pb(Ⅱ)and Cr(Ⅲ)from wastewater by magnetite nanoparticles[J]. Chinese Journal of Environmental Engineering, 2013, 7(9): 3476-3482. |
| [9] |
高园园, 周启星. 纳米零价铁在污染土壤修复中的应用与展望[J]. 农业环境科学学报, 2013, 32(3): 418-425. GAO Yuan-yuan, ZHOU Qi-xing. Application of nanoscale zero-valent iron to contaminated soil remediation:A review[J]. Journal of AgroEnvironment Science, 2013, 32(3): 418-425. |
| [10] |
王顺利, 王秀红, 周新初, 等. 沸石-纳米零价铁的制备及其对溶液中Cu2+的吸附研究[J]. 农业环境科学学报, 2017, 36(3): 583-590. WANG Shun-li, WANG Xiu-hong, ZHOU Xin-chu, et al. The preparation and application for the composite of nanoscale zero valent ironzeolite adsorption to Cu2+ from aqueous solution[J]. Journal of AgroEnvironment Science, 2017, 36(3): 583-590. DOI:10.11654/jaes.2016-1209 |
| [11] |
Kanel S R, Greneche J M, Choi H. Arsenic(Ⅴ)removal from groundwater using nano scale zero-valent iron as a colloidal reactive barrier material[J]. Environmental Science & Technology, 2006, 40(6): 2045-2050. |
| [12] |
Yan W, Herzing A A, Li X, et al. Structural evolution of Pd-doped nanoscale zero-valent iron(nZVI)in aqueous media and implications for particle aging and reactivity[J]. Environmental Science & Technology, 2010, 44(11): 4288-4294. |
| [13] |
Qu G, Kou L, Wang T, et al. Evaluation of activated carbon fiber supported nanoscale zero-valent iron for chromium(Ⅵ)removal from groundwater in a permeable reactive column[J]. Journal of Environmental Management, 2017, 201: 378-387. DOI:10.1016/j.jenvman.2017.07.010 |
| [14] |
Kanel S R, Goswami R R, Clement T P, et al. Two dimensional transport characteristics of surface stabilized zero-valent iron nanoparticles in porous media[J]. Environmental Science & Technology, 2007, 42(3): 896-900. |
| [15] |
Lv X, Xu J, Jiang G, et al. Removal of chromium (Ⅵ)from wastewater by nanoscale zero-valent iron particles supported on multiwalled carbon nanotubes[J]. Chemosphere, 2011, 85(7): 1204-1209. DOI:10.1016/j.chemosphere.2011.09.005 |
| [16] |
Shi L, Zhang X, Chen Z. Removal of chromium(Ⅵ)from wastewater using bentonite-supported nanoscale zero-valent iron[J]. Water Research, 2011, 45(2): 886-892. DOI:10.1016/j.watres.2010.09.025 |
| [17] |
Dong H, Deng J, Xie Y, et al. Stabilization of nanoscale zero-valent iron(nZVI)with modified biochar for Cr(Ⅵ)removal from aqueous solution[J]. Journal of Hazardous Materials, 2017, 332: 79-86. DOI:10.1016/j.jhazmat.2017.03.002 |
| [18] |
Fu R, Yang Y, Xu Z, Et al. The removal of chromium(Ⅵ)and lead (Ⅱ)from groundwater using sepiolite-supported nanoscale zero-valent iron (S-NZVI)[J]. Chemosphere, 2015, 138: 726-734. DOI:10.1016/j.chemosphere.2015.07.051 |
| [19] |
Shipley H J, Yean S, Kan A T, et al. A sorption kinetics model for arsenic adsorption to magnetite nanoparticles[J]. Environmental Science and Pollution Research, 2010, 17(5): 1053-1062. DOI:10.1007/s11356-009-0259-5 |
| [20] |
Roy A, Bhattacharya J. Removal of Cu(Ⅱ), Zn(Ⅱ)and Pb(Ⅱ) from water using microwave-assisted synthesized maghemite nanotubes[J]. Chemical Engineering Journal, 2012, 211: 493-500. |
| [21] |
Karami H. Heavy metal removal from water by magnetite nanorods[J]. Chemical Engineering Journal, 2013, 219: 209-216. DOI:10.1016/j.cej.2013.01.022 |
| [22] |
Ge F, Li M M, Ye H, et al. Effective removal of heavy metal ions Cd2+, Zn2+, Pb2+, Cu2+ from aqueous solution by polymer-modified magnetic nanoparticles[J]. Journal of Hazardous Materials, 2012, 211: 366-372. |
| [23] |
Gong Y, Tang J, Zhao D. Application of iron sulfide particles for groundwater and soil remediation:A review[J]. Water Research, 2016, 89: 309-320. DOI:10.1016/j.watres.2015.11.063 |
| [24] |
Liu J, Valsaraj K T, Devai I, et al. Immobilization of aqueous Hg(Ⅱ) by mackinawite(FeS)[J]. Journal of Hazardous Materials, 2008, 157(2): 432-440. |
| [25] |
Gallegos T J, Han Y S, Hayes K F. Model predictions of realgar precipitation by reaction of As(Ⅲ)with synthetic mackinawite under anoxic conditions[J]. Environmental Science & Technology, 2008, 42(24): 9338-9343. |
| [26] |
Jo S, Lee J Y, Kong S H, et al. Iron monosulfide as a scavenger for dissolved hexavalent chromium and cadmium[J]. Environmental Technology, 2008, 29(9): 975-983. DOI:10.1080/09593330802166186 |
| [27] |
Hyun S P, Davis J A, Sun K, et al. Uranium(Ⅵ)reduction by iron (Ⅱ)monosulfide mackinawite[J]. Environmental Science & Technology, 2012, 46(6): 3369-3376. |
| [28] |
Abbas A, Al-amer A M, Laoui T, et al. Heavy metal removal from aqueous solution by advanced carbon nanotubes:Critical review of adsorption applications[J]. Separation and Purification Technology, 2016, 157: 141-161. DOI:10.1016/j.seppur.2015.11.039 |
| [29] |
Di Z C, Li Y H, Luan Z K, et al. Adsorption of chromium (Ⅵ)ions from water by carbon nanotubes[J]. Adsorption Science & Technology, 2004, 22(6): 467-474. |
| [30] |
Wang H, Zhou A, Peng F, et al. Mechanism study on adsorption of acidified multiwalled carbon nanotubes to Pb(Ⅱ)[J]. Journal of Colloid and Interface Science, 2007, 316(2): 277-283. DOI:10.1016/j.jcis.2007.07.075 |
| [31] |
Li Y H, Wang S, Luan Z, et al. Adsorption of cadmium(Ⅱ)from aqueous solution by surface oxidized carbon nanotubes[J]. Carbon, 2003, 41(5): 1057-1062. DOI:10.1016/S0008-6223(02)00440-2 |
| [32] |
Chen H, Li J, Shao D, et al. Poly(acrylic acid)grafted multiwall carbon nanotubes by plasma techniques for Co(Ⅱ)removal from aqueous solution[J]. Chemical Engineering Journal, 2012, 210: 475-481. DOI:10.1016/j.cej.2012.08.082 |
| [33] |
Zhang C, Sui J, Li J, et al. Efficient removal of heavy metal ions by thiol-functionalized superparamagnetic carbon nanotubes[J]. Chemical Engineering Journal, 2012, 210: 45-52. DOI:10.1016/j.cej.2012.08.062 |
| [34] |
Ren X, Shao D, Zhao G, et al. Plasma induced multiwalled carbon nanotube grafted with 2-vinylpyridine for preconcentration of Pb(Ⅱ) from aqueous solutions[J]. Plasma Processes and Polymers, 2011, 8(7): 589-598. DOI:10.1002/ppap.v8.7 |
| [35] |
Hadavifar M, Bahramifar N, Younesi H, et al. Adsorption of mercury ions from synthetic and real wastewater aqueous solution by functionalized multi-walled carbon nanotube with both amino and thiolated groups[J]. Chemical Engineering Journal, 2014, 237: 217-228. DOI:10.1016/j.cej.2013.10.014 |
| [36] |
Velikovi Z, Vukovi G D, Marinkovi A D, et al. Adsorption of arsenate on iron (Ⅲ)oxide coated ethylenediamine functionalized multiwall carbon nanotubes[J]. Chemical Engineering Journal, 2012, 181: 174-181. |
| [37] |
Liang J, Liu J, Yuan X, et al. Facile synthesis of alumina-decorated multi-walled carbon nanotubes for simultaneous adsorption of cadmium ion and trichloroethylene[J]. Chemical Engineering Journal, 2015, 273: 101-110. DOI:10.1016/j.cej.2015.03.069 |
| [38] |
Moghaddam H K, Pakizeh M. Experimental study on mercury ions removal from aqueous solution by MnO2/CNTs nanocomposite adsorbent[J]. Journal of Industrial and Engineering Chemistry, 2015, 21: 221-229. DOI:10.1016/j.jiec.2014.02.028 |
| [39] |
Addo Ntim S, Mitra S. Removal of trace arsenic to meet drinking water standards using iron oxide coated multiwall carbon nanotubes[J]. Journal of Chemical & Engineering Data, 2011, 56(5): 2077-2083. |
| [40] |
Zhu J, Wei S, Gu H, et al. One-pot synthesis of magnetic graphene nanocomposites decorated with core@double-shell nanoparticles for fast chromium removal[J]. Environmental Science & Technology, 2011, 46(2): 977-985. |
| [41] |
Li J, Zhang S, Chen C, et al. Removal of Cu(Ⅱ)and fulvic acid by graphene oxide nanosheets decorated with Fe3O4 nanoparticles[J]. ACS Applied Materials & Interfaces, 2012, 4(9): 4991-5000. |
| [42] |
Liu M, Chen C, Hu J, et al. Synthesis of magnetite/graphene oxide composite and application for cobalt(Ⅱ)removal[J]. The Journal of Physical Chemistry C, 2011, 115(51): 25234-25240. DOI:10.1021/jp208575m |
| [43] |
Madadrang C J, Kim H Y, Gao G, et al. Adsorption behavior of EDTAgraphene oxide for Pb(Ⅱ)removal[J]. ACS Applied Materials & Interfaces, 2012, 4(3): 1186-1193. |
| [44] |
Liu L, Ding L, Wu X, et al. Enhancing the Hg(Ⅱ)removal efficiency from real wastewater by novel thymine-grafted reduced graphene oxide complexes[J]. Industrial & Engineering Chemistry Research, 2016, 55(24): 6845-6853. |
| [45] |
Zou J P, Liu H L, Luo J, et al. Three-dimensional reduced graphene oxide coupled with Mn3O4 for highly efficient removal of Sb(Ⅲ)and Sb(Ⅴ)from water[J]. ACS Applied Materials & Interfaces, 2016, 8(28): 18140-18149. |
| [46] |
Yao S, Zhang J, Shen D, et al. Removal of Pb(Ⅱ)from water by the activated carbon modified by nitric acid under microwave heating[J]. Journal of Colloid and Interface Science, 2016, 463: 118-127. DOI:10.1016/j.jcis.2015.10.047 |
| [47] |
Ge H, Wang J. Ear-like poly (acrylic acid) -activated carbon nanocomposite:A highly efficient adsorbent for removal of Cd(Ⅱ)from aqueous solutions[J]. Chemosphere, 2017, 169: 443-449. DOI:10.1016/j.chemosphere.2016.11.069 |
| [48] |
Zhao J, Liu J, Li N, et al. Highly efficient removal of bivalent heavy metals from aqueous systems by magnetic porous Fe3O4-MnO2:Adsorption behavior and process study[J]. Chemical Engineering Journal, 2016, 304: 737-746. DOI:10.1016/j.cej.2016.07.003 |
| [49] |
Zhang H, Gu L, Zhang L, et al. Removal of aqueous Pb(Ⅱ)by adsorption on Al2O3-pillared layered MnO2[J]. Applied Surface Science, 2017, 406: 330-338. DOI:10.1016/j.apsusc.2017.02.011 |
| [50] |
Bo L, Li Q, Wang Y, et al. One-pot hydrothermal synthesis of thrust spherical Mg-Al layered double hydroxides/MnO2 and adsorption for Pb(Ⅱ)from aqueous solutions[J]. Journal of Environmental Chemical Engineering, 2015, 3(3): 1468-1475. DOI:10.1016/j.jece.2015.05.023 |
| [51] |
Gheju M, Balcu I, Mosoarca G. Removal of Cr(Ⅵ)from aqueous solutions by adsorption on MnO2[J]. Journal of Hazardous Materials, 2016, 310: 270-277. DOI:10.1016/j.jhazmat.2016.02.042 |
| [52] |
Mallakpour S, Motirasoul F. Use of PVA/α-MnO2-stearic acid nanocomposite films prepared by sonochemical method as a potential sorbent for adsorption of Cd(Ⅱ)ion from aqueous solution[J]. Ultrasonics Sonochemistry, 2017, 37: 623-633. DOI:10.1016/j.ultsonch.2017.02.025 |
| [53] |
Chandio Z A, Talpur F N, Khan H, et al. On-line preconcentration and determination of ultra trace amounts of mercury using surfactant coated alumina modified by dithizone with cold vapor atomic absorption spectrometry[J]. RSC Advances, 2014, 4(7): 3326-3331. DOI:10.1039/C3RA43712D |
| [54] |
Ghaedi M, Niknam K, Shokrollahi A, et al. Flame atomic absorption spectrometric determination of trace amounts of heavy metal ions after solid phase extraction using modified sodium dodecyl sulfate coated on alumina[J]. Journal of Hazardous Materials, 2008, 155(1): 121-127. |
| [55] |
Shabani A M H, Dadfarnia S, Dehghani Z. On-line solid phase extraction system using 1, 10-phenanthroline immobilized on surfactant coated alumina for the flame atomic absorption spectrometric determination of copper and cadmium[J]. Talanta, 2009, 79(4): 1066-1070. DOI:10.1016/j.talanta.2009.02.008 |
| [56] |
Afkhami A, Saber-Tehrani M, Bagheri H. Simultaneous removal of heavy-metal ions in wastewater samples using nano-alumina modified with 2, 4-dinitrophenylhydrazine[J]. Journal of Hazardous Materials, 2010, 181(1): 836-844. |
| [57] |
Zhang Y, Ye Y, Liu Z, et al. Monodispersed hierarchical aluminum/iron oxides composites micro/nanoflowers for efficient removal of As(Ⅴ)and Cr(Ⅵ)ions from water[J]. Journal of Alloys and Compounds, 2016, 662: 421-430. DOI:10.1016/j.jallcom.2015.12.062 |
| [58] |
Jazi M B, Arshadi M, Amiri M J, et al. Kinetic and thermodynamic investigations of Pb(Ⅱ)and Cd(Ⅱ)adsorption on nanoscale organofunctionalized SiO2-Al2O3[J]. Journal of Colloid and Interface Science, 2014, 422: 16-24. DOI:10.1016/j.jcis.2014.01.032 |
| [59] |
Mahmoud M E, Hafez O F, Osman M M, et al. Hybrid inorganic/organic alumina adsorbents-functionalized-purpurogallin for removal and preconcentration of Cr(Ⅲ), Fe(Ⅲ), Cu(Ⅱ), Cd(Ⅱ)and Pb(Ⅱ) from underground water[J]. Journal of Hazardous Materials, 2010, 176(1): 906-912. |
| [60] |
Cai J, Wu X, Zheng F, et al. Influence of TiO2 hollow sphere size on its photo-reduction activity for toxic Cr(Ⅵ)removal[J]. Journal of Colloid and Interface Science, 2017, 490: 37-45. DOI:10.1016/j.jcis.2016.11.025 |
| [61] |
Zhao Y, Zhao D, Chen C, et al. Enhanced photo-reduction and removal of Cr(Ⅵ)on reduced graphene oxide decorated with TiO2 nanoparticles[J]. Journal of Colloid and Interface Science, 2013, 405: 211-217. DOI:10.1016/j.jcis.2013.05.004 |
| [62] |
Luo T, Cui J, Hu S, et al. Arsenic removal and recovery from copper smelting wastewater using TiO2[J]. Environmental Science & Technology, 2010, 44(23): 9094-9098. |
| [63] |
Maleki A, Hayati B, Najafi F, et al. Heavy metal adsorption from industrial wastewater by PAMAM/TiO2 nanohybrid:Preparation, characterization and adsorption studies[J]. Journal of Molecular Liquids, 2016, 224: 95-104. DOI:10.1016/j.molliq.2016.09.060 |
| [64] |
Modwi A, Khezami L, Taha K, et al. Fast and high efficiency adsorption of Pb(Ⅱ)ions by Cu/ZnO composite[J]. Materials Letters, 2017, 195: 41-44. DOI:10.1016/j.matlet.2017.02.089 |
| [65] |
Ma X, Wang Y, Gao M, et al. A novel strategy to prepare ZnO/PbS heterostructured functional nanocomposite utilizing the surface adsorption property of ZnO nanosheets[J]. Catalysis Today, 2010, 158(3): 459-463. |
| [66] |
Sun J, Wang C, Zeng L, et al. Controllable assembly of CeO2 micro/nanospheres with adjustable size and their application in Cr(Ⅵ)adsorption[J]. Materials Research Bulletin, 2016, 75: 110-114. DOI:10.1016/j.materresbull.2015.11.035 |
| [67] |
Cui W, Li P, Wang Z, et al. Adsorption study of selenium ions from aqueous solutions using MgO nanosheets synthesized by ultrasonic method[J]. Journal of Hazardous Materials, 2018, 341: 268-276. DOI:10.1016/j.jhazmat.2017.07.073 |
| [68] |
Kunin R. The use of macroreticular polymeric adsorbents for the treatment of waste effluents[J]. Pure and Applied Chemistry, 1976, 46(2/3/4): 205-211. |
| [69] |
Pan B, Pan B, Zhang W, et al. Development of polymeric and polymer-based hybrid adsorbents for pollutants removal from waters[J]. Chemical Engineering Journal, 2009, 151(1): 19-29. |
| [70] |
Vauthier C, Bouchemal K. Methods for the preparation and manufacture of polymeric nanoparticles[J]. Pharmaceutical Research, 2009, 26(5): 1025-1058. DOI:10.1007/s11095-008-9800-3 |
| [71] |
Khaydarov R A, Khaydarov R R, Gapurova O. Water purification from metal ions using carbon nanoparticle-conjugated polymer nanocomposites[J]. Water Research, 2010, 44(6): 1927-1933. DOI:10.1016/j.watres.2009.11.041 |
| [72] |
Kumar V, Talreja N, Deva D, et al. Development of bi-metal doped micro-and nano multi-functional polymeric adsorbents for the removal of fluoride and arsenic(Ⅴ)from wastewater[J]. Desalination, 2011, 282: 27-38. DOI:10.1016/j.desal.2011.05.013 |
| [73] |
Wei L, Li Y, Noguera D R, et al. Adsorption of Cu2+ and Zn2+ by extracellular polymeric substances(EPS) in different sludges:Effect of EPS fractional polarity on binding mechanism[J]. Journal of Hazardous Materials, 2017, 321: 473-483. DOI:10.1016/j.jhazmat.2016.05.016 |
| [74] |
Liu T, Zhao L, Sun D, et al. Entrapment of nanoscale zero-valent iron in chitosan beads for hexavalent chromium removal from wastewater[J]. Journal of Hazardous Materials, 2010, 184(1): 724-730. |
| [75] |
Sureshkumar V, Daniel S C G K, Ruckmani K, et al. Fabrication of chitosan-magnetite nanocomposite strip for chromium removal[J]. Applied Nanoscience, 2016, 6(2): 277-285. DOI:10.1007/s13204-015-0429-3 |
| [76] |
Mallakpour S, Khadem E. Chitosan reinforced with modified CaCO3 nanoparticles to enhance thermal, hydrophobicity properties and removal of Cu(Ⅱ)and Cd(Ⅱ)ions[J]. Journal of Polymer Research, 2017, 24(6): 86. DOI:10.1007/s10965-017-1241-4 |
| [77] |
Han W, Fu F, Cheng Z, et al. Studies on the optimum conditions using acid-washed zero-valent iron/aluminum mixtures in permeable reactive barriers for the removal of different heavy metal ions from wastewater[J]. Journal of Hazardous Materials, 2016, 302: 437-446. DOI:10.1016/j.jhazmat.2015.09.041 |
| [78] |
Liu M, Wang Y, Chen L, et al. Mg(OH) 2 supported nanoscale zero valent iron enhancing the removal of Pb(Ⅱ)from aqueous solution[J]. ACS Applied Materials & Interfaces, 2015, 7(15): 7961-7969. |
| [79] |
Wang C, Luo H, Zhang Z, et al. Removal of As(Ⅲ)and As(Ⅴ)from aqueous solutions using nanoscale zero valent iron-reduced graphite oxide modified composites[J]. Journal of Hazardous Materials, 2014, 268: 124-131. DOI:10.1016/j.jhazmat.2014.01.009 |
| [80] |
Zhao D, Yang X, Zhang H, et al. Effect of environmental conditions on Pb(Ⅱ)adsorption on β-MnO2[J]. Chemical Engineering Journal, 2010, 164(1): 49-55. DOI:10.1016/j.cej.2010.08.014 |
| [81] |
Gupta A, Vidyarthi S R, Sankararamakrishnan N. Enhanced sorption of mercury from compact fluorescent bulbs and contaminated water streams using functionalized multiwalled carbon nanotubes[J]. Journal of Hazardous Materials, 2014, 274: 132-144. DOI:10.1016/j.jhazmat.2014.03.020 |
| [82] |
Xu H, Qu Z, Zhao S, et al. Different crystal-forms of one-dimensional MnO2 nanomaterials for the catalytic oxidation and adsorption of elemental mercury[J]. Journal of Hazardous Materials, 2015, 299: 86-93. DOI:10.1016/j.jhazmat.2015.06.012 |
 2018, Vol. 37
2018, Vol. 37