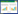文章信息
- 贾月慧, 韩莹琰, 刘杰, 高凡, 梁琼, 俞萍, 刘超杰, 张鑫, 苏博伟
- JIA Yue-hui, HAN Ying-yan, LIU Jie, GAO Fan, LIANG Qiong, YU Ping, LIU Chao-jie, ZHANG Xin, SU Bo-wei
- 生菜对镉胁迫的生理响应及体内镉的累积分布
- Physiological adaptations to cadmium stresses and cadmium accumulation in lettuce
- 农业环境科学学报, 2018, 37(8): 1610-1618
- Journal of Agro-Environment Science, 2018, 37(8): 1610-1618
- http://dx.doi.org/10.11654/jaes.2018-0033
文章历史
- 收稿日期: 2018-01-05
- 录用日期: 2018-04-23
镉是一种累积性的剧毒元素,进入土壤后很容易被植物吸收,导致体内代谢发生紊乱[1]。其对植物的毒害机理可能是:(1)束缚自由巯基使蛋白变性或失活;(2)置换不同蛋白,包括转录因子和酶的辅因子;(3)产生活性氧[2]。镉一旦经皮层组织在根部积累到一定程度,将损害根尖细胞,抑制其多种酶的活性,降低营养元素的吸收和转运,干扰正常代谢,使根系生长速率下降[3]。植物从土壤中吸收镉后,大部分富集在根部,迁移到地上部分的较少。一般而言,植物体内镉的分布具有以下规律:根 > 茎 > 叶 > 子实[2]。当镉转运到植物各个部位,并积累到一定数量(或浓度)后将引起毒害,如脂质过氧化,产生大量丙二醛(MDA)[2]。然而,植物通过调节如过氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等一系列保护酶的活性来响应外界胁迫。低浓度镉将增强酶系统的活性,降低对植物生理毒害,对植物各代谢有一定促进作用[4],但镉继续累积,则酶活性被抑制,进一步干扰叶片气孔的开闭合,降低其电导率、减少CO2的吸收,抑制蒸腾作用,叶片失绿,损坏光合系统,最终导致光合效率下降,影响作物的产量与品质[2, 4]。
根据《全国土壤污染状况调查公报》的数据,镉点污染超标率最高[5]。陈同斌课题组[1] 2006年对北京市蔬菜及菜地土壤镉含量的大规模调查发现:菜地土壤镉累积明显(0.091~0.971 mg·kg-1),其中两个样点镉含量(0.971 mg·kg-1和0.886 mg·kg-1)超过《土壤环境质量标准》(GB 15618—1995)中的二级标准;蔬菜镉含量在0.1~101.412 μg·kg-1,其对北京市部分人群存在一定的潜在健康风险。生菜(Lactuca sativa L.)作为鲜食绿叶蔬菜,鲜嫩口感好、热量低,备受消费者青睐,因此在全国各地被广泛种植[6]。但生菜对镉胁迫的研究相对较少,结论也存在差异。田丹等[7]研究表明,随着镉浓度的升高,生菜种子发芽率、发芽势、发芽指数和活力指数均表现为不同程度的降低;而徐劼等[8]研究表明,低浓度镉胁迫对生菜种子萌发具有明显的促进作用。除此之外,生菜生理对镉毒害阈值及响应程度也存在较大差异,且这些研究大多集中在水培条件下[7-8],无法全面反应生菜的田间栽培情况。因此本文以生菜为材料,水培和基质栽培相结合,研究镉胁迫下生菜种子萌发、生物量、生理生化反应和生菜体内及亚细胞中镉的累积特征,探讨生菜对镉胁迫的响应及镉累积的规律,为生菜镉的毒理学研究提供理论依据。
1 材料与方法 1.1 实验材料供试生菜品种为美国大速生(Lactuca sativa var. capatata L.),种子购自北京开心格林农业科技有限公司。供试蛭石和草炭(pH5.6,有机质含量75%,C/N为50:1)为德国进口TS-1型。
1.2 试验方法 1.2.1 实验材料处理挑选籽粒饱满、大小一致的生菜种子,用1%的次氯酸钠溶液消毒10 min,再用去离子水清洗干净后放入33 ℃左右的温水中浸泡30 min,然后播于铺有两层滤纸的玻璃培养皿中,每皿30粒,置于(15±2)℃无光培养箱。每日加10 mL不同浓度镉(0、0.5、1、5、10、20 mg·L-1,镉以CdCl2的形式添加)的培养液,各处理均重复3次。4 d后测定发芽势(以胚根长度为种子纵径长度一半为标准),7 d后测定发芽率[9]。
发芽势= 4 d内供试种子发芽数/供试种子数×100%
发芽率= 7 d内供试种子发芽数/供试种子数×100%
相对生长量=处理组/对照组×100%
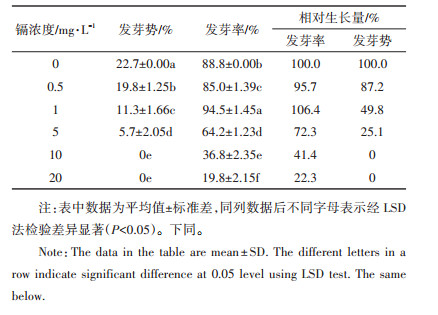
将催芽后的种子播种于盛有基质(草炭:蛭石=2: 1,V:V)的穴盘中,每穴2~3粒,放入光照培养箱中培养(白天夜晚时长14 h/10 h,温度20 ℃/15 ℃,光照强度12 000 lx/0 lx),2周后用1/4 Hoagland完全培养液[9]进行培养,4周后从穴盘移栽至盆钵(8 cm×6 cm×10 cm,基质与穴盘中的一样)中,每盆1颗,同时营养液用1/2 Hoagland培养液,6周后开始浇灌添加了不同浓度镉(0、5、10、20、50、100、200 mg·L-1,镉以CdCl2的形式添加)的Hoagland完全培养液,每个处理15盆。胁迫10 d后采样,测定生理生化指标。胁迫21 d后采样测定生菜的生物量。
1.2.2 测定项目及方法 1.2.2.1 生菜体内镉含量的测定将生菜从基质中取出依次用自来水、高纯水洗涤,擦干水分后将地下与地上部分分开,称量各部分鲜质量(FW)。于105 ℃杀青30 min,65 ℃烘干至恒质量,称量干质量(DW),烘干后的样品研磨过100目筛。称取0.25 g样品于消解管中,加入2 mL硝酸(1: 1,V:V)静置过夜,消解管于电热板上120 ℃低温消解4 h,其间摇动消解管以排除消解过程中产生的气体,将电热板升温到140 ℃继续消解30 min,从电热板上取下样品冷却至室温后用高纯水定容至10 mL。消解完成的样品用电感耦合等离子体发射光谱(ICPOES)测定镉含量,并计算生物富集系数及转运系数。
生物富集系数(BCF)=植株组织中镉含量/基质中镉含量
转运系数(TF)=植株地上部分镉含量/植株地下部分镉含量[10]
1.2.2.2 生菜生理生化指标的测定处理结束后,取生菜的成熟功能叶片。叶绿素采用丙酮浸提、分光光度法测定[6];MDA含量采用硫代巴比妥酸法测定[9];SOD活性采用氮蓝四唑光还原法测定[11];POD活性采用愈创木酚法测定[9];CAT活性采用碘量法测定[9]。
1.2.2.3 生菜苗期亚细胞内镉含量的测定亚细胞组分的提取参照Xin等[12]的方法。取新鲜的生菜根系或地上部分1 g置于10 mL预冷(4 ℃)的提取液[50 mmol·L-1 Tris-HCl(pH 7.5)、250 mmol·L-1蔗糖和1.0 mmol·L-1 C4H10O2S2]中研磨成匀浆,3000 r·min-1离心15 min,沉淀即为细胞壁组分(包括细胞壁和细胞壁碎片),上清液继续12 000 r·min-1离心30 min,沉淀和上清液分别称为细胞器组分和可溶组分(包括细胞液和液泡),分离后的各组分装入10 mL离心管中,经硝酸消化后用ICP-OES测定镉含量。
1.3 数据处理采用Microsoft Office Excel 2003及SPSS 16.0进行数据分析,采用LSD检验法进行差异显著性分析(P < 0.05)。
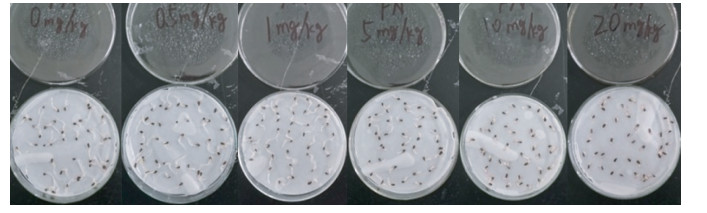
2 结果与分析 2.1 镉浓度对生菜种子萌发的影响用于反映种子萌发的重要参数是发芽势和发芽率,发芽势反映种子的发芽速度和整齐度,发芽率反映种子发芽多少,是发芽生境和种子质量的综合反映。表 1和图 1是不同浓度的镉对生菜种子萌发的影响。可以看出,镉胁迫使生菜种子发芽势显著下降,当镉浓度≥10 mg·L-1时,发芽势均为零。1 mg·L-1的镉显著提高了生菜种子的发芽率,而其他浓度镉都显著降低其发芽率,当镉浓度达20 mg·L-1时仅为19.8%,是对照的22.3%。
|
| 图 1 处理4 d后生菜种子发芽情况 Figure 1 Seed germination of lettuce after 4 d Cd stress |
不同浓度镉对生菜叶绿素含量的影响见表 2。可以看出,镉浓度为5 mg·L-1时,叶绿素总量和叶绿素a含量显著高于对照,叶绿素b的含量与对照之间差异不显著。当镉浓度在10~200 mg·L-1的范围内,叶绿素含量均显著低于相应对照。叶绿素a/叶绿素b在5~20 mg·L-1时,显著高于对照;镉浓度继续增加,生菜叶绿素a/叶绿素b与对照无显著差异。
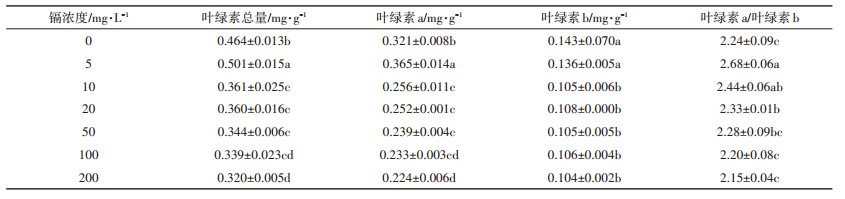
|
植物体内的MDA是膜脂过氧化的主要产物,它的高低可以反映植物体内过氧化作用的强弱。从图 2可以看出,镉浓度为5 mg·L-1时,生菜体内MDA含量显著增加,为对照的1.64倍;随镉浓度的进一步增加,与对照相比,除20 mg·L-1时MDA出现显著下降外,其他处理无显著差异。

|
| 不同字母表示经LSD法检验差异显著(P < 0.05) The different letters indicate significant difference at 0.05 level using LSD test 图 2 镉胁迫下生菜叶片丙二醛(MDA)含量的变化 Figure 2 Effects of Cd stress on MDA concentration in leaves of lettuce |
生物量是植物各种生境条件及自身特征的综合表现,表 3是不同浓度镉对生物量的影响。与对照相比,除地下部分鲜质量外,50、100 mg·L-1镉对生物量干质量、鲜质量总量及各部分都有显著促进作用;其他浓度镉对生物总量及各部位干、鲜质量虽有影响,但统计学上没有显著差异(除去5 mg·L-1镉对地上部分干重显著增加外)。在本研究镉浓度范围内,无论鲜质量还是干质量,镉胁迫对生菜生物量的分配即根冠比与对照相比都无显著差异。
植物体内抗氧化保护酶活性的高低是反映植物对逆境适应的重要指标。表 4是不同浓度镉对生菜成熟叶片中SOD、POD和CAT 3种抗氧化酶活性的影响。可以看出,随着镉浓度的升高,SOD的活性显著下降,200 mg·L-1时最低,比对照下降23.3%;而CAT的活性表现出先升高后下降的规律,镉浓度为20 mg·L-1时达到最高,高出对照38.1%,镉浓度为200 mg·L-1时,降低到对照的水平;POD的活性显著升高,到200 mg·L-1时,达到最大值,是对照4.56倍。说明生菜体内3种酶对镉胁迫的响应存在差异。

|
表 5是不同浓度镉处理下生菜苗期体内镉的含量。生菜地下部分(根系)和地上部分镉含量均随镉浓度的升高而显著增加,但其变化趋势存在一定的差异。生菜根系中镉含量随镉浓度的增加呈线性累积趋势(y=6.17x-13.70,R2=0.93),而地上部分呈对数累积(y=49.00 lnx-46.97,R2=0.99)。且在同一镉浓度下,地下部分镉含量显著高于地上部分,特别是当镉浓度为200 mg·L-1时,地上部分镉含量仅为地下部分的15.7%。随镉浓度的升高地上部分的生物富集系数逐渐下降,而地下部分呈现先升高后下降的趋势,同时地下部分明显高于地上部分;转运系数随镉浓度的增加显著下降,说明生菜根系中镉向地上部分转运能力在下降。
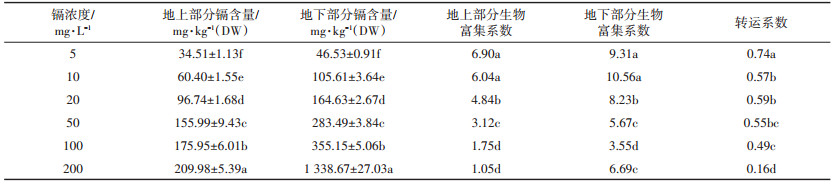
|
生菜亚细胞水平上镉含量(以鲜重计)见表 6及表 7。随着添加镉浓度的增加,地下部分亚细胞中各部分镉含量呈现指数累积趋势,且累积程度大小为细胞壁 > 可溶组分 > 细胞器;地上部分亚细胞中镉含量呈直线累积趋势,且累积程度大小为细胞壁、可溶组分 > 细胞器。地下部分累积的速度远远高于地上部分的速度;基质中同一镉浓度时,地上部分亚细胞中的镉含量远低于地下部分,当镉浓度为200 mg·L-1时,根系中细胞镉含量是地上部分的33.7倍。

|

|
图 3是生菜地下部分和地上部分亚细胞各部分中镉含量的分布比例。地下部分亚细胞中的分布比例是细胞壁 > 可溶组分 > 细胞器(除基质中最大镉浓度时:细胞壁 > 细胞器 > 可溶组分外)。镉主要分布在细胞壁上,占总量的49.6%~61.4%,其次是可溶组分中,占总量的17.9%~33.1%;二者总和占比79.3%~ 86.7%,且随着基质中镉浓度的增加呈现直线下降的趋势(y=-0.02x+84.04,R2=0.50);在细胞器中占比最少(13.3%~20.7%),且随着基质中镉浓度的增加呈直线增加的趋势(y=0.02x+15.95,R2=0.51)。地上部分中亚细胞各部分镉含量在细胞壁和可溶组分中所占比例相差无几,二者之和高达总量的75.3%~84.2%,并且随基质中镉浓度的增加,二者所占比例直线增加(y=0.05x+75.37,R2= 0.86),而细胞器中镉含量所占比例却显著下降(y=-0.05x+24.59,R2=0.86)。

|
| 图 3 生菜各亚细胞组分中镉的分配比例 Figure 3 Distribution percentages of Cd in subcellular fractions of lettuce |
种子萌发是植物对外界胁迫最敏感的阶段[13],通过观察生菜种子发芽对外源镉的响应,可以更系统地认识镉胁迫对植物的毒害。种皮对重金属胁迫具有一定屏障作用,但当种子吸水膨胀,胚根萌动突破种皮时,胚根最早受到镉毒害,并随着细胞分裂、胚根的发育,镉越来越多的聚集在胚根生长点附近,并诱导细胞产生乙烯直接伤害根部组织,使得胚根端部变黑而停止生长[14],从而降低发芽速度。本研究结果验证了这一点:镉胁迫的生菜种子发芽势都显著低于对照,且随着镉浓度的增加,发芽势明显降低。相对于胚根,重金属对胚芽的影响却表现出阶段性和多元化特征[15]。随着种子的进一步萌发,一定浓度镉提高种子萌发初期蛋白酶、淀粉酶、脂肪酶等相关酶的活性,加速胚乳中营养物质的降解,从而促进其萌发代谢,提高种子发芽率[4];而高镉胁迫又会抑制相关酶的活性,使得种子内存储的营养物质分解速率降低,导致种子萌发所需物质和能量获取不足,从而降低其发芽率[2, 4]。这一规律在本研究种子发芽率试验中得到体现:一定浓度(1 mg·L-1)镉对生菜种子发芽率有明显促进作用,但过低(0.5 mg·L-1)或过高(≥5 mg·L-1)浓度镉胁迫都显著降低其发芽率。其与徐劼等[8]研究结果一致:低浓度促进种子发芽,高浓度抑制种子发芽。
当作物根系累积到一定量的镉后,不仅严重干扰根系代谢,还影响养分、水分向地上部分转运[3]。转运到地上部分的镉会使叶绿素合成受阻,特别是叶绿素a、叶绿色b及叶绿色a/b会受到不同程度的影响[8]。叶绿体受到光照时,在光合系统Ⅰ的还原端产生活性氧,从而启动膜脂过氧化,但植物体内相关酶具备自由基清除功能,使活性氧的产生与清除维持平衡,继而减缓对植物光合作用的影响;当植物受到环境胁迫时,这种平衡将被打破,叶绿素含量下降[16]。叶绿素b具有光能吸收和传递作用,而叶绿素a起着光能捕获和电荷分离的双重作用[17],这可能导致叶绿素a相对于叶绿素b对环境胁迫更为敏感[16],最终导致植物光合能力下降。本研究表明(表 2和表 3):与对照相比,低浓度镉(5 mg·L-1)对生菜叶绿素总量及叶绿素a有促进作用,叶绿素b无显著差异;随着镉浓度的增加,三者都显著下降;生物量的响应相对迟缓,当50、100 mg·L-1镉胁迫,生菜生物量总量及地上部分较对照显著升高,在200 mg·L-1才显著下降。这可能与环境胁迫植物自我保护系统有关[4]。
3.2 生菜对镉胁迫的生理响应植物受到外界胁迫时植株体内会产生大量的活性氧自由基,促使细胞膜内的不饱和脂肪酸发生过氧化反应产生MDA,其含量可反映机体内脂质过氧化的程度以及细胞膜受损伤程度[2]。镉是质膜过氧化的重要诱变剂[18],高浓度的镉诱导会产生较多MDA,这在很多研究[19-21]中都已证实。本研究中镉浓度在5 mg·L-1时MDA含量显著高于对照,更高的镉浓度与对照无显著差异或显著低于对照。这一结果似乎与大多数研究存在差异[19-21],其可能原因是:MDA的含量不仅与镉胁迫浓度有关,而且随胁迫时间的延长呈现先升高而后下降趋势。本研究之所以看到随镉浓度(> 5 mg·L-1)升高,MDA值维持不变或降低的结果,可能与只测定了镉胁迫一段时间后成熟叶片的MDA值有关。在此期间,镉胁迫下生菜自身会产生一系列的生理生化变化来最大可能地降低镉的毒害。首先,根系尽可能通过阻滞镉向地上部分的转移,降低地上部分镉总量来保护地上部分组织[23]。从表 5中的转运系数看出,随着镉浓度的增加,生菜的转运系数显著下降。这一结果成为镉在植株体内分布的普遍规律:地下部分 > 地上部分[2]。其次,植物通过维持或增加干物质量,以延缓镉在体内含量的快速增加,从而降低其对植株的毒害。表 3中,无论是总量,还是地上、地下部分,相对于对照处理,一定量的镉浓度(50、100 mg·L-1)促使生菜生物量显著增加,其他浓度对生物量无显著影响。再者,植物可以将镉吸持到非活性部位以降低镉的毒害,通过细胞壁的固持阻碍镉进一步进入细胞内;即便进入,细胞质内的谷胱甘肽、草酸、柠檬酸盐等可对镉进行螯合或沉淀,以避免与细胞器接触,降低其毒害[23]。从图 3中看出,无论是地上部分还是地下部分,镉在生菜亚细胞中的分布比例都说明了以上解毒机制:细胞壁 > 细胞质 > 细胞器。这与大多数研究结果一致:细胞器的镉含量最低,细胞壁等非活性部分的固持作用是耐镉的重要机制[24, 25],生菜对镉的耐受可能也源于此。
植株体内保护酶体系也是植物对于逆境胁迫至关重要的保护机制[2, 29]。植物遭受镉胁迫后产生的自由基随抗氧化系统(SOD、POD、CAT等)的启动而被清除,以防止膜脂过氧化[26]。其中,产生的超氧阴离子自由基主要由SOD清除,而将产生的H2O2分解为O2和H2O的主要酶是POD、CAT,这些酶活性的变化可以反映植物的抗性[27]。镉胁迫下这3种酶活性因植物抗性强弱而存在差异[23]。本研究(表 4)显示:随着镉浓度的升高,SOD活性下降,其结果与田丹等[7]对生菜的研究不同:随着镉浓度的增加,SOD活性先增加,而后弱有下降;CAT的活性随着镉浓度升高是先上升后下降,这与大多数研究结果非常一致[23],表明CAT活性的变化对生菜的膜系统具有一定的保护作用;而POD的活性随镉浓度升高呈极显著的直线上升,这与大多数研究结果一致[7, 28]。有研究认为:POD活性的增强是植物耐镉的主要酶类[4, 29],因此POD也可能是生菜耐镉的主要酶类。3种酶类相互协调,最终导致成熟生菜叶片MDA值随着镉浓度(> 5 mg·L-1)升高无明显增加趋势,正如张金彪等[2]对3种酶在镉毒害保护机制方面的陈述:植物细胞存在着自由基的产生和消除两个过程,只有SOD、CAT和POD三者协调一致,才能使自由基维持在一个较低水平,避免其毒害。
4 结论(1)镉胁迫显著降低生菜发芽势;1 mg·L-1镉胁迫显著提高发芽率,其他浓度显著降低发芽率。
(2)低浓度(5 mg·L-1)镉显著促进叶绿素总量和叶绿色a含量;高浓度镉(10~200 mg·L-1)显著降低叶绿素总量、叶绿素a、叶绿素b含量;镉胁迫对根冠比没有显著影响;随着镉浓度的升高,SOD的活性显著下降,CAT的活性先升高后下降,POD的活性显著升高。
(3)地下部分镉含量显著高于地上部分;随镉浓度的升高,地上部分的生物富集系数逐渐下降,而地下部分呈现先升高后下降的趋势;转运系数随镉浓度的增加显著下降;镉在亚细胞分布存在以下规律:地下部分为细胞壁 > 可溶组分 > 细胞器,地上部分为细胞壁、可溶组分 > 细胞器。地下部分(根系)的滞留作用和细胞壁的固持是生菜应对镉胁迫的重要耐性机制。
| [1] |
宋波, 陈同斌, 郑袁明, 等. 北京市菜地土壤和蔬菜镉含量及其健康风险分析[J]. 环境科学学报, 2006, 26(8): 1343-1353. SONG Bo, CHEN Tong-bin, ZHENG Yuan-ming, et al. A survey of cadmium concentrations in vegetables and soils in Beijing and the potential risks to human health[J]. Acta Scientiae Circumstantiae, 2006, 26(8): 1343-1353. |
| [2] |
张金彪, 黄维南. 镉对植物的生理生态效应的研究进展[J]. 生态学报, 2000, 20(3): 514-523. ZHANG Jin-biao, HUANG Wei-nan. Advances on physiological and ecological effects of cadmium on plants[J]. Acta Ecologica Sinica, 2000, 20(3): 514-523. |
| [3] |
冯汉青, 杜变变, 王庆文, 等. 镉胁迫下活性炭对小麦幼根的保护作用[J]. 生态学报, 2016, 36(10): 2962-2968. FENG Han-qing, DU Bian-bian, WANG Qing-wen, et al. The role of activated carbon in protecting the roots of wheat seedlings under cadmium stress[J]. Acta Ecologica Sinica, 2016, 36(10): 2962-2968. |
| [4] |
王晓娟, 王文斌, 杨龙, 等. 重金属镉(Cd)在植物体内的转运途径及其调控机制[J]. 生态学报, 2015, 35(23): 7921-7929. WANG Xiao-juan, WANG Wen-bin, YANG Long, et al. Transport pathways of cadmium(Cd)and its regulatory mechanisms in plant[J]. Acta Ecologica Sinica, 2015, 35(23): 7921-7929. |
| [5] |
陈能场, 郑煜基, 何晓峰, 等. 《全国土壤污染状况调查公报》探析[J]. 农业环境科学学报, 2017, 36(9): 1689-1692. CHEN Neng-chang, ZHENG Yu-ji, HE Xiao-feng, et al. Analysis of the report on the national general survey of soil contamination[J]. Journal of Agro-Environment Science, 2017, 36(9): 1689-1692. DOI:10.11654/jaes.2017-1220 |
| [6] |
李雅博, 李婷, 韩莹琰, 等. 叶用莴苣热激蛋白基因LsHsp70-2711的克隆及高温胁迫下的功能分析[J]. 中国农业科学, 2017, 50(8): 1486-1494. LI Ya-bo, LI Ting, HAN Ying-yan, et al. Cloning and function analysis of heat-shock-protein LsHsp70-2711 gene under high temperature stress in leaf lettuce(Lactuca sativa L.)[J]. Scientia Agricultura Sinica, 2017, 50(8): 1486-1494. DOI:10.3864/j.issn.0578-1752.2017.08.012 |
| [7] |
田丹, 任艳芳, 王艳玲, 等. 镉胁迫对生菜种子萌发及幼苗抗氧化酶系统的影响[J]. 北方园艺, 2018, 42(2): 15-21. TIAN Dan, REN Yan-fang, WANG Yan-ling, et al. Effects of cadmium stress on seed germination, seedling growth and antioxidant enzyme system of lettuce[J]. Northern Horticulture, 2018, 42(2): 15-21. |
| [8] |
徐劼, 胡博华, 戈涛, 等. 镉胁迫对生菜种子萌发及幼苗生理特性的影响[J]. 湖北农业科学, 2014, 53(20): 4892-4896. XU Jie, HU Bo-hua, GE Tao, et al. Effects of cadmium stress on seed germination and physiological characteristics of lettuce seedling[J]. Hubei Agricultural Sciences, 2014, 53(20): 4892-4896. |
| [9] |
王学奎, 黄见良. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2015. WANG Xue-kui, HUANG Jian-liang. Principles and techniques of plant physiological biochemical experiment[M]. Beijing: Higher Education Press, 2015. |
| [10] |
刘俊祥, 魏树强, 翟飞飞, 等. Cd2+胁迫下多年生黑麦草的生长与生理响应[J]. 核农学报, 2015, 29(3): 587-594. LIU Jun -xiang, WEI Shu-qiang, ZHAI Fei-fei, et al. Growth and physiology response of perennial ryegrass to Cd2+ stress[J]. Journal of Nuclear Agricultural Sciences, 2015, 29(3): 587-594. DOI:10.11869/j.issn.100-8551.2015.03.0587 |
| [11] |
路文静. 植物生理学实验教程[M]. 北京: 中国林业出版社, 2012. LU Wen-jing. Course of plant physiology experiment[M]. Beijing: China Forestry Publishing House, 2012. |
| [12] |
Xin W, Liu Y G, Zeng G M, et al. Subcellular distribution and chemical forms of cadmium in Bechmeria nivea(L.)Gaud[J]. Environmental & Experimental Botany, 2008, 62(3): 389-395. |
| [13] |
Chen Y X, He Y F, Luo Y M, et al. Physiological mechanism of plant roots exposed to cadmium[J]. Chemosphere, 2003, 50(6): 789-793. DOI:10.1016/S0045-6535(02)00220-5 |
| [14] |
吴鹏, 周青. 大豆种子萌发对镉与模拟酸雨胁迫的响应[J]. 安全与环境学报, 2010, 10(1): 12-14. WU Peng, ZHOU Qing. Effects of the soil cadmium and the simulated acid rain on the soybean seed germination[J]. Journal of Safety and Environment, 2010, 10(1): 12-14. |
| [15] |
段昌群, 王焕校, 曲仲湘. 重金属对蚕豆(Vicia faba)根尖的核酸含量及核酸酶活性影响的研究[J]. 环境科学, 1992, 13(5): 31-35. DUAN Chang-qun, WANG Huan-xiao, QU Zhong-xiang. Studies on the effects of heavy metals on the contents of nucleic acids and activities of nucleases in the root tips of Vicia faba[J]. Environmental Science, 1992, 13(5): 31-35. |
| [16] |
林植芳, 李双顺, 林桂珠, 等. 水稻叶片的衰老与超氧物歧化酶活性及脂质过氧化作用的关系[J]. 植物生态学报, 1984, 26(6): 605-615. LIN Zhi-fang, LI Shuang-shun, LIN Gui-zhu, et al. Superoxide dismutase activity and lipid peroxidation in ralation to senescence of rice leaves[J]. Journal of Plant Ecology, 1984, 26(6): 605-615. |
| [17] |
唐树延, 孟继武, 杨文杰, 等. 大豆光合生理生态的研究第五报大豆光合作用中叶绿素a、b间的能量传递[J]. 大豆科学, 1985, 4(3): 185-192. TANG Shu-yan, MENG Ji-wu, YANG Wen-jie, et al. Energy transfer between pigments chl. a and b in photosynthesis of soybean[J]. Soybean Science, 1985, 4(3): 185-192. |
| [18] |
王爱云, 钟国锋, 徐刚标, 等. 铬胁迫对芥菜型油菜生理特性和铬富集的影响[J]. 环境科学, 2011, 32(6): 1717-1725. WANG Ai-yun, ZHONG Guo-feng, XU Gang-biao, et al. Effects of Cr(Ⅵ)stress on physiological characteristics of Brassica juncea and its Cr uptake[J]. Environmental Science, 2011, 32(6): 1717-1725. |
| [19] |
刘柿良, 杨容孑, 马明东, 等. 土壤镉胁迫对龙葵(Solanum nigrum L.)幼苗生长及生理特性的影响[J]. 农业环境科学学报, 2015, 34(2): 240-247. LIU Shi-liang, YANG Rong-jie, MA Ming-dong, et al. Effects of soil cadmium on growth and physiological characteristics of Solanum nigrum L. plants[J]. Journal of Agro-Environment Science, 2015, 34(2): 240-247. DOI:10.11654/jaes.2015.02.006 |
| [20] |
Gusman G S, Oliveira J A, Farnese F S, et al. Mineral nutrition and enzymatic adaptation induced by arsenate and arsenite exposure in lettuce plants[J]. Plant Physiology & Biochemistry, 2013, 71(2): 307-314. |
| [21] |
Wei S H, Zhou Q X, Wang X, et al. A newly-discovered Cd-hyperaccumulator Solanum nigrum L[J]. Chinese Science Bulletin, 2005, 50(1): 33-38. DOI:10.1360/982004-292 |
| [22] |
熊愈辉, 杨肖娥. 镉对植物毒害与植物耐镉机理研究进展[J]. 安徽农业科学, 2006, 34(13): 2969-2971. XIONG Yu-hui, YANG Xiao-e. Review of the toxic effects of cadmium on plants and their tolerant mechanism[J]. Journal of Anhui Agricultural Sciences, 2006, 34(13): 2969-2971. DOI:10.3969/j.issn.0517-6611.2006.13.016 |
| [23] |
Wu F B, Dong J, Qian Q Q, et al. Subcellular distribution and chemical form of Cd and Cd-Zn interaction in different barley genotypes[J]. Chemosphere, 2005, 60(10): 1437-1446. DOI:10.1016/j.chemosphere.2005.01.071 |
| [24] |
He J Y, Zhu C, Ren Y F, et al. Uptake, subcellular distribution, and chemical forms of cadmium in wild-type and mutant rice[J]. Pedosphere, 2008, 18(3): 371-377. DOI:10.1016/S1002-0160(08)60027-2 |
| [25] |
陈亚慧, 刘晓宇, 王明新, 等. 蓖麻对镉的耐性、积累及与镉亚细胞分布的关系[J]. 环境科学学报, 2014, 34(9): 2440-2446. CHEN Ya-hui, LIU Xiao-yu, WANG Ming-xin, et al. Cadmium tolerance, accumulation and relationship with Cd subcellular distribution in Ricinus communis L[J]. Acta Scientiae Circumstantiae, 2014, 34(9): 2440-2446. |
| [26] |
Rahoui S, Chaoui A, Ferjani E E. Membrane damage and solute leakage from germinating pea seed under cadmium stress[J]. Journal of Hazardous Materials, 2010, 178(1/2/3): 1128-1131. |
| [27] |
邵国胜. 水稻镉耐性和积累的基因型差异与机理研究[D]. 杭州: 浙江大学, 2005. SHAO Guo-sheng. Genotypic differences in cadmium tolerance and accumulation in rice and its mechanisms[D]. Hangzhou: Zhejiang University, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10335-2006084931.htm |
| [28] |
李冬琴, 陈桂葵, 郑海, 等. 镉对两品种玉豆生长和抗氧化酶的影响[J]. 农业环境科学学报, 2015, 34(2): 221-226. LI Dong-qin, CHEN Gui-kui, ZHENG Hai, et al. Effects of cadmium on growth and antioxidant enzyme activities of two kidney bean(Phaseolus vulgaris L.) cultivars[J]. Journal of Agro-Environment Science, 2015, 34(2): 221-226. DOI:10.11654/jaes.2015.02.003 |
| [29] |
丛建民, 陈凤清. 模拟镉胁迫生长土壤环境中龙葵的抗逆生理[J]. 东北林业大学学报, 2015, 43(4): 42-45. CONG Jian-min, CHEN feng-qing. Ecological stress and physiological changes cadmium hyperaccumulator in Solanum nigrum L[J]. Journal of Northeast Forestry University, 2015, 43(4): 42-45. |
 2018, Vol. 37
2018, Vol. 37