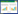文章信息
- 邓闻杨, 罗学刚, 罗蓝, 王焯
- DENG Wen-yang, LUO Xue-gang, LUO Lan, WANG Zhuo
- 三种微生物对铀胁迫下凤眼莲荧光生理及铀累积特性的影响
- Effects of three microorganisms on fluorescence physiology and accumulative characteristics of Eichhornia crassipes under uranium stress
- 农业环境科学学报, 2018, 37(8): 1626-1633
- Journal of Agro-Environment Science, 2018, 37(8): 1626-1633
- http://dx.doi.org/10.11654/jaes.2018-0417
文章历史
- 收稿日期: 2018-03-30
- 录用日期: 2018-06-07
2. 西南科技大学核废物与环境安全国防重点学科实验室, 四川 绵阳 621010;
3. 西南科技大学环境与资源学院, 四川 绵阳 621010
2. State Defense Key Laboratory of the Nuclear Waste and Environmental Security, Southwest University of Science and Technology, Mianyang 621010, China;
3. Environment and Resources College, Southwest University of Science and Technology, Mianyang 621010, China
目前,原子能的应用在世界范围内得到普及,促发了铀矿的大量开采与冶炼,在应用的同时,也产生了大量的铀矿冶三废,其中的放射性重金属通过地表水流冲刷以及地下水渗透等方式进入地球水循环,形成放射性废水。这些放射性废水的存在,会对生态圈造成危害,如通过生物链进入人体,以体内辐射以及化学毒性的方式损害人体健康,并且由于放射性废水量大、半衰期长的特点,危害将会长期存在[1-2]。因此,近年来对铀矿废水的处理成为国内外的研究热点。
广泛使用的铀矿废水修复方法有物理法、化学法和生物修复法。生物修复法由于方法简便、无二次污染的特性,且可以通过资源化使修复过程具有其他经济效益,所以拥有较好的前景[3]。生物修复中主要用到的是植物与微生物两种修复材料,二者在重金属修复中具有不同的作用机制及效果。Lee等[4]利用根际过滤方法修复含铀地下水,结果表明:向日葵能在24 h内去除铀废水中超过80%的铀,处理后的铀浓度低于30 μg· L-1。Tsuruta[5]研究发现烟草节杆菌、枯草芽孢杆菌、藤黄微球菌对铀具有高效吸附作用。但是由于修复环境本身的毒害性,导致植物修复与微生物修复都有修复时间缓慢、修复效率不高的缺点[6]。而研究表明,微生物和植物的联合使用,能够通过二者间的相互作用,显著增加修复的效果,因此重金属修复领域的微生物-植物互作研究成为热点[7]。Eapen等[8]利用发根农杆菌(Agrobacterium rhizogenes)与芥菜型油菜(Brassica juncea)和苋色黎(Chenopodium amaranticolor)进行联合修复,结果表明2种植物根部富集铀的能力显著增强。
凤眼莲(Eichhornia crassipes)具有较发达的棕色根系,适应能力极强。有研究表明,凤眼莲由于其本身特性而对重金属具有良好的富集能力[9-12]。胶质芽孢杆菌(Bacillus mucilaginosus)和枯草芽孢杆菌(Bacillus subtilis)在自然界都具有重要作用,能释放较多激素和酶促进植物生长及抗病害能力[13-14]。黑曲霉(Aspergillus niger)作为一种产柠檬酸的功能菌种,目前也已广泛应用于重金属修复中。因此本实验选用水培的方法,接种3种微生物进行微生物-植物联合修复,期望对以后水体的植物-微生物联合修复起一定的理论支撑作用。
1 材料与方法 1.1 试验材料凤眼莲(Eichhornia crassipes)幼苗购自绵阳市信捷商贸有限责任公司。
胶质芽孢杆菌(Bacillus mucilaginosus)、枯草芽孢杆菌(Bacillus subtilis)由西南科技大学生物质材料教育部工程研究中心提供,黑曲霉(Aspergillus niger)由西南科技大学核废物与环境安全国防重点学科实验室提供。
1.2 处理设计高浓度重金属对植物存在较强的胁迫毒害作用,普遍采用U浓度为0.5~50 mg· L-1[10-12]。本实验U浓度设置为0、5、15、25 mg· L-1,各浓度下设置3个微生物处理组及对照组:CK(对照组)、K(枯草芽孢杆菌)、J(胶质芽孢杆菌)、H(黑曲霉),共16个处理组,每个处理设置3个重复。
1.3 实验设计 1.3.1 微生物活化及培养细菌采用LB液体培养基,胰蛋白胨10 g、浸出酵母粉5 g、NaCl 10 g、H2O 1 L;真菌采用PDA固体培养基(土豆200 g,加水煮沸20 min,过滤得过滤液加入葡萄糖20 g、琼脂20 g,定容1 L。活化3 d后,接种扩大培养4 d,保存于4 ℃下备用[15]。
1.3.2 大棚实验试验前在试验场用不含U污染的水体对凤眼莲进行7 d的环境驯化。使用10 L透明水桶做试验容器,用UO2(CH3COO)2·2H2O浓缩液和5加仑桶装纯净水(购自绵阳西科水电安装工程有限公司清源水厂)配制各U浓度以模拟U污染水体,体积为5 L,加入1/ 10 Hoagland营养液,0.5 g NH4NO3,5 g C6H12O6·H2O。取驯化后长势相同的凤眼莲加入配制好的模拟水体中(鲜重14 g±1 g),并在桶中放入一块灭菌海绵(做前期微生物载体)[15],使凤眼莲根系紧靠海绵。做好液面标记,隔天补充纯净水,使体积恒定。试验在西南科技大学核素生物效应试验场温室大棚中进行,大棚通风及透光性能良好,温度高于30 ℃自动风控降温。
1.3.3 微生物接种两种细菌在4 ℃下,8000 r·min-1离心20 min。菌泥用无菌水稀释,于600 nm处测定OD值为0.5。真菌用无菌水冲刷,制成孢子悬液,于560 nm[16]处测定OD值为0.3。接种时两种细菌菌悬液5 mL,真菌孢子悬液5 mL,各自接种于灭菌海绵上。开始培养后每隔4 d接种一次,共4次。
1.3.4 叶绿素荧光参数测定培养14 d后随U对凤眼莲胁迫时间增加,凤眼莲叶片会逐渐出现泛黄、萎焉等不利于数据测定的现象,因此在14 d时测定叶绿素荧光参数,采用M-PEA荧光仪(英国Hansatech公司),测量前先将叶片暗适应20 min,再进行测定[17]。
1.3.5 抗氧化酶活性测定14 d时测定抗氧化酶系统,称取0.2 g剪碎后的新鲜植物叶片于预冷的研钵中,加入相应的缓冲液在冰浴中研磨成匀浆,在4 ℃下离心,上清液即为相应的酶粗提液。SOD的测定使用氮蓝四唑(NBT)光化还原法,以抑制NBT光化还原的50%为1个酶活性单位(U·g-1)[18]。POD的测定使用愈创木酚法,以每分钟A470变化0.01为1个POD活性单位(U·g-1·min-1)[19];CAT的测定采用过氧化氢法,以每分钟A240变化0.01为1个活性单位(U·g-1·min-1)[20];
1.3.6 植物收获及数据测定培养21 d,凤眼莲吸附U浓度趋于稳定时收获凤眼莲。用自来水清洗后再用去离子水清洗2~3次,分开根系与茎叶[21]。分别在105 ℃下杀青30 min,后调温80 ℃烘干至恒质量,分别用电子分析天平(德国Sartorius集团)称量各部分干质量。用高速万能粉碎机(北京永光明医疗仪器有限公司)粉碎各部分,称取0.2 g样品,150 ℃用微波消解仪(意大利Milestone公司)进行消解,消解前加入5 mL浓硝酸(65%~ 68%HNO3)与2 mL 30%H2O2。消解完成后将消解液定容至50 mL,用孔径为0.45 μm针孔滤膜进行过滤后,用电感耦合等离子发射光谱质谱仪(Agilent 7700x ICP-MS,美国安捷伦科技有限公司)测定U含量。
1.4 数据处理[22]局部富集量(mg)=富集浓度(mg·g-1)×干质量(g)
总富集量(mg)=茎叶富集量(mg)+根系富集量(mg)
整体富集浓度(mg·g-1)=总富集量(mg)/总干质量(g)
转移系数(TF)=茎叶富集浓度(mg·g-1)/根系富集浓度(mg·g-1)
生物富集系数(BCF)=整体富集浓度(mg·kg-1)/ U处理浓度(mg· L-1)
利用DPS 7.5进行数据分析;Origin Pro 8.5软件作图。
2 结果与分析 2.1 微生物对凤眼莲U胁迫下生物量的影响图 1a表明,在无U存在时,接种3种微生物会抑制凤眼莲根系干质量,但随着U处理浓度升高,微生物会在不同浓度下表现出对凤眼莲根系的促生作用。其中,在5 mg· L-1时,J对比CK增长最明显,干质量达0.417 8 g,增长36.2%;15 mg· L-1时,H与J对比CK组分别增长20.2%与42%;25 mg· L-1时,K组凤眼莲根系增长最明显,根系干质量为0.257 1 g,增长达34.8%。

|
| 图 1 不同浓度U及微生物处理下凤眼莲根系(a)及叶(b)干质量 Figure 1 The root (a), stem and leaf (b)dry weight of Eichhornia crassipes under treatments of different concentration of U and microbial |
由图 1b可以看出,CK组茎叶干质量随着U处理浓度升高,表现出先升高后降低的趋势,K组则表现出较平稳的现象,H与J组则随U处理浓度升高表现出促进茎叶干质量的现象。在0、5 mg· L-1时,K组凤眼莲茎叶干质量分别达0.425 0 g及0.405 2 g,对比同浓度下的CK组,分别增长296.1%及34.8%;15 mg· L-1下,3种微生物皆使凤眼莲茎叶干质量降低;25 mg· L-1时,3种微生物对凤眼莲茎叶干质量皆有促进作用,J组促进作用最明显,凤眼莲茎叶干质量达0.530 6 g,较CK组增长60.5%,H与K组增长分别为23.7%及22%。
2.2 微生物对凤眼莲U胁迫下抗氧化酶系统的影响由图 2可以看出,CK组的凤眼莲CAT活性随U处理浓度升高而下降,POD、SOD活性则随U处理浓度升高呈现出先下降后升高的趋势。H组凤眼莲3种酶活的变化趋势与CK组相似,POD活性在15、25 mg·L-1下较CK组有所提高,分别增长27.5%及47.7%,但CAT、SOD活性在各浓度下较CK组皆有降低的趋势;J组POD、CAT活性都呈现出随U处理浓度升高而先升高后降低再升高的趋势,其中POD活性在15、25 mg· L-1下高于CK组,分别增长14.4%及32.2%,CAT活性在5、25 mg· L-1时超过CK组,分别增长19.7%及83.9%,SOD活性则随U处理浓度升高而先升高后降低,分别在5、15 mg· L-1下高于CK组,分别增长202.9%及112.2%;K组凤眼莲3种酶活都呈现随U处理浓度升高而下降的趋势,其中POD及SOD活性都在5、15 mg· L-1时超过CK组,POD活性增长分别为73.6%及16.6%,SOD活性增长分别为193%及76.6%,CAT活性则在15、25 mg· L-1下超过CK组25.2%及15.8%。
|
| 图 2 不同浓度U及微生物处理下凤眼莲的POD(a)、CAT(b)及SOD活性(c) Figure 2 POD(a), CAT(b)and SOD(c)activity of Eichhornia crassipes cultured with different concentrations of U and microorganisms |
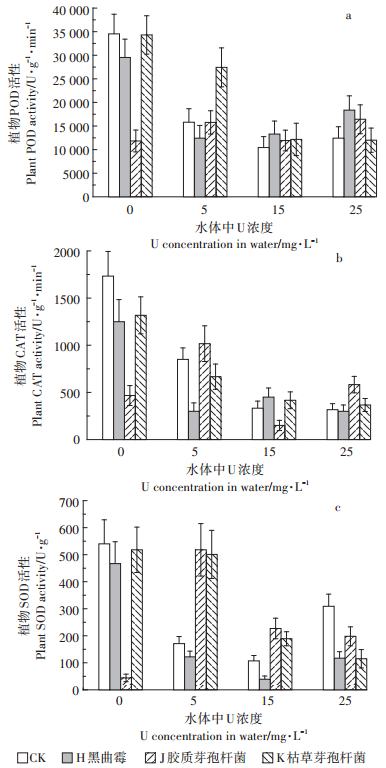
由图 3a可以看出,CK组凤眼莲的PSⅡ最大光化学效率(FV/Fm)随着U处理浓度升高而呈先升高后降低的趋势,微生物处理下则表现出先降低后升高的趋势。在0、15、25 mg· L-1下,3种微生物皆能提高植物的FV/Fm,5 mg· L-1时则有下降的趋势;其中H组凤眼莲的FV/Fm提升最为明显,在0、15、25 mg· L-1下,分别对比CK提高了13.2%、20.5%和21.2%。
|
| 图 3 不同浓度U及微生物处理下凤眼莲的FV/Fm(a)、PIabs(b)及Vj(c) Figure 3 FV/Fm(a), PIabs (b)and Vj(c)of Eichhornia crassipes cultured with different concentrations of U and microorganisms |
由图 3b和图 3c可以看出,CK的叶片光化学性能指数(PIabs)和植物叶片的可变荧光强度(Vj)随U处理浓度升高而逐渐升高,各微生物处理组则皆先升高后下降。在0 mg· L-1时,微生物处理对PIabs和Vj没有明显的影响,但在5、15 mg· L-1时超过CK,25 mg· L-1下低于CK。其中H组在5、15 mg· L-1下,凤眼莲PIabs和Vj提升最明显,PIabs分别增长142.3%和216.7%,Vj分别增长48.6%和15.8%。
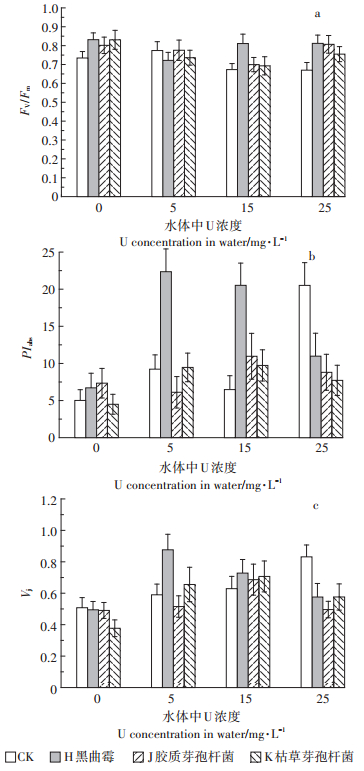
2.4 微生物对凤眼莲U累积特征的影响图 4a和图 4b表明,不同微生物会影响凤眼莲各部分对U的吸收能力。其中5 mg· L-1时,K组凤眼莲根系吸附能力比CK增长8.2%,H组茎叶吸附能力比CK增长9.2%;15 mg· L-1时,H组凤眼莲的根系吸附能力提升最明显,比CK增加10.1%,K组茎叶吸附能力提高最明显,比CK增长28.4%;25 mg· L-1时,H组与J组的根系吸收能力表现出较大的提高,吸附浓度分别为7.51 mg·g-1和8.42 mg·g-1,对比CK分别增长22%及36.6%,同时,H组与K组的茎叶吸收能力有明显的提升,对比CK分别增长8.8%及14.1%,吸收浓度分别为4.17 mg·g-1和4.37 mg·g-1。
|
| 图 4 不同浓度U及微生物处理下凤眼莲根系(a)、茎叶(b)、整株U吸收浓度(c)及整株U提取量(d) Figure 4 Root (a), stem and leaf (b)and the whole plant (c)of Eichhornia crassipes absorbs the concentration of U, and the The amount of U extraction of whole plant (d)of Eichhornia crassipes under treatments of different concentration of U and microbial |
考虑到整株植物的生物量等因素,可以从图 4c和图 4d得出微生物对凤眼莲整体修复效果的影响。可以看出,随着U处理浓度的升高,微生物对整株植物U吸收能力及U总提取量的提升也逐渐明显。5 mg· L-1时,仅有H组凤眼莲整体吸附浓度高于CK,但吸附量最低;15 mg· L-1时,H组与K组整体吸附浓度高于CK,其中K组的提升最明显,较之CK增长16%,但是吸附量也是最低的;25 mg· L-1时,各微生物处理组在两个指标上均表现出较高的提升作用,其中整株吸附浓度表现为H > J > K > CK,H组的整株吸附浓度最高为5.28 mg·g-1,对比CK增长了12.7%,U的总提取量表现为J > H > K > CK,J组的U总提取量最高为3.71 mg,较CK提高51.8%。
由表 1可以看出,在不同浓度下,不同微生物处理将会对凤眼莲的TF及BCF产生不同的影响。5 mg· L-1下,仅H组凤眼莲TF提高,对比CK增长7.9%;15、25 mg· L-1下,K组凤眼莲的TF有明显的提升,对比CK增长分别达29.6%及24.4%。对于BCF,5 mg· L-1下与TF表现一样,仅H组比CK提高了4.5%;15 mg· L-1下,K组与H组的BCF有上升趋势,对比CK分别增长16%及8.9%;25 mg· L-1下3种微生物皆对植物BCF有促进作用,表现为H > J > K > CK,对比CK增长分别为12.7%、8%及3.9%。
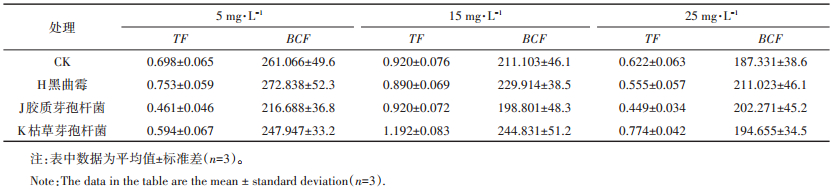
|
生物量是植物对逆境胁迫响应的综合体现与常用指标[23]。微生物处理对凤眼莲各部位生物量的影响趋势相似,皆是在较低浓度下对生长产生抑制,随着U处理浓度升高,逐渐表现为促进作用,25 mg· L-1时,枯草芽孢杆菌使凤眼莲根系干质量增长达34.8%,胶质芽孢杆菌使凤眼莲茎叶干质量增长60.5%。有研究表明,微生物可以释放大量的有机酸,参与重金属元素的吸收、运输、积累等过程,有机酸的释放亦可酸化植物生长微环境[7]。在0 mg· L-1时,微生物对凤眼莲的生长有抑制作用,这可能是由于微生物自身释放的有机酸等,在较低U浓度下改变了植物根系环境,抑制了植物的生长,而随着U处理浓度升高,不同微生物释放的有机酸与重金属结合,降低了酸性环境的刺激及重金属毒性,提高了植物的抗胁迫能力,促进植物生长。但其中枯草芽胞杆菌对凤眼莲茎叶在较低U浓度下也具有良好的促进作用,这可能是由于其微生物本身的茎叶促生功能[24]。
由于U的化学毒性而使植物体内产生过多的自由基和过氧化物,这些自由基及过氧化物由POD、CAT和SOD的共同作用去除[25-26]。黑曲霉使植物三种酶活普遍下降,这可能是因为黑曲霉释放的有机酸等物质,螯合了重金属并减少其毒性,提高了植物对U的耐受性。而另外两种微生物则对凤眼莲抗氧化酶活性在不同浓度下有不同的影响,胶质芽胞杆菌在0 mg· L-1时,极大地降低了三种酶活性,但随U处理浓度升高,却提高了三种酶活,这可能是由于胶质芽孢杆菌本身对植物有较强的促生作用,能减少周围环境对植物的不利影响,但在U胁迫下,也会对U的毒性更加敏感,与胶质芽孢杆菌类似,枯草芽孢杆菌也使得较低U浓度下三种酶活性明显提升,可能是提高了植物对低浓度U的敏感度,间接启动植物自身的抗胁迫机制。有研究表明,微生物-植物联合修复体系中微生物通过启动植物自身内部的响应机制来提高抗胁迫能力[27-29],但枯草芽孢杆菌不具备使植物对环境耐受的作用。总体而言,胶质芽孢杆菌与枯草芽孢杆菌能在不同时期提高植物抗氧化酶活性以应对重金属胁迫,这与朱靖[30]施加EM菌剂后植物抗氧化酶活性上升现象一致。
叶绿素荧光成像技术利用植物叶绿素荧光原理来得到植物光合作用状态、叶片异质性等直观的信息,是一种便捷、无损害的研究手段[31],其中Fv/Fm反映了光系统Ⅱ反应中心的能量捕获率,一般植物恒定在0.75~0.85,遭受胁迫时这个值显著下降[32-33],PIabs和Vj能综合反映PSⅡ所受的影响[17]。三种微生物的接种,对凤眼莲FV/Fm、PIabs和Vj指标皆有一定的影响。就整体而言,三种微生物的接种使FV/Fm普遍升高,PIabs和Vj也在一定浓度下有明显的提升,其中皆以黑曲霉的提升效果最佳。这证明在一定的U浓度胁迫下,微生物能增强PSⅡ系统的功能,黑曲霉的促进效果最明显,这可能是由于黑曲霉的代谢产物螯合重金属,减少其毒性的原因。
微生物处理能明显提高植物各部位富集U的能力及总提取量。25 mg· L-1时,胶质芽孢杆菌使凤眼莲根系吸收浓度提升最明显,吸收浓度为8.42 mg· g-1,比CK增长36.6%,枯草芽孢杆菌使凤眼莲的茎叶吸收能力提升最大,比CK增长14.1%,吸收浓度为4.37 mg·g-1,胶质芽孢杆菌使凤眼莲的U总提取量达到最高,为3.71 mg,较CK提高51.8%。有相关研究表明,根际微生物的代谢可把一些大分子化合物转化为小分子化合物,这些转化产物如有机酸、铁载体和生物表面活性剂等对植物根际的重金属有显著的活化作用,微生物分泌的螯合物还可与植物体内重金属结合,改变重金属在植物体内的存在形态[34],促进植物吸收。但其中较高浓度时枯草芽孢杆菌降低了植物根系富集能力,可能是基于微生物作用下某些重金属的直接减量以降低重金属对植物毒害作用,而胶质芽孢杆菌对植物茎叶富集能力也产生抑制,可能是通过阻隔了其向地上部转移,从而间接地提高植物的抗性,而这也正好符合接种胶质芽孢杆菌后,凤眼莲TF降低最明显的现象。就整体富集特征而言,15 mg· L-1下,接种枯草芽孢杆菌的TF最高,为19.2,5 mg· L-1下接种黑曲霉的BCF最高,为272.8,证明微生物对凤眼莲的转移能力及U吸附能力都有明显的促进。
4 结论枯草芽孢杆菌、胶质芽孢杆菌和黑曲霉三种微生物在U污染水体的植物修复中具有一定积极的作用,能显著提高凤眼莲在U污染水体中的生物量、富集浓度、吸附量等指标,其中接种胶质芽孢杆菌整体吸附效果最好。生理生化指标证明微生物对植物抗氧化系统及PSⅡ系统在U胁迫下具有一定的正面效果。对植物-微生物联合修复做出部分探索,证明其联合体系具有良好的应用价值。
| [1] |
Ding D X, Fu P K, Li L, et al. U(Ⅵ)ion adsorption thermodynamics and kinetics from aqueous solution onto raw sodium feldspar and acidactivated sodium feldspar[J]. Journal of Radioanalytical and Nuclear Chemistry, 2014, 299(3): 1903-1909. DOI:10.1007/s10967-013-2903-2 |
| [2] |
Parrish R R, Horstwood M, Arnason J G, et al. Depleted uranium contamination by inhalation exposure and its detection after approximately 20 years:Implications for human health assessment[J]. Science of the Total Environment, 2008, 390(1): 58-68. DOI:10.1016/j.scitotenv.2007.09.044 |
| [3] |
丁德馨, 李广悦, 胡南, 等. 铀尾砂中植物采铀方法研究[J]. 矿冶工程, 2010, 30(4): 58-60. DING De-xin, LI Guang-yue, HU Nan, et al. Study on phyto-uranium mining from uranium mill sand[J]. Mining and Metallurgical Engineering, 2010, 30(4): 58-60. |
| [4] |
Lee M, Yang M J. Rhizofiltration using sunflower(Helianthus annuus L.)and bean(Phaseolus vulgaris L. var. vulgaris)to remediate uranium contaminated groundwater[J]. Journal of Hazardous Materials, 2010, 173: 589-596. DOI:10.1016/j.jhazmat.2009.08.127 |
| [5] |
Tsuruta T. Removal and recovery of uranyl ion using various microorganisms[J]. Journal of Bioscience and Bioengineering, 2002, 94(1): 23-28. DOI:10.1016/S1389-1723(02)80111-6 |
| [6] |
Kuppusamy S, Palanisami T, Megharaj M, et al. In-situ remediation approaches for the management of contaminated sites:A comprehensive overview[J]. Rev Environ Contam Toxicol, 2016, 236(18): 1-115. |
| [7] |
李韵诗, 冯冲凌, 吴晓芙, 等. 重金属污染土壤植物修复中的微生物功能研究进展[J]. 生态学报, 2015, 35(20): 6881-6890. LI Yun -shi, FENG Chong-ling, WU Xiao-fu, et al. A review on the functions of microorganisms in the phytoremediation of heavy metal-contaminated soils[J]. Acta Ecologica Sinica, 2015, 35(20): 6881-6890. |
| [8] |
Eapen S, Suseelan K N. Potential for rhizofiltration of uranium using hairy root cultures of Brassica juncea and Chenopodium amaranticolor[J]. Environmental Research, 2003, 91(2): 127-133. DOI:10.1016/S0013-9351(02)00018-X |
| [9] |
Mishra K, Gupta K, Rai U N. Bioconcentration and phytotoxicity of chromium in Eichhornia crassipes[J]. Journal of Environmental Biology, 2009, 30(4): 521-526. |
| [10] |
Tiwari S, Dixit S, Verma N. An effective means of biofiltration of heavy metal contaminated water bodies using aquatic weed Eichhornia crassipes[J]. Environmental Monitoring & Assessment, 2007, 129(1/2/3): 253-256. |
| [11] |
Dixit S, Dhote S. Evaluation of uptake rate of heavy metals by Eichhornia crassipes and Hydrilla verticillata[J]. Environmental Monitoring & Assessment, 2010, 169(1/2/3/4): 367-374. |
| [12] |
Mehra A, Farago M E, Banerjee D K. A study of Eichhornia crassipes growing in the overbank and floodplain soils of the River Yamuna in Delhi, India[J]. Environmental Monitoring & Assessment, 2000, 60(1): 25-45. |
| [13] |
杨榕. 胶质芽孢杆菌促进印度芥菜富集土壤镉的效应研究[D]. 保定: 河北农业大学, 2013. YANG Rong. Effects of Bacillus mucilaginosus on soil Cd accumulation by Brassica juncea[D]. Baoding: Hebei Agricultural University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10086-1014105934.htm |
| [14] |
黄曦, 许兰兰, 黄荣韶, 等. 枯草芽孢杆菌在抑制植物病原菌中的研究进展[J]. 生物技术通报, 2010(1): 24-29. HUANG Xi, XU Lan-lan, HUANG Rong-shao, et al. Research advance in controlling plant diseases by Bacillus subtilis[J]. Biotechnology Bulletin, 2010(1): 24-29. |
| [15] |
马旻. 水产养殖废水的植物-微生物联合修复研究[D]. 北京: 中国农业科学院, 2011. MA Min. Study on phyto-microbial restoration of fishing aquacultural wastewater[D]. Beijing: Chinese Academy of Agricultural Sciences, 2011. http://cdmd.cnki.com.cn/article/cdmd-82101-1011158641.htm |
| [16] |
李爱华, 岳思君, 马海滨. 真菌孢子三种计数方法相关性的探讨[J]. 微生物学杂志, 2006, 26(2): 107-110. LI Ai-hua, YUE Si-jun, MA Hai-bin. Correlativity of three counting methods of fungal spore[J]. Journal of Biology, 2006, 26(2): 107-110. |
| [17] |
Schansker G, Srivastava A, Strasser R J. Characterization of the 820 nm transmission signal paralleling the chlorophyll a fluorescence rise (OJIP)in pea leaves[J]. Functional Plant Biology, 2003, 30(7): 785-796. DOI:10.1071/FP03032 |
| [18] |
Tewari A, Singh R, Singh N K, et al. Amelioration of municipal sludge by Pistia stratiotes L.:Role of antioxidant enzymes in detoxification od metals[J]. Bioresource Technology, 2008, 99(18): 8715-8721. DOI:10.1016/j.biortech.2008.04.018 |
| [19] |
Li Z G, Gong M. The improvement of determination peroxidase activity in plants by guaiacol[J]. Plant Physiology Communications, 2008, 44(4): 323-324. |
| [20] |
Yang L F, Pang J, Peng X L, et al. Measurement of catalase activity in plants by ultraviolet spectrophotometry[J]. Modern Agricultural Sciences and Technology, 2009(20): 364-366. |
| [21] |
张飞, 罗学刚, 陈功亮, 等. 铀对土壤微生物数量及酶活性的影响[J]. 安全与环境学报, 2016, 16(6): 370-376. ZHANG Fei, LUO Xue-gang, CHEN Gong-liang, et al. Effect of the uranium radiation on the change of the microbial amount in the soil and the enzyme activity[J]. Journal of Safety and Environment, 2016, 16(6): 370-376. |
| [22] |
贾文甫. 铀及伴生重金属富集植物特性分析和评价[D]. 绵阳: 西南科技大学, 2016. JIA Wen-fu. Characteristics analysis and evaluation on hyperaccumulator of uranium and its associated heavy metals[D]. Mianyang: Southwest University of Science and Technology, 2016. |
| [23] |
Sairam R K, Srivastava G C. Changes in antioxidant activity in subcellular fractions of tolerant and susceptible wheat genotypes in responses to long term salt stress[J]. Plant Science, 2002, 162(6): 897-904. DOI:10.1016/S0168-9452(02)00037-7 |
| [24] |
Cavalca L, Zanchi R, Corsini A, et al. Arsenic-resistant bacteria associated with roots of the wild Cirsium arvense(L.)plant from an arsenic polluted soil, and screening of potential plant growth-promoting characteristics[J]. Systematic & Applied Microbiology, 2010, 33(3): 154-164. |
| [25] |
Srivastava S, Bhainsa K C, D'Souza S F. Investigation of uranium accumulation potential and biochemical responses of an aquatic weed Hydrilla uerticillata(L. f.)Royle[J]. Bioresource Technology, 2010, 101(8): 2573-2579. DOI:10.1016/j.biortech.2009.10.054 |
| [26] |
严政, 谢水波, 李仕友, 等. 凤眼莲、大薸对铀胁迫的生理生化响应[J]. 安全与环境学报, 2012, 12(3): 1-5. YAN Zheng, XIE Shui-bo, LI Shi-you, et al. Physiological and biochemical responses of Eichhornia crassipes and Pistia stratiotes induced at uranium stress[J]. Journal of Safety and Environment, 2012, 12(3): 1-5. |
| [27] |
Zhang X, Li C, Nan Z. Effects of cadmium stress on growth and antioxidative systems in Achnatherum inebrians symbiotic with Neotyphodium gansuense[J]. Journal of Hazardous Materials, 2010, 175(1/2/3): 703. |
| [28] |
Hildebrandt U, Regvar M, Bothe H. Arbuscular mycorrhiza and heavy metal tolerance[J]. Phytochemistry, 2007, 68(1): 139-146. DOI:10.1016/j.phytochem.2006.09.023 |
| [29] |
Ouziad F, Hildebrandt U, Schmelzer E, et al. Differential gene expressions in arbuscular mycorrhizal-colonized tomato grown under heavy metal stress[J]. Journal of Plant Physiology, 2005, 162(6): 634-649. DOI:10.1016/j.jplph.2004.09.014 |
| [30] |
朱靖. 三种水生植物对水体中铀的富集特征及响应机制[D]. 绵阳: 西南科技大学, 2016. ZHU Jing. Accumulation and response mechanism of three aquatic plants to uranium stress in hydroponic condition[D]. Mianyang: Southwest University of Science and Technology, 2016. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D830831 |
| [31] |
陈功亮, 罗学刚. 铀胁迫对酸模叶绿素荧光特性和酶活性的影响[J]. 环境科学与技术, 2015, 38(3): 38-43. CHEN Gong-liang, LUO Xue-gang. Effect of uranium stress on chlorophyll fluorescence characteristics and enzyme activity of Rumex acetosa L.[J]. Environmental Science & Technology, 2015, 38(3): 38-43. |
| [32] |
简敏菲, 汪斯琛, 余厚平, 等. Cd2+、Cu2+胁迫对黑藻(Hydrilla verticillata)的生长及光合荧光特性的影响[J]. 生态学报, 2016, 36(6): 1719-1727. JIAN Min-fei, WANG Si-chen, YU Hou-ping, et al. Influence of Cd2+ or Cu2+ stress on the growth and photosynthetic fluorescence characteristics of Hydrilla verticillata[J]. Acta Ecologica Sinica, 2016, 36(6): 1719-1727. |
| [33] |
张文斌, 谢瑶, 黄儒珠, 等. 水体铜污染对水葫芦(Eichhornia crassipes)叶绿素荧光及生长的影响[J]. 福建师范大学学报(自然科学版), 2016, 32(2): 55-61. ZHANG Wen-bin, XIE Yao, HUANG Ru-zhu, et al. Effects of water pollution of copper on the chlorophyll fluorescence parameters and the growth of Eichhornia crassipes[J]. Journal of Fujian Normal University (Natural Science Edition), 2016, 32(2): 55-61. |
| [34] |
Sheng X F, Xia J J, Jiang C Y, et al. Characterization of heavy metalresistant endophytic bacteria from rape(Brassica napus)roots and their potential in promoting the growth and lead accumulation of rape[J]. Environmental Pollution, 2008, 156(3): 1164-1170. DOI:10.1016/j.envpol.2008.04.007 |
 2018, Vol. 37
2018, Vol. 37