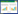文章信息
- 肖诗琦, 宋收, 陈晓明, 戚鑫, 张祥辉, 田甲, 黄森, 董发勤
- XIAO Shi-qi, SONG Shou, CHEN Xiao-ming, QI Xin, ZHANG Xiang-hui, TIAN Jia, HUANG Sen, DONG Fa-qin
- 高通量测序揭示铀污染对土壤真菌群落结构的影响
- Effect of uranium pollution on the soil fungal community as revealed via high-throughput sequencing
- 农业环境科学学报, 2018, 37(8): 1698-1704
- Journal of Agro-Environment Science, 2018, 37(8): 1698-1704
- http://dx.doi.org/10.11654/jaes.2018-0245
文章历史
- 收稿日期: 2018-02-26
- 录用日期: 2018-04-27
2. 西南科技大学国防重点实验室, 四川 绵阳 621010
2. Defense Key Laboratory, Southwest University of Science and Technology, Mianyang 621010, China
随着核电工业的快速发展,我国对天然铀的需求量剧增。铀矿冶炼和应用过程中,产生了大量含放射性铀等重金属的尾矿渣、尾矿水,使得土壤受到了放射性重金属的污染[1-2]。土壤被铀污染后,一方面具有放射性污染,通过放射性衰变产生射线穿透机体组织,损害细胞,另一方面,可通过呼吸系统或食物链等途径进入人体,造成损害更大的内照射损伤,严重威胁人类身体健康[3-6]。因此,有必要考察铀污染对土壤生态环境的影响。
土壤微生物在土壤生态系统中起着关键作用,80%~90%的土壤相关功能都被微生物所调节,包括土壤养分转化,系统的稳定性及抗干扰能力等[7]。在生物学上微生物被认定为最敏感的土壤质量指标,其能直接反映污染物的毒性及潜在影响[8-10]。其中真菌构成了土壤的大部分微生物生物量,其具有分解有机质、为植物提供养分的功能,是生态系统健康的指示物[11]。此外真菌可通过不同机制对重金属产生耐性,包括细胞外金属吸附和沉淀、细胞内/胞外酶的产生、金属与细胞壁的结合及细胞内的吸附和络合等[12]。因此,对土壤真菌群落结构的研究能为评估和修复铀污染生态环境提供一定的理论参考。
高通量测序具有高效、准确、信息量丰富等特点,已被广泛应用于环境微生物群落研究中。Wu等[13]利用高通量测序技术,分析了电子污染回收区中土壤理化性质及重金属对微生物群落组成和多样性的影响,结果表明土地使用模式会改变微生物群落组成,并且汞是改变微生物群落多样性最主要的因子。Guo等[14]利用高通量测序技术揭示了重金属污染土壤中微生物群落的变化,并获得重金属敏感菌及耐性菌。这种技术为研究环境中微生物群落结构提供了大量的信息。基于此,本研究采用高通量测序研究了真菌群落组成及多样性,比较不同铀浓度处理后土壤真菌群落结构差异,为铀污染土壤生态质量评估及修复提供依据。
1 材料与方法 1.1 样品采集及预处理供试土壤采自西南科技大学校园内无污染、植被肥沃的暗棕壤,土壤基本理化性质见表 1。采样方法:在1 m2内采用5点法取样,采样时先铲去地表植物,刮掉5 mm厚的表层土壤,挖取直径为20 cm的土坑,取样深度为6~10 cm。土壤采集后经过筛、去除杂质等前处理。土壤胁迫处理采取向供试土壤中添加外源铀的形式,样品采用培养皿进行培养,每个培养皿中25 g湿土。选用醋酸双氧铀[UO2(CH3COO2)2·2H2O,分析纯,湖北楚胜威化工有限公司],以纯铀计,配制成1 g·L-1铀溶液并以其为母液进行胁迫处理。外源铀胁迫浓度为2、5、10、20、50、100 mg·kg-1,依次记为U2、U5、U10、U20、U50和U100。以原始土壤作为空白对照,记为U0。处理后的土壤放置在25 ℃下进行培养,胁迫时间为15 d,土壤水分保持为田间持水量的60%。
采用OMEGA生物公司的E.Z.N.A. Soil DNA Kit抽提试剂盒提取土壤总DNA。扩增选取真菌18S rRNA基因中的ITS1F-ITS2区段作为扩增对象,采用引物:正向ITS1F(5'-CTTGGTCATTTAGAGGAAG TAA-3'),反向2043R(5'-GCTGCGTTCTTCATCGA TG C-3')。使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,将PCR产物用Quanti-FluorTM-ST蓝色荧光定量系统进行检测定量,根据测得的DNA浓度,将样品按1: 1比例混合,并振荡混合均匀。MiSeq文库构建及Illumina高通量测序均由上海美吉生物医药科技有限公司完成。将测得序列上传至NCBI数据库中,获得登录号SRR6921796、SRR6921807、SRR6921809、SRR6921813、SRR6921814、SRR6921851和SRR6921858。
1.3 数据分析多样性数据分析:对测得所有序列进行OTU划分,基于97%的相似性生成OTU表格,并构建稀释曲线。应用Mothur软件中的summary.single命令,计算Chao1、Ace、Shannon及Simpson 4种常用的生物多样性指数。
分类学分析:使用Qiime平台与RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析(置信度阈值为0.7),其中以Unite为数据库,得到不同浓度铀处理样本的真菌在门和属水平上的组成[15-16]。分类学数据库中会出现一些分类学谱系中的中间等级没有科学名称,以norank作为标记。分类学比对后根据置信度阈值的筛选,会有某些分类谱系在某一分类级别分值较低,以Unclassified标记。
统计分析:采用SPSS 17.0中相关性分析考察铀污染与真菌群落的关系。主成分分析(Principle component analysis)方法分析不同浓度铀处理样本间真菌群落的差异,采用R语言的Vegan包实现[17]。
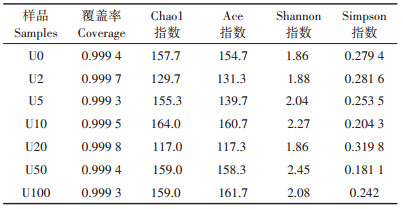
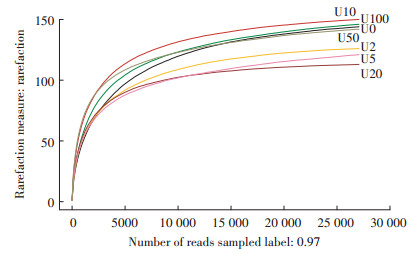
2 结果与分析 2.1 土壤真菌多样性指数测序共得到有效reads 223 004条,平均每个样品31 857条,其中平均碱基数高达7 771 584,平均片段长度为245 bp。采用对序列进行随机抽样的方法,以抽到的序列数与它们所能代表OTU的数目构建稀释性曲线,当曲线趋向平坦时,说明测序数据量合理。如图 1所示,6个处理组的稀释性曲线先呈直线上升随后均趋于平坦,更多的数据量只会产生少量新的OTU,说明样本量足以覆盖所有真菌。并且样本测序深度指数值均在99%以上(表 2),进一步证实本次测序结果能较好地代表样本中微生物的真实情况。此外,还获得不同样本中真菌的Alpha多样性指数值。Ace和Chao1指数均可用于估算群落中OTU的数目,两种指数算法不同。该试验中,U10、U50和U100处理组的Chao1和Ace指数较对照组高,而U2、U5和U20处理组的较对照组低,其中U20处理组的两种指数均最低。Shannon和Simpson均表征微生物群落多样性。Shannon值越大,说明群落多样性越高,而Simpson值越大,群落多样性越低。其中U20处理组的Shannon值最低,为1.86;U50处理组的Shannon值最高,为2.45。除U20处理组外,其余铀处理组多样性均高于对照组,该结果表明了铀处理对土壤真菌多样性有重要影响,并且20 mg·kg-1的铀处理对土壤真菌影响较大。
|
| 图 1 铀处理下土壤真菌的稀释性曲线 Figure 1 Rarefaction curves of soil fungi under uranium stress |
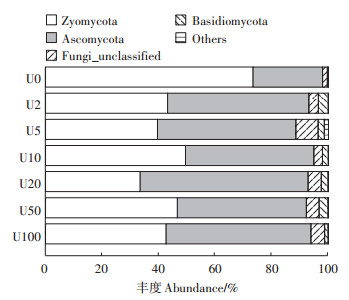
由图 2可知,检测所得的OTU主要属于4个门类,在整体水平接合菌门(Zygomycota,33.46%~ 73.36%)丰度最高,其次为子囊菌门(Ascomycota,24.56%~59.33%)、未被分类的真菌门Fungi_unclassified(1.68%~7.86%)及担子菌门(Basidiomycota,0.41%~ 3.53%)。与对照组相比,土壤在受到铀胁迫后,接合菌门丰度下降,而子囊菌门丰度升高。与贺根和等[18]研究结果相似,子囊菌门在受到重金属污染后丰度升高,表明子囊菌门真菌可能对重金属具有较强的耐受性。此外,未分类真菌在土壤中占有一定比例,并且其在外源铀胁迫后的土壤中比例更高,因此未知真菌在土壤响应铀胁迫中具有重要意义。
|
| 图 2 铀处理下土壤优势真菌的相对丰度 Figure 2 Relative abundance of dominant fungi under uranium stress |
在属水平(图 3),获得前100种优势菌属。丰度大于1%的菌属有Mortierella、Ascomycota_unclassified、Fungi_unclassified、Fusarium、Staphylotrichum、Basidiomycota_unclassified、Montagnulaceae_unclassified、Haematonectria、Podospora、Agaricales_unclassified、Coniochaetaceae_unclassified、Pyrenochaetopsis和Entrophospora。其中Mortierella(33.46%~73.3%)和Ascomycota_unclassified(15.89%~52.56%)显著富集在各处理组中。与对照相比,铀处理之后土壤中Mortierella的数量显著下降,最多减少了40%;而Ascomycota_unclassified明显增加,最高增加了37%。

|
| 相对丰度Relative abundance of community/% 图 3 铀处理下土壤真菌群落聚类热图 Figure 3 Heatmap of fungal community clusters under uranium stress |
此外,在铀处理后,部分优势菌种消失,同时也出现新的物种。其中Mortierellales_unclassified,Lophiostoma,Xylaria和Thelonectria仅在对照组中检测到,而Trichosporon和Agaricomycetes_unclassified仅出现在各铀处理组中。某些菌属仅在某一铀处理组中检测到,如Glomus,Fellomyces,Rhizoctonia,Scutellinia和Occultifur仅存在于U100处理组中,Myxotrichaceae_unclassified和Eurotiomycetes_unclassified仅存在于U50组中,而Westerdykella和Sporobolomyces仅存在于U10处理组中。以上结果表明,土壤在受到铀污染后,其真菌群落组成有明显的变化。
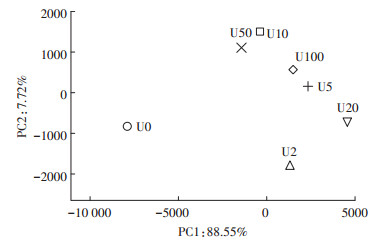
2.3 铀污染对土壤真菌群落的影响利用主成分分析(PCA)考察不同浓度铀污染土壤中真菌群落结构的差异。从图 4可以看出,第一主坐标轴对样品差异的贡献值为88.55%,第二主坐标的贡献值为7.72%。种类聚类中距离较近的样本代表其真菌群落结构较为相似,其中U10和U50铀处理样品的真菌结构相似,U5和U100铀处理样品的真菌结构相似,而U0对照组土壤中真菌结构与铀处理组相差较大。该结果表明了不同浓度的铀污染对土壤中的真菌群落结构有明显影响。
|
| 图 4 铀处理下土壤真菌群落PCA分析 Figure 4 PCA analysis of fungal communities under uranium stress |
本研究采用相关性分析,进一步考察了铀与优势菌属间的关系。分析结果显示多数优势菌属与铀无显著关系,其中10种菌属与铀有显著相关性,表明该10种真菌对铀具有一定耐性。如表 3所示,铀与Epicoccum、Agaricomycetes_unclassified和Cylindrocarpon呈显著相关(P<0.05),与Pseudeurotium、Glomu、Fellomyces、Rhizoctonia、Scutellinia、Occultifur和Cephaliophora呈极显著正相关(P<0.01)。
本研究采用Illumina MiSeq测序技术,从真菌群落多样性、组成及结构方面考察了不同浓度铀污染对土壤微生物的影响。研究结果表明,不同浓度铀处理后,土壤真菌群落丰度及多样性均产生明显变化。这可能是由于当微生物群落暴露于重金属污染程度改变的环境时,对重金属毒性敏感的微生物显著减少,而耐性微生物能很快适应环境的变化[19]。此外,多数铀处理组Shannon指数均高于对照组,表明铀处理后真菌群落多样性上升。与本研究相似,陈承利[20]发现重金属污染使土壤中真菌增多,从而使其多样性增加。而Jose等[21]研究发现高浓度重金属污染会显著降低细菌群落多样性,这可能由于微生物对重金属的响应程度不同,其中真菌对重金属耐性最高,其次是细菌和放线菌。
在群落组成上,真菌主要以Mortierella和Ascomycota_unclassified为主。其中Mortierella在铀处理后,丰度下降。该结果与杨金水等[22]对铅锌矿区中土壤优势真菌的分析结果相似,Mortierella在低浓度重金属污染样品中丰度更高。同时,铀胁迫后某些菌属消失,也新增了部分菌属。例如Xylaria仅在对照组中检出而Trichosporon仅在铀处理后出现。Fellomyces,Eurotiomycetes_unclassified和Sporobolomyces等仅存在于某一铀处理组中。主成分分析结果表明,受到铀处理后的土壤真菌群落结构更为相似。这些结果表明在铀污染下,土壤真菌群落结构发生了变化。这可能是一定程度的铀污染改变了原有群落内部种群之间的竞争关系,导致原始种群失去了优势,而耐铀微生物丰度增加并且某些微生物耐受铀的过程产生的产物保护了其他种群的微生物,从而使铀污染土壤的优势种群发生了明显改变[23]。
本研究中获得的对铀具有耐性的真菌中Glomus、Rhizoctonia、Scutellinia、Agaricomycetes及Cylindrocarpon均为菌根真菌。该类真菌可与植物形成共生体系,是自然界普遍存在的微生物,其在铀的固定和累积中起着一定的作用[24-25]。大量的研究证实[26-28],在重金属污染土壤中,菌根真菌一方面可以帮助植物吸收矿质养分促进其生长,从而增强植物对重金属污染的耐受能力,另一方面菌根真菌自身能够吸收、固持重金属,从而在一定程度上降低土壤重金属对植物的有效性和毒性[29-31]。郑文君等[32]考察了接种Glomus sp.对蜈蚣草吸附铀的影响。研究结果表明,接种该真菌有助于蜈蚣草吸附铀并能减缓铀对蜈蚣草的毒害。Vare[33]利用能量分散X射线考察了菌根真菌对重金属的耐性机理,其在菌根真菌的液泡中发现有重金属聚磷酸沉淀。其中磷酸根易与铀螯合形成结晶体,并且其能主动吸收铀并能在细胞内形成铀的磷酸盐沉淀[34]。本研究中真菌对铀的耐性可能是由于铀离子在进入细胞后被转运至液泡,或者在胞质中与磷酸或其他易结合物质结合形成沉淀。其中铀的磷酸沉淀能大幅降低细胞中可溶性铀的浓度,从而使细胞免受进一步毒害。基于此,利用微生物对铀的耐受性机制和环境行为的特点来修复受铀污染的环境前景广阔,进一步研究微生物的耐铀机制有着重要的理论与实践意义。
4 结论(1) 与对照组比较,铀污染后真菌群落多样性有明显改变。铀胁迫浓度为50 mg·kg-1时,土壤真菌多样性最高,铀胁迫浓度为20 mg·kg-1时,土壤真菌多样性最低。
(2) 铀污染后土壤优势种群发生明显改变。与对照组比较,Mortierella丰度最多减少了40%;而Ascomycota_unclassified最高增加了37%。主成分分析结果表明,铀处理组土壤真菌群落结构均与对照组差异最大。
(3) 相关性分析结果得到10种对铀具有耐性的真菌,分别是Pseudeurotium,Glomus,Agaricomycetes_ unclassified,Epicoccum,Fellomyces,Rhizoctonia,Scutellinia,Occultifur,Cephaliophora和Cylindrocarpon。
| [1] |
Sun S Y, Zhou Q. Ecological effect and bioremediation of radioactive contaminated soil[J]. Chinese Journal of Eco-Agriculture, 2008, 16(2): 523-528. DOI:10.3724/SP.J.1011.2008.00523 |
| [2] |
Holmes A L, Joyce K, Xie H, et al. The impact of homologous recombination repair deficiency on depleted uranium clastogenicity in Chinese hamster ovary cells:XRCC3 protects cells from chromosome aberrations, but increases chromosome fragmentation[J]. Mutattion Research, 2014, 762(1): 1-9. |
| [3] |
Fathi R A, Matti L Y, Alsalih H S, et al. Environmental pollution by depleted uranium in Iraq with special reference to Mosul and possible effects on cancer and birth defect rates[J]. Medicine Conflict and Survival, 2013, 29(1): 7-25. DOI:10.1080/13623699.2013.765173 |
| [4] |
Pattison J E. The interaction of natural background gamma radiation with depleted uranium micro-particles in the human body[J]. Journal of Radiological Protection, 2013, 33(1): 187-198. DOI:10.1088/0952-4746/33/1/187 |
| [5] |
刘小玲, 陈晓明, 宋收, 等. 柠檬酸杆菌对U(Ⅵ)的去除效应及机理研究[J]. 核农学报, 2015, 29(9): 1774-1781. LIU Xiao-ling, CHEN Xiao-ming, SONG Shou, et al. The removal effect and mechanism of citrobacter freundii on U(Ⅵ)[J]. Journal of Nuclear Agricultural Sciences, 2015, 29(9): 1774-1781. DOI:10.11869/j.issn.100-8551.2015.09.1774 |
| [6] |
史建军. 放射性核素对生态环境的影响[J]. 核农学报, 2011, 25(2): 397-403. SHI Jian-jun. Nuclear accident impact on the ecological environment[J]. Journal of Nuclear Agricultural Sciences, 2011, 25(2): 397-403. DOI:10.11869/hnxb.2011.02.0397 |
| [7] |
Lozano Y M, Hortal S, Armas C, et al. Interactions among soil, plants, and microorganisms drive secondary succession in a dry environment[J]. Soil Biology and Biochemistry, 2014, 78: 298-306. DOI:10.1016/j.soilbio.2014.08.007 |
| [8] |
Nannipieri P, Ascher J, Ceccherini M T, et al. Microbial diversity and soil functions[J]. European Journal of Soil Science, 2003, 54(4): 655-670. DOI:10.1046/j.1351-0754.2003.0556.x |
| [9] |
Silva M C P E, Semenov A V, Schmitt H, et al. Microbe-mediated processes as indicators to establish the normal operating range of soil functioning[J]. Soil Biology and Biochemistry, 2013, 57(3): 995-1002. |
| [10] |
宋收, 陈晓明, 肖伟, 等. 基于BIOLOG指纹解析土壤可培微生物对铀污染的响应[J]. 核农学报, 2016, 30(6): 1169-1177. SONG Shou, CHEN Xiao-ming, XIAO Wei, et al. Response of soil cultivatable microorganisms to uranium contamination based on BIOLOG fingerprint analysis method[J]. Journal of Nuclear Agricultural Sciences, 2016, 30(6): 1169-1177. DOI:10.11869/j.issn.100-8551.2016.06.1169 |
| [11] |
张晶, 张慧文, 李新宇, 等. 土壤真菌多样性及分子生态学研究进展[J]. 应用生态学报, 2004, 15(10): 1958-1962. ZHANG Jing, ZHANG Hui-wen, LI Xin-yu, et al. Research advances in soil fungal diversity and molecular ecology[J]. Chinese Journal of Applied Ecology, 2004, 15(10): 1958-1962. DOI:10.3321/j.issn:1001-9332.2004.10.051 |
| [12] |
Oladipo O G, Awotoye O O, Olayinka A, et al. Heavy metal tolerance traits of filamentous fungi isolated from gold and gemstone mining sites[J]. Brazilian Journal of Microbiology, 2017, 49(1): 29-37. |
| [13] |
Wu W C, Dong C X, Wu J H, et al. Ecological effects of soil properties and metal concentrations on the composition and diversity of microbial communities associated with land use patterns in an electronic waste recycling region[J]. Science of the Total Environment, 2017, 601/602: 57-65. DOI:10.1016/j.scitotenv.2017.05.165 |
| [14] |
Guo H H, Nasir M, Lv J L, et al. Understanding the variation of microbial community in heavy metals contaminated soil using high throughput sequencing[J]. Ecotoxicology and Environmental Safety, 2017, 144: 300-306. DOI:10.1016/j.ecoenv.2017.06.048 |
| [15] |
Wang Q, Garrity G M, Tiedje J M, et al. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267. DOI:10.1128/AEM.00062-07 |
| [16] |
Kõljalg U, Nilsson R H, Abarenkov K, et al. Towards a unified paradigm for sequence-based identification of fungi[J]. Molecular Ecology, 2013, 22(21): 5271-5277. DOI:10.1111/mec.12481 |
| [17] |
赖江山, 米湘成. 基于Vegan软件包的生态学数据排序分析[C]//中国生物多样性保护与研究进展Ⅸ. 北京: 气象出版社, 2012: 332-343. LAI Jiang-shan, MI Xiang-cheng. Ordination analysis of ecological data using vegan package in R[C]//Advances in biodiversity conservation and research in China Ⅸ. Beijing: China Meteorological Press, 2012: 332-343. |
| [18] |
贺根和, 王小东, 刘强, 等. 铝胁迫对酸性红壤中真菌种群多样性的影响[J]. 农业环境科学学报, 2014, 33(9): 1736-1742. HE Gen-he, WANG Xiao-dong, LIU Qiang, et al. Effect of aluminum stress on fungal community diversity in acidic red soils[J]. Journal of Agro-Environment Science, 2014, 33(9): 1736-1742. DOI:10.11654/jaes.2014.09.010 |
| [19] |
Ranjard L, Lignier L, Chaussod R. Cumulative effects of short-term polymetal contamination on soil bacterial community structure[J]. Applied and Environmental Microbiology, 2006, 72(2): 1684-1687. DOI:10.1128/AEM.72.2.1684-1687.2006 |
| [20] |
陈承利. 重金属Cd、Pb、Hg污染对土壤微生物及其活性影响的研究[D]. 杭州: 浙江大学, 2006. CHEN Cheng-li. Effect of Cd, Pb and Hg pollution on soil microorganisms and their activity[D]. Hangzhou: Zhejiang University, 2006. |
| [21] |
Jose J, Giridhar R, Anas A, et al. Heavy metal pollution exerts reduction/adaptation in the diversity and enzyme expression profile of heterotrophic bacteria in Cochin estuary, India[J]. Environmental Pollution, 2011, 159(10): 2775-2780. DOI:10.1016/j.envpol.2011.05.009 |
| [22] |
杨金水, 杨扬, 孙良明, 等. 铅锌矿区土壤真菌响应重金属污染的群落组成变化[J]. 北京大学学报, 2017, 53(2): 387-396. YANG Jin-shui, YANG Yang, SUN Liang-ming, et al. Characterization of soil fungal community in response to heavy metal pollution in lead-zinc mining area[J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2017, 53(2): 387-396. |
| [23] |
郭建华, 李华平, 朱红慧. 大宝山重金属污染土壤微生物群落优势种群分析[J]. 华南农业大学学报, 2010, 31(3): 56-60. GUO Jian-hua, LI Hua-ping, ZHU Hong-hui. Analysis of dominant species of microbial community in heavy metals contaminated soil from Dabaoshan area[J]. Journal of South China Agricultural University, 2010, 31(3): 56-60. |
| [24] |
刘润进, 焦惠, 李岩, 等. 丛枝菌根真菌物种多样性研究进展[J]. 应用生态学报, 2009, 20(9): 2301-2307. LIU Run-jin, JIAO Hui, LI Yan, et al. Research advances in species diversity of arbuscular mycorrhizal fungi[J]. Chinese Journal of Applied Ecology, 2009, 20(9): 2301-2307. |
| [25] |
Barescut J C, Gariel J C, Peres J M, et al. Use of mycorrhizal fungi for the phytostabilisation of radio-contaminated environment(European project MYRRH):Overview on the scientific achievements[J]. Radioprotection, 2005, 40(S1): 41-46. |
| [26] |
Chen B D, Li X L, Tao H Q, et al. The role of arbuscular mycorrhiza in zinc uptake by red clover growing in a calcareous soil spiked with various quantities of zinc[J]. Chemosphere, 2003, 50(6): 839-846. DOI:10.1016/S0045-6535(02)00228-X |
| [27] |
Meier S, Borie F, Bolan N, et al. Phytoremediation of metal-polluted soils by arbuscular mycorrhizal fungi[J]. Critical Reviews in Environmental Science and Technology, 2012, 42(7): 741-775. DOI:10.1080/10643389.2010.528518 |
| [28] |
Kothe E, Varma A. Bio-Geo interactions in metal-contaminated soils[M]. Berlin: Springer Berlin Heidelberg, 2012, 31.
|
| [29] |
伍松林, 张莘, 陈保冬. 丛枝菌根对土壤-植物系统中重金属迁移转化的影响[J]. 生态毒理学报, 2013, 8(6): 847-856. WU Song -lin, ZHANG Xin, CHEN Bao-dong. Effects of arbuscular mycorrhizal fungi on heavy metal translocation and transformation in the soil-plant continuum[J]. Asian Journal of Ecotoxicology, 2013, 8(6): 847-856. DOI:10.7524/AJE.1673-5897.20121019001 |
| [30] |
Wu S L, Chen B D, Sun Y Q, et al. Chromium resistance of dandelion (Taraxacum platypecidum Diels.)and bermudagrass(Cynodon dactylon[Linn.] Pers.)is enhanced by arbuscular mycorrhiza in Cr(Ⅵ)-contaminated soils[J]. Environmental Toxicology and Chemistry, 2014, 33(9): 2105-2113. DOI:10.1002/etc.v33.9 |
| [31] |
Zhang X, Ren B H, Wu S L, et al. Arbuscular mycorrhizal symbiosis influences arsenic accumulation and speciation in Medicago truncatula L. in arsenic-contaminated soil[J]. Chemosphere, 2015, 119: 224-230. DOI:10.1016/j.chemosphere.2014.06.042 |
| [32] |
郑文君, 王明元. 接种丛枝菌根真菌对蜈蚣草吸收铀的影响[J]. 环境科学, 2015, 36(8): 3004-3010. ZHENG Wen-jun, WANG Ming-yuan. Influence of uranium in Pteris vittata L. inoculated by arbuscular mycorrhizal fungus[J]. Environmental Science, 2015, 36(8): 3004-3010. |
| [33] |
Vare H. Aluminium poly phosphate in the ectomycorrhizal fungal Suillus variegatus(Fr)O. Kunze as revealed by energy dispersive spectrometry[J]. The New Phytologist, 1990, 116(4): 663-668. DOI:10.1111/nph.1990.116.issue-4 |
| [34] |
Loppi S, Riccobono F, Zhang Z H, et al. Lichens as biomonitors of uranium in the Balkan areas[J]. Environmental Pollution, 2003, 125(2): 277-280. DOI:10.1016/S0269-7491(03)00057-5 |
 2018, Vol. 37
2018, Vol. 37