文章信息
- 徐伟慧, 刘帅, 王志刚
- XU Wei-hui, LIU Shuai, WANG Zhi-gang
- 一株DMP降解菌的分离鉴定及特性研究
- Isolation, identification, and degradation characteristics of a DMP-degrading strain
- 农业环境科学学报, 2018, 37(8): 1724-1732
- Journal of Agro-Environment Science, 2018, 37(8): 1724-1732
- http://dx.doi.org/10.11654/jaes.2018-0089
文章历史
- 收稿日期: 2018-01-16
- 录用日期: 2018-04-09
2. 农业部华南都市农业重点实验室, 广州 510640
2. Key Laboratory of Urban Agriculture in South China, Ministry of Agriculture, Guangzhou 510640, China
邻苯二甲酸酯(Phthalic acid ester,PAEs)又被称作酞酸酯,是一种使用面广,年产量大的人工合成有机化合物[1]。其常被用作增塑剂和软化剂而添加到塑料用品之中,PAEs被证明具“三致”作用[2-3]。目前PAEs已广泛存在于空气、水体和土壤等环境介质,并在动植物体内积累[4-5],最终通过食物链危害人类的健康。
PAEs在环境中尤其是土壤环境中不易自然降解,因此利用微生物降解土壤环境中的PAEs已经成为研究热点。中国国家环境监测中心将邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)和邻苯二甲酸二辛酯(DNOP)3种PAEs确定为环境优先控制污染物[6-7]。本实验室前期研究发现DMP可改变黑土土壤呼吸,影响土壤酶活性以及物质的代谢,使黑土微生物区系结构和功能代谢菌群数量发生改变,微生物多样性降低[8-9],导致黑土生态系统功能受到影响。因此,寻找高效的DMP降解菌尤为重要。本研究以长期覆盖塑料废弃物的垃圾场的土壤为试材,筛选能降解DMP的菌株并研究其特性,旨在分离降解DMP的优势菌种,为今后构建具有高效降解性能的微生物体系及控制DMP污染和土壤生物修复的研究奠定基础。
1 材料与方法 1.1 供试培养基微量元素储备液:CaSO4·5H2O 4.0 g,FeSO4·7H2O 7.0 g,FeCl3·6H2O 7.0 g,CoCl3·6H2O 0.2 g,NaMO4·2H2O 3.4 g,CaCl2 2.0 g,H2O 1000 mL,pH 7.0。
基础无机盐(MSM)培养基:K2HPO4·12H2O 1.0 g,KH2PO4 1.0 g,NH4Cl 0.8 g,NaCl 1.0 g,MgSO4·7H2O 0.5 g,微量元素储备液2 mL,H2O 1000 mL。
LB培养基:蛋白胨10.0 g,酵母粉5.0 g,NaCl 10.0 g,H2O 1000 mL。
1.2 DMP降解菌的分离与鉴定从长期覆盖塑料废弃物的露天垃圾场中采集土样,称5 g土样放于含有50 mg·L-1 DMP的MSM培养液中进行梯度压力驯化培养,在温度30 ℃,转速130 r·min-1的条件下培养3 d,取1 mL菌液接种到含有100 mg·L-1 DMP的MSM培养基中继续培养,3 d后从含有100 mg·L-1 DMP的MSM培养基中取1 mL菌液接种到含有150 mg·L-1 DMP的MSM培养基中继续培养,以此步骤进行培养,30 d后直至培养基中的DMP浓度达到500 mg·L-1,培养30 d后,取0.1 mL菌液稀释涂布到固体MSM培养基平板中,30 ℃培养7 d。挑选不同菌落形态的单菌落接种到新鲜的MSM琼脂板上进行划线培养。随后重复划线培养2~3次,在此期间用接种环挑取细菌进行番红染色,并利用光学显微镜制片观察,直至分离的培养物为纯培养物的单菌落,将分离纯化得到的细菌接入LB液体培养基中进行培养,3 d后取菌液离心,弃上清,沉淀保存在-20 ℃的冰箱中备用。
16S rDNA序列分析:使用Ezup柱式细菌基因组DNA抽提试剂盒(编号:B518255)提取DNA。PCR扩增采用细菌通用引物[10],27f:(5'-AGAGTTTGATCCT-GGCTCAG-3')和1492r:(5'-TACGGCTAC CTTGTTACG-ACTT-3'),由上海生工合成。PCR反应体系20 μL为:10×Ex Taq buffer 2.0 μL、2.5 Mm dNTP Mix 1.6 μL、5p 27f 0.8 μL、5p 1492r 0.8 μL、DNA模板0.5 μL、5u Ex Taq 0.2 μL、ddH2O 14.1 μL。PCR反应条件:95 ℃预变性5 min,95 ℃变性30 s,55 ℃ 30 s,72 ℃ 90 s,24个循环,72 ℃延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳检测,采用SanPrep柱式PCR产物纯化试剂盒纯化PCR产物,送上海美吉生物医药科技有限公司测序。测序结果在NCBI的GenBank数据库中进行Blast比对,寻找与目的序列同源性最高的已知分类地位菌种的16S rDNA序列。采用MEGA 5.0软件以邻接法构建系统发育树。
1.3 DMP降解菌生长及降解的特性研究将纯菌株接种到150 mL含有500 mg·L-1 DMP的MSM培养基中,在转速130 r·min-1、温度30 ℃的条件下培养3 d,每隔12 h测量菌液OD600,并取10 mL菌液离心,取上清用乙酸乙酯萃取,将上层有机相旋转蒸发,利用高效液相色谱测量培养基中剩余的DMP浓度。所有的实验均重复3次。
1.4 DMP降解菌对不同碳源的利用将0.1 mL菌液分别接种到含有不同碳源为底物的MSM培养基中,在转速130 r·min-1,温度30 ℃的条件下培养3 d。根据菌株的生长情况以及OD600的大小确定降解菌对不同碳源的利用能力。底物分别为DMP、DBP(邻苯二甲酸二丁酯)、DEP、DEHP(邻苯二甲酸二异辛酯)、PA(邻苯二甲酸)、PCA(原儿茶酸)、蔗糖和葡萄糖。
1.5 不同温度和pH对DMP降解菌生长的影响将菌株接种在MSM的液体培养基中(DMP 500 mg·L-1),30 ℃、130 r·min-1条件下活化培养36 h。取1 mL活化后的菌液接种到含有不同pH的MSM培养基的三角瓶内,pH分别为5.0、6.0、7.0、8.0和9.0,以30 ℃、130 r·min-1条件培养3 d。每隔12 h取5 mL菌液测量OD600,所有实验均重复3次。
将1 mL活化后的菌液接种到含有500 mg·L-1 DMP的MSM培养基(pH7)中,分别在25、27.5、30、32.5 ℃和35 ℃温度下培养3 d。每隔12 h取5 mL菌液测量OD600,所有实验均重复3次。
1.6 DMP降解菌降解DMP的动力学方程及中间代谢产物研究取1 mL活化后的菌液接种到含有不同初始DMP (100、200、300、400 mg·L-1和500 mg·L-1)浓度的MSM培养基中,在转速130 r·min-1及最佳pH和温度的条件下培养3 d(pH 8,30 ℃)。每隔12 h取10 mL培养液4000 r·min-1离心10 min,上清液用乙酸乙酯萃取,旋转蒸发仪浓缩,高效液相色谱分析仪测量培养基中剩余的DMP浓度。利用液相质谱联用技术分析降解过程中所生成的中间代谢产物。动力学参数的计算参考Chen等[11]的方法,曲线拟合动力学分析采用Sig⁃ ma Plot软件,所有的测试均重复3次。
1.7 DMP降解菌降解基因的扩增使用Ezup柱式细菌基因组DNA抽提试剂盒(编号:B518255)从新培养的菌液中提取细菌DNA。根据Eaton[12]发现的降解基因序列设计引物,引物如表 1所示。以降解菌DNA为模板分别在不同退火温度下进行PCR扩增,跑琼脂糖凝胶电泳,凝胶成像系统观察,切取符合目的片段大小的PCR产物送至上海生工测序,核酸序列在NCBI网站进行比对。
采用Excel 2013和Sigma Plot等软件进行数据统计分析与作图。
2 结果与分析 2.1 DMP降解菌的分离与鉴定本研究通过驯化、富集培养4周后成功从长期覆盖塑料废弃物的垃圾场土壤中分离了一株DMP降解菌,将其命名为QD15-1,菌株QD15-1是一株好氧菌,在DMP为唯一碳源和能源的MSM平板上菌落形态呈现出不透明的乳黄色,菌落表面湿润,边缘整齐如图 1a。

|
| 图 1 菌株QD15-1的菌落图与显微观察 Figure 1 Colony of strain QD15-1 and microscopic observation |
在光学显微镜下菌体为球状,无芽孢,革兰氏染色为阴性(图 1b)。生理生化指标见表 2,伏-普试验、油脂水解试验和吲哚试验等结果为阳性,其余试验为阴性。
根据16S rDNA的测序结果和GenBank中已登录的核苷酸序列进行同源性比较,发现菌株QD15-1与Paracoccus sp. CY-b28(JX997853.1)等的同源相似度为100%,并采用MEGA 5.0软件构建菌株QD15-1的16S rDNA系统发育树(图 2),基于菌株的形态学特征、生理生化特征和16S rDNA基因序列分析,将菌株确定为Paracoccus sp. QD15-1。

|
| 图 2 基于QD15-1和相关菌株的16S rDNA序列采用邻接法建立的系统发育树 Figure 2 Established phylogenetic tree by neighbor-joining method, based on 16S rDNA sequences of QD15-1 and the related strains |
菌株Paracoccus sp. QD15-1的生长曲线及其对DMP的降解情况如图 3所示。随着菌株QD15-1吸光值(OD600)逐渐增高,培养基中的DMP含量下降。菌株QD15-1接种到培养基中12 h内菌液的吸光值增长很小,表明菌株QD15-1繁殖量少,此阶段为菌株的适应期,此时期内DMP降解速率小。12~48 h是菌株QD15-1的对数生长期,此时期菌株QD15-1生长迅速,菌液OD600增长迅速,培养基中DMP的浓度下降最为明显,且下降到最低值。48~60 h,菌株QD15-1生长进入到稳定期,此时期内菌液的吸光值达到最高,OD600为1.64,并保持稳定,表明培养基的菌体量已达到最大,此时培养基中DMP浓度略有上升。经过60 h的培养,培养基中DMP浓度从500 mg·L-1下降到50.16 mg·L-1,降解率为89.9%。

|
| 图 3 菌株QD15-1生长曲线及其对DMP的降解曲线 Figure 3 Growth curve of strain QD15-1 and the degradation curve of DMP |
培养3 d后通过吸光值大小判断菌株利用底物的能力,菌株QD15-1利用不同底物的情况如表 3所示。菌株QD15-1能利用DMP、DBP、DEP、DEHP、PA和葡萄糖为唯一碳源和能源在MSM培养基中生长,但其不能利用PCA和蔗糖进行生长。
不同pH对菌株QD15-1生长的影响如图 4所示。从图 4中可以看出,菌株QD15-1能够在pH 6~9范围内生长,在pH 5条件下,菌株QD15-1不能正常生长;在pH 7和pH 8条件下,菌株QD15-1进入对数生长期的时间要早于pH 9,且在pH 7和pH 8条件下,菌株QD15-1对数生长期的增长率十分接近,在pH 8的条件下菌液OD600最大,因此,以DMP为唯一碳源,菌株QD15-1生长最适pH为8。

|
| 图 4 不同pH对菌株QD15-1生长的影响 Figure 4 The effect of different pH on strain QD15-1 growth |
从图 5中可以看出,菌株QD15-1能够在25~ 35 ℃这个范围内生长,培养12 h后菌株进入对数生长期,在25 ℃下菌株进入对数生长期的OD600最低,35 ℃条件下菌株生长速率先慢后快,30 ℃条件下菌株进入对数生长期的OD600最高,表明在30 ℃时菌株QD15-1的生长速度最快。因此,以DMP为唯一碳源,菌株QD15-1最适生长温度为30 ℃。

|
| 图 5 不同温度对菌株QD15-1生长的影响 Figure 5 The effect of different temperature on growth of strain QD15-1 |
如图 6所示,培养60 h后菌株QD15-1可降解大部分DMP,降解率随着初始DMP浓度的升高(100、200、300、400、500 mg·L-1)而增高,分别为80.0%、89.0%、89.6%、91.7%和97.0%。同时菌株QD15-1降解DMP符合一级动力学方程:
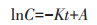 (1)
(1)

|
| 图 6 不同初始DMP浓度对菌株QD15-1降解能力的影响 Figure 6 The effect of different initial concentrations of DMP on degradation ability of strain QD15-1 |
式中:C为DMP随着时间增长的剩余浓度,t为培养时间,K为一级动力学常数,A表示常数。DMP生物降解的半衰期可以根据下面方程计算:
表 4显示降解菌QD15-1在不同初始DMP浓度(100~500 mg·L-1)下的降解动力学方程。DMP生物降解过程符合一级降解动力学方程(R2>0.9)。随着DMP浓度的增加,其半衰期相应地缩短,从2.17 d缩短到0.84 d。

|
从QD15-1的基因组中扩增出2个降解基因,测序结果显示,一个基因的长度为577 bp,此基因序列与Arthrobacter keyseri 12B中发现的邻苯二甲酸酯双加氧酶基因小亚基的同源相似度高达92%,该基因在Genbank的名称及登录号为:PAphtAb(MH040800)。另一个基因的基因长度为1008 bp,此基因序列与Arthrobacter keyseri 12B中发现的3,4-二羟基-3,4二氢邻苯二甲酸脱氢酶的同源相似度为88%,该基因在Genbank的名称及登录号为:PAphtB(MH040801)。
2.8 中间代谢产物的确认及代谢途径的推测从图 7a中可看出,DMP的峰值在色谱图中保留的时间为3.50 min,在光谱上其离子特征峰为163。图 7b中显示PA的峰值在色谱图中保留的时间为0.81 min,在光谱上其离子特征峰为149。图 7c显示PCA的峰值在色谱图上保留的时间为1.26 min,其在光谱上离子特征峰为109和153。从图 8中可以看出,接入降解菌QD15-1培养3 d后,在色谱图中有1个峰明显升高,保留时间为1.62 min,其离子特征峰为149和163,由此可知,DMP可能生成了邻苯二甲酸单酯;而未接入降解菌株QD15-1的在1.62 min处也有一个微小的峰,表明DMP可在常温条件下水解形成邻苯二甲酸单酯,但降解速度很慢。同时,在图 8b中还出现了2个新的峰,保留时间分别为0.63 min和5.0 min,其中保留时间为0.63 min,峰的光谱特征很乱,暂时不能确定其是什么物质,而保留时间为5.0 min,峰的光谱特征峰为149,与PA的特征峰吻合,说明培养基中有PA生成。因此,联系之前降解基因扩增的结果,可推测DMP在降解菌的作用下首先水解生成邻苯二甲酸单酯,然后再转化成PA,在邻苯二甲酸双加氧酶基因(PAphtAb)和3,4-二羟基-3,4-二氢邻苯二甲酸脱氢酶基因(PAphtB)的作用下进一步降解。

|
| 图 7 标准物DMP(a)、PA(b)和PCA(c)的色谱图和光谱图 Figure 7 Standard DMP(a), PA(b)and PCA(c)chromatograms and spectra |

|
| 图 8 未接入降解菌 QD15-1(a)和接入降解菌 QD15-1(b)培养 3 d后的色谱图 Figure 8 The chromatograms of 3 days non-inoculation strain(a)and after inoculation degrading strain QD15-1(b) |
本研究成功分离了一株能利用DMP作为唯一碳源生长的菌株,经鉴定为Paracoccus sp. QD15-1,好氧,革兰氏阴性。近年来,关于Paracoccus sp.降解污染物的研究报道很多,如噬氨副球菌HPD-2能够明显提高土壤中多环芳烃的降解率[13]。张永乐等[14]分离了一株用于溴苯腈降解的副球菌MXX-04,能够以溴苯腈为唯一氮源进行生长,降解率为95.3%。本研究中菌株Paracoccus sp. QD15-1能将培养基中浓度为500 mg·kg-1的DMP降解到50.16 mg·kg-1,降解率为89.9%。底物广谱性利用实验表明,该菌株能利用DMP、DBP、DEP和DEHP等,与陈湖星等[15]研究结果类似,其筛选出的不动杆菌HS-B1能分别以BBP、DMP、DEP、DBP、DEHP等PAEs类化合物为唯一碳源在MSM培养基中生长。Zhang等[16]从河底泥中筛选出能以PAEs为唯一碳源生长的菌株Sphingomonas sp. XJ1。金雷等[17]在长期受垃圾污染的土壤中筛选到一株DBP降解菌,该菌株在含有初始浓度为100 mg·L-1的DBP培养基中生长5 d可降解大部分DBP,降解率可达到82.7%。Wu等[18]分离鉴定的DBP降解菌可降解DBP最大为浓度400 mg·L-1,在48 h内降解率达96%,但没有报道该菌株降解其他PAEs的能力。本研究筛选的菌株Paracoccus sp. QD15-1是一株高效降解DMP的菌株,随着初始DMP浓度(100、200、300、400、500 mg·L-1)的升高,降解率升高,降解率分别为80.0%、89.0%、89.6%、91.7%和97.0%,可能原因是随着碳源的增多,菌株生长繁殖较快,导致降解率提高。
菌株Paracoccus sp. QD15-1生长的pH范围是6~ 9,温度范围是25~35 ℃,最适宜生长条件为初始pH 8.0,温度30 ℃。该菌株与已发现的PAEs降解菌Paenibacillus sp. S-3[19]相比,能更好地适应碱性环境,在修复碱性环境中DMP污染时具有优势。同时,本研究发现随着DMP的降解,摇瓶内pH会发生变化,培养3 d后,初始pH值为5到9的摇瓶内pH会降低,可能原因是底物DMP在菌株的作用下被快速降解生成邻苯二甲酸,之后邻苯二甲酸的生成量不再增加,pH也随之稳定。而初始pH为5的摇瓶pH有所下降,但变化不大,可能与菌株不能在酸性条件下生长,邻苯二甲酸生成量小有关。李魁晓等[20]研究DMP生物降解的过程中也发现了类似的现象。
菌株Paracoccus sp. QD15-1降解DMP符合一级降解动力学方程,Chen等[11]分离鉴定的DBP降解菌Camelimonas sp. M11同样符合一级降解动力学方程。Zhao等[21]研究发现DBP降解菌Providencia sp. 2D降解DBP的过程也符合一级动力学方程,不同的是该菌株降解DBP的半衰期随着初始DBP浓度的升高而增长,初始浓度从50 mg·kg-1到1000 mg·kg-1,其半衰期从8.66 h增长到了26.16 h。本研究中菌株Paracoccus sp. QD15-1降解DMP半衰期的数值随着DMP浓度的增加而缩短,从2.17 d缩短到0.84 d,可能与初始DMP浓度的升高降解率升高有关,说明高浓度的DMP对菌株Paracoccus sp. QD15-1的降解无抑制作用。
据文献报道[22-24],目前研究比较成熟的有两种降解途径,分别是细菌(G+)降解途径和细菌(G-)降解途径,这两种途径的第一步降解大致相同,都是通过PAEs的自然水解或者在酯酶的作用下进行水解形成邻苯二甲酸,再经过双加氧酶等一系列的酶作用生成原儿茶酚,再经一些酶的作用将苯环打开,最后逐步降解,最终生成水和二氧化碳。这两种途径不同的是涉及到的降解基因不同,其中革兰氏阳性菌的降解基因是3,4双加氧酶基因(phtA)和3,4-二羟基-3,4-二氢邻苯二甲酸脱氢酶(phtB),而革兰氏阴性菌通过邻苯二甲酸4,5双加氧酶(ophA)和4,5-二羟基-4,5-二氢邻苯二甲酸脱氢酶(ophB)[25-26]。为了研究Paracoccus sp. QD 15-1降解DMP的途径,本研究从基因和中间代谢产物两方面对该菌株进行了研究。因菌株Paracoccus sp. QD 15-1为革兰氏阴性菌,实验首先选择革兰氏阴性菌降解途径中所参与的基因设计引物进行PCR,遗憾的是经过反复多次PCR都得不到目的基因条带,随后本实验又根据革兰氏阳性菌降解途径中所参与的基因设计了引物并进行PCR,有趣的是,PCR实验成功得到了2条和目的基因大小相同的条带,后经过纯化、测序分析和BLAST比对,显示这两个条带为实验想要得到目的基因——邻苯二甲酸酯双加氧酶基因小亚基(PAphtAb)和3,4-二羟基-3,4-二氢邻苯二甲酸脱氢酶(PAphtB),这两个基因与Arthrobacterkeyseri 12B[12]上的降解基因的同源性分别为92%和88%。为什么革兰氏阴性菌中会有革兰氏阳性菌的基因,经过分析,推断可能是基因片段和质粒在微生物之间发生了水平转移。水平转移是指某些基因如本实验的降解基因通过转化、转导、接合等途径在细菌和细菌之间、环境和细菌之间、病毒和细菌之间传播,最终使得更多细菌获得降解功能[27]。基因的水平转移和基因的传播突破了生物遗传的种属保守限制,基因可在同种属细菌之间转移,也可以在亲缘关系较远的细菌如革兰氏阴性菌和革兰氏阳性菌之间传播[28]。因此,本研究分离得到DMP降解菌Paracoccus sp. QD 15-1为革兰氏阴性,可能通过基因的水平转移得到了革兰氏阳性菌的基因片段并整合到了自己的基因组中,从而使自己获得了降解PAEs的能力。
利用高效液相质谱对降解菌Paracoccus sp. QD 15-1的中间代谢产物进行研究,结果表明,在培养3 d后摇瓶中出现了新物质,分别为邻苯二甲酸单酯和邻苯二甲酸,表明DMP在降解菌的作用下首先水解生成邻苯二甲酸单酯,然后再转化成邻苯二甲酸,这与Eaton[12]的研究发现PAEs在酯酶的作用下直接生成邻苯二甲酸的结果有所不同,推断可能是该菌株的基因组中没有能够让PAEs快速水解的酯酶,而且这与PCR的结果也相互对应。另外,本研究发现Paracoccus sp. QD 15-1的降解中间产物中没有原儿茶酸生成,这个结果恰好与降解基因的研究结果相一致,由于该菌株的降解基因中正好缺少了一个脱羧酶(phtC),所以导致PAEs只能降解到邻苯二甲酸而无法生成原儿茶酸。因此,推测该菌株可能还有其他降解途径,或者不能将PAEs完全降解为水和二氧化碳。
4 结论(1) 从长期覆盖塑料废弃物的垃圾场土壤中分离到一株以DMP为唯一碳源的菌株,经鉴定该菌株为副球菌属,命名为Paracoccus sp. QD15-1,革兰氏阴性,该菌株能降解多种PAEs。
(2) 以DMP为唯一碳源,菌株Paracoccus sp. QD15- 1生长的最适条件为pH 8,温度30 ℃;该菌株是一株高效降解DMP的菌株,降解DMP过程符合一级动力学方程,随着DMP初始浓度的增加,半衰期缩短。
(3) 该菌株中含有2个降解PAEs的基因PAphtAb和PAphtB,推测其降解途径为:DMP降解为邻苯二甲酸单酯,其再分解为邻苯二甲酸,通过PAphtAb和PAphtB的作用进一步降解。
| [1] |
陈波, 倪静. 土壤中的邻苯二甲酸酯及其生态毒理学效应[J]. 广东农业科学, 2011, 38(2): 155-157. CHEN Bo, NI Jing. Phthalates in soil and toxicological effects of phthalic acid esters[J]. Guangdong Agricultural Sciences, 2011, 38(2): 155-157. |
| [2] |
Latini G. Monitoring phthalate exposure in humans[J]. Clinica Chimica Acta, 2005, 361: 20-29. DOI:10.1016/j.cccn.2005.05.003 |
| [3] |
Abdul-Ghani S, Yanai J, Abdul-Ghani R, et al. The teratogenicity and behavioral teratogenicity of di(2-ethylhexyl)phthalate(DEHP)and di-butyl Phthalate(DBP)in a chick model[J]. Neurotoxicology and Teratology, 2012, 34(1): 56-62. DOI:10.1016/j.ntt.2011.10.001 |
| [4] |
聂湘平, 吴志辉, 李凯彬, 等. 不同暴露方式下酞酸酯在黄斑篮子鱼体中的富集[J]. 中国环境科学, 2007, 27(4): 467-471. NIE Xiang-ping, WU Zhi-hui, LI Kai-bin, et al. Effects of different exposure ways upon the bioaccumulation of phathalate esters in Siganusoramin[J]. China Environmental Science, 2007, 27(4): 467-471. |
| [5] |
Dickson S M, Siegrist M, Keller C, et al. Phthalate exposure through food and consumers'risk perception of chemicals in food[J]. Risk Anal, 2009, 29(8): 1170-1181. DOI:10.1111/risk.2009.29.issue-8 |
| [6] |
Jin D, Bai Z, Chang D, et al. Biodegradation of di-n-butyl phthalate by an isolated Gordonia sp. strain QH-11:Genetic identification and degradation kinetic[J]. Journal of Hazardous Materials, 2012, 221: 80-85. |
| [7] |
Jin D, Kong X, Cui B, et al. Biodegradation of di-n-butyl phthalate by a newly isolated halotolerant Sphingobium sp[J]. International Journal of Molecular Sciences, 2013, 14(12): 24046-24054. DOI:10.3390/ijms141224046 |
| [8] |
王志刚, 胡影, 徐伟慧, 等. 邻苯二甲酸二甲酯污染对黑土土壤呼吸和土壤酶活性的影响[J]. 农业环境科学学报, 2015, 34(7): 1311-1316. WANG Zhi-gang, HU Ying, XU Wei-hui, et al. Impacts of dimethyl phthalate contamination on respiratory rates and enzyme activities in black soil[J]. Journal of Agro-Environment Science, 2015, 34(7): 1311-1316. DOI:10.11654/jaes.2015.07.012 |
| [9] |
王志刚, 胡云龙, 徐伟慧, 等. 邻苯二甲酸二甲酯污染对黑土微生物丰度和多样性的影响[J]. 生态与农村环境学报, 2015, 31(5): 779-783. WANG Zhi-gang, HU Yun-long, XU Wei-hui, et al. Impacts of dimethyl phthalate contamination on abundance and diversity of microbes in black soil[J]. Journal of Ecology and Rural Environment, 2015, 31(5): 779-783. DOI:10.11934/j.issn.1673-4831.2015.05.026 |
| [10] |
孙卓, 杨利民. 人参病原菌拮抗细菌的分离筛选与鉴定[J]. 植物保护学报, 2015, 42(1): 79-86. SUN Zhuo, YANG Li-min. Screening and identification of antagonistic bacteria against Panax ginseng pathogeny fungus[J]. Journal of Plant Protection, 2015, 42(1): 79-86. |
| [11] |
Chen X, Zhang X L, Yang Y, et al. Biodegradation of an endocrinedisrupting chemical di-n-butyl phthalate by newly isolated Camelimonas sp. and enzymatic properties of its hydrolase[J]. Biodegradation, 2015, 26: 171-182. DOI:10.1007/s10532-015-9725-6 |
| [12] |
Eaton R W. Plasmid-encoded phthalate catabolic pathway in Arthrobacterkeyseri 12B[J]. Journal of Bacteriology, 2001, 183(12): 3689-3703. DOI:10.1128/JB.183.12.3689-3703.2001 |
| [13] |
刘增俊, 滕应, 骆永明, 等. 噬氨副球菌HPD-2固体发酵条件优化及其对PAHs污染土壤的修复效果[J]. 土壤, 2010, 42(3): 404-409. LIU Zeng-jun, TENG Ying, LUO Yong-ming, et al. Optimal conditions of solid state fermentation on Paracoccus aminovorans HPD-2 and its remediation potential in PAH-contaminated soil[J]. Soils, 2010, 42(3): 404-409. |
| [14] |
张永乐, 蔡双梅, 邱沪生, 等. 一种用于溴苯腈降解的副球菌属MXX-04及其应用[P]. CN103243056A, 2013. ZHANG Yong-le, CAI Shuang-mei, QIU Hu-sheng, et al. A deputy for bromoxynil degradation bacteria genera MXX-04 and its application[P]. CN103243056A, 2013. |
| [15] |
陈湖星, 杨雪, 张凯, 等. 1株高效BBP降解菌的分离与特性研究[J]. 环境科学, 2013, 34(7): 2882-2888. CHEN Hu-xing, YANG Xue, ZHANG Kai, et al. Isolation and characterization of a highly efficient BBP-degrading bacterium[J]. Environmental Science, 2013, 34(7): 2882-2888. |
| [16] |
Zhang X, Hu P L, Zhou H B. Study on degradation pathway of DBP by Sphingomonas sp. XJ1 under aerobic condition[J]. Progress in Modern Biomedicine, 2010(6): 1110-1113. |
| [17] |
金雷, 严忠雍, 施慧, 等. 邻苯二甲酸二丁酯DBP降解菌S-3的分离、鉴定及其代谢途径的初步研究[J]. 农业生物技术学报, 2014, 22(1): 101-108. JIN Lei, YAN Zhong-yong, SHI Hui, et al. Identification of a dibutyl phthalate(DBP) -degrading strain S-3 and preliminary studies on the metabolic pathway[J]. Journal of Agricultural Biotechnology, 2014, 22(1): 101-108. |
| [18] |
Wu X, Wang Y, Liang R, et al. Biodegradation of an endocrine-disrupting chemical di-n-butyl phthalate by newly isolated Agrobacterium sp. and the biochemical pathway[J]. Process Biochemistry, 2011, 46(5): 1090-1094. DOI:10.1016/j.procbio.2011.01.031 |
| [19] |
Jin L, Sun X, Zhang X, et al. Co-metabolic biodegradation of DBP by Paenibacillus sp. S-3 and H-2[J]. Current Microbiology, 2014, 68(6): 708-716. DOI:10.1007/s00284-014-0533-8 |
| [20] |
李魁晓, 顾继东. 邻苯二甲酸二甲酯的好氧生物降解及生化途径[J]. 环境科学与技术, 2006, 29(2): 36-37. LI Kui-xiao, GU Ji-dong. Aerobic degradation of dimethyl phthalate ester by a mangrove microorganism[J]. Environmental Science and Technology, 2006, 29(2): 36-37. |
| [21] |
Zhao H M, Du H, Feng N X, et al. Biodegradation of di-n-butyl phthalate and phthalic acid by a novel Providencia sp. 2D and its stimulation in a compost-amended soil[J]. Biology and Fertility of Soils, 2016, 52(1): 1-12. DOI:10.1007/s00374-015-1047-7 |
| [22] |
Stingley R L, Brezna B, Khan A A, et al. Novel organization of genes in a phthalate degradation operon of Mycobacterium vanbaalenii PYR-1[J]. Microbiology, 2004, 150: 3749-3761. DOI:10.1099/mic.0.27263-0 |
| [23] |
骆祝华, 黄翔玲, 叶德赞. 环境内分泌干扰物——邻苯二甲酸酯的生物降解研究进展[J]. 应用与环境生物学报, 2008(6): 890-897. LUO Zhu -hua, HUANG Xiang-ling, YE De-zan. Advances in research of biodegradation of environmental endocrinedisruptors-phthalate esters[J]. Chinese Journal Applied Environment Biology, 2008(6): 890-897. |
| [24] |
温志丹, 高大文, 李喆, 等. 邻苯二甲酸酯降解菌的分离鉴定及降解特性[J]. 哈尔滨工业大学学报, 2013(12): 38-42. WEN Zhi-dan, GAO Da-wen, LI Zhe, et al. Isolation and identification of phthalate-degrading bacteria and their characteristics[J]. Journal of Harbin Institute of Technology, 2013(12): 38-42. DOI:10.11918/j.issn.0367-6234.2013.12.007 |
| [25] |
Chang H K, Zylstra G L. Novel organization of the genes for phthalate degradation from Burkholderia cepacia DBO1[J]. Journal of Bacteriology, 1998, 6529-6537. |
| [26] |
Li D D, Yan J L, Wang L, et al. Characterization of the phthalate acid catabolic gene cluster in phthalate acid esters transforming bacterium-Gordonia sp. strain HS-NH1[J]. International Biodeterioration & Biodegradation, 2016, 106: 34-40. |
| [27] |
Ochman H, Jeffrey G L, Eduardo A G. Lateral gene transfer and the nature of bacterial innovation[J]. Nature, 2000, 405(6784): 299-304. DOI:10.1038/35012500 |
| [28] |
刘苗苗, 杨敏, 张昱, 等. 环境中抗药基因水平转移研究进展[J]. 生态毒理学报, 2015, 10(5): 11-19. LIU Miao-miao, YANG Min, ZHANG Yu, et al. Horizontal transfer of antibiotic resistance genes in environment:A review[J]. Asian Journal of Ecotoxicology, 2015, 10(5): 11-19. |
 2018, Vol. 37
2018, Vol. 37