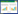文章信息
- 田甲, 王莉, 陈晓明, 张祥辉, 戚鑫, 肖诗琦, 敬路淮, 晏婷婷, 罗学刚
- TIAN Jia, WANG Li, CHEN Xiao-ming, ZHANG Xiang-hui, QI Xin, XIAO Shi-qi, JING Lu-huai, YAN Ting-ting, LUO Xue-gang
- 利用白腐菌与改性活性炭处置铀富集黑麦草残渣
- Phanerochaete chrysosporium and modified activated carbon for dealing with heavy uranium-enriched Lolium perenne residue
- 农业环境科学学报, 2018, 37(8): 1775-1784
- Journal of Agro-Environment Science, 2018, 37(8): 1775-1784
- http://dx.doi.org/10.11654/jaes.2018-0270
文章历史
- 收稿日期: 2018-03-01
- 录用日期: 2018-05-30
2. 西南科技大学核废物与环境安全国防重点实验室, 四川 绵阳 621010;
3. 土壤环境污染治理与修复四川省重点实验室, 成都 610045
2. State Defense Key Laboratory of the Nuclear Waste and Enviromental Security, Southwest University of Science and Technology, Mianyang 621010, China;
3. Sichuan Key Laboratory of Soil Environmental Pollution Control and Remediation, Chengdu 610045, China
近年来,随着铀等重金属向环境的不断转移,生态环境遭到了严重的破坏。在当今生态环境修复技术当中,植物修复技术以环境友好、价格低廉和操作简易等优势,成为环境生态修复中最重要的研究方向之一,引起了人们广泛关注。在运用植物修复技术处理环境污染后,会产生大量的重金属富集生物质,而现如今对重金属富集生物质的处置技术相对匮乏[1-2]。对重金属富集生物质的处置是回收重金属的绿色循环的重要一环,但要避免对其处置不当而再次造成生态环境污染。对重金属富集生物质的预处理一直是一个非常难以解决的问题,而对生物质的预处理方法一般可以分为生物法、物理法和化学法,相对于物理化学方法,生物法具有环境友好、成本低廉和条件温和等优势。
经王莉等[3]研究,利用氧化亚铁硫杆菌对铀富集生物质黑麦草进行降解,发现氧化亚铁硫杆菌对黑麦草有较强的腐蚀作用,在菌种接种量10%、投加14 g· L-1 S0处理10 d后,其对黑麦草的降解效果较好,纤维素、半纤维素及木质素的降解率分别达到81.31%、82.29%和26.02%,失重率达29.74%,铀浸出率达80.10%。因为氧化亚铁硫杆菌对生物质中的木质素降解率仅有26.02%,因此需要利用另外一种微生物对其腐蚀残渣进行进一步处理。白腐菌是一种腐生在树木或木材上的丝状真菌,能让木材腐烂;白腐菌能产生漆酶、木质素过氧化物酶等特殊酶系降解生物质,在了解其降解木质素机理的基础上,各国学者广泛开展了在利用白腐菌降解农作物秸秆中的木质素、提高秸杆综合利用率等方面的研究,并取得了一定成果。早在1996年,Xu[4]在将稻秆转化为饲料的过程中,筛选出了几十种能够显著改善稻草秸秆适口性的白腐菌。Albino等[5]曾探究不同白腐菌对麦稻秸秆的微生物预处理过程,结果表明白腐菌能降解秸秆中大量的木质素。
试验过程中会产生含有一定浓度铀的降解废液,如果这些废液不经过处理直接排入自然环境,将会造成二次污染,对人体健康、人类的生存和发展产生严重威胁[6]。目前,针对水体中铀的处置方法主要包括化学沉淀、溶剂萃取、离子交换、离子浮选、膜分离和生物吸附等。相比于其他方法,吸附法因具有操作简便、工艺成熟、运行稳定并且适用范围广等多种优点[7]而成为了铀处置方法中的重要研究方向之一。作为吸附材料的活性炭的研究在当前最为广泛,本试验中所使用的是经改良的活性炭,其比普通活性炭更具有优势。因此形成一条成本更低、能耗更少的微生物预处理工艺。
1 材料与方法 1.1 材料 1.1.1 菌种实验所使用微生物包括:白腐菌(Phanerodontia chrysosporium,CGMCC5.776),购于中国普通微生物菌种保藏管理中心;氧化亚铁硫杆菌(Thiobacillus ferro-oxidans,ATCC53990),购于中国微生物菌种中心。
1.1.2 黑麦草残渣选取在西南科技大学国防重点实验室生长52 d的黑麦草(Lolium perenne),截取地上部分,以在氧化亚铁硫杆菌接种量10%、投加14 g·L-1 S0处理10 d后的剩余残渣为原材料[3]。
1.1.3 降解废液试验所用降解废液来自两部分,一部分是利用氧化亚铁硫杆菌在最优腐蚀条件下(10%菌+14 g·L-1 S0)所产生的废液(之前研究),另一部分来自白腐菌最优工艺条件下液体发酵过程产生的废液总合。
1.1.4 培养基9K培养基配置方法:A液为(NH4)2SO4 3.0 g,K2HPO4 0.5 g,KCl 0.1 g,MgSO4·7H2O 0.5 g,Ca(NO3)2 0.01 g,去离子水800 mL,pH 2.0,121 ℃高压灭菌30 min。B液为FeSO4·7H2O 44.78 g,去离子水200 mL,pH 2.0,再经微孔滤膜(0.22 μL孔径)进行过滤除菌。在超净工作台上将A、B液混合。
LM2合成培养液:酒石酸1.0 mL,微量元素液15.0 mL,大量元素液15.0 mL,VB1 13.0 mL,加水定容至50.0 mL。其中,酒石酸铵浓度为22.0 g·L-1;大量元素液成分为20 g·L-1 KH2PO4、13.8 g·L-1 MgSO4·7H2O、1.0 g·L-1 CaCl2和0.6 g·L-1 NaCl;微量元素液成分为0.35 g·L-1 MnSO4·H2O、60 mg·L-1 FeSO4·7H2O、110 mg·L-1 CoCl2·6H2O、60 mg·L-1 ZnSO4·7H2O、95 mg·L-1 CuSO4 · 5H2O、6 mg · L-1 AlK(SO4)2 · 12H2O、6 mg · L-1 H3BO3、6 mg·L-1 Na2MoO4·2H2O和100 mg·L-1 VB1。
1.2 实验方案设计 1.2.1 LM2与黑麦草残渣固液比对白腐菌腐蚀作用的影响称取经氧化亚铁硫杆菌腐蚀后的黑麦草残渣5 g于250 mL锥形瓶中,再分别按照固液比1:7、1:9、1: 11、1:13加入已灭菌的合成培养液LM2,构成液体培养基,每瓶再按10%(V/W)的接种量接入菌种白腐菌于25 ℃下分别静置培养10、20、30、40、50 d。相同固液比未接种者在同样条件下培养,记作CK1、CK2、CK3、CK4,作为对照组。每个处理组重复3次。
1.2.2 改性活性炭对降解废液的吸附作用初始活性炭(HG/T 3491—1999),购自重庆茂业化学试剂有限公司,颗粒平均直径为1.50 mm。
活性炭改性:第一步活性炭的预处理,先用2%的硝酸清洗活性炭2次,去除其表面附着的无机杂质。再用去离子水反复清洗几次,滤去其上部溶液和浮渣,直至上清液澄清透明,且pH值与去离子水pH值相同。洗净后的活性炭放入鼓风干燥箱中,110 ℃烘24 h,取出后将其置于密闭的棕色瓶中干燥保存。第二步活性炭的改性,称取经预处理的活性炭50 g,加入100 mL体积浓度为30%的HNO3溶液,75 ℃水浴下回流2 h。待样品冷却至室温后,过滤,弃去滤液,滤渣用去离子水反复清洗,直至pH值稳定在7.0左右,110 ℃条件下干燥24 h,置于棕色瓶中干燥保存。
分别准确称取0.48、0.96、1.44、1.92、2.40、2.88、3.36 g改性活性炭,再加入15 mL U(Ⅵ)废液,探究其在不同pH值(1、2、3、4、5、6、7、8、9)、温度(20、25、30、35 ℃)、时间(0.5、1、2、3、4、5、6、7、8、9、11、13、15、17 h)条件下铀的吸附率和吸附量的变化,并建立改性活性炭吸附过程中的吸附动力学模型。以未改性活性炭为对照组。
1.3 分析方法 1.3.1 木质素、纤维素和半纤维素含量分析木质素降解率=(样品初始木质素含量×样品质量-处理后样品木质素含量×处理后样品质量)(/样品初始木质素含量×样品质量)×100%
其中涉及的质量均为干质量下称量,下同。纤维素、半纤维素降解率的计算公式与木质素的降解率公式相同,替换上述木质素即可以得到纤维素、半纤维素降解率。
1.3.2 铀浸出率和失重率分析铀浸出率=(样品初始质量×样品成分初始含量-处理后样品质量×样品处理后含量)(/样品初始质量×样品成分初始含量)×100%。
失重率=(样品初始质量-处理后样品质量)/样品初始质量×100%。
1.3.3 活性炭吸附指标计算吸附容量=(吸附前溶液中铀的浓度-吸附后t时刻时溶液中铀的浓度)×溶液体积/吸附剂质量
吸附率=(吸附前溶液中铀的浓度-吸附后t时刻时溶液中铀的浓度)/吸附前溶液中铀的浓度×100%
准一级力学模型表达式:lg(平衡吸附量- t时刻的吸附量)=lg(平衡吸附量)-一级吸附速率常数×时间t/2.303
准二级动力学模型表达式:时间t/t时刻吸附量= 1/(二级吸附速率常数×平衡吸附量的平方)+时间t/平衡吸附量
1.3.4 数据统计方法数据用Oringe 8.5和SPSS 22.0等软件进行统计分析处理,文章所出现的图表数据都是3次重复的平均值±标准差(SE),采用单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)比较不同数据的差异。
2 结果与讨论 2.1 白腐菌对黑麦草残渣的腐蚀利用ICP-MS(电感耦合等离子体质谱仪)检测黑麦草残渣铀含量,其成分(干质量)为:纤维素(9.99± 0.37)%,半纤维素(7.19 ± 0.31)%,木质素(23.11 ± 1.11)%,U(Ⅵ)(84.9±7.5)mg·kg-1。
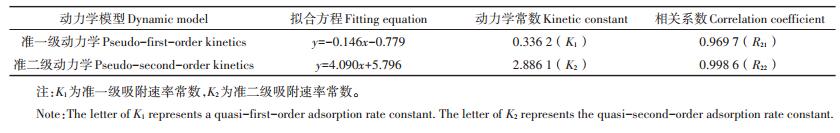
2.1.1 白腐菌强化纤维素降解考察黑麦草残渣与LM2培养基的不同固液比下,接种10%白腐菌对黑麦草残渣纤维素的降解作用,结果如图 1所示。反应前20 d,4个处理组中纤维素降解较慢,之后开始快速降解,50 d后,4个处理组中纤维素降解率由大到小依次为1:11>1:9>1:13>1:7,其中纤维素降解率最大达37.78%,白腐菌对纤维素的降解先慢后快。王宏勋等[8]在研究白腐菌选择性降解秸秆木质纤维素研究中,其纤维素的降解也表现出该变化趋势。对照组中纤维素的降解可能是由于第一步降解残渣的弱酸性而致使白腐菌溶液pH值变化所引起。经王莉等[3]研究,氧化亚铁硫杆菌经最优条件下处理黑麦草10 d,纤维素降解率达81.31%,第二步利用白腐菌固液比1:11继续处理黑麦草腐蚀残渣50 d,纤维素降解率达37.78%,总纤维素降解率高达88.37%。Bari等[9]和Liers等[10]利用白腐菌(P.ostreatus,X.hypoxylon)单独预处理技术分别处理海滩木120 d和72 d后,仅能降解其中19.94%和23%的纤维素,远低于本试验结果。氧化亚铁硫杆菌联合白腐菌两步微生物预处理技术,相比于真菌单独预处理技术可以有效提高纤维素的降解效率,缩短反应周期。
|
| 图 1 白腐菌对纤维素的降解作用 Figure 1 Phanerodontia chrysosporium on cellulose degradation of Lolium perenne |
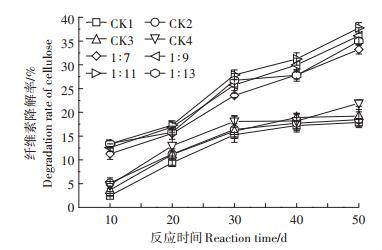
从图 2中可以看出,利用白腐菌进一步处理黑麦草腐蚀残渣,4个处理组中半纤维素都有明显降解,而白腐菌能产生木聚糖酶降解半纤维素[11]。反应前20 d,半纤维素降解速率较快,20 d后,降解速率趋于稳定。1:7、1:9、1:11、1:13这4个处理组中半纤维素降解率由第10 d的27.30%、29.27%、31.24%、28.40%增大至第50 d的41.21%、39.92%、42.87%、41.94%。而CK1、CK2、CK3、CK4 4个对照组中半纤维素降解率由第10 d的24.56%、23.33%、24.12%、26.32%增大至第50 d的33.11%、32.42%、34.23%、33.68%。反应第10 d,各处理组与对照组之间差异不显著(P < 0.05),10 d后,白腐菌对半纤维素降解作用与对照组之间拉开较大差距。50 d后,固液比1:11处理组中半纤维素降解率可达42.87%,经过两种微生物预处理后,黑麦草中总半纤维素降解率高达89.89%。然而,Song等[12]和Kaffenberger等[13]通过真菌单独预处理技术,仅能降解木材中62.38%和20.27%的半纤维素,因此本实验结果能更有效提高半纤维的降解。
|
| 图 2 白腐菌对半纤维素的降解作用 Figure 2 Phanerodontia chrysosporium on hemicellulose degradation of Lolium perenne |
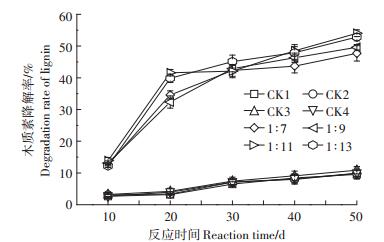
从图 3中可以看出,1:7、1:9、1:11、1:13这4个处理组中木质素降解率由10 d的12.68%、13.14%、13.90%、12.21%增大至50 d的47.72%、49.63%、54.05%、52.82%。4个处理样品的降解率又呈1: 11>1: 13>1:9>1:7的顺序,说明在一定范围内,随着固液比的增加,木质素的降解率也增加。白腐菌对木质素的降解呈现先快后慢的规律,反应前20 d,木质素降解率增加较快,1:11处理组中木质素降解率由第10 d的13.90%迅猛上升到41.59%,提高了1.99倍。20 d后,降解率增加缓慢,第50 d,木质素降解率最高达54.05%,相比对照组提高了3.97倍。在4个不同固液比条件下,白腐菌对木质素的降解均高于半纤维素和纤维素,而氧化亚铁硫杆菌对纤维素、半纤维素的降解均明显高于木质素。说明真菌对木质素的降解效果较好,而细菌能对纤维素、半纤维素快速降解,白腐菌不仅对普通生物质中木质素降解效果显著[14-15],对铀富集黑麦草中木质素降解也表现出较好效果。白腐菌降解木质素可分为细胞内和细胞外2个过程。在白腐菌细胞内能自身合成降解木质素等有机物的酶类[16]。在C、N、S等主要营养物质的限制下,白腐菌将启动整个降解系统,产生细胞内的葡萄糖氧化酶和细胞外的乙二醛氧化酶[17]。它们利用分子氧氧化相应底物从而激活过氧化物酶,启动酶催化循环。白腐菌合成的细胞外酶主要包括木素过氧化物酶、锰过氧化物酶和漆酶等。白腐菌降解木质素的过程,首先是利用木质素降解酶自身形成的过氧化氢,启动一系列自由基链反应。然后,通过高活性酶中间体,将木质素等有机物氧化成羟基等氧化能力很强的多种自由基,实现对木质素的生物降解[18]。经过两步微生物预处理黑麦草60 d后,其总木质素降解率高达66.01%。Nazarpour等[19]采用白腐菌单独一步预处理橡胶木63 d,其木质素降解率仅为37%。两步微生物预处理中木质素降解率高于一般的白腐菌单独预处理的结果。2.1.4白腐菌降解过程中黑麦草残渣的失重率和铀浸出率
|
| 图 3 白腐菌对木质素的降解作用 Figure 3 Phanerodontia chrysosporium on lignin degradation of Lolium perenne |
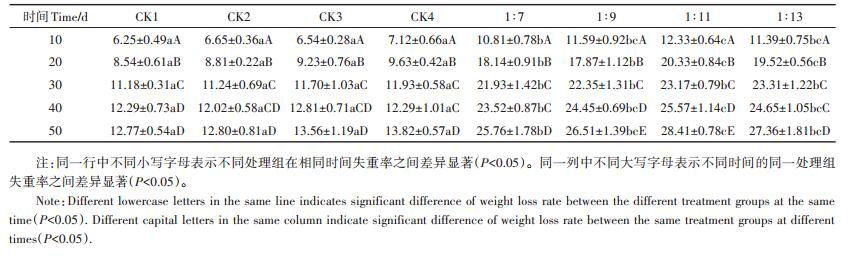
从表 1中可以看出,经过50 d的培养,4个处理组中黑麦草残渣失重率分别由第10 d的10.81%、11.59%、12.33%、11.39%增至第50 d的25.76%、26.51%、28.41%、27.36%。4个处理组中黑麦草残渣失重率大小为1:11>1:9>1:13>1:7,降解过程的前30 d,黑麦草残渣重量变化明显,1:11处理组中黑麦草残渣失重率从第10 d的12.33%增至第20 d的20.33%,提高了0.65倍。第20 d到第30 d提高了0.14倍。降解30 d后,失重率变化开始减小,每10 d失重率仅提高0.10倍左右。而对照组中经过50 d的反应黑麦草残渣失重率仅有12%左右。白腐菌降解过程的前30 d是快速降解阶段,这对将来利用白腐菌联合其他微生物实现生物质快速降解具有一定意义。通过白腐菌进一步降解50 d后,黑麦草总的失重率高达49.70%,该试验结果与Richter等[20]、Konuma等[21]的研究结果相符。黑麦草质量的减少对其后续处理和资源化利用具有重要意义。
|
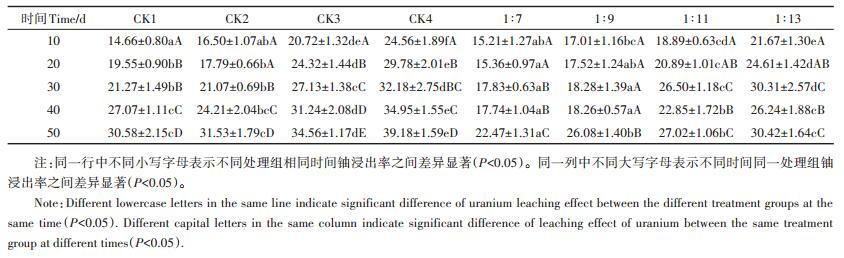
白腐菌液体发酵过程中,适当提高白腐菌固液比有利于铀的浸出(P < 0.05),他各处理组中铀浸出率大小依次为1:13>1:11>1:9>1:7(表 2),且除反应第10 d外各处理组试验结果均低于相应的对照组;如反应第50 d,1:11处理组中铀的浸出效率为27.02%,而其对照组CK3中铀的浸出效率为34.56%,同样地,1:7、1:9和1:13处理组也表现出相同规律。产生该试验结果的原因是,尽管白腐菌能够通过分泌木质素降解酶(过氧化物酶、锰过氧化物酶、漆酶等)对黑麦草中木质纤维素成分进行降解,从而使铀游离浸出,但由于白腐菌细胞内含有氮、磷、氧和硫等电负性大的羧基、磷酰基、羟基、酰胺基等基团,它们能够通过络合作用或螯合作用与重金属离子形成可溶性络合物或螯合物,从而吸附浸出到溶液中的铀[22-23]。因此,本试验中铀的最终浸出效率受白腐菌降解和吸附作用的综合影响。各处理组中铀的浸出效率随着时间的推移,先增大,后减小,再增大,呈动态变化,其中1: 11处理组中铀的最大浸出效率达27.02%,经过两步微生物预处理,黑麦草固体中总铀浸出率达85.48%,而第一步氧化亚铁硫杆菌在最优腐蚀条件下对铀的浸出效率达80.10%,经过白腐菌进一步处理后,其虽然能有效提高木质素的降解效率,但其对铀的游离浸出贡献较小。同样地,Hanif等[24]和Lebrun等[25]利用白腐菌在生物质堆肥和重金属废水处理方面的应用也取得较好成果。通过微生物预处理能有效减少黑麦草中铀的含量,这对其进一步的无害处理和重金属回收工艺的研究具有重要意义。
|
随着改性活性炭(30%N-GAC)和未改性活性炭(GAC)投加量的增加,溶液中U(Ⅵ)的去除率也逐渐增加,而吸附容量却逐渐减小(图 4)。当改性活性炭投加量为0.72 g时,U(Ⅵ)的吸附率达到了93.62%,吸附容量达到0.22 mg·g-1,而此时未改性活性炭吸附率和吸附容量仅为77.69%和0.18 mg·g-1。继续增加这两种吸附剂的投加量,吸附率不再明显提高,反而使吸附容量不断下降,这是因为当溶液中U(Ⅵ)浓度一定时,随着投加量的增加,改性活性炭上吸附位点的数量也会相应增加,从而提高其吸附能力,增大U(Ⅵ)的去除效率。由于溶液中U(Ⅵ)的数量是固定的,随着改性活性炭用量的增加,单位改性活性炭吸附U(Ⅵ)的量必然会减少,从而引起吸附容量的降低。因此,当改性活性炭投加量为0.72 g时,其吸附效果较理想,此时其平衡吸附容量明显高于未改性活性炭,此研究与于静等[26]研究结果一致。

|
| 30%N-GAC-R:改性活性炭吸附率;GAC-R:未改性活性炭吸附率;30%N-GAC-qt:改性活性炭吸附容量;GAC-qt:未改性活性炭吸附容量。下同 The phrase of 30%N-GAC-R indicates the adsorption rate of modified activated carbon. The phrase of GAC-R indicates the adsorption rate of unmodified activated carbon. The phrase of 30%N-GAC-qt indicates the adsorption capacity of modified activated carbon. The phrase of GAC-qt indicates the adsorption capacity of unmodified activated carbon. The same below 图 4 改性活性炭投加量对U(Ⅵ)的吸附 Figure 4 Dosage of modified activated carbon on adsorption of U (Ⅵ) |
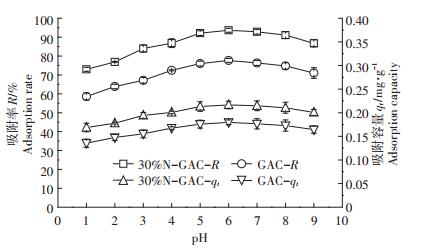
从图 5中可以看出,pH值会影响U(Ⅵ)的吸附。当pH值为2~6时,改性活性炭对U(Ⅵ)的吸附率和吸附容量随着pH值的增大而逐渐增大,当pH=6时,达到最大值。随着pH值的继续增大(7~9),U(Ⅵ)的吸附率和吸附量逐渐减少,其主要原因是溶液的pH值会对改性活性炭表面的活性位点以及溶液中铀酰离子的存在状态产生一定的影响。当溶液pH值较小时,高浓度的氢离子会与铀酰离子竞争吸附位点,氢离子将占据活性炭表面大部分的活性位点,电荷之间将产生静电斥力作用,受静电斥力的影响,铀酰离子很难接近活性位点,从而影响活性位点的结合,因此,降低了铀离子的去除率。当溶液pH值较大时,铀会形成UO2(OH)+、(UO2)3(OH)5+、(UO2)4(OH)7+等形式的多核铀酰羟基配合物以及铀酰羟基配合物,这些络合物的存在会使U(Ⅵ)的吸附受到抑制。
|
| 图 5 溶液pH值对改性活性炭吸附U(Ⅵ)的影响 Figure 5 Effect of pH value of solution on adsorption of U (Ⅵ)by modified activated carbon |
此试验结果未改性活性炭的吸附率仅为77%左右,与刘大前等[27]的研究结果相似。同时,试验条件下改性活性炭吸附容量明显大于未改性活性炭(P < 0.05),其主要原因一方面是经硝酸氧化后的活性炭,增加了其表面的酸性基团以及吸附活性位点,从而提高了其化学吸附能力;另一方面,活性炭经过改性后,能通过增加表面乱层程度加强活性炭表面的范德华力,从而提高其物理吸附能力。
2.2.3 温度对U(Ⅵ)吸附的影响当反应温度从20 ℃升高至25 ℃时,改性活性炭和未改性活性炭对溶液中U(Ⅵ)的吸附率和吸附量增加幅度均不大(图 6),改性活性炭中吸附率仅增加了0.60%。随着温度的继续升高,改性活性炭和未改性活性炭对U(Ⅵ)的吸附率和吸附容量均下降,因此,可以推测改性活性炭吸附U(Ⅵ)的反应是放热反应。同样地,于静等[26]的研究结果表明活性炭对U(Ⅵ)的吸附是自发放热熵增过程。
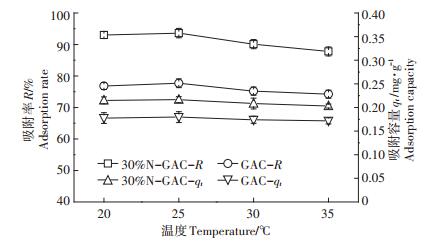
|
| 图 6 温度对改性活性炭吸附U(Ⅵ)的影响 Figure 6 Effect of temperature on adsorption of U(Ⅵ)by modified activated carbon |
由图 7可知,在反应初始阶段(0.5~6 h),改性活性炭和未改性活性炭对U(Ⅵ)吸附速率均较快,为快速吸附阶段,改性活性炭吸附率从30.53%快速增至85.84%,吸附量从0.07 mg·g-1快速增加到0.20 mg·g-1,而此时未改性活性炭中吸附率从24.51%仅增至68.11%,吸附量从0.06 mg·g-1增加到0.16 mg·g-1,其结果小于改性活性炭。反应9 h时,U(Ⅵ)的吸附率和吸附量均达到最大值,之后其吸附率和吸附量的变化趋于稳定。吸附平衡时,改性活性炭吸附率为93.62%,吸附容量为0.22 mg·g-1,而此时未改性活性炭吸附率仅为77.69%,吸附容量仅为0.18 mg·g-1,由此说明活性炭经过改性后,能显著提高U(Ⅵ)的吸附率,同时影响吸附容量。吸附反应初期,溶液中U(Ⅵ)浓度相对较大,因此,改性活性炭对U(Ⅵ)吸附速率较快。随着反应时间的推移,改性活性炭表面会吸附溶液中的大量杂质,阻碍反应的进行,反应速率逐渐变慢。该试验与喻清等[28]利用固定化黑曲霉活性炭吸附U(Ⅵ)的研究结果相似。
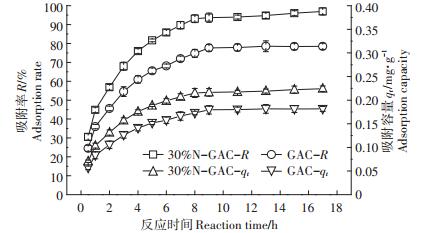
|
| 图 7 反应时间对改性活性炭吸附U(Ⅵ)的影响 Figure 7 Effect of reaction time on adsorption of U (Ⅵ)by modified activated carbon |
由图 8和表 3可知,改性活性炭吸附准一级动力学模型方程为:y=- 0.146x - 0.779,相关系数为0.969 7;准二级动力学模型方程为:y=4.090x+5.796,相关系数为0.998 6,准二级动力学模型对吸附铀过程的拟合系数高于准一级动力学模型。因此,在拟合改性活性炭吸附铀的过程中准二级动力学模型更具有优越性,说明改性活性炭对铀的吸附过程主要是化学吸附机理过程。
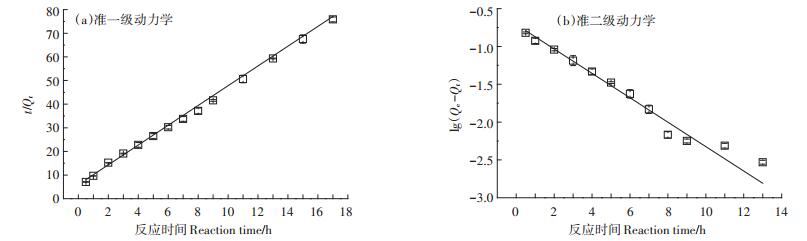
|
| Qt:t时刻的吸附量,mg·g-1;Qe:平衡吸附量,mg·g-1 Qt: Amount of adsorption at time t; Qe: Amount of equilibrium adsorption 图 8 改性活性炭吸附U(Ⅵ)的准一级和准二级动力学模型 Figure 8 Pseudo-first-order and pseudo-second-order kinetic models for adsorption of uranium by activated carbon |
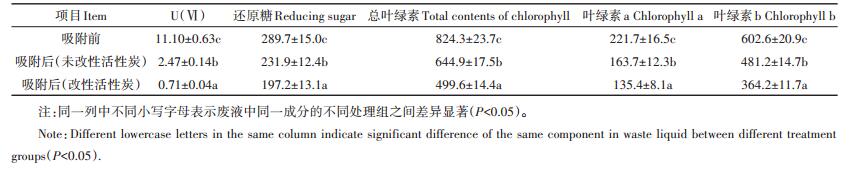
降解废液成分分析:ICP-MS测量U(Ⅵ),叶绿素a、b的测定采用分光光度法[29],还原性糖的测定采用DNS法[30]。其结果如下:U(Ⅵ)(11.10±0.63)mg·L-1,还原糖(289.7±15.0)mg·L-1,总叶绿素(824.3±23.7)mg·L-1,叶绿素a(221.7±16.5)mg·L-1,叶绿素b(602.6± 20.9)mg·L-1。
经过改性活性炭吸附后,废液颜色有较大变化。吸附前降解废液呈墨绿色,较为澄清透明(图 9a)。经过改性活性炭吸附后,其溶液颜色明显变浅,而未改性活性炭中溶液颜色与吸附前溶液颜色只有略微差异(图 9b),从图中可以看出改性活性炭对溶液物理状态的改变更加明显。吸附前降解废液中U(Ⅵ)的含量为11.10 mg·L-1,经过改性活性炭吸附后,其含量减少为0.71 mg·L-1,而经过未改性活性炭吸附后,溶液中U(Ⅵ)剩余含量为2.47 mg·L-1,比改性活性炭高出2.5倍,说明使用相同量的吸附剂改性活性炭对U(Ⅵ)的吸附效率更高(表 4)。其中还原糖含量由289.7 mg·L-1减少为197.2 mg·L-1,吸附率达31.95%,而未改性活性炭对还原糖的吸附率仅为19.94%。总叶绿素含量由起初的824.3 mg·L-1减少为499.6 mg·L-1,其中叶绿素b含量变化最大,由初始的602.6 mg· L-1减少为364.2 mg·L-1,吸附率达39.56%,而未改性活性炭对还原糖以及各色素的吸附效果均明显小于改性活性炭(P < 0.05)。

|
| 图 9 活性炭吸附前后废液情况 Figure 9 The picture of wastewater before and after adsorption by activated carbon |
|
(1)白腐菌对黑麦草残渣具有较强的腐蚀作用,在接种量10%条件下反应50 d,对纤维素、半纤维素和木质素都具有腐蚀作用,其中木质素的降解效果最好,其次是半纤维素,最后是纤维素。
(2)白腐菌进一步降解铀富集黑麦草50 d后,黑麦草失重率为28.41%,黑麦草总的失重率高达49.70%;铀浸出率为27.02%,总铀浸出率高达80.10%。这对其进一步的无害化处理和重金属回收工艺的研究具有重要意义。
(3)改性活性炭添加量为28.8 g·L-1时,单位改性活性炭吸附U(Ⅵ)的量最高,铀吸附率高达93.62%,吸附容量达到0.22 mg·g-1,均高于未改性活性炭。
(4)当溶液pH=6时,改性活性炭较未改性活性炭吸附U(Ⅵ)周期缩短,改性活性炭铀吸附率最高。而温度对活性炭的影响很小。
(5)本课题的试验方法相比一般的物理化学处理技术,能显著提高木质素的降解,而且经济效益更高,降解效率更好,条件要求更低,具有较高的应用价值。
| [1] |
Katayama H, Banba N, Sugimura Y, et al. Subcellular compartmentation of strontium and zinc in mulberry idioblasts in relation to phytoremediation potential[J]. Environmental and Experimental Botany, 2013, 85: 30-35. DOI:10.1016/j.envexpbot.2012.06.001 |
| [2] |
Sas-Nowosielska A, Kucharski R, Malkowski E, et al. Phytoextraction crop disposal:An unsolved problem[J]. Environmental Pollution, 2004, 128(3): 373-379. DOI:10.1016/j.envpol.2003.09.012 |
| [3] |
王莉, 陈晓明, 罗学刚, 等. 氧化亚铁硫杆菌(Thiobacillus ferrooxidans)对重金属富集植物腐蚀作用研究[J]. 农业环境科学学报, 2016, 35(12): 2420-2430. WANG Li, CHEN Xiao-ming, LUO Xue-gang, et al. The corrosive effects of Thiobacillus ferrooxidans on heavy metal-enriched plant[J]. Journal of Agro-Environment Science, 2016, 35(12): 2420-2430. DOI:10.11654/jaes.2016-0826 |
| [4] |
Xu F. Oxidation of phenols anilines and benzenethiols by fungal laccase:Correlation between activity and redox potentials as well as halide inhibition[J]. Biochemistry, 1996, 35(23): 7608-7614. DOI:10.1021/bi952971a |
| [5] |
Albino A D, Freitas G S, Marques G S, et al. Enzymatic saccharification of biologically pre-treated wheat straw with white-rot fungi[J]. Bioresource Technology, 2010, 101(15): 6045-6050. DOI:10.1016/j.biortech.2010.02.110 |
| [6] |
Vanhom J, Huang H. Uranium(Ⅵ)bio-coordination chemistry from biochemical, solution and protein structural data[J]. Coordination Chemistry Reviews, 2006, 250(7/8): 765-775. |
| [7] |
左天明, 左魏铭, 李金莲. 活性炭吸附法处理含铀放射性废水[J]. 四川地质学报, 2015, 35(3): 473-475. ZUO Tian-ming, ZUO Wei-ming, LI Jin-lian. Treatment of U-bearing wastewater by active carbon adsorption[J]. Acta Geologica Sichuan, 2015, 35(3): 473-475. |
| [8] |
王宏勋, 杜甫佑, 张晓昱. 白腐菌选择性降解秸秆木质纤维素研究[J]. 华中科技大学学报(自然科学版), 2006, 34(3): 97-100. WANG Hong-xun, DU Fu-you, ZHANG Xiao-yu. Selective degradation of corn straw lignocellulose by white-rot fungi[J]. Huazhong University of Science & Technology(Nature Science Edition), 2006, 34(3): 97-100. |
| [9] |
Bari E, Nazarnezhad N, Kazemi S M, et al. Comparison between degradation capabilities of the white rot fungi pleurotus ostreatus and trametes versicolor in beech wood[J]. International Biodeterioration & Biodegradation, 2015, 104: 231-237. |
| [10] |
Liers C, Arnstadt T, Ullrich R, et al. Patterns of lignin degradation and oxidative enzyme secretion by different wood-and litter-colonizing basidiomycetes and ascomycetes grown on beech-wood[J]. Fems Microbiology Ecology, 2011, 78(1): 91-102. DOI:10.1111/j.1574-6941.2011.01144.x |
| [11] |
张晓昱, 黄慧艳, 陈龙. 天然木质纤维素中白腐菌漆酶与半纤维素酶的分泌及相互影响[C]. 北京: 第六届菌物学学术讨论会, 2003. ZHANG Xiao-yu, HUANG Hui-yan, CHEN Long. Secretion and reciprocity of laccase and xylanase from white rot fungi in natural lignocellulose[C]. Beijing: 6th Mycology Academic Symposium, 2003. |
| [12] |
Song Z L, Gai H Y, Liu X F, et al. Comparison of seven chemical pretreatments of corn straw for improving methane yield by anaerobic digestion[J]. PloS One, 2014, 9(4): e93801. DOI:10.1371/journal.pone.0093801 |
| [13] |
Kaffenberger J T, Schilling J S. Comparing lignocellulose physiochemistry after decomposition by brown rot fungi with distinct evolutionary origins[J]. Environmental Microbiology, 2015, 17(12): 4885-4897. DOI:10.1111/1462-2920.12615 |
| [14] |
Chen C, Chen J K, Ni W, et al. Biodegradation of orange G by woodrot fungi Phanerochaete sordida TXJ-1302A and Tyromyces lauteus TXJ-1302B[J]. Bioresource Technology, 2008, 99(9): 3926-3929. DOI:10.1016/j.biortech.2007.07.022 |
| [15] |
Arora D S, Sharma R K. Ligninolytic fungal laccases and their biotechnological applications[J]. Appl Biochem Biotechnol, 2010, 160(6): 1760-1788. DOI:10.1007/s12010-009-8676-y |
| [16] |
唐菊, 段传人, 黄友莹, 等. 白腐菌木质素降解酶及其在木质素降解过程中的相互作用[J]. 生物技术通报, 2011(10): 32-36. TANG Ju, DUAN Chuan-ren, HUANG You-ying, et al. Characteristics of ligninolytic enzymes of white-rot fungus and their interactions in the process of lignin degradation[J]. Biotechnology Bulletin, 2011(10): 32-36. |
| [17] |
祝锦婷. 黄孢原毛平革菌抗营养阻遏产酶和降解木质素机制研究[D]. 福州: 福建农林大学, 2011. ZHU Jin-ting. Reserch on anti-nutritional-repression enzyme production and lignin-degradation mechanism of phanerochete chrysosporium[D]. Fuzhou: Fujian Agriculture and Forestry University, 2011. |
| [18] |
张旭初. 黄孢原毛平革菌木质素降解酶系的生产、纯化及在合成手性亚砜中的应用[D]. 杭州: 浙江工业大学, 2010. ZHANG Xu-chu. Production, purification and application of ligninolytic enzymes from phanerochaete chrysosporium[D]. Hangzhou: Zhejiang University of Technology, 2010. |
| [19] |
Nazarpour F, Abdullah D K, Abdullah N, et al. Evalution of biological pretreatment of rubber wood with white rot fungi for enzymatic hydrolysis[J]. Materials, 2013, 6(5): 2059-2073. DOI:10.3390/ma6052059 |
| [20] |
Richter D L, Glaeser J A. Wood decay by Chlorociboria aeruginascens (Nyl.)kanouse(helotiales, leotiaceae)and associated basidiomycete fungi[J]. International Biodeterioration & Biodegradation, 2015, 105: 239-244. |
| [21] |
Konuma R, Umezawa K, Mizukoshi A, et al. Analysis of microbial volatile organic compounds produced by wood-decay fungi[J]. Biotechnology Letters, 2015, 37(9): 1845-1852. DOI:10.1007/s10529-015-1870-9 |
| [22] |
Bashir H, Gangwar R, Mishra S. Differential production of lignocellulolytic enzymes by a white rot fungus Termitomyces sp. OE147 on cellulose and lactose[J]. Biochimica et Biophysica Acta-proteins and Proteomics, 2015, 1854(10): 1290-1299. DOI:10.1016/j.bbapap.2015.07.005 |
| [23] |
张婷婷, 吴京科, 祁娜, 等. 白腐菌在有机固体废弃物堆肥中的研究进展[J]. 吉林农业科学, 2011, 36(4): 37-40. ZHANG Ting-ting, WU Jing-ke, QI Na, et al. Application of whiterot fungi on organic solid waste composting[J]. Journal of Jilin Agricultural Sciences, 2011, 36(4): 37-40. |
| [24] |
Hanif M A, Bhatti H N. Remediation of heavy metals using easily cultivable, fast growing, and highly accumulating white rot fungi from hazardous aqueous streams[J]. Desalination and Water Treatment, 2015, 53(1): 238-248. DOI:10.1080/19443994.2013.848413 |
| [25] |
Lebrun J D, Demont-Caulet N, Cheviron N, et al. Oxidoreductases provide a more generic response to metallic stressors(Cu and Cd) than hydrolases in soil fungi:New ecotoxicological insights[J]. Environmental Science and Pollution Research, 2016, 23(4): 3036-3041. DOI:10.1007/s11356-015-5145-8 |
| [26] |
于静, 王建龙, 蒋翼周. 活性炭吸附放射性废水中U(Ⅵ)的特性研究[J]. 清华大学学报(自然科学版), 2016, 56(3): 312-317. YU Jing, WANG Jian-long, JIANG Yi-zhou. Adsorption of uranium (Ⅵ)by activated carbon from radioactive wastewater[J]. Journal of Tsinghua University, 2016, 56(3): 312-317. |
| [27] |
刘大前, 刘峙嵘, 王长福, 等. 活性炭负载纳米零价铁去除水溶液中U (Ⅵ)的研究[J]. 人工晶体学报, 2016, 45(5): 1328-1334. LIU Da-qian, LIU Zhi-rong, WANG Chang-fu, et al. Removal of uranium (Ⅵ)from aqueous solution using nanoscale zero-valent iron supported on activated charcoal[J]. Journal of Radioanalytical & Nuclear Chemistry, 2016, 45(5): 1328-1334. |
| [28] |
喻清, 丁德馨, 李登科, 等. 固定化黑曲霉活性炭吸附铀的机理[J]. 中国有色金属学报, 2016, 26(4): 936-945. YU Qing, DING De-xin, LI Deng-ke, et al. Adsorption mechanism of uranium of immobilizing Aspergillus niger activated carbon[J]. Transactions of Nonferrous Metals Society of China, 2016, 26(4): 936-945. |
| [29] |
金霞, 金志芳, 孙光举, 等. 分光光度法测定海水中叶绿素含量的研究[J]. 广州化工, 2010, 38(4): 132-133, 136. JIN Xia, JIN Zhi-fang, SUN Guang-ju, et al. Detection the content of chlorophyll in seawater by spectrophotometric method[J]. Guangzhou Chemical Industry, 2010, 38(4): 132-133, 136. |
| [30] |
王欢, 卢红梅, 张义明, 等. 固态发酵食醋中还原糖、总糖含量测定[J]. 中国酿造, 2011, 30(9): 172-175. WANG Huan, LU Hong-mei, ZHANG Yi-ming, et al. Determination of the contents of reducing sugar and total sugar in solid-state fermented vinegar[J]. China Brewing, 2011, 30(9): 172-175. |
 2018, Vol. 37
2018, Vol. 37