文章信息
- 周曼, 邓良伟, 杨红男, 刘刈, 蒲小东, 陈子爱, 李和平, 李扬眉
- ZHOU Man, DENG Liang-wei, YANG Hong-nan, LIU Yi, PU Xiao-dong, CHEN Zi-ai, LI He-ping, LI Yang-mei
- 鸡粪中温干式沼气发酵启动阶段温度变化对产气性能的影响
- Effect of temperature changes on the performance of gas production at the start-up stage of chicken manure mesophilic temperature dry biogas fermentation
- 农业环境科学学报, 2018, 37(8): 1785-1792
- Journal of Agro-Environment Science, 2018, 37(8): 1785-1792
- http://dx.doi.org/10.11654/jaes.2018-0415
文章历史
- 收稿日期: 2018-03-30
- 录用日期: 2018-06-07
2. 四川农业大学水利水电学院, 四川 雅安 625014
2. College of Water Resource and Hydropower, Sichuan Agricultural University, Ya'an 625014, China
沼气发酵技术是处理畜禽粪污的重要手段,在消纳有机废弃物、保护环境的同时,能生产可再生能源甲烷和有机肥,因此受到越来越广泛的关注[1-2]。
温度是影响厌氧微生物及沼气发酵过程的关键因素。通常温度越高,微生物活性越高,相应地,沼气发酵分为常温(15~25 ℃)、中温(35~37 ℃)、高温(50~60 ℃)三个温度范围。迄今为止,大多数沼气发酵系统在中温范围运行。在厌氧微生物生长范围内,一般温度每升高10 ℃,沼气发酵反应速度增加约一倍。当温度低于最优温度,每下降1 ℃,沼气发酵速率下降11%[3],如果发酵液温度突然变化超过3 ℃,污泥的活性会显著降低[6]。具体到每种发酵原料,受温度影响也不相同。例如,在10、15、20、25、30 ℃和35 ℃温度下猪场废水沼气发酵最大容积产气率分别是0.071、0.271、1.173、1.948、2.196 L·L-1·d-1和2.871 L·L-1·d-1[4]。可用温度活性系数(θ值)定量反映温度对沼气发酵的影响,在15~20 ℃范围θ值最高为1.332,20~25、25~30 ℃和30~35 ℃分别为1.043、1.041和1.028[5]。
脱氢酶和辅酶F420是产甲烷菌代谢途径两种重要辅酶,其在微生物体内或者污泥样品内含量可以用来衡量活性微生物量的大小以及该污泥样品对某种有机物的降解活性。在乙酸、丙酸、乳酸和丁酸对沼气发酵过程的胁迫作用中,脱氢酶的活性可反应活性污泥的活性变化[7]。从不同的膜载体对牛粪厌氧发酵的影响可看出,辅酶F420在某种程度上可以作为产甲烷菌数量变化的参考[8],辅酶F420的相对浓度与甲烷产生速率呈线性相关,这进一步表明辅酶F420可以表示特定生物反应器的产甲烷活性[9]。
相对于湿式沼气发酵,干式发酵具有沼渣沼液浓度高、数量少、容易利用等优点[10-11]。但是,干发酵过程传质困难,随总固体(TS)浓度增加,传质能力急剧降低,TS浓度为8%和25%发酵液的有效扩散系数数值分别仅为水的参考值的1/50和1/185[12]。各种中间代谢产物和微生物的交流受到严重限制,加剧氨抑制和脂肪酸积累,从而进一步使微生物活性受到抑制。猪粪湿式和干式沼气发酵都可以顺利启动并良好运行[13-14],但鸡粪比牛粪、餐厨废弃物、猪粪和活性污泥都有更高的氮含量[15],一般采用湿式沼气发酵,进料TS为8.93%,早期总氨氮(TAN)浓度低于5000 mg · L-1,原料沼气产气率为0.35~0.4 L · g-1VSadded,但随发酵进行,TAN浓度增加,沼气产量降低[16],因为随温度增加,游离氨浓度增加,导致氨氮抑制加重,使得沼气产量减少。鸡粪干式沼气发酵很多尝试都最终失败[17]。鉴于此,本文研究了鸡粪中温沼气干发酵的启动,并考察了启动阶段温度变化对产气性能的影响,通过分析发酵过程中产气率、总氨氮、挥发性脂肪酸、脱氢酶活性和辅酶F420浓度变化反映污泥活性,以期为鸡粪沼气发酵工程的启动提供科学参考。
1 材料与方法 1.1 试验材料鸡粪取自四川省雅安市某规模蛋鸡场,取回当日新鲜鸡粪置于4 ℃冰箱冷藏备用。接种污泥取自四川省某规模猪场正常运行的废水处理沼气工程,取回后35 ℃水浴培养至无残余产气备用。底物和接种污泥理化指标见表 1。
干式沼气发酵试验装置为具有三通出口的玻璃瓶,总容积2500 mL(有效容积1600 mL),用带有进料管、出料管和排气管的橡皮塞密封(图 1)。集气瓶为总容积为2500 mL玻璃瓶,用带有进气管和排水管的橡皮塞密封,沼气发酵瓶和集气瓶通过橡皮管连接。测量集气瓶排出水的容积,即为沼气产量。

|
| A:发酵瓶(A-1进料斗,A-2出料阀,A-3沼气导管,A-4水浴锅);B:集气瓶(B-1排水管);C:量筒 A: Fermentation bottle (A-1: Feed hopper, A-2: Discharge valve, A-3: Biogas outlet tube, A-4: Water bath); B: Gas collection bottle(B-1: Water outlet tube); C: Measuring cylinder 图 1 沼气发酵装置示意图 Figure 1 Diagrammatic sketch of anaerobic reactor |
试验采用污泥全接种,即将1600 mL厌氧污泥装入沼气发酵瓶。反应器设计容积负荷为1.1 g TS· L-1·d-1,进料TS浓度为22.09%,水力停留时间为160 d。即每日进料10 mL,进料之前先排出发酵残余物10 mL。共5组反应器,每组2个重复。
初始5组反应器均设置在35 ℃水浴连续培养,待出料pH、出料COD、日产气量稳定后,将其中4组反应器分别转移至15、20、25 ℃和30 ℃条件下进行水浴培养,待降温处理一段时间后,再次将4个降温处理组反应器升温恢复至35 ℃培养条件。35 ℃温度处理组反应器为对照,始终保持发酵温度不变。整个试验过程中每日测沼气产量和甲烷含量,每隔2 d测TAN、VFAs、脱氢酶活性和辅酶F420浓度。试验开始前测定接种污泥化学成分为C11.91H5.02O1.69NS0.18,鸡粪化学成分为C16.05H29.35O3.06NS0.06。
1.4 分析方法TS、VS测定采用重量法;pH值测定采用pHS- 3C+酸度计;TAN测定采用纳氏试剂分光光度法(HJ 535—2009);TKN测定采用硫酸-过氧化氢消解-凯氏定氮法;VFAs成分测定采用气相色谱仪Aglient 7820A GC火焰监测器(Agilent Technologies,USA);沼气成分测定采用沼气成分分析仪(BIOGAS 5000,Geotech,UK);元素分析测定采用元素分析仪(CE In⁃ struments,Milano,Italy);脱氢酶活性测定以2-3-5- triphenyltetrazolium chloride(TTC)为底物,经脱氢酶催化还原反应后生成红色产物TTCH2-trifenylforma⁃ zane(TF),颜色的深浅反映脱氢酶活性的高低[18];辅酶F420测定采用紫外分光光度法[19]。FA由公式(1)计算[20]:
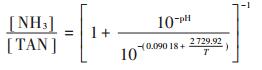 (1)
(1) 式中:[NH3]为游离氨含量,mg·L-1;[TAN]为总氨态氮含量,mg·L-1;T 为发酵料液的温度,K。
2 结果与讨论 2.1 温度变化对发酵运行的影响在厌氧生态系统中,产甲烷菌对温度波动比较敏感,发酵液温度改变会导致污泥活性发生改变,产气也随之变化。如图 2所示,5组厌氧反应器首先同时于35 ℃温度下启动运行,使用水浴锅维持发酵温度,每日进出料,进料TS浓度为22.09%,进料负荷为1.1 g TS·L-1·d-1,容积产气率逐渐稳定在0.459~0.510 L· L-1·d-1之间。运行至第6 d后,温度突然下降至30、25、20 ℃和15 ℃时,相比35 ℃温度处理组,30、25 ℃和20 ℃温度处理组的容积产气率分别降低27.2%、73.4%和95.3%,随后产气量逐渐小幅上升。15 ℃温度处理组发生产气停滞现象,超过10 d才恢复产气。各温度处理组在各自温度条件下运行12 d,第18 d温度骤升恢复至35 ℃,15 ℃温度处理组产气量发生短暂停滞,20、25 ℃和30 ℃温度处理组产气量发生小幅降低,之后皆出现产气上升的现象,25 ℃和30 ℃最早恢复到与35 ℃对照组产气相当的状态,15 ℃和20 ℃产气量逐渐提升,最终在近10 d时也基本恢复到与35 ℃对照组相当的产气量。15 ℃和20 ℃产气恢复较慢原因主要是由于低温运行时快速积累了较高的VFAs(图 3)。整个发酵过程中,对总VFAs构成中乙酸、丙酸和丁酸含量分析发现,乙酸始终占总VFAs中绝对比例,对总酸大量积累有最大贡献。脂肪酸大于4000 mg·L-1时发酵过程发生抑制[21],在恢复到35 ℃时,15 ℃和20 ℃温度处理组VFAs浓度分别达到5829 mg·L-1和7465 mg·L-1,远超过了抑制阈值,因此需经历更长时间降解积累中间产物,故导致产气率降低,随VFAs浓度降低,产气逐渐得以恢复。变温处理期间,各温度处理组TAN浓度在2700~3200 mg·L-1之间(图 4),35 ℃温度处理组FA浓度最高为170 mg· L-1。FA的抑制阈值为1100 mg · L-1(对应TAN为3400 mg·L-1),低于此浓度,比增长速率基本保持不变[21]。此过程TAN浓度在抑制阈值之下,FA浓度远低于抑制阈值。

|
| 图 2 容积产气率和甲烷产率的变化 Figure 2 Variations of methane yield and volumetric biogas production rate |

|
| 图 3 总挥发酸浓度变化 Figure 3 Variations of total volatile acid |

|
| 图 4 氨氮和游离氨浓度变化 Figure 4 Variations of TAN and FA |
试验结果说明在鸡粪干发酵启动阶段,因为运行时间不长,TAN尚未达到抑制产气浓度,产气效果主要受温度影响。甲烷微生物对温度变化非常敏感,尤其突然降低温度使沼气发酵微生物活性受限,微生物的生长和代谢随之降低,继而导致中间代谢产物如VFAs积累,产气能力降低。因此,为了保持厌氧反应器高效稳定的产气性能,保持适宜、稳定的温度尤为重要。试验中较大幅度的温度变化,并没有对反应器造成持续恶劣的影响,重新恢复到35 ℃时,经历一定时间,各温度变化组最终产气量均恢复到与35 ℃产气量相当水平。这说明沼气发酵微生物对一定温度变化范围波动具有一定的适应性,足够的时间范围内可以顺利恢复。
2.2 温度变化对沼气产量和甲烷含量的影响沼气产量和甲烷含量是评价沼气工程发酵效果的重要指标,而原料的化学成分决定了潜在沼气产量和气体成分。已知原料的化学成分可以评估理论甲烷产量。
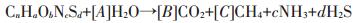 (2)
(2)  (3)
(3) 式中:T 为温度,℃;P为气压,mmHg(1 mmHg= 0.133 3 kPa)。
本研究底物鸡粪的化学成分为C16.05H29.35O3.06NS0.06,在标准温度和气压下(STP,0 ℃、760 mmHg),由公式(2),可计算得到理论原料沼气产率和原料甲烷产率,分别为1.42 L Biogas·g-1VS和0.85 L CH4·g-1VS,理论甲烷含量60.0%。如图 2所示第(Ⅱ)阶段,温度骤降,不同温度处理组产气性能受到不同程度影响。15、20、25、30 ℃和35 ℃温度处理组最大原料甲烷产率分别为0.011、0.074、0.211、0.261 L CH4·g-1VS和0.294 L CH4·g-1VS。35 ℃温度处理组产气率最高,但也仅为理论值的35%。实际值较理论值偏低,主要原因是底物降解不完全。一方面底物中含有一部分难降解有机物,这部分有机物未降解。另一方面,底物可利用有机物转化不完全,未转化或未转化为沼气底物排出反应器。
容积产气率是沼气工程设计和投资核算的基础参数。变温处理期间,15、20、25、30 ℃和35 ℃温度处理组最大容积沼气产气率分别为0.017、0.126、0.357、0.442 L·L-1·d-1和0.493 L·L-1·d-1。35 ℃温度处理组最大容积沼气产气率最高。容积产气率不随温度而线性增加可能是由微生物对底物的饱和程度决定的[5]。
由公式(3)计算可得,忽略水蒸汽气压的影响,不同温度下不同干燥气体理论产率和实际产率差异不大。变温处理过程中,沼气成分发生变化,随温度增加,甲烷含量增加。35、30、25、20 ℃和15 ℃温度处理组的平均甲烷含量分别为60%、59%、57%、53%和50%。15 ℃和20 ℃的甲烷含量要明显低于25~ 35 ℃,说明低温条件VFAs积累,造成酸化,酸化细菌活性相对较高,产甲烷细菌活性降低,产甲烷阶段比产酸阶段受到更大影响,产甲烷菌对低温更敏感。
变温过程中,不同温度条件下产气性能的差异可能是由于微生物群落结构和活性随温度梯度的变化而急剧变化,相应的导致了消化性能的变化,即甲烷产量、VFAs浓度等发生变化。对于温度变化造成的影响并未见较多报道,有学者研究了猪粪湿发酵反应器从35 ℃降低至30 ℃,并再次恢复到32 ℃两个温度脉冲过程,原料甲烷产率均有所降低,但较快恢复到和35 ℃相当的产气率,结果并未造成较大的影响[22]。Lin等[23]研究了在不同温度下微生物基因表达和沼气生产的关系,每日甲烷产量和总产气量随温度(25、35、45 ℃和50 ℃)升高而增加。微生物调节的温度影响厌氧消化系统性能,其运行机制还不甚清楚。一种可能是由于通过增加微生物群落的α多样性和提供更多功能途径的潜在相关活动和代谢网络的活动,并增加微生物群落整个活动,尤其是产甲烷活动,从而提高厌氧消化过程的力量和效率[23]。另一种可能通过减少功能性途径的多样性(α多样性相反),但提高中心功能的途径,使大部分细胞的活动和资源投资于甲烷及相关途径,提高转换效率[24]。本试验变温处理时间短,主要考察由于温度变化造成的影响,各温度处理组也可能尚未达到各自温度条件下的稳定运行状态,对于不同温度条件对厌氧干发酵产气性能的长期影响需要更多试验研究。
2.3 酶活对产气特性的反应脱氢酶作为一种胞内酶与细胞内的氧化磷酸化过程紧密相关,是反映沼气发酵体系中微生物活性的一个重要指标[25-26]。由图 5a可以看出,与35 ℃时相比,温度骤降为15、20、25 ℃和30 ℃的酶活分别降低了65.52%、50.63%、42.53%和36.78%。各温度处理组在稳定运行时,随温度降低,脱氢酶也呈现较低的活性,第12 d,15、20、25、30 ℃和35 ℃的酶活性分别为45.36、79.2、158.4、365.2 TF μg · mL-1 · h-1和383.2 TF μg·mL-1·h-1。运行至第18 d,温度再次升高,酶活力逐渐上升,试验运行至第30 d到第40 d,各温度处理组间酶活性差异不显著(P>0.05)(图 6)。

|
| 图 5 脱氢酶活性和辅酶F420浓度变化 Figure 5 Variations of dehydrogenase activity and F420 concentrations |

|
| 图 6 脱氢酶和辅酶F420与甲烷产率的线性相关性 Figure 6 The linear correlation of dehydrogenase activity and F420 concentrations with methane yield |
在厌氧消化产甲烷的代谢途径中有两类重要的辅酶,一是作为甲基载体的辅酶,二是作为电子载体的辅酶。辅酶F420属于后者,是产甲烷菌特有的辅酶,其浓度可以反映厌氧颗粒污泥产甲烷的活性[9]。由图 5b可以看出,与35 ℃时相比,温度骤降为15、20、25 ℃和30 ℃时F420酶活分别降低了89.10%、79.15%、71.56%和29.86%。随温度降低,各温度处理组辅酶F420也呈现较低的活性,第12 d,15、20、25、30 ℃和35 ℃的酶活性分别为0.16、0.34、1.11、1.77 μmol·L-1和1.89 μmol·L-1。运行至第18 d,温度再次升高,酶活力逐渐上升,试验运行至第30 d到第40 d,对各温度处理组间酶活性差异不显著(P>0.05)(图 6)。
也有研究表明辅酶F420作为厌氧活性污泥指标可能是不可行的[19],即在同种污泥的不同时期,辅酶F420的含量与最大甲烷产率之间存在着一定的正相关,但不为线性相关。在本试验中辅酶F420相对浓度与甲烷产率呈现一定的线性相关性的原因一种可能是由于同种污泥的不同运行时期,产甲烷菌的种类及其各自所占的比例不同,而导致不同的甲烷菌中辅酶F420的含量不同;另一种可能是辅酶F420作为产甲烷菌所特有的辅酶[27],其活性变化与蛋白质含量呈线性相关[19],且一般认为辅酶F420是由嗜氢产甲烷菌分泌的[28]。鸡粪中未降解蛋白质含量较高,其沼气发酵过程中以耐受氨氮的嗜氢甲烷菌为主导[16],故而呈现更为敏感的变化。
3 结论(1)采用污泥全接种方式,35 ℃鸡粪中温干式沼气发酵可以顺利启动,挥发酸没有达到抑制浓度,氨氮也尚未达到抑制水平,温度是影响产气性能的主要因素。
(2)沼气发酵微生物对温度变化敏感。鸡粪中温干式沼气发酵启动过程中,温度变化会导致产气量降低,较低温度条件下VFAs快速大量积累,对产气影响较大。沼气发酵微生物对一定范围的温度变化具有一定的适应性,足够的时间内可以顺利恢复,但温度变化导致厌氧干发酵启动时间延长。
(3)相比脱氢酶,辅酶F420的活性变化与甲烷产率变化趋势更相似,有更好的线性拟合关系,能反映鸡粪中温干式沼气发酵启动过程中产气性能的变化,可作为厌氧干发酵启动阶段或进行变温管理中监测污泥活性的指标。
| [1] |
Khalid A, Arshad M, Anjum M, et al. The anaerobic digestion of solid organic waste[J]. Waste Management, 2011, 31(8): 1737-1744. DOI:10.1016/j.wasman.2011.03.021 |
| [2] |
Hansen K H, Angelidaki I, Ahring B K. Improving thermophilic anaerobic digestion of swine manure[J]. Water Research, 1999, 33(8): 1805-1810. DOI:10.1016/S0043-1354(98)00410-2 |
| [3] |
邓良伟. 沼气工程[M]. 北京: 科学出版社, 2015, 58-59. DENG Liang-wei. Biogas engineering[M]. Beijing: Science Press, 2015, 58-59. |
| [4] |
杨红男, 邓良伟. 不同温度和有机负荷下猪场粪污沼气发酵产气性能[J]. 中国沼气, 2016, 34(3): 36-43. YANG Hong-nan, DENG Liang-wei. The biogas production performance of anaerobic digestion of swine wastewater under different organic loading rate and temperatures[J]. China Biogas, 2016, 34(3): 36-43. |
| [5] |
Deng L W, Yang H N, Liu G J, et al. Kinetics of temperature effects and its significance to the heating strategy for anaerobic digestion of swine wastewater[J]. Applied Energy, 2014, 134: 349-355. DOI:10.1016/j.apenergy.2014.08.027 |
| [6] |
李磊磊, 郭勇, 秦娜娜, 等. 沼气伴热研究进展[J]. 环境工程, 2011, 29(4): 125-129. LI Lei-lei, GUO Yong, QIN Na-na, et al. Progress in research on the biogas heating[J]. Environmental Engineering, 2011, 29(4): 125-129. |
| [7] |
黄振兴, 严群, 阮文权, 等. 有机酸胁迫下厌氧污泥产氢效果[J]. 微生物学通报, 2010, 37(4): 529-533. HUANG Zhen-xing, YAN Qun, RUAN Wen-quan, et al. Effect of organic acids stress on biohydrogen production by anaerobic granular sludge[J]. Microbiology China, 2010, 37(4): 529-533. |
| [8] |
李杰, 李文哲, 许洪伟, 等. 牛粪湿法厌氧消化规律及载体影响的研究[J]. 农业工程学报, 2007, 23(3): 186-191. LI Jie, LI Wen-zhe, XU Hong-wei, et al. Rules of anaerobic digestion of cow manure by wet method and the effect of carriers[J]. Transactions of the Chinese Society of Agricultural Engineering, 2007, 23(3): 186-191. |
| [9] |
李卫华, 盛国平, 陆锐, 等. 厌氧产甲烷受抑制过程的三维荧光光谱解析[J]. 光谱学与光谱分析, 2011, 31(8): 2131-2135. LI Wei-hua, SHENG Guo-ping, LU Rui, et al. Analysis of the EEM fluorescence spectra of effluent from anaerobic methane reactor during the inhibition process[J]. Spectroscopy and Spectral Analysis, 2011, 31(8): 2131-2135. |
| [10] |
Kothari R, Pandey A K, Kumar S, et al. Different aspects of dry anaerobic digestion for bio-energy:An overview[J]. Renewable & Sustainable Energy Reviews, 2014, 39(6): 174-195. |
| [11] |
王明, 李文哲, 殷丽丽, 等. 高固体含量进料提高餐厨废弃物连续厌氧发酵性能[J]. 农业工程学报, 2015, 31(3): 283-287. WANG Ming, LI Wen-zhe, YIN Li-li, et al. High solid concentration feedstock improving performance of continuous anaerobic digestion of food waste[J]. Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(3): 283-287. |
| [12] |
Bollon J, Benbelkacem H, Gourdon R, et al. Measurement of diffusion coefficients in dry anaerobic digestion media[J]. Chemical Engineering Science, 2013, 89(4): 115-119. |
| [13] |
刘刚金, 邓良伟, 陈子爱, 等. 常温条件下猪粪干发酵的启动[J]. 中国沼气, 2013, 31(3): 18-22. LIU Gang-jin, DENG Liang-wei, CHEN Zi-ai, et al. Start up of dry anaerobic digestion of swine manure under ambient temperature[J]. China Biogas, 2013, 31(3): 18-22. |
| [14] |
王明, 赵胜雪, 李旭荣, 等. 猪粪中温半干法连续厌氧发酵产气性能[J]. 农业工程学报, 2018, 34(1): 204-209. WANG Ming, ZHAO Sheng-xue, LI Xu-rong, et al. Biogas production performance of swine manure by mesophilic semi-dry continuous anaerobic digestion[J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(1): 204-209. DOI:10.11975/j.issn.1002-6819.2018.01.28 |
| [15] |
Qiao W, Yan X, Ye J, et al. Evaluation of biogas production from different biomass wastes with/without hydrothermal pretreatment[J]. Renewable Energy, 2011, 36(12): 3313-3318. DOI:10.1016/j.renene.2011.05.002 |
| [16] |
Niu Q G, Qiao W, Qiang H, et al. Mesophilic methane fermentation of chicken manure at a wide range of ammonia concentration:Stability, inhibition and recovery[J]. Bioresource Technology, 2013, 137(11): 358-367. |
| [17] |
Gallert C, Winter J. Mesophilic and thermophilic anaerobic digestion of source-sorted organic wastes:Effect of ammonia on glucose degradation and methane production[J]. Applied Microbiology & Biotechnology, 1997, 48(3): 405-410. |
| [18] |
张洪宾, 谷洁, 孙薇, 等. 不同原料配比对厌氧发酵过程中产气量VFA和脱氢酶活性的影响[J]. 农业环境科学学报, 2012, 31(2): 422-427. ZHANG Hong -bin, GU Jie, SUN Wei, et al. Effects of different rations of materials on biogas production, VFA and the activity of dehedrogenase during anaerobic process[J]. Journal of Agro-Environment Science, 2012, 31(2): 422-427. |
| [19] |
唐一, 胡纪萃. 辅酶F420作为厌氧污泥活性指标的研究[J]. 中国沼气, 1990, 8(1): 11-15. TANG Yi, HU Ji-cui. Studies on the use of coenzyme F420 as a parameter for anaerobic sludge activity[J]. China Biogas, 1990, 8(1): 11-15. |
| [20] |
Hansen K H, Angelidaki I, Ahring B K. Anaerobic digestion of swine manure:Inhibition by ammonia[J]. Water Research, 1998, 32(1): 5-12. DOI:10.1016/S0043-1354(97)00201-7 |
| [21] |
勒系意, 黄运红, 任雨涵, 等. 梯度有机负荷下农业废弃物厌氧发酵特性及微生物群落[J]. 农业工程学报, 2017, 33(17): 239-247. LE Xi-yi, HUANG Yun-hong, REN Yu-han, et al. Anaerobic digestion characteristics and microbial structure of agricultural wastes under gradient organic loadings[J]. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(17): 239-247. DOI:10.11975/j.issn.1002-6819.2017.17.032 |
| [22] |
Chae K J, Jang A, Yim S K, et al. The effects of digestion temperature and temperature shock on the biogas yields from the mesophilic anaerobic digestion of swine manure[J]. Bioresource Technology, 2008, 99(1): 1-6. DOI:10.1016/j.biortech.2006.11.063 |
| [23] |
Lin Q, De V J, Li J, et al. Temperature affects microbial abundance, activity and interactions in anaerobic digestion[J]. Bioresource Technology, 2016, 209: 228-236. DOI:10.1016/j.biortech.2016.02.132 |
| [24] |
Lin Q, Vrieze J D, He G, et al. Temperature regulates methane production through the function centralization of microbial community in anaerobic digestion[J]. Bioresource Technology, 2016, 216: 150-158. DOI:10.1016/j.biortech.2016.05.046 |
| [25] |
Yang H W, Jiang Z P, Shi S Q, et al. INT-dehydrogenase activity test for assessing anaerobic biodegradability of organic compounds[J]. Ecotoxicology & Environmental Safety, 2002, 53(3): 416-421. |
| [26] |
Mosher J J, Levison B S, Johnston C G. A simplified dehydrogenase enzyme assay in contaminated sediment using 2-(p-Iodophenyl)-3(p-nitrophenyl)-5-phenyl tetrazolium chloride[J]. Journal of Microbiological Methods, 2003, 53(3): 411-415. DOI:10.1016/S0167-7012(02)00251-8 |
| [27] |
Dolfing J, Mulder J W. Comparison of methane production rate and coenzyme F420 content of methanogenic consortia in anaerobic granular sludge[J]. Applied & Environmental Microbiology, 1985, 49(5): 1142-1145. |
| [28] |
Reynolds P J, Colleran E. Evaluation and improvement of methods for coenzyme F420 analysis in anaerobic sludges[J]. Journal of Microbiological Methods, 1987, 7(2/3): 115-130. |
| [29] |
程国玲, 李巧燕, 李永峰. 产甲烷菌细菌学原理与应用[M]. 哈尔滨: 哈尔滨工业大学出版社, 2013, 44-47. CHENG Guo-ling, LI Qiao-yan, LI Yong-feng. Bacteriology principle and application of methanogenic bacteria[M]. Harbin: Harbin Institute of Technology Press, 2013, 44-47. |
 2018, Vol. 37
2018, Vol. 37