2. 中国科学院南京土壤研究所土壤环境与污染修复重点实验室, 南京 210008
2. Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China
锑(Sb)是人体和植物的非必需元素,具有潜在的慢性毒性和致癌性[1]。Sb会抑制植物发芽和生长,抑制光合作用,影响膜结构和通透性[2]。Sb通过呼吸、饮食或皮肤等暴露途径进入人体后,不仅干扰体内糖与蛋白质的代谢,损害心脏、肝脏及神经系统,还会对黏膜产生刺激作用[3]。由于Sb具有较好的阻燃性,能增加子弹的硬度等特性,广泛应用于各行各业,人类对Sb的需求量越来越大,使得Sb矿的开采等活动急速增加。我国是世界上最大的Sb资源大国,储存量和产量均居于世界首位,且多年Sb产量达到世界总产量的80%[4]。近年来,随着含Sb矿产的大量开采,Sb矿周边土壤受到严重污染。Sb环境污染问题已经引起广泛的重视,目前国内外对Sb的生态毒理研究主要集中在植物、藻类对Sb的吸收[5]和积累过程[6-7]以及Sb对植物、藻类光合作用的胁迫[8]等,总体来说研究比较散,不够系统,由于缺乏系统性的生态毒性阈值研究,迄今为止,我国还未颁布关于Sb的土壤环境标准,因此开展Sb生态毒性和阈值研究就显得尤为重要。
水稻是中国乃至亚洲的主要粮食作物之一,世界上有90%的水稻产于亚洲。我国是水稻生产消费大国,大约有65%的人是以水稻为主食[9],南方Sb矿周边种植大量的水稻,对水稻生长造成一定的污染,湖南省Sb矿山附近的水稻土中检测到Sb的含量是1565 mg·kg-1 [10],是WHO推荐的土壤Sb污染最大允许浓度36 mg·kg-1的43倍,水稻植株的根和种子积累分别高达225 mg·kg-1和5.79 mg·kg-1[11]。根伸长抑制率是评价重金属生态毒性的一个重要指标[12-13]。本研究选取全国各地、各种类型的水稻作为研究对象,研究不同品种水稻对Sb胁迫的响应差异,以根伸长半抑制最大效应浓度(Concentration for 50% of maximal effect,EC50)作为主要参考,对比水稻根部Sb的吸收,及SOD酶和MDA等生理生化指标,比较不同品种水稻对Sb的敏感性,初步探究Sb致毒机理,为污染地区种植水稻品种的选择提供依据;同时为开展Sb毒性阈值和生态毒性研究及我国Sb标准的建立提供技术支撑。
1 材料与方法 1.1 实验材料(1)水稻品种:供试水稻品种共44种,包括连糯一号、浙优18、鄂丰28、南粳5055、Ⅱ优7954远杂绿稻Q7、徐旱1号、淮粳5号、紫香米、南粳9108、武育糯16号、绿旱、6两优9368、旱稻998、川香优2号、钱优0506、冈优177、镇籼优184、钱优1号、春优84、徽两优898、川优6203、黑稻、钱优0508、龙庆稻1号、超级旱稻502、龙稻20、冈优7954、富禾66、旱稻65、深两优5183、苏育糯、黑糯米、荆两优1198、Ⅱ优1259、郑旱6号、扬粳687、绿糯米、中优188、东农425、镇糯19号、盐粳6号、Ⅱ优98、屉优267
(2)供试试剂:酒石酸锑钾,KSbC4H4O7·1/2H2O,AR,上海试四赫维化工有限公司;焦锑酸钾,K2H2Sb2O7·4H2O,AR,上海试四赫维化工有限公司;实验过程中所使用的试剂均为分析纯;去离子水。
(3)供试仪器:多功能环境培养箱(MLR-351H,三洋,日本);原子荧光光度计(AFS-230E,北京海光仪器公司);莱伯泰科微控数显电热板(EG35A Plus,浙江纳德科学仪器有限公司);高速离心机(TG16- WS,湖南凯达科学仪器有限公司)。
1.2 研究方法 1.2.1 72 h根伸长毒性测试选取饱满的水稻种子,洗净,经消毒、泡种、催芽之后,挑选根长一致的幼芽移植到500 mL装有营养液的PVC罐中,Sb(Ⅲ)和Sb(Ⅴ)处理下的各种不同浓度均设置3个平行,每个平行中有6株幼芽,营养液是1/4强度IRRI营养液[14],Sb(Ⅲ)和Sb(Ⅴ)的暴露浓度分别为:0.00、0.31、0.61、3.07、6.14、30.69、61.38、92.07 mg·L-1和0.00、0.51、2.54、5.08、25.38、50.78、76.17、101.55 mg·L-1等8个浓度梯度。通过HNO3和NaOH调节营养液pH到5.5。将装有营养液和幼芽的PVC罐置于32 ℃培养箱中培养72 h。72 h之后拍下幼芽的照片,以Image J处理图片测得水稻根伸长,记录并计算根伸长的平均值、相对根伸长(Relative root elongation,RRE)。RRE计算公式为:

|
(1) |
式中:RLT是指不同浓度Sb(Ⅲ)或Sb(Ⅴ)处理下样品的根长,RLC是RLT对应处理下的对照组根长;RLS代表初始根长。
EC50常指半数最大效应浓度,在本实验中表示相对根伸长RRE为50%时暴露液的浓度,EC50是定量反应Sb对水稻的胁迫能力大小的一个指标,EC50越大说明Sb的毒性越小,反之Sb的毒性越大。EC50可以根据Haanstra等定义的对数模型计算,对数模型公式如下[15]:
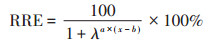
|
(2) |
式中:RRE为记录的相对根伸长或者Sb浓度通过拟合得到的相对根伸长,a是表示抑制比率参数,b是相对根伸长为50%时暴露液Sb浓度的对数,x是Sb浓度的自然对数。
1.2.2 水稻根中Sb总浓度的测定毒性暴露试验结束后,收集水稻根,用去离子水漂洗3~4次后,所有的根都放进烘箱中,90 ℃杀青1 h,70 ℃烘干至恒质量。称质量后置于50 mL锥形瓶中,加入适量的硝酸并放上小漏斗,放置在通风橱中冷消解一夜。次日,进行消解,定容,用原子荧光光度计(AFS)测定[16]。Sb的检测限是20 μg·L-1。标准样品(GBW10015菠菜)用于质量控制,其回收率为126.67%。同时做试剂空白。
Cmax可根据Michaelis-Menten方程计算[17],方程如下:
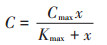
|
(3) |
式中:C是水稻根中Sb的浓度,Cmax是水稻根吸收Sb的最大浓度,Kmax是最大吸收常数,x是培养液中Sb的浓度。
1.2.3 酶指标测定经2.2.1和2.2.2实验筛选出的紫香米、扬粳687、深两优5183和徐旱1号作为试验水稻,经过消毒和催芽处理后,开展根伸长抑制试验,Sb的暴露浓度为6.09 mg·L-1。以1/4 IRRI来配制培养液,选择根长一致的幼芽,培养72 h后将根剪下并称鲜重,然后用破碎机进行破碎组织,离心,显色,用考马斯亮蓝法测定蛋白含量,用WST-1法测定SOD活力,用酶标仪比色法测定MDA含量[18]。
1.2.4 数据处理根长通过ImageJ(国立健康研究所,美国)处理;根伸长计算用Excel处理;EC50半数最大效应浓度曲线和最大吸收曲线通过OriginPro 8.5拟合。采用单因素并结合多重比较法(Tukey检验)比较各品种之间的显著性(P < 0.05)。本实验所有数据均为3次重复,数据统计分析采用SPSS 20.0软件,采用OriginPro 8.5画图。
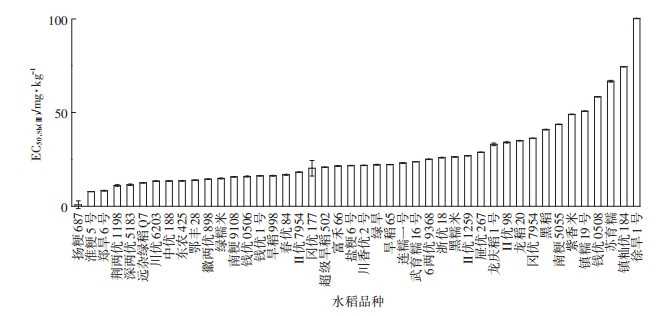
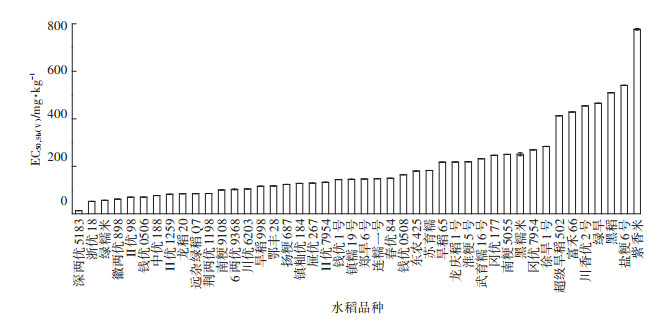
2 结果与讨论 2.1 不同形态的Sb对水稻根伸长的胁迫不同形态的Sb均能抑制水稻根系的生长,且相较于Sb(Ⅴ),Sb(Ⅲ)对水稻根系形态各指标的影响比较大[19]。Sb、As为同族元素,两者之间的性质有很多相似之处,有研究表明水稻不同品种耐As性存在差异[20],本研究表明不同品种水稻对Sb的耐性也存在差异。不同品种水稻的EC50结果如图 1、图 2,由此可见Sb(Ⅲ)的毒性比Sb(Ⅴ)的毒性大,且不同基因型水稻对Sb的敏感性存在显著差异(P < 0.05)(数据未列出)。如图 1所示,扬粳687的EC50,Sb(Ⅲ)值最小为0.82 mg·L-1,表明扬粳687是对Sb(Ⅲ)的敏感品种;徐旱1号的EC50,Sb(Ⅲ)值最大为100.24 mg·L-1,表明徐旱1号是Sb(Ⅲ)的耐性品种,徐旱1号的EC50,Sb(Ⅲ)是扬粳687的122倍。如图 2所示,EC50,Sb(Ⅴ)最小的是深两优5183值为13.34 mg·L-1,表明深两优5183是Sb(Ⅴ)的敏感品种;EC50,Sb(Ⅴ)最大的是紫香米值为776.78 mg· L-1,表明紫香米是Sb(Ⅴ)的耐性品种,紫香米的EC50,Sb(Ⅴ)是深两优5183的58倍。
|
图 1 Sb(Ⅲ)对不同品种水稻EC50的影响 Figure 1 Effect of Sb(Ⅲ)on EC50 of different rice |
|
图 2 Sb(Ⅴ)对不同品种水稻EC50的影响 Figure 2 Effect of Sb(Ⅴ)on EC50 of different rice |
根系是植物吸收矿物质营养和水分的主要器官,植物能够通过减少根部与重金属的接触面积,从而降低对重金属的吸收[19]。根对重金属的吸收量在一定程度上影响整株植物对重金属的吸收量。不同形态的Sb进入水稻的方式不同,且水稻对Sb的吸收速率也不一样[11]。
不同品种水稻对Sb的吸收最大值也有显著差异(P < 0.05)(数据未列出),结果如图 3和图 4所示。由图 3可见,不同品种的水稻对Sb(Ⅲ)的吸收最大值在5~12 mg·kg-1之间,敏感品种扬粳687的最大吸收值为8.43 mg·kg-1,耐性品种徐旱1号的最大吸收值为6.09 mg·kg-1。由图 4可见,水稻对Sb(Ⅴ)的最大吸收值在0.5~11.5 mg·kg-1之间,敏感品种深两优5183的最大吸收值为1.69 mg·kg-1,耐性品种紫香米的最大吸收值为2.06 mg·kg-1。本研究结果验证了Sb(Ⅲ)处理下的水稻根吸收Sb含量高于Sb(Ⅴ)处理的结论。

|
图 3 Sb(Ⅲ)培养下不同品种水稻对Sb的最大吸收量 Figure 3 The maximum absorption of Sb by different varieties of rice under Sb(Ⅲ)culture |
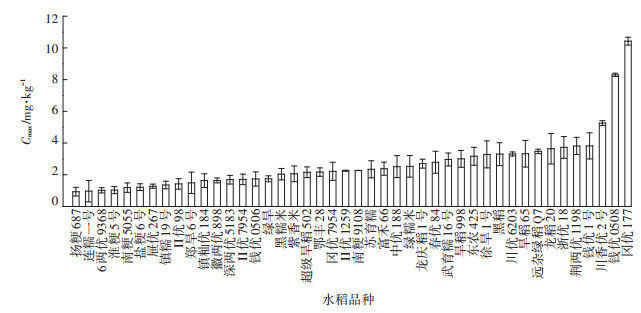
|
图 4 Sb(Ⅴ)培养下不同品种水稻对Sb的最大吸收量 Figure 4 The maximum absorption of Sb by different varieties of rice under Sb(Ⅴ)culture |
重金属对植物的发芽率、根伸长及一些根部的形态变化有一定的影响,其中根伸长的变化是植物对重金属胁迫最直观的指标之一。由图 5A可见,水稻在Sb(Ⅲ)处理下的相对根伸长小于Sb(Ⅴ)处理组,扬粳687、深两优5183和紫香米在不同的Sb处理下存在显著差异(P < 0.05),徐旱1号在不同的Sb处理下没有显著的差异(P > 0.05)。对照组、Sb(Ⅲ)处理组和Sb(Ⅴ)处理组徐旱1号的根伸长抑制率分别为:0、21.92%和22.86%,紫香米的根伸长抑制率分别为:0、46.75%、35.40%。
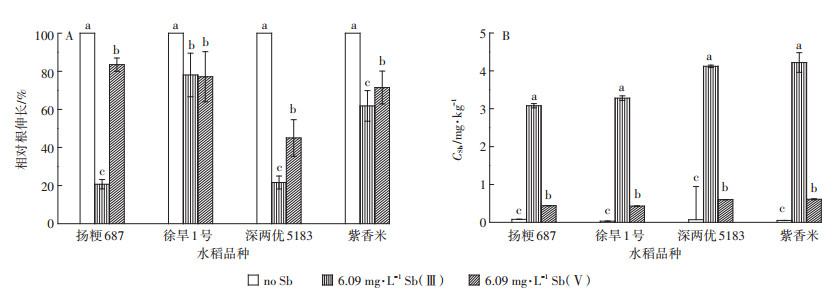
|
每个水稻品种下不同小写字母表示不同Sb处理间差异显著(P < 0.05)。下同 Different lowercase letters indicate significant difference between different Sb treatments in the same variety(P < 0.05). The same below 图 5 不同处理下水稻相对根伸长(A)和Sb总量(B)的比较 Figure 5 The relative root elongation(A)and the concentration of rice(B)with different Sb treatments |
植物体内过量的Sb会影响植物的生长,5~10 mg·kg-1 Sb在植物组织中会损伤植物的生长[21]。本研究结果显示如图 5B,6.09 mg·L-1 Sb处理组,水稻的根部Sb含量均小于5 mg·kg-1,表明在该浓度下植物的生长受到的损伤不严重。不同Sb处理的水稻根部对Sb吸收存在着显著差异,有研究表明Sb(Ⅲ)处理组的一些植物根吸收Sb浓度大约是Sb(Ⅴ)处理组的3倍[22]。本研究的结果显示,在Sb(Ⅲ)处理下这四种水稻根的Sb含量是Sb(Ⅴ)处理组的5倍。两个结果之间存在偏差可能的原因有两个:一是实验所使用的植物不同,二是实验所用的时间不同。
2.3.3 水稻根在Sb胁迫下超氧化物歧化酶的差异SOD(超氧化物歧化酶)是生物体内普遍存在的酶之一,在ROS防御机制中起着关键的作用,它能够降低膜脂过氧化作用,维持细胞膜的稳定性[23]。抗氧化和解毒是环境胁迫的第一道防线[24],但增加污染物浓度可能导致这些过程的崩溃和其他相关反应的刺激[25],SOD活力的降低表明对细胞的毒性超过细胞的极限,造成了SOD的消耗或者造成SOD瞬间保护不足[26]。研究表明外源As处理下,小于20 mg·kg-1时As浓度增加时植物体内SOD增加,说明SOD在低As条件下在保护植物方面起着重要的作用;外源As大于20 mg·kg-1时,As增加时植物体内的SOD呈减少趋势,是植物中毒现象[27]。Chai等研究发现Sb的存在降低了苎麻(Boehmeria nivea)中SOD含量,但存在明显的浓度效应,40 mg·L-1的Sb显著降低了SOD酶活性,但随着浓度的进一步增加,SOD酶活性又显著增加[28]。我们的研究发现6.09 mg·L-1的Sb(Ⅲ)和Sb(Ⅴ)处理均显著增加了水稻根中SOD酶活性,与Sb(Ⅲ)相比,Sb(Ⅴ)处理增加更为显著(图 6A)。
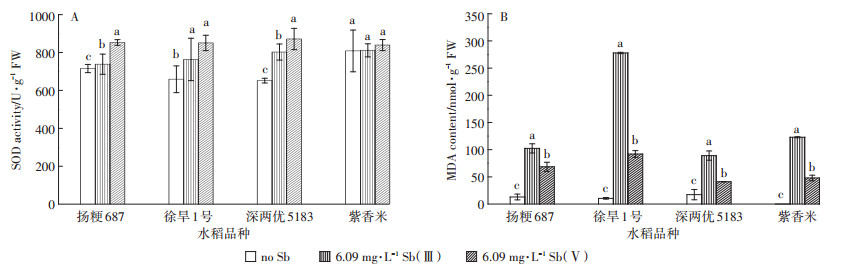
|
图 6 不同Sb处理下水稻的SOD活力(A)和MDA含量(B) Figure 6 The activity of SOD(A)and the concentration of MDA(B)with different Sb treatments |
丙二醛(MDA)是过量的活性氧指数和细胞膜脂质过氧化作用产物,可作为应激化条件下脂质过氧化状态的指标[23]。MDA含量的增加通常表现为保护机制,消耗丙二醛对植物器官有轻微的损害[26]。As浓度的增加导致水稻根茎中MDA的增加是由于As引起的氧化压力[27],Sb污染使ROS诱导脂质过氧化,导致MDA的含量增加。研究结果表明(图 6B),水稻根部受到Sb的胁迫之后MDA的含量均比对照组大;且相比于Sb(Ⅴ)处理组,Sb(Ⅲ)处理组的水稻根MDA含量较大,表明水稻幼苗的生长过程中受到Sb(Ⅲ)引起的氧化压力大于Sb(Ⅴ)引起的氧化压力,说明该Sb(Ⅲ)对水稻根部的伤害更严重。
3 结论根伸长的变化是植物对重金属胁迫最直观的指标之一,论文以EC50作为水稻耐Sb能力大小的筛选指标研究了Sb对水稻的生物毒性,发现Sb(Ⅲ)对水稻根伸长的毒性显著大于Sb(Ⅴ),试验的44种水稻品种中,扬粳687是Sb(Ⅲ)的敏感品种,徐旱1号是Sb(Ⅲ)的耐性品种;深两优5183是Sb(Ⅴ)的敏感品种,紫香米是Sb(Ⅴ)的耐性品种。水稻对不同形态Sb的吸收差异较大,水稻对Sb的吸收量与水稻对Sb的敏感性之间没有显著的相关性,但是水稻对Sb(Ⅲ)的吸收显著高于Sb(Ⅴ)。Sb显著影响了水稻根中SOD酶活性和MDA含量,6.09 mg·L-1的Sb处理增加了水稻根中SOD酶活性,且Sb(Ⅴ)处理显著高于Sb(Ⅲ);Sb暴露显著增加了水稻根中MDA含量,且Sb(Ⅲ)处理显著高于Sb(Ⅴ),表明Sb(Ⅲ)的毒性要高于Sb(Ⅴ)。
| [1] |
Elliott B M, Mackay J M, Clay P, et al. An assessment of the genetic toxicology of antimony trioxide[J]. Mutat Res, 1998, 415(1/2): 109-117. |
| [2] |
Chai L Y, Wang Y, Yang Z H, et al. Physiological characteristics of Ficus tikoua under antimony stress[J]. Transactions of Nonferrous Metals Society of China, 2017, 27(4): 939-945. DOI:10.1016/S1003-6326(17)60106-7 |
| [3] |
廖自基. 环境中微量重金属元素的污染危害与迁移转化[M]. 北京: 科学出版社, 1989, 150-176. LIAO Zi-ji. Pollution hazards and migration and transformation of trace heavy metals in environment[M]. Beijing: Science Press, 1989, 150-176. |
| [4] |
王修, 王建平, 刘冲昊, 等. 我国锑资源形势分析及可持续发展策略[J]. 中国矿业, 2014(5): 9-13. WANG Xiu, WANG Jian-ping, LIU Chong-hao, et al. Situation analysis and sustainable development trategy of antimony resources in China[J]. Chinese Journal of Mining, 2014(5): 9-13. DOI:10.3969/j.issn.1004-4051.2014.05.004 |
| [5] |
Feng R W, Wei C Y, Tu S X, et al. The uptake and detoxification of antimony by plants:A review[J]. Environmental & Experimental Botany, 2013, 96(96): 28-34. |
| [6] |
王晓丽.植物中锑的积累过程及锑与砷的复合作用研究[D].武汉: 华中农业大学, 2012: 7-15. WANG Xiao-li. Mechanisms of antimony accumulation and the interaction between antimony and arsenic in plants[D]. Wuhan: Huazhong Agricultural University, 2012: 7-15. http://cdmd.cnki.com.cn/Article/CDMD-10504-1012457626.htm |
| [7] |
薛亮.锑矿区植物重金属积累特征及其耐锑机理研究[D].北京: 中国林业科学研究院, 2013: 23-50. XUE Liang. Research on characteristic of heavy metal accumulation and antimony tolerant mechanism of plants in antimony mine area[D]. Beijing: Chinese Academy of Forestry, 2013: 23-50. |
| [8] |
张强, 刘飞, 纪磊, 等. 锑胁迫对玉米生物量、光合特性及锑积累的影响[J]. 核农学报, 2017, 31(8): 1633-1639. ZHANG Qiang, LIU Fei, JI Lei, et al. Effects of antimony stress on the biomass, photosynthetic characteristics and antimony accumulation of maize[J]. Journal of Nuclear Agricultural Sciences, 2017, 31(8): 1633-1639. |
| [9] |
孟桂元, 唐婷, 周静, 等. 不同水稻品种种子萌发及根芽生长的耐镉性差异研究[J]. 杂交水稻, 2015, 30(5): 65-69. MENG Gui-yuan, TANG Ting, ZHOU Jing, et al. Studies on cadmium tolerance differences of seed germination and growth of roots and shoots in different rice varieties[J]. Hybrid Rice, 2015, 30(5): 65-69. |
| [10] |
He M C, Yang J R. Effects of different forms of antimony on rice during the period of germination and growth and antimony concentration in rice tissue[J]. Science of the Total Environment, 1999, 243/244(99): 149-155. |
| [11] |
Ren J H, Ma L Q, Sun H J, et al. Antimony uptake, translocation and speciation in rice plants exposed to antimonite and antimonate[J]. Science of the Total Environment, 2014, 475: 83-89. DOI:10.1016/j.scitotenv.2013.12.103 |
| [12] |
Abedin M, Joinal, Meharg A A. Relative toxicity of arsenite and arsenate on germination and early seedling growth of rice(Oryza sativa L.)[J]. Plant & Soil, 2002, 243(1): 57-66. |
| [13] |
何俊瑜, 任艳芳. 镉胁迫对水稻种子萌发、幼苗生长和淀粉酶活性的影响[J]. 华北农学报, 2008, 22(增刊1): 399-404. HE Jun-yu, REN Yan-fang. Effect of cadmium on seed germination, seedling growth and amylolytic activity of rice[J]. Acta Agriculture Boreali-Sinica, 2008, 22(Suppl1): 399-404. |
| [14] |
Yoshida S, Forno D A, Cock J H. Laboratory manual for physiological studies of rice[M]. Manila: International Rice Research Institute, 1976, 7-11.
|
| [15] |
崔晓丹.不同水分管理对土壤锑、砷有效性及水稻吸收土壤锑的影响研究[D].北京: 中国科学院大学, 2015: 49-60. CUI Xiao-dan. Effects of different water managements on the uptake of soil Sb by rice(Oryza sativa L.)[D]. Beijing: Chinese Academy of Sciences, 2015: 49-60. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2957999 |
| [16] |
Krachler M, Zheng J, Koerner R, et al. Increasing atmospheric antimony contamination in the northern hemisphere:snow and ice evidence from Devon Island, Arctic Canada[J]. Journal of Environmental Monitoring Jem, 2005, 7(12): 1169-1176. DOI:10.1039/b509373b |
| [17] |
常江, 章力干. 镧钙对水稻磷、钾吸收速率的影响[J]. 安徽农业大学学报, 1994(4): 494-497. CHANG Jiang, ZHANG Li-gan. Effects of lanthanum and calcium on rate of phosphorus and potassium uptake in rice[J]. Journal of Anhui Agricultural University, 1994(4): 494-497. |
| [18] |
Zhang F Q, Wang Y S, Lou Z P, et al. Effect of heavy metal stress on antioxidative enzymes and lipid peroxidation in leaves and roots of two mangrove plant seedlings(Kandelia candel and Bruguiera gymnorrhiza)[J]. Chemosphere, 2007, 67(1): 44-50. DOI:10.1016/j.chemosphere.2006.10.007 |
| [19] |
Li X, Yang Y, Jia L, et al. Zinc-induced oxidative damage, antioxidant enzyme response and proline metabolism in roots and leaves of wheat plants[J]. Ecotoxicology & Environmental Safety, 2013, 89(11): 150-157. |
| [20] |
雷蕾, 吴倩桦, 吕海琴, 等. 不同形态锑对水稻生长及根系形态特征的影响研究[J]. 农业环境科学学报, 2017, 36(3): 437-442. LEI Lei, WU Qian-hua, LÜ Hai-qin, et al. Effects of different forms of antimony on the growth and root morphology of rice plant[J]. Journal of Agro-Environment Science, 2017, 36(3): 437-442. |
| [21] |
Hajiani N J, Ghaderian S M, Karimi N, et al. A comparison of antimony accumulation and tolerance among Achillea wilhelmsii, Silene vulgaris and Thlaspi arvense[J]. Plant & Soil, 2016, 1-15. |
| [22] |
刘文菊, 胡莹, 毕淑芹, 等. 苗期水稻吸收和转运砷的基因型差异研究[J]. 中国农学通报, 2006, 1(6): 356-360. LIU Wen-ju, HU Ying, BI Shu-qin, et al. Study of genotypic differences on arsenic uptake by and translocation in rice seedlings[J]. Chinese Agricultural Science Bulletin, 2006, 1(6): 356-360. DOI:10.3969/j.issn.1000-6850.2006.06.091 |
| [23] |
Kabatapendias A, Pendias H K. Trace elements in soils and plants[J]. CRC Press, 2011, 951-974. |
| [24] |
Wilhelm F D. Reactive oxygen species, antioxidants and fish mitochondria[J]. Frontiers in Bioscience A Journal & Virtual Library, 2007, 12(1): 1229. |
| [25] |
Jin Z, Zhu X S, Cai Z H. Tributyltin toxicity in abalone(Haliotis diversicolor supertexta)assessed by antioxidant enzyme activity, metabolic response, and histopathology[J]. Journal of Hazardous Materials, 2010, 183(1/2/3): 428. |
| [26] |
Ma T, Christie P, Ying T, et al. Rape(Brassica chinensis L.)seed germination, seedling growth, and physiology in soil polluted with di-n-butyl phthalate and bis(2-ethylhexyl) phthalate[J]. Environmental Science & Pollution Research, 2013, 20(8): 5289-5298. |
| [27] |
蒋汉明, 邓天龙, 赖冬梅, 等. 砷对植物生长的影响及植物耐砷机理研究进展[J]. 广东微量元素科学, 2009, 16(11): 1-5. JIANG Han-ming, DENG Tian-long, LAI Dong-mei, et al. Progresses on the effect of arsenic dor plant and plant tolerance mechanism[J]. Guangdong Trace Elements Science, 2009, 16(11): 1-5. DOI:10.3969/j.issn.1006-446X.2009.11.001 |
| [28] |
Chai L Y, Mubarak H, Yang Z H, et al. Growth, photosynthesis, and defense mechanism of antimony(Sb)-contaminated Boehmeria nivea L.[J]. Environmental Science & Pollution Research, 2016, 23(8): 7470-7481. |
 2018, Vol. 37
2018, Vol. 37


