镉(Cd)是毒性极大的重金属,具有较强的潜伏性、隐蔽性、滞后性、积累性、不可逆转性及降解、治理难度大等特点,已被国际癌症研究机构列为强致癌物质之一。相关研究已证实[1]:低浓度的Cd也会危害人体健康,即使Cd含量未达到毒害植物的浓度,也会使植物可食部分的Cd含量超出人类的可食用标准。目前我国总耕地面积约为1.2亿hm2,而我国受重金属污染的耕地面积高达5000万hm2,其中,中、重度耕地污染面积相当于全国耕地总面积的1/40[2],因此,对我国耕地土壤进行环境监测及污染修复的行动迫在眉睫。
土壤微生物和土壤酶是生态系统中不可缺少的部分[3],其中土壤微生物不仅可以促进土壤养分和土壤有机质的循环与转化,而且还参与土壤有机质的矿化和土壤腐殖质的形成,在生态系统的物质循环和能量流动过程中发挥着重要的作用。而土壤酶活性易受到土壤物理性质、化学性质和生物学性质及这三种性质共同影响,其活性变化明显,因此可直接反映土壤生物化学过程的方向和强度,可作为评价土壤肥力的一个灵敏性生物指标[4]。有研究表明,土壤微生物生物量和土壤酶活性与重金属污染程度存在显著的负相关[5-6]。段学军等[7]的研究表明,适量浓度的Cd含量可以刺激土壤微生物生长,提高土壤酶活性。
红壤是我国亚热带地区的主要土壤类型,而水稻土又是我国农业生产中最重要的土壤种类之一,由于过量施用化肥农药以及一些不当的农事操作造成了土壤中重金属含量超标[8-9],从而降低了土壤质量和作物品质及产量,严重影响了整个红壤地区农业及经济的可持续发展。近年来,我国学者也对重金属污染进行了大量研究,但大部分的研究主要针对矿区土壤及旱地土壤,而关于重金属污染导致红壤性水稻土中土壤微生物学特性发生变化的研究报道较少。因此本文以湖南红壤性水稻土为研究对象,通过野外采集土壤样品进行室内模拟试验,研究了外源Cd胁迫浓度对红壤性水稻土中土壤微生物生物量碳、氮和土壤酶活性的影响,探讨了外源Cd胁迫浓度与土壤微生物学指标之间的关系,以期为红壤性水稻土重金属污染研究提供生物学指标和科学依据。
1 材料与方法 1.1 土壤样品的采集及实验设置试验区位于湖南省长沙县北山镇荣合桥社区长沙春雷农业科技开发有限公司试验基地(28°26′ 12″ N,113°3′ 33″ E),气候条件优越,年降雨量1 422.4 mm,年蒸发量1 382.2 mm,无霜期275 d,年积温6 480 ℃,年平均气温16.8~17.2 ℃,日照时数1 677.1 h。该地区土壤是由第四纪红色黏土发育而来的红壤性水稻土。于2017年4月17日按5点取样法采集土壤0~15 cm深度的新鲜土样,混合均匀后装入无菌塑料袋中密封带回实验室备用。对采集的土样进行风干处理,一部分用于测定土壤基本理化性质,一部分用于培养实验使用。
称取18份过2 mm筛的风干土,每份300 g;再分别配制0、1、3、5、7、10 mg·kg-1浓度梯度的CdCl2· 2.5H2O水溶液500 mL,将土样分别与不同浓度的CdCl2·2.5H2O水溶液混合均匀,每个处理重复3次,使土壤含水量为田间最大持水量的60%(即每份土样添加101.52 mL的CdCl2·2.5H2O水溶液),使添加Cd浓度分别为0、1、3、5、7、10 mg·kg-1,置于28 ℃恒温培养箱中培养30 d,每日定时取出,用称重法来控制土样的含水量,30 d后将土样风干,进行各项目的测定。
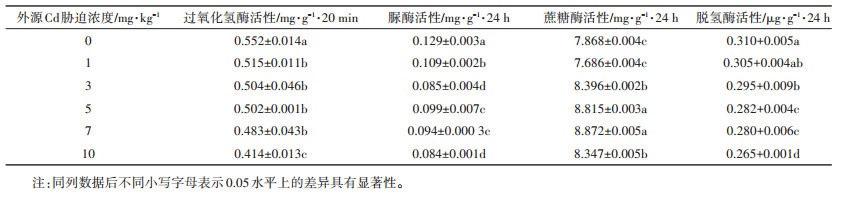
1.2 分析方法土壤基本理化性质的测定参照《土壤农化分析》[10],土壤全量Cd的测定采用氢氟酸-硝酸-高氯酸消煮,ICP-MS测定;土壤微生物生物量碳、氮含量,测定方法采用氯仿熏蒸-K2SO4浸提法;脲酶、蔗糖酶和过氧化氢酶活性分别采用靛酚蓝比色法、3,5-二硝基水杨酸比色法和高锰酸钾滴定法测定[11]。结果见表 1。
|
|
表 1 土壤基本理化性质 Table 1 Basic physical and chemical properties of soil |
采用Excel 2007软件对数据进行处理并绘图,SPSS 22.0统计分析软件进行通径分析,显著性水平设为α=0.05。通径分析即:将相关系数分为直接通径系数和间接通径系数,更直观地了解它们的作用方式。其计算原理:设在p个自变量x1,x2,…,xp中,每两个变量之间和应变量y之间的简单相关系数能够组成求解通径系数的标准化正规方程,即:
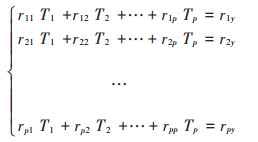
|
式中:T1,T2,…,Tp为直接通径系数。直接通径系数可以通过上述相关矩阵的逆矩阵计算获得。
间接通径系数能够通过相关系数和直接通径系数的乘积来计算[12];决定系数可通过相关系数、直接通径系数与间接通径系数总和三者来计算,即:决定系数=相关系数×直接通径系数+间接通径系数总和×直接通径系数。
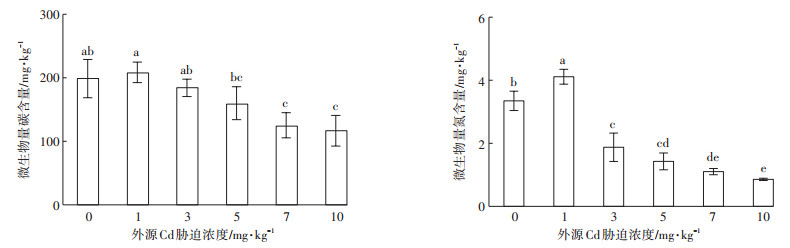
2 结果与分析 2.1 外源Cd胁迫对红壤性水稻土微生物生物量碳、氮的影响图 1显示了外源Cd胁迫对红壤性水稻土微生物生物量碳、氮的影响。随着外源Cd浓度的增加,土壤微生物生物量碳、氮含量较对照均呈先增加后减少的趋势。在外源Cd胁迫浓度为1 mg·kg-1时,土壤微生物生物量碳、氮含量呈增加的趋势,其中土壤微生物生物量氮含量较对照显著增加(P < 0.05),增幅为22.85%;随着外源Cd胁迫浓度的继续上升,土壤微生物生物量碳、氮含量逐渐下降,且外源Cd胁迫浓度越高,下降趋势越明显。在外源Cd胁迫浓度分别为7 mg·kg-1和10 mg·kg-1时,土壤微生物生物量碳含量较对照分别降低了36.96%和41.32%;而在外源Cd胁迫浓度分别为3、5、7 mg·kg-1和10 mg·kg-1时,土壤微生物生物量氮含量显著降低,较对照分别降低了43.99%、57.37%、67.07%和74.42%。
|
图中不同小写字母表示不同外源Cd胁迫浓度对水稻土微生物生物量碳、氮的影响差异显著(P < 0.05)。 图 1 外源Cd胁迫对水稻土微生物生物量碳、氮的影响 Figure 1 Effects of cadmium stress on microbial biomass carbon, nitrogen in paddy soil |
土壤酶活性是反映土壤肥力状况、土壤自净能力以及土壤重金属污染程度的重要指标。由表 2可知,过氧化氢酶、脲酶和脱氢酶活性均随外源Cd胁迫浓度的增加而减少,且外源Cd胁迫浓度越大下降趋势越明显;而蔗糖酶活性则表现出先下降后上升的趋势。在外源Cd胁迫浓度为1 mg·kg-1时,与对照相比,过氧化氢酶和脲酶活性均显著降低(P < 0.05),较对照分别下降了6.70%和15.50%;当外源Cd胁迫达到3 mg·kg-1时,与对照相比,过氧化氢酶、脲酶和脱氢酶活性均显著降低,而蔗糖酶活性则显著升高;当外源Cd胁迫浓度为7 mg·kg-1时,蔗糖酶活性达最大值,较对照增加了12.74%;当外源Cd胁迫浓度为10 mg· kg-1时,过氧化氢酶、脲酶和脱氢酶活性均达最低值,较对照分别下降了25%、34.88%和14.52%,而蔗糖酶活性较对照增加了6.37%。
|
|
表 2 Cd胁迫对水稻土酶活性的影响 Table 2 Effects of cadmium stress on enzyme activities in paddy soil |
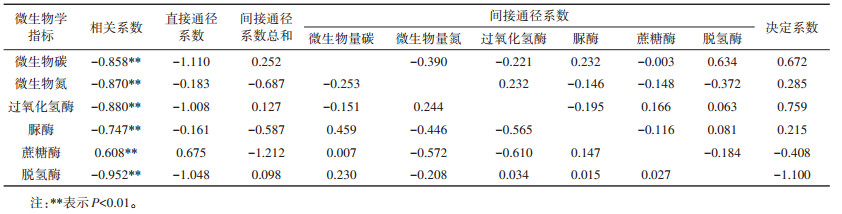
为了进一步探讨重金属Cd对微生物学指标影响,利用通径分析统计方法将重金属Cd与微生物学指标的相关系数分为直接作用和间接作用。从表 3可知,Cd胁迫对微生物生物量碳的直接作用最大(直接通径系数为-1.110),其余按直接通径系数大小(绝对值)从大到小依次为脱氢酶、过氧化氢酶、蔗糖酶、微生物生物量氮和脲酶。其中Cd胁迫对蔗糖酶的直接影响是正效应,而对其他微生物学指标的直接影响则是负效应。外源Cd胁迫对微生物生物量碳、过氧化氢酶、脱氢酶这3个微生物学指标的直接通径系数均显著大于各自间接通径系数总和,且这3个微生物学指标的间接作用系数总和很小,说明了Cd胁迫对这3个微生物学指标的影响主要是体现在直接作用上,与其他微生物学指标的关联作用较弱,其余微生物学指标与Cd胁迫浓度的直接通径系数相关性较低,随着Cd胁迫浓度的增加,过氧化氢酶和脱氢酶活性减少。通过表 3中的间接通径系数总和可知,微生物生物量氮和脲酶的间接通径系数之和远大于其直接通径系数,分别是-0.687和-0.587,与其他微生物学指标的关联作用较强,说明外源Cd主要通过影响其他微生物指标活性间接影响该指标的活性。其中蔗糖酶的直接通径系数为0.675,间接通径系数之和为-1.212,其间接通径系数之和大于直接通径系数,说明外源Cd的加入通过影响土壤理化性质和其他微生物学指标来间接影响土壤蔗糖酶活性,并使间接作用略大于直接作用,从而导致了蔗糖酶的变化趋势异于其他微生物学指标的变化趋势。
|
|
表 3 Cd胁迫浓度与微生物学指标之间的通径分析 Table 3 Path analysis between cadmium stress and microbiological indicators |
由表 3可知,外源Cd胁迫与各微生物学指标存在极显著的相关性,其中Cd与脱氢酶的相关性最大,对其他微生物学指标相关性(绝对值)从大到小依次为:过氧化氢酶、微生物生物量氮、微生物生物量碳、脲酶、蔗糖酶。而通过计算得出的决定系数表明,外源Cd胁迫对脱氢酶的综合决定能力最大,对其他微生物学指标的综合决定能力大小(绝对值)依次是:过氧化氢酶、微生物生物量碳、蔗糖酶、微生物生物量氮和脲酶。
3 讨论 3.1 Cd胁迫对土壤微生物生物量的影响土壤微生物生物量碳是土壤中活性有机质的重要组成部分,其含量仅占土壤有机质的1%~4%,但在生态系统中发挥着重要作用,而土壤微生物生物量氮含量是衡量土壤重金属污染程度的重要指标,可用于评价土壤质量,指示土壤生态系统变化状况[13-14]。韩桂琪等[15]通过室内培养试验发现重金属Cd、Zn、Cu和Pb复合污染对微生物生物量的影响与其浓度有关,在较低浓度时刺激微生物生物量的增加,而高浓度时则表现为抑制;赵辉等[16]通过以菜地土为盆栽试验的供试土壤进行试验表明,低浓度Cd(≤2.0 mg·kg-1),可增加土壤中微生物生物量碳含量;而王秀丽等[17]研究则表明,铜锌冶炼厂附近的水稻土中土壤微生物生物量碳、氮含量随Cd胁迫浓度的增加而逐渐减少。由此可以得出,土壤重金属污染对土壤微生物生物量的影响主要与重金属的含量有关。在本研究中Cd胁迫对湖南红壤性水稻土土壤微生物生物量碳、氮含量影响的变化趋势基本相同,随着Cd胁迫浓度的增加,与对照相比微生物生物量碳、氮含量均呈先增加后减少的趋势,这与曾路生等[18]研究结果基本一致。由表 3可知,微生物生物量碳含量主要是外源Cd的直接作用的结果,这可能是因为Cd是土壤微量元素的一种,低浓度时可以刺激土壤微生物的生长发育和繁殖[19],加强微生物活动,在一定程度下增加土壤微生物生物量碳含量,而随着Cd胁迫浓度的增加,Cd的毒害作用大于刺激作用,进而抑制了土壤微生物的生长和繁殖,影响微生物种群的生存能力或竞争能力,导致微生物生物量碳含量降低。从表 3可得,微生物生物量氮含量变化主要是外源Cd的直接作用和间接作用的结果,其中外源Cd的间接作用占主导因素。外源Cd通过影响土壤微生物和土壤酶活性间接导致了土壤微生物生物量氮含量先增大后减小。
3.2 Cd胁迫对土壤酶的影响土壤酶主要源于土壤微生物的分泌,是土壤结构中的重要组成部分[20]。在本研究中,随着外源Cd胁迫浓度的增加,脱氢酶、过氧化氢酶和脲酶的活性逐渐降低,且与外源Cd胁迫浓度表现出极显著的负相关,通过通径分析可知,外源Cd对过氧化氢酶和脱氢酶活性的直接抑制作用(-1.008,-1.048)大于间接促进作用(0.127,0.098);外源Cd对脲酶活性的直接抑制作用(-0.161)和间接抑制作用(-0.587)均造成了土壤脲酶活性下降;而外源Cd对蔗糖酶的直接促进作用(0.675)小于间接抑制作用(-1.212)。外源Cd抑制脱氢酶、过氧化氢酶和脲酶活性机理主要是因为Cd2+可以与酶分子中的活性部位-巯基和含咪唑的配位体等结合,形成比较稳定的络合物,从而与底物发生竞争作用,抑制酶活性;其次是由于重金属污染土壤微生物的生存环境,抑制了土壤微生物的生长和繁殖,从而减少了体内酶的分泌和合成,最后导致土壤酶活性下降[21];而蔗糖酶活性随着外源Cd胁迫浓度的增加表现出先下降再上升后下降的趋势,这与吴丹等[22]研究结果相似,因为Cd对蔗糖酶活性具有刺激作用,Cd的加入可以促进酶的活性中心与底物间的配位结合,保持酶分子的专性结构,同时改变了酶催化反应的平衡条件,增加了蔗糖酶活性,而后随着Cd胁迫浓度的增加,Cd占据了酶分子的活性中心,或与酶分子的羧基、巯基和氨基等相结合,导致酶活性降低[23]。
3.3 微生物生物量与土壤酶活性的相互作用土壤酶主要来源于土壤微生物,而土壤酶活性与土壤微生物的数量、生物量、多样性以及土壤动物的数量呈显著或极显著正相关[24]。通径分析表明,Cd胁迫对各个微生物学指标的影响是相互的,Cd胁迫对微生物生物量氮、脲酶及蔗糖酶活性的影响除了其本身的直接作用外,主要还是通过Cd胁迫对其他微生物学指标的影响来间接影响它们的活性,其间接作用大于直接作用;对于微生物生物量碳、过氧化氢酶及脱氢酶活性而言,Cd对其活性的影响是直接的,其中对微生物生物量碳的直接作用最大(-1.110)。在本研究中,土壤中各微生物学指标(微生物生物量碳、氮、过氧化氢酶、脲酶和蔗糖酶)都可衡量土壤重金属污染程度,其中Cd胁迫与脱氢酶的相关系数最大(r=-0.952**)。因此,用脱氢酶活性衡量重金属污染程度更为准确,可作为湖南红壤性水稻土Cd污染土壤质量评价的灵敏指标。
4 结论(1)对湖南红壤性水稻土进行室内培养试验可知,土壤微生物量和酶活性随外源Cd胁迫浓度的变化而相应变化,微生物量和蔗糖酶活性随外源Cd胁迫浓度的增加先增加后减少,而过氧化氢酶、脱氢酶和脲酶活性则随着Cd胁迫浓度的增加而显著降低。
(2)通径分析表明土壤微生物生物量碳、氮、过氧化氢酶、脲酶和脱氢酶与Cd胁迫浓度存在极显著(P < 0.01)的负相关,而蔗糖酶与Cd胁迫浓度存在极显著(P < 0.01)的正相关;它们均可作为衡量土壤重金属污染程度的敏感指标,其中脱氢酶与Cd胁迫浓度的相关性最大,能够更加准确地衡量湖南红壤性水稻土Cd污染程度;与微生物生物量碳的直接通径系数最大,与脲酶的直接通径系数最小。
| [1] |
李志博, 骆永明, 宋静, 等. 基于稻米摄入风险的稻田土壤镉临界值研究:个案研究[J]. 土壤学报, 2008, 45(1): 76-81. LI Zhi-bo, LUO Yong-ming, SONG Jing, et al. Critical values for Cd in paddy field based on Cd risk of rice consumption:A case study[J]. Acta Pedologica Sinica, 2008, 45(1): 76-81. DOI:10.3321/j.issn:0564-3929.2008.01.010 |
| [2] |
高峰. 耕地重金属污染修复之困[J]. 中国土地, 2014(2): 14-15. GAO Feng. Heavy metal pollution in arable land[J]. China Land, 2014(2): 14-15. DOI:10.3969/j.issn.1002-9729.2014.02.004 |
| [3] |
赵彤, 蒋跃利, 闫浩, 等. 黄土丘陵区不同坡向对土壤微生物生物量和可溶性有机碳的影响[J]. 环境科学, 2013, 34(8): 3223-3230. ZHAO Tong, JIANG Yue-li, YAN Hao, et al. Effects of different aspect on soil microbial biomass and dissolved organic carbon of the loess hilly area[J]. Environmental Science, 2013, 34(8): 3223-3230. |
| [4] |
Shu J, Chen Q, Wang Y, et al. Path analysis of soil enzyme activity and soil chemical-physical properties of pinusarmandii plantation[J]. Journal of Northeast Forestry University, 2014(a): 88-92. |
| [5] |
张倩.若尔盖铀矿区土壤的微生物群落分布及对外源铀的响应[D].绵阳: 西南科技大学, 2016. ZHANG Qian. Investigation on soil microorganism community distribution of uranium mine in Ruoergai Area and response to exogenous uranium pollution stress[D]. Mianyang: Southwest University of Science and Technology, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10619-1016113240.htm |
| [6] |
张文影.采煤复垦区土壤酶活性特征及重金属污染评价[D].合肥: 安徽理工大学, 2014. ZHANG Wen-ying. Study on characteristics of the soil enzyme activity and evaluation of the heavy metal pollution in reclaimed soil of coal mine[D]. Hefei: Anhui University of Science and Technology, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2696908 |
| [7] |
段学军, 闵航. Cd胁迫下稻田土壤生物活性与酶活性综合研究[J]. 农业环境科学学报, 2004, 23(3): 422-427. DUAN Xue-jun, MIN Hang. Effects of Cd on the biological activities and the enzyme activities in submerged paddy soil[J]. Journal of AgroEnvironment Science, 2004, 23(3): 422-427. DOI:10.3321/j.issn:1672-2043.2004.03.002 |
| [8] |
罗小玲, 郭庆荣, 谢志宜, 等. 珠江三角洲地区典型农村土壤重金属污染现状分析[J]. 生态环境学报, 2014, 23(3): 485-489. LUO Xiao-ling, GUO Qing-rong, XIE Zhi-yi, et al. Study on heavy metal pollution in typical rural soils in Pearl River Delta Area[J]. Ecology and Environmental Sciences, 2014, 23(3): 485-489. DOI:10.3969/j.issn.1674-5906.2014.03.018 |
| [9] |
易秀, 郭婷婷, 谷晓静. 陕西省泾惠渠灌区土壤重金属污染累积趋势预测[J]. 生态环境学报, 2010, 19(9): 2209-2213. YI Xiu, GUO Ting-ting, GU Xiao-jing. The prediction of accumulation trend for soil pollution of heavy metals in Jinghuiqu irrigation district of Shaanxi[J]. Ecology and Environment, 2010, 19(9): 2209-2213. DOI:10.3969/j.issn.1674-5906.2010.09.033 |
| [10] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000, 150-152. LU Ru-kun. Soil agricultural chemical analysis method[M]. Beijing: China Agricultural Science and Technology Press, 2000, 150-152. |
| [11] |
关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986, 28-35. GUAN Song-yin. Soil enzyme and its research method[M]. Beijing: Agricultural Press, 1986, 28-35. |
| [12] |
唐启义. DPS数据处理系统[M]. 北京: 科学出版社, 2007, 703-711. TANG Qi-yi. DPS data processing system[M]. Beijing: Science Press, 2007, 703-711. |
| [13] |
Wang Q, Zhou D, Long C, et al. Indication of soil heavy metal pollution with earthworms and soil microbial biomass carbon in the vicinity of an abandoned copper mine in Eastern Nanjing, China[J]. European Journal of Soil Biology, 2009, 45(3): 229-234. DOI:10.1016/j.ejsobi.2008.12.002 |
| [14] |
盛浩, 周萍, 袁红, 等. 亚热带不同稻田土壤微生物生物量碳的剖面分布特征[J]. 环境科学, 2013, 34(4): 1576-1582. SHENG Hao, ZHOU Ping, YUAN Hong, et al. Profile of soil microbial biomass carbon in different types of subtropical paddy soils[J]. Environmental Science, 2013, 34(4): 1576-1582. |
| [15] |
韩桂琪, 王彬, 徐卫红, 等. 重金属Cd、Zn、Cu和Pb复合污染对土壤生物活性的影响[J]. 中国生态农业学报, 2012, 20(9): 1236-1242. HAN Gui-qi, WANG Bin, XU Wei-hong, et al. Effects of heavy metal compound contamination of Cd, Zn, Cu and Pb on soil biological activity[J]. Chinese Journal of Eco-Agriculture, 2012, 20(9): 1236-1242. |
| [16] |
赵辉, 王琳琳, 宋宁宁, 等. 设施土壤中微生物生物量碳和脱氢酶活性对镉与邻苯二甲酸酯复合污染的响应[J]. 华北农学报, 2017, 32(2): 232-238. ZHAO Hui, WANG Lin-lin, SONG Ning-ning, et al. Effects of soil microbial biomass carbon and dehydrogenase activity in greenhouse soil to Cd-PAEs[J]. Acta Agriculturae Boreali-Sinica, 2017, 32(2): 232-238. |
| [17] |
王秀丽, 徐建民, 姚槐应, 等. 重金属铜、锌、镉、铅复合污染对土壤环境微生物群落的影响[J]. 环境科学学报, 2003, 23(1): 22-27. WANG Xiu-li, XU Jian -min, YAO Huai-ying, et al. Effects of Cu, Zn, Cd and Pb compound contamination on soil microbial community[J]. Acta Scientiae Circumstantiae, 2003, 23(1): 22-27. DOI:10.3321/j.issn:0253-2468.2003.01.005 |
| [18] |
曾路生, 廖敏, 黄昌勇, 等. 镉污染对水稻土微生物量、酶活性及水稻生理指标的影响[J]. 应用生态学报, 2005, 16(11): 2162-2167. ZENG Lu -sheng, LIAO Min, HUANG Chang-yong, et al. Effects of Cd contamination on paddy soil microbial biomass and enzyme activities and rice physiological indices[J]. Chinese Journal of Applied Ecology, 2005, 16(11): 2162-2167. DOI:10.3321/j.issn:1001-9332.2005.11.031 |
| [19] |
孔丝纺, 姚兴成, 张江勇, 等. 生物质炭的特性及其应用的研究进展[J]. 生态环境学报, 2015, 24(4): 716-723. KONG Si-fang, YAO Xing-cheng, ZHANG Jiang-yong, et al. Review of characteristics of biochar and research progress of its applications[J]. Ecology and Environmental Sciences, 2015, 24(4): 716-723. |
| [20] |
陈海燕.镉污染土壤的生物修复: 热化学研究耐镉菌株抗性机制[D].武汉: 中国地质大学, 2009. CHEN Hai-yan. Bio-remediation of Cd-contaminated soil: Thermos chemical study of the mechanism of Cd-resistant microbes[D]. Wuhan: China University of Geosciences, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10491-2009153682.htm |
| [21] |
Chen C, Chen D, Lam S K. Simulation of nitrous oxide emission and mineralized nitrogen under different straw retention conditions using a gentrification-decomposition model[J]. Clean-soil, Air, Water, 2015, 43(4): 577-583. DOI:10.1002/clen.v43.4 |
| [22] |
吴丹, 王友保, 李伟, 等. 镉胁迫对吊兰生长与土壤酶活性的影响[J]. 环境化学, 2012, 31(10): 1562-1568. WU Dan, WANG You-bao, LI Wei, et al. Effects of cadmium exposure on Chlorophytum comosum growth and soil enzyme activities[J]. Environmental Chemistry, 2012, 31(10): 1562-1568. |
| [23] |
和文祥, 朱铭羲, 张一平. 土壤酶与重金属关系的研究现状[J]. 土壤与环境, 2000(2): 139-142. HE Wen-xiang, ZHU Ming-xi, ZHANG Yi-ping. Recent advance in relationship between soil enzymes and heavy metals[J]. Soil and Environmental Sciences, 2000(2): 139-142. DOI:10.3969/j.issn.1674-5906.2000.02.015 |
| [24] |
Yang G, Liang M, Miao C Y, et al. Spatial characteristics of soil enzyme activities and microbial community structure under different land uses in Chongming Island, China:Geostatistical modelling and PCR-RAPD method[J]. Science of the Total Environment, 2010, 408(16): 3251-3260. DOI:10.1016/j.scitotenv.2010.04.007 |
 2018, Vol. 37
2018, Vol. 37