2. 天津市机动车排污监控中心, 天津 300391
2. Monitoring Center for Vehicle Emission, Tianjin 300391, China
全氟化合物(perfluoroalkyl substances,PFASs)是一类人工合成的新型有机污染物,因具有良好的物理化学性质而被广泛应用于生产和生活的各个领域中。全氟烷基酸类(perfluoroalkyl acids, PFAAs),即全氟烷基羧酸(perfluorocarboxylic acids,PFCAs)和全氟烷基磺酸(perfluoroalkyl sulfonates,PFSAs)是最常见的离子型PFASs,广泛存在于大气[1-2]、水体[3-4]、土壤[5]、沉积物[6]、生物体[7]甚至人体[8]中。这类物质具有环境持久性,其中一些长链PFAAs还具有生物蓄积性,并且毒理学研究表明,其具有细胞毒性[9]、肝脏毒性[10]、生殖/发育毒性[11]等。2009年,斯德哥尔摩公约将全氟辛烷磺酸(perfluorooctane sulfonic acid,PFOS)列为持久性有机污染物,受限使用;全氟辛酸(perfluorooctanoic acid,PFOA)也被美国及欧盟列为危险物质。近年来,短链PFASs(PFCAs C < 7;PFSAs C < 6)作为长链PFASs的替代物而被广泛应用[12]。与长链PFASs相比,短链PFASs虽然具有较低的动物富集性和毒性[13],但在环境介质中具有更强的迁移能力,且可能具有植物富集能力和潜在毒性。
PFAAs可能以多种途径进入到土壤,包括大气的干湿沉降、地表径流以及固体废弃物的堆放及施用。很多国家都有城市污水处理厂剩余污泥回田作为肥料的做法。我国目前产生的市政污泥约有16%用于回田,69%用于填埋、焚烧或生产建材,仍有15%未能得到妥善处理[14]。研究表明,PFAAs在污水处理工艺中不但不能被有效去除,而且还由于前体物质的降解[15],负荷增加,PFAAs主要在污泥中富集,污泥的不当处置或直接应用将形成土壤中PFAAs的重要来源[16]。目前,PFAAs在世界范围内的土壤中都被检出,浓度在几个ng·g-1到几百个ng·g-1的水平,总体浓度不高,一个重要的原因就是PFAAs溶解度较大,移动性较强。吸附和淋溶是影响全氟化合物在土壤-水体系中迁移和生物有效性的两个重要过程。能够被强烈吸附的PFAAs容易滞留在土壤表面,吸附小的PFAAs容易通过淋溶作用下迁移到地下水及其他水体,造成水环境的污染,而且被植物吸收的生物有效性也增加[17]。国内外学者对PFASs在水环境中分布进行了深入的研究,而对于其在土壤中的环境行为研究却比较缺乏,且多是对PFOS和PFOA两种最受关注的目标物进行研究。本文分别采用批量平衡法和土柱实验研究了不同链长的典型PFAAs在两种土壤的吸附解吸和淋溶行为,研究结果可以为全面评价不同碳链长度PFAAs在土壤中环境行为及其对地下水生态风险等提供科学依据。
1 材料与方法 1.1 仪器与设备Waters OA_SPE Waters Xevo TQ_S超高效液相色谱质谱联用仪(Waters公司,美国);恒温振荡器(金坛科析仪器公司);超声波清洗器(昆山超声仪器公司);循环水式多用真空泵(郑州长城科工贸有限公司)。
1.2 试剂与材料标准品:全氟丁烷羧酸(PFBA,99.5%)、全氟丁烷磺酸(PFBS,98%)和全氟己烷磺酸(PFHxS,98%)购于美国Sigma-Aldrich公司;全氟戊烷羧酸(PFPeA,98%)购于日本TCI公司;全氟己烷羧酸(PFHxA,98%)、全氟庚烷羧酸(PFHpA,98%)购自美国Matrix Scientific公司;全氟辛烷羧酸(PFOA,98%)、全氟辛烷磺酸(PFOS,97%)购于法国Strem Chemicals公司。4种内标物质(13C4-PFBA、13C4 - PFHxS、13C4-PFOA、13C4-PFOS)均购于加拿大Wellington Laboratories,纯度均大于99%。
甲醇:色谱纯,CNW,德国;氯化钠:分析纯,99.5%,天大科威;醋酸铵:色谱纯,98%,CNW,德国;氯化钙:分析纯,天大科威;腐植酸:Sigma-Aldrich,美国;水:纯净水,杭州娃哈哈集团有限公司;15、50 mL聚丙烯离心管:CNW,德国。
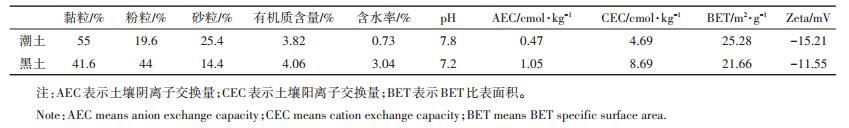
本文采用两种北方典型土壤(黑土和潮土)为供试土壤,分别采集于辽宁沈阳和天津南开大学花园,采样深度为0~20 cm。将土壤剔除石块、植物残体等杂物后,经自然风干,过10目网筛,装入密封袋-20 ℃保存备用。部分土壤过100目筛,用于吸附解吸实验。土壤理化性质如表 1所示。
|
|
表 1 供试土壤的基本理化性质 Table 1 Physical and chemical properties of the tested soil |
实验所用的土柱淋溶装置为玻璃材质的圆柱管(内径5 cm×高60 cm)。玻璃柱的外壁标有刻度,用来控制土柱装填条件的一致性。
1.2 实验方法 1.2.1 吸附解吸实验吸附动力学实验:称取一系列1.0 g土壤样品加入50 mL聚丙烯离心管中,加入0.5 mg·L-1的PFAAs单标溶液和20 mL 0.02 mol·L-1的NaCl背景液,于25± 0.5 ℃下恒温振荡(200 r·min-1),分别在0、0.25、0.5、1、3、6、12、24、48 h取样,以4000 r·min-1离心10 min,分离上清液并过0.45 μm水相滤膜,添加5 ng混合内标(13C4 - PFBA、13C4-PFOA、13C4-PFHxS、13C4 - PFOS)后,测定PFAAs浓度。根据质量平衡原理,采用差减法得到土壤吸附量。同时做不加土壤的离心管作空白对照实验,结果显示吸附过程没有观察到PFAAs的损失。
吸附等温线实验操作同吸附动力学,实验PFAAs浓度梯度依次为0.050、0.125、0.25、0.40、0.50、0.60、0.75、1.0 mg·L-1,平衡时间为48 h。
解吸动力学实验:首先按照上述步骤进行吸附实验,达到吸附稳态后,离心分离上清液,全部取出上清液后,然后补加相同体积不含PFAAs的背景溶液进行解吸实验,在不同时间间隔取样,离心取上清液测定PFAAs浓度,直到水相中PFAAs的浓度不再发生明显变化。
解吸等温线实验操作同解吸动力学实验,PFAAs初始浓度梯度为:0.050、0.125、0.25、0.40、0.50、0.60、0.75、1.0 mg·L-1,取样时间为48 h。
1.2.2 淋溶实验土壤淋溶试验依据OECD[18]标准方法进行。在玻璃柱底部均匀铺撒厚度约为2 cm的玻璃纤维,再装填2 cm石英砂,将600 g经高温蒸汽灭菌(121 ℃,30 min)的土样缓慢分批装柱。装填后,土柱约为32 cm。土柱上方铺撒2 cm石英砂,最上方盖一张抽提后的滤纸。用0.02 mol·L-1 NaCl溶液模拟雨水淋溶,直到淋出液没有目标物检出,滤干装置内水柱。在土柱顶端加入1 mL 1000 mg·L-1的目标PFAAs标准使用液,静置24 h后开始用0.02 mol·L-1 NaCl溶液模拟雨水淋溶,直到淋出液没有目标物检出。
溶解性有机质(dissolved organic matter,DOM)对土壤中PFAAs的淋溶行为影响研究,实验装置、方法同上。将一定量腐植酸与0.1%NaOH溶液1:5(m/v)混合,磁力搅拌器上搅拌24 h,静置0.5 h,取上层液体过0.45 μm滤膜,再将提取液过0.22 μm滤膜,得到DOM储备液溶液。DOM溶液于4 ℃冰箱保存备用。使用前将DOM储备液按需稀释至设定浓度。DOM溶液的有机碳含量采用TOC分析仪(SHIMADZU TOC-Vcph,日本岛津)测定。应用含不同浓度(5、20 mg C·L-1)的DOM与0.02 mol·L-1 NaCl混合溶液进行淋溶。
每淋出25 mL滤液(1个孔体积)作为1个采样点,每个柱子收集20个样品,共500 mL淋溶液。取100 μL淋出液加入等体积含2 ng混合内标溶液,充分混匀后过0.22 μm滤膜到自动进样瓶中待测。
采样结束后,将玻璃柱中土柱取出,每4 cm分为一段,作为一个土壤样品。土壤样品冷冻干燥后,称取0.50 g样品于15 mL离心管中,分别添加混合内标10 ng,用甲醇连续提取三次(每次分别为2.5、1.5、1.0 mL),vortex使得甲醇和土壤充分混合后,在200 r· min-1振荡提取2 h,然后在25 ℃条件下超声20 min,再在4000 r·min-1下离心10 min,取上清液转移至新的离心管中,合并三次提取液,氮吹定容至1 mL,在15 000 r·min-1高速离心5 min,过0.22 μm膜待测。
1.3 测定方法采用Waters OA_SPE Waters Xevo TQ_S超高效液相色谱质谱联用仪进行检测。
液相条件:色谱柱为Waters Acquity UPLC C18色谱柱(1.7 μm,2.1×50 mm),流动相为含2.5 mmol·L-1醋酸铵的甲醇和水,柱温为50 ℃;进样量5 μL。流动相梯度洗脱程序为:10%的甲醇在0.8 min内升高到40%,经1.5 min到45%,5 min到85%,7 min达到100%,9 min回到初始比例。控制5.6~7 min流速为0.55 mL·min-1,其余时间流速为0.4 mL·min-1。
质谱条件:应用电喷雾离子源,选择负离子模式多反应监测(MRM)模式进行定量检测。离子源温度150 ℃,脱溶剂气体流速800 L · h-1,脱溶剂温度350 ℃,碰撞气流速0.15 mL·min-1。具体质谱参数参见Zhao等[19]。
1.4 数据分析与质量控制 1.4.1 数据分析吸附解吸实验:分别采用线性吸附等温式(公式1)和Freundlich吸附等温式(公式2)对实验数据进行拟合。
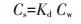
|
(1) |
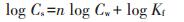
|
(2) |
式中:Cs和Cw分别表示平衡时土壤对PFAAs的吸附量和溶液中PFAAs的浓度;Kd表示吸附平衡常数;Kf为Freundlich系数,表征吸附剂吸附容量的大小;n为Freundlich指数,表征吸附的非线性程度,当n=1时,等温线为线性。
采用Origin9.0和Excel进行数据统计与分析。
1.4.2 质量控制方法回收率:设置土壤样品空白实验、前加标实验(样品前处理前加入10 ng物质)和后加标实验(前处理完成后加入10 ng目标物质),分别做3个平行。8种PFAAs的回收率范围为95%~114%,相对标准偏差为2.0%~4.6%。
标准曲线:用甲醇配制浓度范围为0.10~100 μg· L-1的混合标准工作曲线,分别用13C4-PFBA、13C4 - PFOA和13C4-PFHxS、13C4-PFOS作为PFCAs和PFSAs的内标来对标线进行校正,线性相关系数大于0.99。
仪器检出限(limit of detection,LOD)和仪器定量限(limit of quantification,LOQ)分别定义为3倍和10倍信噪比的峰高所对应的浓度水平。8种PFAAs的LOD和LOQ范围分别为3.2~13、11~43 ng·L-1。
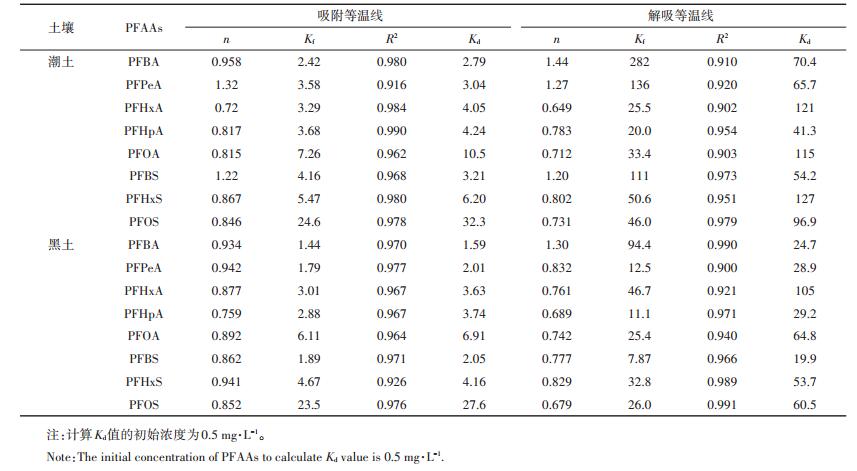
2 结果与讨论 2.1 PFAAs在两种土壤中的吸附 2.1.1 吸附动力学曲线PFAAs在两种土壤中的吸附均表现出“二阶段”特征(图 1)。在0~1 h,潮土和黑土对PFAAs的吸附速率快,吸附量快速增加。满1 h时,除PFPeA外,潮土对PFAAs的吸附量达到48 h吸附量的70%以上;在黑土中,除PFHpA和PFBS外,其余PFAAs的吸附量也达到48 h吸附量的70%以上。包怡梦等[20]研究中受试土壤对PFOA、PFOS等长链PFAAs的吸附在1 h达到平衡。随着吸附时间延长,吸附量的增加速率明显变缓,潮土对8种PFAAs的吸附在12 h达到平衡,对于黑土,平衡时间为24 h。为保证吸附完全达到平衡,本实验选取平衡时间为48 h。吸附达到平衡时,潮土对PFAAs吸附量大于黑土。潮土和黑土对PFOS的吸附量最大,分别为59%和55%;其次为PFOA,吸附量分别为33%和31%;对PFBA、PFPeA、PFBS、PFHpA的吸附量均为10%左右。
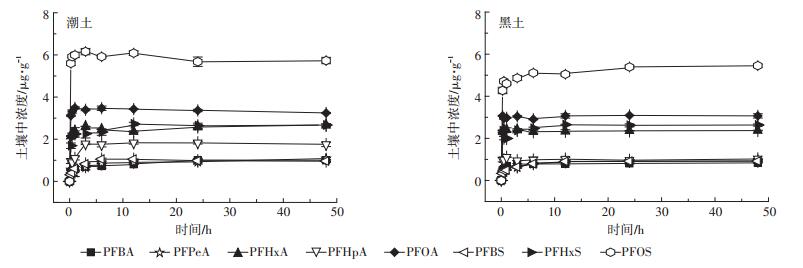
|
图 1 PFAAs在两种土壤中的吸附动力学曲线 Figure 1 Sorption kinetics of PFAAs in two soils |
两种土壤对PFAAs的吸附量随着PFAAs溶液浓度的增加而增加(图 2)。将吸附等温线数据用线性吸附等温方程和Freundlich吸附等温方程分别进行拟合,由拟合决定系数R2可知,Freundlich方程对8种PFAAs在两种土壤吸附等温线的拟合效果较好,R2大于0.916(表 2)。Freundlich系数Kf表征吸附剂吸附容量的大小,Kf值越大土壤对PFAAs的吸附能力越强。由表 2可知,潮土对8种PFAAs的吸附程度顺序为PFOS>PFOA>PFHxS>PFBS>PFHPA>PFPeA>PFHxA> PFBA。随着碳链增长,PFCAs和PFSAs的Kf值呈现出增加的趋势,且对于相同碳链长度的PFCAs和PFSAs,潮土对PFSAs的吸附能力更强。黑土也表现出与潮土同样的吸附规律,说明碳氟链的长度与官能团均为影响土壤对PFAAs吸附作用的重要因素。这是因为随着碳链的增长,CF2基团的增加,PFAAs的疏水性增加;磺酸基团(-SO3H)的分子量大,相同碳原子数的PFSAs比PFCAs疏水性强。Freundlich指数n都在0.72~1.32之间,即曲线拟合为非线性,表明土壤对PFAAs的吸附作用除疏水作用外,还有静电吸附、氢键作用等其他特殊作用机制。Zhang等[21]研究发现,PFCAs(C5~C15)和PFSAs(C4、C6、C8)在污泥中的吸附也遵循随着碳链增加吸附量增加且同碳原子数磺酸吸附量大于羧酸的规律,并且疏水作用和静电作用力是主要的作用机制。
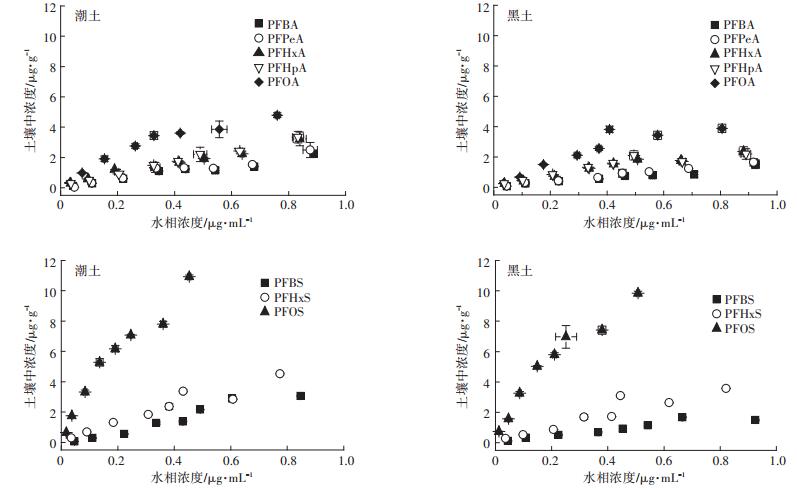
|
图 2 PFAAs在两种土壤中的吸附等温线 Figure 2 Sorption isotherms of PFAAs in two soils |
|
|
表 2 PFAAs在两种土壤中的吸附和解吸Freundlich等温线参数 Table 2 The sorption and desorption Freundlich isotherm parameters of PFAAs in two soils |
有机碳含量是控制疏水性有机物吸附行为的主要因素。Wei等[22]发现PFOS在土壤中的吸附与土壤有机碳含量呈正相关。本文计算了浓度为0.5 mg·L-1的Kd值(表 2),潮土大于黑土。其原因为,本文使用的潮土的有机质含量(3.82%)较高,仅略低于黑土(4.06%),并且有机质含量也不是决定PFAAs吸附行为的唯一因素。由于同时具有疏水性和亲水性官能团,导致其具有独特的吸附性质。对于亲水性有机物而言,其在土壤上的吸附主要是分配作用和表面吸附,两种作用对于吸附机制的贡献与化合物和土壤性质有关。土壤的比表面积是控制表面吸附机制的重要因素[23],潮土含有较多的黏粒(表 1),具有更高的比表面积,提供了更多的吸附位点,因而吸附量较高。另外,溶解性有机质可与有机化合物相互作用形成配合物,增加其表观溶解度[24]。黑土的溶解性有机质含量较高,促进了PFAAs在水相的溶解,从而降低了吸附。Jeon等[25]的研究结果表明溶解性有机质可以减少黏土矿物对PFOA和PFOS的吸附,Yang等[26]也发现溶解性有机质的存在抑制了沉积物对PFOA的吸附。
2.2 PFAAs在两种土壤中的解吸 2.2.1 解吸动力学曲线PFAAs在潮土和黑土中解吸进行到24 h时基本达到平衡,本实验选取48 h为最终解吸时间。解吸达到平衡时,潮土中PFBA、PFPeA、PFBS、PFHpA的解吸量均能达到50%左右,其余PFAAs的解吸量小于25%;除PFHxA和PFHxS外,黑土对PFAAs的解吸量均低于潮土(图 3)。这可能是因为潮土有机质含量相对较低,而且在解吸液中,溶解性有机质的浓度也较低,发挥作用较小。有机质含量越高,土壤对PFAAs吸附滞留能力越强,吸附态的PFAAs越不容易被重新释放到水溶液中。实验室之前的研究也表明,土壤中芘的解吸率明显与土壤有机质含量有关,有机质含量越高,被吸附的芘越不容易发生解吸[27]。这表明控制吸附和控制解吸的微观结构并不一致,总的吸附量不能反映吸附态污染物的赋存状态。一般认为只有解吸到溶液中的污染物才具有生物有效性,可见解吸是控制污染物流动性与生物有效性的关键因素。
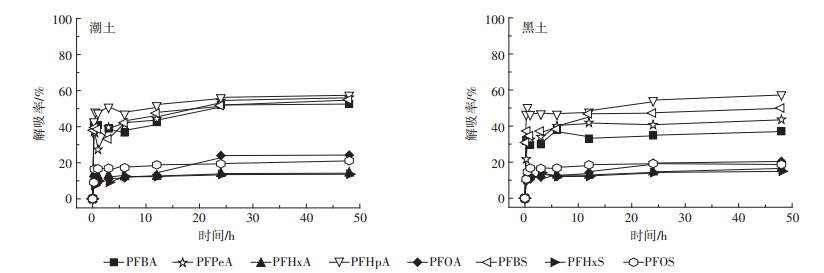
|
图 3 PFAAs在两种土壤中的解吸动力学曲线 Figure 3 Desorption kinetics of PFAAs in two soils |
同种类化合物间与其在不同土壤的解吸等温线存在一定的差异(图 4)。将解吸等温线数据用线性吸附等温方程和Freundlich吸附等温方程分别拟合的结果表明,与吸附过程相似,Freundlich方程对8种PFAAs在两种土壤解吸等温线的拟合效果相对较好,R2大于0.900(表 2)。采用Freundlich方程拟合得到的解吸等温线方程与吸附等温线方程存在差异,计算0.5 mg·L-1的Kd值,发现解吸的Kd值均显著大于吸附的Kd值,说明PFAAs在两种土壤的解吸都存在迟滞现象。对PFAAs在不同粒级沉积物的解吸研究表明,经过四次连续解吸,PFPeA、PFHpA、PFOA、PFBS、PFHxS的四次解吸总量为98.2%~74.2%,PFOS的解吸总量仅为18.2%,链长和官能团共同影响PFAAs在沉积物的解吸,碳链越长,解吸越难发生[23]。PFOS在腐植酸的吸附也具有解吸迟滞性[28],对于非离子型有机化合物,其解吸迟滞性是由吸附剂有机质的“硬度”和芳香度决定的,而吸附剂与溶液中离子间的静电作用力对离子型有机化合物的解吸迟滞起决定作用[29]。
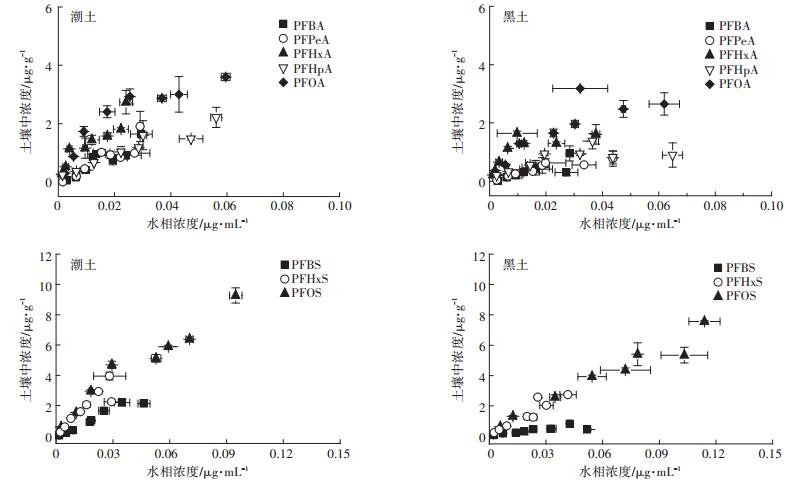
|
图 4 PFAAs在两种土壤中的解吸等温线 Figure 4 Desorption isotherms of PFAAs in two soils |
潮土、黑土淋溶实验中PFAAs的回收率分别为41.0%~86.9%、46.2%~97.3%,除PFHxA、PFHpA、PFBS外,其他PFAAs回收率均在60%以上。原因可能是:替代内标造成的定量误差;玻璃柱底部玻璃纤维吸附;土壤间隙水未测定。除PFOS外,其他PFAAs都能够淋溶进入水相,而PFOS则被强烈吸附到土壤中,仅有0.01%进入水相中。在两种土柱中,除PFOA、PFHxS、PFOS外,其余5种PFAAs在水相中的检出量占总量的89%以上。淋溶后PFOA和PFHxS在土柱中的分布随土壤深度的增加而增加,在底部28~32 cm处含量最高,而PFOS主要分布在0~16 cm土层,在4~8 cm处含量最高。
在潮土中,PFBA、PFPeA淋溶行为相似,表现为快速淋溶,在第9个采样点时淋溶液中目标物浓度达到最大,分别为10 305、7268 μg·L-1,其他PFAAs的相对淋溶曲线比PFBA和PFPeA要平缓(图 5)。对PFCAs和PFSAs均表现出碳链越长,淋溶液达到最大浓度时间越长,淋出量越小,即碳链越长越难以从土壤中淋溶出来,与解吸实验中碳链越长越难发生解吸的结论是一致的。Gellrich等[30]的研究结果也表明PFAAs的淋溶行为与链长密切相关:PFAAs的碳链越长,越容易被土柱中土壤吸附,越不易发生淋溶;含碳原子数 < 5的PFAAs表现为快速淋溶,随链长增加,淋出时间延长。
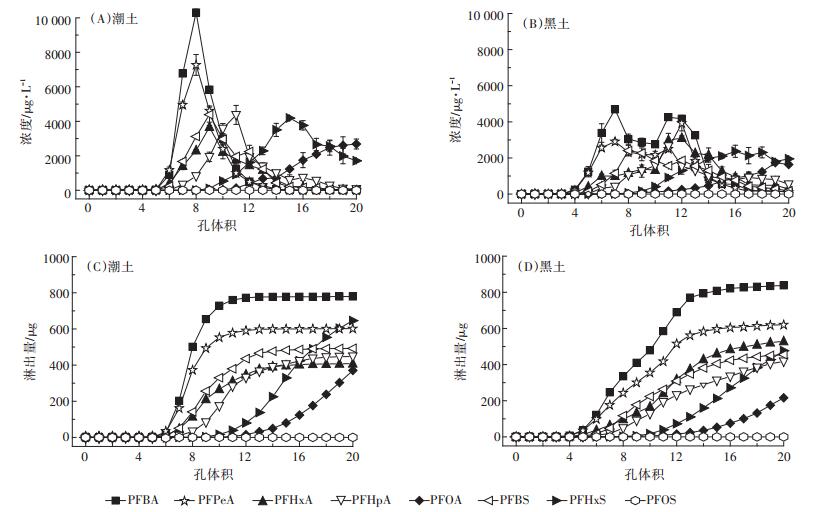
|
图 5 PFAAs在两种土壤中的相对淋溶曲线(A和B)和累积淋溶曲线(C和D) Figure 5 Relative leaching curves(A and B)and cumulative leaching curves(C and D)of PFAAs in two soils |
黑土中8种目标化合物的穿透曲线形状相较要平缓。吸附实验结果表明相同实验条件下,潮土对PFAAs的吸附能力强于黑土,且吸附态的PFAAs更容易被解吸,这是由于黑土中的有机质含量较高,土壤对PFAAs的保留能力相对较强。在黑土中,有的化合物的淋溶曲线出现了两个峰值,主要是由于黑土中溶解性有机质的作用,出现了PFAAs与溶解性有机质的共迁移过程;潮土中砂粒含量比黑土中丰富,溶解态的PFAAs易在水流作用下沿着大孔隙向下运动,流出土柱。
2.3.2 DOM对两种土壤中PFAAs淋溶行为的影响DOM的加入能够增加水溶性较大的短链PFAAs的总回收率(2.7%~50%),显著增加它们在两种土壤淋溶液中的浓度,且除PFHpA外,低浓度(5 mg C· L-1)DOM促进淋溶的效果更好。水体中的DOM可以起到中间载体的作用,能够吸附碳链较短的PFAAs,从而促进其在环境中的迁移[31]。DOM与农药的相互作用也能够促进其淋溶,增加农药的溶解度,DOM分子与除草剂二氯苯二甲脲对土壤吸附位点的竞争,能够增强其淋溶能力[32]。高浓度(20 mg C·L-1)DOM的加入促进潮土对PFOA、PFHxS、PFOS的吸附,增加量分别为111、180、35.6 μg;降低了PFOA、PFHxS的淋出量,降低量分别为76.4、293 μg。两种浓度DOM的存在也会显著增加黑土对PFHxS、PFOS的吸附量(129~165 μg),降低PFHxS的淋出量(低浓度时293 μg,高浓度时128 μg)。这可能是因为大量的DOM增加了土壤有机碳含量,增强了吸附质的疏水性,使得容易被吸附的PFOA、PFHxS和PFOS在土壤上的吸附含量增加,从而造成其流动性的减弱。
DOM的加入改变了两种土壤淋出液中PFAAs浓度的分布(图 6、图 7)。在潮土中,低浓度DOM存在下,不改变相对穿透曲线的形状,但是会增加PFPeA、PFHxA、PFBS的最大淋出浓度,降低了PFHpA、PFHxS的最大淋出浓度,对其他物质影响不大。高浓度DOM淋出液会改变相对淋溶曲线的形状和浓度,相对淋溶曲线出现双峰,且变化相对平缓,而且在实验条件下PFOA、PFHxS的淋出速度减慢,达到峰值实验延长;在黑土中,两种浓度DOM的存在使得原本浓度变化缓慢的相对穿透曲线变成峰值突出的快速变化曲线,尤其是高浓度DOM对短链PFAAs的相对曲线形状影响最大。引起上述变化的原因可能是低浓度DOM的增溶作用,使得淋出液中PFAAs浓度增加,高浓度DOM与PFAAs的共吸附,增加了土壤对PFAAs的保留能力,从而使淋出液中目标物浓度下降,改变了相对穿透曲线的形状。
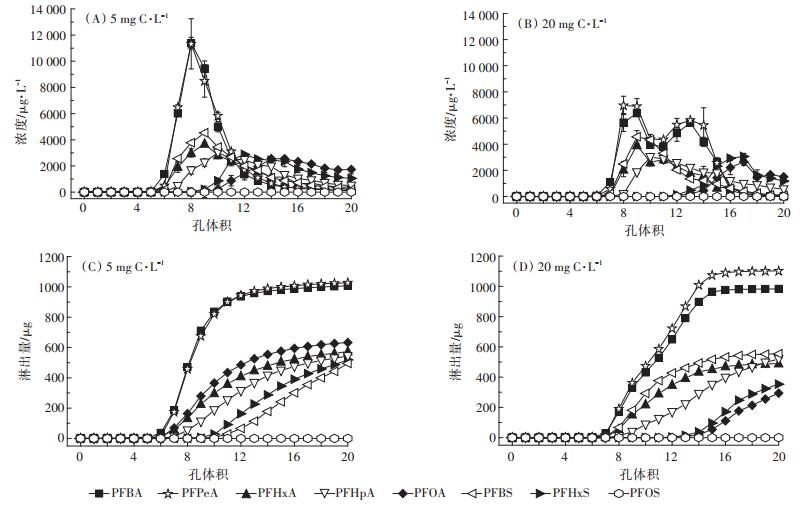
|
图 6 添加DOM后潮土中PFAAs的相对淋溶曲线(A和B)和累积淋溶曲线(C和D) Figure 6 Relative leaching curves (A and B)and cumulative leaching curves (C and D)of PFAAs in the fluvo-aquic soil in the presence of DOM |
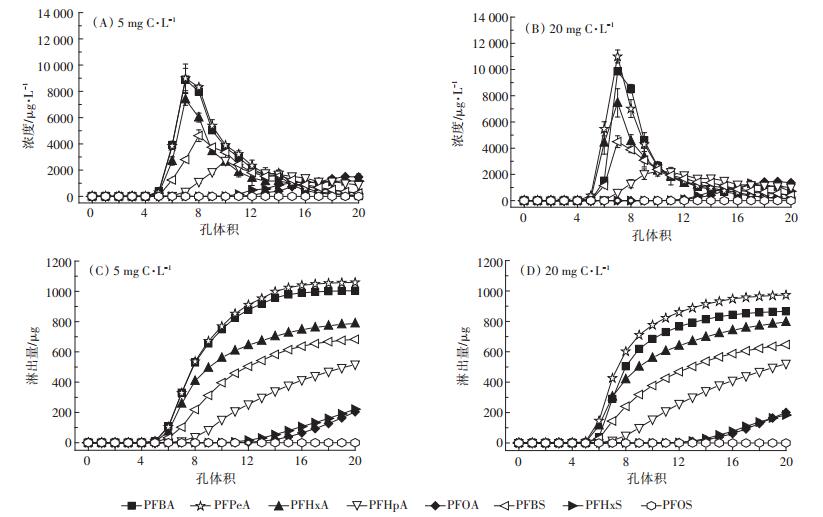
|
图 7 添加DOM后黑土中PFAAs的相对淋溶曲线(A和B)和累积淋溶曲线(C和D) Figure 7 Relative leaching curves(A and B)and cumulative leaching curves(C and D)of PFAAs in the black soil in the presence of DOM |
DOM的加入对不同PFAAs的淋溶行为影响不同,从累积淋出量来看,两种浓度(5、20 mg C·L-1)DOM存在时,PFAAs在两种土壤中的淋溶大致遵循具有相同官能团的PFAAs,碳链越长,累积淋出量越少的规律,与未加DOM一致。对于DOM对不同碳链长度PFAAs淋溶行为的影响及其影响机制,文献尚无报道,需要进一步研究。
3 结论(1)PFAAs在土壤中的吸附和解吸在24 h内均能达到平衡,解吸存在迟滞性。PFAAs在土壤中的吸附和解吸均符合Freundlich吸附等温线。土壤对PFSAs的吸附能力优于相同碳链长度的PFCAs,且长链全氟化合物更容易吸附到土壤上。潮土对PFAAs的吸附能力强于黑土,土壤有机质含量和粒径分布、溶解性有机质共同影响土壤对PFAAs的吸附能力。
(2)PFAAs在潮土和黑土土柱中的淋溶行为具有明显的差异,黑土土柱淋出液中PFAAs浓度变化小于潮土土柱。短链PFAAs不容易被土柱吸附,穿透淋出时间较短。随着碳链延长,土壤对PFAAs吸附量增加,淋出时间延长,累积淋出率降低。99%以上的PFOS被土柱吸附,不能够发生淋溶。DOM能够改变PFAAs的相对穿透曲线的形状,对短链PFAAs的淋溶具有促进作用,增加了对地下水的潜在威胁,同时抑制了PFOA、PFHxS在土层中向下迁移。
| [1] |
Butt C M, Berger U, Bossi R, et al. Levels and trends of poly-and perfluorinated compounds in the arctic environment[J]. Science of the Total Environment, 2010, 408(15): 2936-2965. DOI:10.1016/j.scitotenv.2010.03.015 |
| [2] |
Li J, Del Vento S, Schuster J, et al. Perfluorinated compounds in the Asian atmosphere[J]. Environmental Science & Technology, 2011, 45(17): 7241-7248. |
| [3] |
Becker A M, Gerstmann S, Frank H. Perfluorooctane surfactants in waste waters, the major source of river pollution[J]. Chemosphere, 2008, 72(1): 115-121. DOI:10.1016/j.chemosphere.2008.01.009 |
| [4] |
Yu N Y, Shi W, Zhang B B, et al. Occurrence of perfluoroalkyl acids including perfluorooctane sulfonate isomers in Huai River Basin and Taihu Lake in Jiangsu Province, China[J]. Environmental Science & Technology, 2013, 47(2): 710-717. |
| [5] |
Zhang H, Wen B, Hu X, et al. Determination of fluorotelomer alcohols and their degradation products in biosolids-amended soils and plants using ultra-high performance liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A, 2015, 1404(1): 72-80. |
| [6] |
Ahrens L, Yamashita N, Yeung L W Y, et al. Partitioning behavior of per-and polyfluoroalkyl compounds between pore water and sediment in two sediment cores from Tokyo Bay, Japan[J]. Environmental Science & Technology, 2009, 43(18): 6969-6975. |
| [7] |
Yoo H, Washington J W, Jenkins T M, et al. Quantitative determination of perfluorochemicals and fluorotelomer alcohols in plants from biosolid-amended fields using LC/MS/MS and GC/MS[J]. Environmental Science & Technology, 2011, 45(19): 7985-7990. |
| [8] |
Zhang T, Sun H, Lin Y, et al. Distribution of poly-and perfluoroalkyl substances in matched samples from pregnant women and carbon chain length related maternal transfer[J]. Environmental Science & Technology, 2013, 47(14): 7974-7981. |
| [9] |
Liu G, Zhang S, Yang K, et al. Toxicity of perfluorooctane sulfonate and perfluorooctanoic acid to Escherichia coli:Membrane disruption, oxidative stress, and DNA damage induced cell inactivation and/or death[J]. Environmental Pollution, 2016, 214: 806-815. DOI:10.1016/j.envpol.2016.04.089 |
| [10] |
Lau C, Anitole K, Hodes C, et al. Perfluoroalkyl acids:A review of monitoring and toxicological findings[J]. Toxicological Sciences, 2007, 99(2): 366-394. DOI:10.1093/toxsci/kfm128 |
| [11] |
Hirata-Koizumi M, Fujii S, Furukawa M, et al. Repeated dose and reproductive/developmental toxicity of perfluorooctadecanoic acid in rats[J]. Environmental Toxicology, 2012, 30(11): 63-79. |
| [12] |
Zhou Z, Liang Y, Shi Y L, et al. Occurrence and transport of perfluoroalkyl acids(PFAAs), including short-chain PFAAs in Tangxun Lake, China[J]. Environmental Science & Technology, 2013, 47(16): 9249-9257. |
| [13] |
Newsted J L, Beach S A, Gallagher S P, et al. Acute and chronic effects of perfluorobutane sulfonate(PFBS)on the mallard and northern bobwhite quail[J]. Archives of Environmental Contamination & Toxicology, 2008, 54(3): 535. |
| [14] |
Fu L, Du B, Wang F, et al. Organophosphate triesters and diester degradation products in municipal sludge from wastewater treatment plants in China:Spatial patterns and ecological implications[J]. Environmental Science & Technology, 2017, 51(23): 13614-13623. |
| [15] |
Sun H W, Zhang X Z, Wang L, et al. Perfluoroalkyl compounds in municipal WWTPs in Tianjin, China-concentrations, distribution and mass flow[J]. Environmental Science and Pollution Research, 2012, 19(5): 1405-1415. DOI:10.1007/s11356-011-0727-6 |
| [16] |
Wen B, Li L, Zhang H, et al. Field study on the uptake and translocation of perfluoroalkyl acids(PFAAs)by wheat(Triticum aestivum L.) grown in biosolids-amended soils[J]. Environmental Pollution, 2014, 184(1): 547-554. |
| [17] |
Blaine A C, Rich C D, Sedlacko E M, et al. Perfluoroalkyl acid uptake in lettuce(Lactuca sativa)and strawberry(Fragaria ananassa)irrigated with reclaimed water[J]. Environmental Science & Technology, 2014, 48(24): 14361-14368. |
| [18] |
OECD. OECD guidelines for the testing of chemicals[J]. Methods in Molecular Biology, 2004, 947: 37-56. |
| [19] |
Zhao L, Zhou M, Zhang T, et al. Polyfluorinated and perfluorinated chemicals in precipitation and runoff from cities across eastern and central China[J]. Archives of Environmental Contamination and Toxicology, 2013, 64(2): 198-207. DOI:10.1007/s00244-012-9832-x |
| [20] |
包怡梦, 赵璞君, 夏星辉, 等. 土壤对全氟化合物的吸附作用[J]. 中国科技论文, 2015, 10(3): 270-274. BAO Yi-meng, ZHAO Pu-jun, XIA Xing-hui, et al. Sorption of perfluoroalkyl surfactants on soils[J]. China Science Paper, 2015, 10(3): 270-274. DOI:10.3969/j.issn.2095-2783.2015.03.006 |
| [21] |
Zhang C J, Yan H, Li F, et al. Sorption of short-and long-chain perfluoroalkyl surfactants on sewage sludges[J]. Journal of Hazardous Materials, 2013, 260: 689-699. DOI:10.1016/j.jhazmat.2013.06.022 |
| [22] |
Wei C L, Song X, Wang Q, et al. Sorption kinetics, isotherms and mechanisms of PFOS on soils with different physicochemical properties[J]. Ecotoxicology and Environmental Safety, 2017, 142: 40-50. DOI:10.1016/j.ecoenv.2017.03.040 |
| [23] |
Zhao L X, Zhu L Y, Yang L P, et al. Distribution and desorption of perfluorinated compounds in fractionated sediments[J]. Chemosphere, 2012, 88(11): 1390-1397. DOI:10.1016/j.chemosphere.2012.05.062 |
| [24] |
Barriuso E, Baer U, Calvet R. Dissolved organic matter and adsorption-desorption of dimefuron, atrazine, and carbetamide by soils[J]. Journal of Environmental Quality, 1992, 21(3): 359-367. |
| [25] |
Jeon J, Kannan K, Lim B J, et al. Effects of salinity and organic matter on the partitioning of perfluoroalkyl acid(PFAs)to clay particles[J]. Journal Environmental Monitoring, 2011, 13(6): 1803-1810. DOI:10.1039/c0em00791a |
| [26] |
Yang K H, Lin Y C, Fang M D, et al. Sorption of perfluorooctanoic acid (PFOA)onto sediment in the presence of dissolved natural organics[J]. Separation Science & Technology, 2013, 48(10): 1473-1478. |
| [27] |
李俊国, 孙红文. 芘在土壤中的长期吸附和解吸行为[J]. 环境科学, 2006, 27(1): 165-170. LI Jun-guo, SUN Hong-wen. Sorption and desorption behavior of pyrene in soils[J]. Environmental Science, 2006, 27(1): 165-170. |
| [28] |
Jia C, You C, Pan G. Effect of temperature on the sorption and desorption of perfluorooctane sulfonate on humic acid[J]. Journal of Environmental Sciences, 2010, 22(3): 355-361. DOI:10.1016/S1001-0742(09)60115-7 |
| [29] |
Pignatello J, Lu Y, Leboeuf E, et al. Nonlinear and competitive sorption of apolar compounds in black carbon-free natural organic materials[J]. Journal of Environmental Quality, 2006, 35(4): 1049-1059. DOI:10.2134/jeq2005.0362 |
| [30] |
Gellrich V, Stahl T, Knepper T P. Behavior of perfluorinated compounds in soils during leaching experiments[J]. Chemosphere, 2012, 87(9): 1052-1056. DOI:10.1016/j.chemosphere.2012.02.011 |
| [31] |
郭杏妹, 吴宏海, 王伟伟, 等. 土壤溶解性有机质及其表面反应性的研究进展[J]. 生态科学, 2007, 26(1): 88-92. GUO Xing-mei, WU Hong-hai, WANG Wei-wei, et al. Advances on research of dissolved organic matter and its surface reactivity in soils[J]. Ecologic Science, 2007, 26(1): 88-92. |
| [32] |
Cox L, Velarde P, Cabrera A, et al. Dissolved organic carbon interactions with sorption and leaching of diuron in organic-amended soils[J]. European Journal of Soil Science, 2007, 58(3): 714-721. DOI:10.1111/ejs.2007.58.issue-3 |
 2018, Vol. 37
2018, Vol. 37