磷素是植物生长所必需的矿质营养元素,土壤磷素供给不足是制约植物生长发育的重要因素之一[1]。通常土壤中95%以上磷为无效磷,主要是矿物磷酸盐类,植物很难直接吸收利用。为了保证产量,每年施入大量磷肥,但施入的磷肥当季作物利用率仅为5%~25%[2],其余依然形成难溶磷,所以提高土壤磷素利用效率一直是科研工作者关注的课题。前人研究发现土壤中存在大量的溶磷微生物,能将难溶磷转化为有效磷。溶磷微生物可分为3大类群:溶磷细菌、溶磷放线菌和溶磷真菌。溶磷能力较强的细菌类群有:芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas),放线菌中链霉菌属(Streptomyces)溶磷能力较强,溶磷能力较强的真菌为青霉菌属(Penicillium)、曲霉菌属(Aspergillus)及AM菌根真菌等[3-7]。
应用溶磷微生物活化土壤磷素是一种安全、经济、有效的农业措施[8]。溶磷微生物通过酸化、螯合和交换反应等方式将土壤磷库中的磷由矿物态转化为可溶态[9],从而显著提高土壤中有效磷的含量,促进作物生长。Gulden等[10]报道施用拜莱青霉(Penicillium bilaii)使豌豆植株根毛量增长了22%并对豌豆生长有明显的促进作用。Vessey等[1]也发现在加拿大的两个地区用P. bilaii接种后,豌豆的根长增加40%,根重提高13%。用该菌株制成的解磷菌剂已在加拿大商品化生产[11]。菌肥不仅促进了作物生长,也对土壤微生物群落产生一定影响。有研究表明菌肥虽然未从本质上改变土壤细菌的种类和分布,但可对土壤细菌的多样性产生影响[12]。李朔[13]利用DEEG技术研究发现,施用细菌复合微生物肥料后增加了白菜田土壤中微生物的多样性。但目前,真菌生物菌肥的研究主要集中于其对土壤理化性质的影响、作物增产和品质改善方面,而对根际土壤细菌群落影响的研究报道较少。
本文以实验室前期从植物根际土壤中筛选出的2株溶磷真菌菌株为材料[14],研究其在土壤中的溶磷效果,然后经固体发酵后制成生物菌肥,研究其对玉米的促生作用,并测定其对玉米根际土壤细菌群落结构的影响,为高效溶磷菌肥的研发提供理论依据。
1 材料与方法 1.1 供试菌株草酸青霉(Penicillium oxalicum)NJDL-03和黑曲霉(Aspergillus niger)NJDL-12,溶磷细菌肠杆菌(Enterobacter sp.)San8[15],实验室保存。
1.2 培养基及试剂(1)PDA培养基:马铃薯200 g,葡萄糖20 g,H2O 1000 mL,琼脂20 g,pH值保持自然。
(2)NA培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂20 g,H2O 1000 mL,pH值7.0。
1.3 溶磷真菌土培实验供试土壤采自安徽省滁州市凤阳县安徽科技学院后山(石灰性土壤),其理化性质见表 1。
|
|
表 1 供试土壤的基本理化性质 Table 1 The soil basic physical and chemical properties |
菌株NJDL-03和NJDL-12于PDA平板上涂布培养,于28 ℃培养4 d后,用无菌生理盐水洗涤制成孢子悬浮液,血球计数板计数孢子数量,使孢子悬液浓度达到106个·mL-1;菌株Enterobacter sp. San8于NA培养液中培养2 d,离心,去除上清液,加入无菌生理盐水,制成San8菌悬液,涂布计数,San8数量达到108 CFU·mL-1。分别取NJDL-03、NJDL-12孢子悬液及San8菌悬液50 mL接种到装有250 g过20目筛的土壤中。菌株NJDL-03、NJDL-12及San8每个处理设置5个重复,并设置不接菌对照(CK),各处理置于28 ℃培养。分别采用钼锑抗比色法[16]和雷兹pHS- 3C pH计每周测定土壤速效磷含量和pH值。
1.4 溶磷真菌固体发酵设计两种发酵培养基。发酵培养基1配方为:玉米芯:麦麸粉:蚯蚓粪:稻壳:黄豆粉=8:2:8:1:1,发酵培养基2配方为:玉米芯:麦麸粉:稻壳:菜粕:黄豆粉=10: 2: 2: 4: 2,料水比均为1: 1。取于28 ℃培养4 d后的NJDL-03和NJDL-12种子液以15%接种量分别接种到装有250 g的2种已灭菌的固体发酵培养基的三角瓶中,每处理5个重复,用玻璃棒搅拌均匀并于28 ℃培养6 d,随后得到NJDL-03和NJDL-12生物菌肥。
1.5 溶磷真菌对玉米的促生效果盆栽实验供试玉米种子品种为京城12,设置CK、Substrate(成分是发酵菌肥的基质)、San8、NJDL-03、NJDL-12 5个处理,每盆装石灰性土壤5.0 kg,每个处理重复5盆。Substrate处理每盆加基质50 g,而San8处理每盆加入含50 mL San8菌悬液(菌数达到108 CFU·mL-1)的基质50 g,NJDL-03和NJDL-12处理每盆分别加入相应菌肥50 g。盆栽实验于2015年9月26日至11月19日在南京农业大学资环院温室二楼内进行,测定玉米植株生长状况、用SPAD502叶绿素仪测定玉米叶片叶绿素含量,每个处理随机挑取3盆,每盆6次,取其平均值。土壤蔗糖酶活性测定采用3,5-二硝基水杨酸法比色法;土壤脲酶活性测定采用苯酚钠-次氯酸钠比色法;土壤中性磷酸酶活性按S-NP活性测定试剂盒(苏州科铭生物技术有限公司)说明书步骤测定。
1.6 玉米根际土壤细菌群落高通量测序在玉米盆栽实验进行到45 d时,取玉米根际土壤0.5 g,使用强力土壤DNA提取试剂盒(MoBio,Power-Soil DNA Isolation Kit)提取土壤DNA,提取操作参照其说明书。将提取后的DNA送至北京诺禾致源生物信息有限公司进行高通量测序。土壤细菌MiSeq高通量测序参照Caporaso等[17]的方法,引物为563F(5′- AYT GGG YDT AAA GVG-3′)和802R(5′ -TAC NVG GGT ATC TAA TCC-3′)。PCR扩增体系为30 μL(2× Master Mix 15 μL;Forward Primer 1 μL;Reverse Primer 1 μL;Template DNA 0.5 μL;ddH2O 12.5 μL),PCR反应条件均为:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,进行27个循环;72 ℃延伸10 min。
1.7 数据处理与分析数据整理与计算用Microsoft Excel 2007软件,用SPSS16.0统计分析软件进行数据方差分析与差异显著性检验,显著性水平设定为P < 0.05。
2 结果 2.1 溶磷菌对土壤pH和速效磷含量变化的影响土培实验,不同处理土壤pH、速效磷随时间的变化结果见图 1。石灰性土壤的起始pH为7.84,CK的pH基本维持在7.80上下,而接种溶磷菌处理的土壤pH均有所下降,溶磷细菌San8处理的pH在第24 d下降到最低值7.62,之后回升维持在7.7左右,而NJDL- 03和NJDL-12处理均在第10 d就下降到最低值,分别为7.58和7.55,随后保持在7.60左右。可能是到后期,溶磷菌生长达到稳定,产酸能力亦趋于稳定,而石灰性土壤的缓冲性能对土壤pH进行了一定的调节。CK处理土壤速效磷基本没有变化,San8处理土壤速效磷达到最高时仅比CK增加了65.69%。随着培养时间延长,而溶磷真菌处理的土壤速效磷含量变化较大,较CK约提高5倍左右,较San8处理提高3倍左右,且NJDL-03处理土壤速效磷比NJDL-12略高。NJDL-03和NJDL-12处理在第10 d土壤速效磷达到最大值,分别为15.31、14.95 mg·kg-1,随后维持在13.50 mg·kg-1左右。分析原因,可能由于菌剂接入土壤中,溶解了部分难溶性的磷,使土壤中的速效磷含量有所上升,但随着时间的延长,土壤对磷素的吸附固定加强使速效磷含量减少,土壤磷素循环逐渐达到平衡,速效磷保持相对稳定。
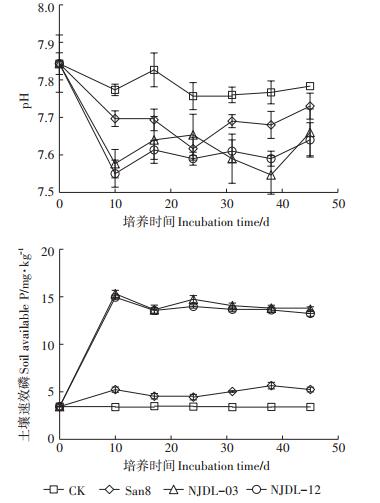
|
图 1 不同处理土壤pH、速效磷随时间的变化 Figure 1 The changes of pH and available phosphorus in soil with different treatments over time |
真菌NJDL-12(R2=0.97)和NJDL-03(R2=0.81)处理下土壤速效磷变化规律与pH负相关,而细菌San8处理下相关性不大(R2=0.32)。
2.2 固体发酵培养基配方比较NJDL-03和NJDL-12在发酵配方1中发酵孢子数分别达到了4.33×1010个·g-1和1.66×1010个·g-1,而在发酵配方2中发酵,孢子数分别为4.67×109个·g-1和1.33×108个·g-1(表 2)。可见固体发酵配方1更适合溶磷真菌的生长,可用作后续盆栽实验的真菌生物菌肥发酵培养基。
|
|
表 2 菌株NJDL-03和NJDL-12在两种固体发酵培养基中的孢子数量 Table 2 The number of spores of NJDL-03 and NJDL-12 in different fermentation media |
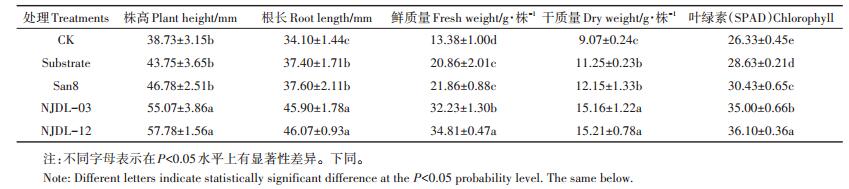
由表 3可见,溶磷细菌San8与Substrate处理对玉米生长的影响没有明显差异,而溶磷真菌NJDL-03、NJDL-12与Substrate处理相比,其间差异显著;真菌NJDL-12处理的玉米鲜重高于NJDL-03处理,且差异显著,而干重差异不显著,但与San8处理相比差异显著。NJDL-12、NJDL-03、San8、Substrate处理的玉米植株干重分别较CK增加了67.70%、67.14%、33.96%、24.04%。叶绿素是反映植物生长的重要指标,NJDL- 03、NJDL-12处理的玉米叶片叶绿素分别是CK的1.37、1.33倍,而San8处理是CK的1.16倍。
|
|
表 3 不同处理对玉米生长的影响 Table 3 The effect of different treatment on growth of maize with different treatments |
各处理叶片及根系全磷含量规律均为:NJDL-12 >NJDL-03>San8>Substrate>CK。NJDL-12叶片和根系全磷分别为1.26、1.17 g·kg-1,分别比CK增长了132.61%、79.67%,NJDL-03比CK增长了80.82%、44.67%,而San8仅增长了59.20%、4.61%,且只有叶片全磷差异显著。图 2中,除CK外,真菌NJDL-12和NJDL-03等玉米根系与叶片全磷含量相比各处理均低于叶片,说明溶磷菌肥和基质均能促进玉米生长,且对地上部的促生效果更显著。

|
不同字母表示在P < 0.05水平上有显著性差异。下同 Different letters indicate statistically significant differences at the P < 0.05 probability level. The same below 图 2 不同处理玉米叶片和根系含磷量比较 Figure 2 Comparison of phosphorus content in the leaf and root of maize with different treatments |
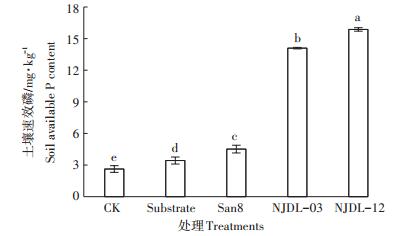
图 3显示不同处理土壤速效磷高低顺序为:NJDL - 12>NJDL - 03> San8>Substrate>CK。NJDL-12和NJDL-03处理的土壤速效磷分别为15.87、14.10 mg·kg-1,是CK的5.03、4.36倍,而San8处理及Substrate处理的土壤速效磷为4.51、3.43 mg·kg-1,仅较CK提高了0.71、0.30倍。
|
图 3 不同处理土壤速效磷含量变化 Figure 3 Changes of the available phosphorus in soil with different treatments |
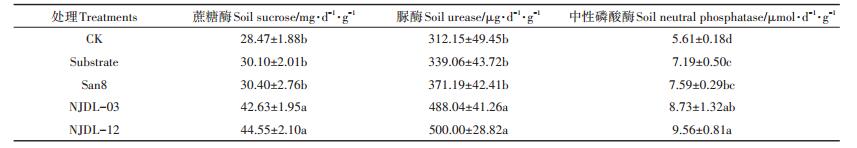
表 4中真菌菌肥处理的土壤蔗糖酶、脲酶及中性磷酸酶活性均高于其他处理,且NJDL-12处理的土壤各酶活性略高于NJDL-03处理,但差异不显著。在土壤蔗糖酶、脲酶及磷酸酶三种酶活中,NJDL-12、NJDL-03分别比San8提高了46.55%、34.74%、25.96%和40.23%、31.48%、15.02%,San8处理则比CK提高了6.78%、18.91.%、35.29%。
|
|
表 4 不同处理中土壤酶活性的变化 Table 4 The changes of soil enzyme activity with different treatments |
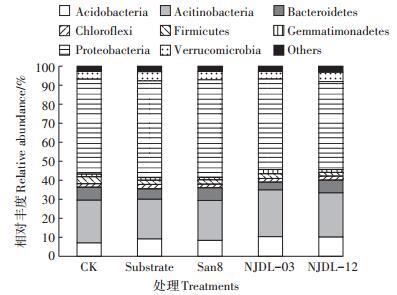
原始序列经过抽提分配后,在97%相似度水平,16SrRNA基因序列共有7624个OUT。不同处理中玉米根际土壤细菌门水平的相对丰度变化显示(图 4),根际主要富集了变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria),此三个细菌门的丰度分别达到了50%、20%和10%左右,其次是拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflex)、芽单胞菌门(Gemmatimonadetes)及疣微菌门(Verrucomicrobia),约占20%,其中厚壁菌门(Firmicutes)丰度仅占1%~3%,各处理较CK丰度明显降低,有显著差异性。
|
图 4 不同处理中根际土壤细菌门水平的相对丰度 Figure 4 Relative abundances of bacterial phyla with different treatments |
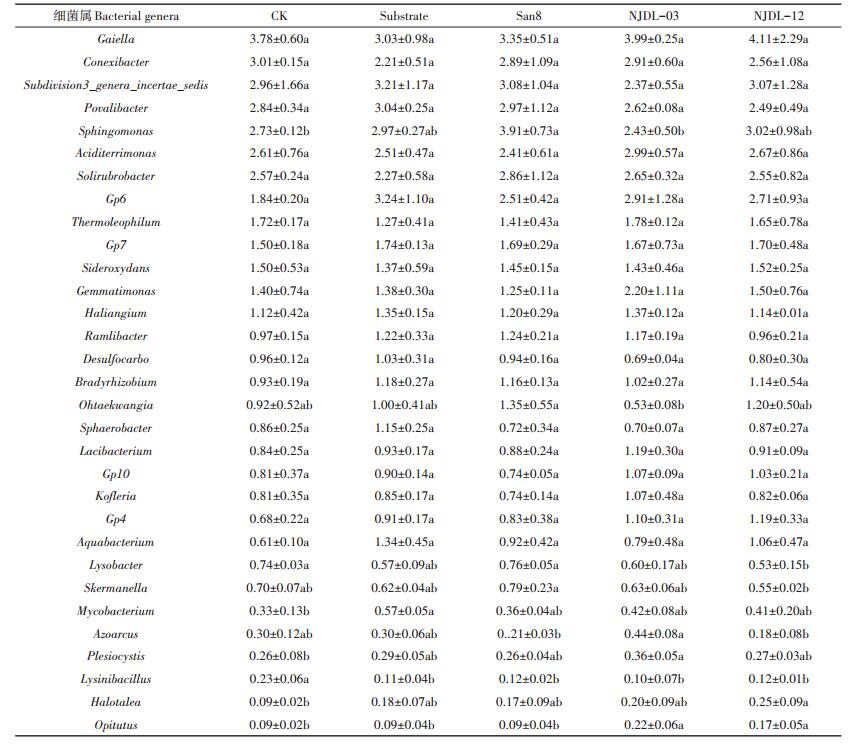
表 5中细菌属丰度>1%的有23个属,丰度最高的为Gaiella属,其次为康奈斯氏杆菌属(Conexibacter)、Subdivision3_genera_incertae_sedis类群、Povalibacter属,鞘氨醇单胞菌属(Sphingomonas)、酸土单胞菌属(Aciditerrimonas)和土壤红杆菌属(Solirubrobacter)等,而丰度>1%且存在显著性差异的细菌属只有2个属,分别为鞘氨醇单胞菌属(Sphingomonas)和类链球菌属(Ohtaekwangia)。San8处理的土壤Sphingomonas丰度最高,为CK的1.43倍,NJDL-12菌肥处理为CK的1.11倍,NJDL-03菌肥处理与CK差异不显著。Ohtaekwangia丰度除了NJDL-03菌肥处理外,其余各处理均较CK增加。丰度 < 1%的9个细菌属各处理之间差异显著,尤其是赖氨酸芽孢杆菌属(Lysinibacillus)丰度,各处理均较CK显著降低;其次是丰祐菌属(Opitutus),经真菌菌肥NJDL-03及NJDL-12处理后丰度显著增加,而细菌菌肥San8及Substrate处理后与CK相比差异不显著;分枝杆菌属(Mycobacterium)、小囊菌属(Plesiocystis)和嗜盐杆菌属(Halotalea)的丰度,各处理相对于CK均有明显的增加,真菌菌肥处理后的溶杆菌属(Lysobacter)相对于CK有所减少。
|
|
表 5 不同处理根际土壤主要细菌类群(属水平>0.1%)的丰度变化 Table 5 The abundance of main bacterial genera in different treatments |
土壤中存在大量的溶磷菌,对活化土壤磷素起到重要的作用。溶磷草酸青霉NJDL - 03和黑曲霉NJDL-12是实验室分离保存的溶磷效果较好的微生物。将溶磷生物菌肥接种到石灰性土壤中进行土培,降低了土壤pH值,提高了土壤速效磷含量。土培实验45 d,菌株NJDL-03和NJDL-12处理土壤的速效磷分别是CK的4.0、3.9倍,San8处理则是CK的1.54倍,表明真菌的溶磷效率远高于溶磷细菌。Kucey等[18]研究亦发现真菌的溶磷能力要强于细菌。前期摇瓶实验发现菌株NJDL-03主要产生草酸、甲酸、酒石酸、柠檬酸等,产生有机酸总量4489 mg·L-1,NJDL-12主要产生草酸、甲酸、苹果酸等有机酸,产酸总量为10 331 mg·L-1[15];而菌株san8主要产生草酸、甲酸、苹果酸、乳酸等有机酸,其产酸总量为4153 mg·L-1[16]。可见菌株产生有机酸的种类及数量不同,是其溶磷能力不同的主要原因,王岳坤等[19]研究报道不同的有机酸对土壤中难溶性磷的溶解效率不同。
本实验结果表明,生物菌肥的应用增加了土壤速效磷含量,提高了土壤酶活性,并促进了玉米植株的生长。为进一步深入探索生物菌肥溶磷促生的机制,本实验检测了玉米根际细菌群落的变化,研究发现所有处理在门水平均具有相同的三大优势菌群,分别为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)。这与韩亚飞等[20]研究的变形菌门、放线菌门和酸杆菌门为不同类型土壤的优势群落的结果一致。经统计分析发现,变形菌门、酸杆菌门的丰度与土壤速效磷含量及土壤酶活变化有显著的相关性。李丹[21]研究发现在不同土地利用方式下,土壤细菌群落中拟杆菌门及δ-变形菌门与脲酶呈负相关,蓝藻及疣微菌与脲酶和过氧化氢酶呈正相关。这说明土壤细菌群落结构变化与土壤理化性质紧密相关。
在细菌属水平,虽然有些细菌属丰度很低,但其具有一些特殊作用,对土壤理化性质的改变及植株的生长不可忽视。各处理的植株根际赖氨酸芽孢杆菌属(Lysinibacillus)丰度相对于CK均减少,据文献报道Lysinibacillus具有较强的诱导碳酸盐矿物形成能力,并且细菌死亡后的自溶过程会使环境pH值升高[22]。菌肥处理后,根际中鞘氨醇单胞菌属(Sphingomonas)、小囊菌属(Plesiocystis)丰度较对照有所增加,其中Sphingomonas是土壤中一类重要的资源微生物,不仅具有较强的降解多环芳烃的能力[23],更具有溶磷作用[24],Plesiocystis则是生态环境中磷酸酯和磷酸酶的分解细菌[25]。此实验结果说明经过溶磷生物菌肥处理之后,对根际细菌群落组成有所改变,增加功能微生物的丰度,有利于土壤磷素的溶解,促进植物生长。
目前功能生物肥料的研发、生产已取得了丰硕成果,但由于不同土壤理化性质的差异,其应用效果稳定性仍需进一步提高,故本文的实验结果为溶磷生物菌肥在生产上应用提供了理论参考。
4 结论(1)溶磷真菌NJDL-03和NJDL-12的溶磷效果高于溶磷细菌San8。
(2)施加不同的溶磷生物菌肥皆能促进玉米生长,促生效果顺序是NJDL-12>NJDL-03>San8>Substrate>CK,生物菌肥处理不仅改善了土壤理化性质,同样提高了某些功能微生物的丰度,进而影响了根际土壤细菌群落组成。
| [1] |
Vessey J K, Heisinger K G. Effect of Penicillium bilaii inoculation and phosphorus fertilisation on root and shoot parameters of field-grown pea[J]. Canadian Journal of Plant Science, 2001, 81(3): 361-366. DOI:10.4141/P00-083 |
| [2] |
赵小蓉, 林启美. 微生物解磷的研究进展[J]. 中国土壤与肥料, 2001(3): 7-11. ZHAO Xiao-rong, LIN Qi-mei. A review of phosphate dissolving microorganisms[J]. Soil and Fertilizers Sciences in China, 2001(3): 7-11. DOI:10.3969/j.issn.1673-6257.2001.03.002 |
| [3] |
陈凯, 李纪顺, 杨合同, 等. 巨大芽孢杆菌P1的解磷效果与发酵条件研究[J]. 中国土壤与肥料, 2010(4): 73-76. CHEN Kai, LI Ji-shun, YANG He-tong, et al. Phosphate solubilizing abilities of Bacillus megaterium strain P1 and its fermentation conditions[J]. Soil and Fertilizers Sciences in China, 2010(4): 73-76. DOI:10.3969/j.issn.1673-6257.2010.04.016 |
| [4] |
胡晓峰, 郭晋云, 张楠, 等. 一株溶磷抑病细菌的筛选及其溶磷特性[J]. 中国农业科学, 2010, 43(11): 2253-2260. HU Xiao-feng, GUO Jin-yun, ZHANG Nan, et al. Screening of a phosphate solubilizing and disease inhibiting bacteria strain and studies on its P-solubilizing characteristics[J]. Scientia Agricultura Sinica, 2010, 43(11): 2253-2260. DOI:10.3864/j.issn.0578-1752.2010.11.008 |
| [5] |
Souchie, Luizazcón E, Rosario B, et al. Phosphate solubilization and synergism between P-solubilizing and arbuscular mycorrhizal fungi[J]. Pesquisa Agropecuária Brasileira, 2006, 41(9): 1405-1411. DOI:10.1590/S0100-204X2006000900009 |
| [6] |
Anita P, Namrata D, Bhavesh K, et al. Phosphate solubilization by Penicillium spp. isolated from soil samples of Indian Himalayan region[J]. World Journal of Microbiology and Biotechnology, 2008, 24(1): 97-102. DOI:10.1007/s11274-007-9444-1 |
| [7] |
李学平, 刘萍. 盐碱化土壤中1株耐盐解磷放线菌的生物学特性[J]. 江苏农业科学, 2015, 43(8): 363-365. LI Xue-ping, LIU Ping. Biological characteristics of a salt-tolerant and phosphate -solubilizing actinomycete strain in saline-alkali soil[J]. Jiangsu Agricultural Sciences, 2015, 43(8): 363-365. |
| [8] |
Kucey R M N, Janzen H H, Leggett M E. Microbially mediated increases in plant-available phosphorus[J]. Advances in Agronomy, 1989, 42: 199-228. DOI:10.1016/S0065-2113(08)60525-8 |
| [9] |
Son H J, Park G T, Cha M S, et al. Solubilization of insoluble inorganic phosphates by a novel salt-and pH-tolerant Pantoea agglomerans R-42 isolated from soybean rhizosphere[J]. Bioresource Technology, 2006, 97(2): 204-210. DOI:10.1016/j.biortech.2005.02.021 |
| [10] |
Gulden R H, Vessey J K. Penicillium bilaji inoculation increases roothair production in field pea[J]. Canadian Journal of Plant Science, 2000, 80(4): 801-804. DOI:10.4141/P99-171 |
| [11] |
Beckie H J, Schlechte D, Moulin A P, et al. Response of alfalfa to inoculation with Penicillium bilaji(Provide)[J]. Revue Canadienne De Phytotechnie, 1998, 78(1): 91-102. |
| [12] |
朱丹, 张磊, 韦泽秀, 等. 菌肥对青稞根际土壤理化性质以及微生物群落的影响[J]. 土壤学报, 2014, 51(3): 628-636. ZHU Dan, ZHANG Lei, WEI Ze -xiu, et al. Effects of bacterial manure on soil physicochemical properties and microbial community diversity in rhizosphere of highland barley[J]. Acta Pedologica Sinica, 2014, 51(3): 628-636. |
| [13] |
李朔.利用DGGE法研究微生物肥料培养过程中菌群的变化[D].北京: 北京化工大学, 2012. LI Shuo. The culture of function bacteria and bacteria colony's change in compound microorganism fertilizer by DGGE[D]. Beijing: Beijing University of Chemical Technology, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10010-1012414526.htm |
| [14] |
Li Z, Bai T, Dai L, et al. A study of organic acid production in contrasts between two phosphate solubilizing fungi:Penicillium oxalicum and Aspergillus niger[J]. Scientific Reports, 2016, 6: 25313. DOI:10.1038/srep25313 |
| [15] |
冯哲叶, 陈莎莎, 王文超, 等. 几株溶磷细菌的筛选和鉴定及其溶磷效果[J]. 南京农业大学学报, 2017(5): 842-849. FENG Zhe-ye, CHEN Sha-sha, WANG Wen-chao, et al. Screening and identification of several phosphate-solubilizing bacteria and effect of their P-solubility[J]. Journal of Nanjing Agricultural University, 2017(5): 842-849. |
| [16] |
鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000. BAO Shi -dan. Soil and agricultural chemistry analysis[M]. 3rd Edition. Beijing: China Agriculture Press, 2000. |
| [17] |
Caporaso J G, Lauber C L, Walters W A, et al. Global patterns of 16s rRNA diversity at a depth of millions of sequences per sample[J]. Proceedings of the National Academy of Sciences, 2011, 108(Suppl 1): 4516-4522. |
| [18] |
Kucey R M N, Leggett M E. Increased yields and phosphorus uptake by westar canola(Brassica napus L.)inoculated with a phosphate-solubilizing isolate of Penicillium bilaji[J]. Canadian Journal of Soil Science, 1989, 69(2): 425-432. DOI:10.4141/cjss89-042 |
| [19] |
王岳坤, 于飞, 唐朝荣. 海南生态区植物根际解磷细菌的筛选及分子鉴定[J]. 微生物学报, 2009, 49(1): 64-71. WANG Yue-kun, YU Fei, TANG Chao-rong. Screening and molecular identification of phosphate-solubilizing bacteria in rhizosphere soils in Hainan ecosystem[J]. Acta Microbiologica Sinica, 2009, 49(1): 64-71. DOI:10.3321/j.issn:0001-6209.2009.01.012 |
| [20] |
韩亚飞, 伊文慧, 王文波, 等. 基于高通量测序技术的连作杨树人工林土壤细菌多样性研究[J]. 山东大学学报:理学版, 2014, 49(5): 1-6. HAN Ya-fei, YI Wen-hui, WANG Wen-bo, et al. Soil bacteria diversity in continuous cropping poplar plantation by high throughput sequencing[J]. Journal of Shandong University(Natural Science), 2014, 49(5): 1-6. |
| [21] |
李丹.不同土地利用方式对土壤性质及细菌群落结构的影响[D].哈尔滨: 东北林业大学, 2011. LI Dan. Effect on soil properties and soil bacterial community structure by different land use in maoer mountain region[D]. Harbin: Northeast Forestry University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10225-1011146682.htm |
| [22] |
李福春, 郭文文. 三种好氧细菌诱导碳酸钙矿物的形成[J]. 南京大学学报:自然科学版, 2013, 49(6): 665-672. LI Fu-chun, GUO Wen-wen. Three kinds of aerobic bacteria induced mineralization of calcium carbonate[J]. Journal of Nanjing University (Natural Science), 2013, 49(6): 665-672. |
| [23] |
张梦露, 党志, 伍凤姬, 等. 利用流式细胞术研究鞘氨醇单胞菌GY2B降解菲过程中细菌表面特性的变化[J]. 环境科学, 2014, 35(4): 1449-1456. ZHANG Meng-lu, DANG Zhi, WU Feng-ji, et al. Using flow cytometry to explore the changes of Sphingomonas sp. GY2B bacterial surface characteristics in the process of degrading phenanthrene[J]. Environmental Science, 2014, 35(4): 1449-1456. |
| [24] |
陈丹阳, 李汉全, 张炳火, 等. 两株解磷细菌的解磷活性及作用机制研究[J]. 中国生态农业学报, 2017, 25(3): 410-418. CHEN Dan-yang, LI Han-quan, ZHANG Bing-huo, et al. Phosphatesolubilizing activities and action mechanisms of two bacteria[J]. Chinese Journal of Eco-Agriculture, 2017, 25(3): 410-418. |
| [25] |
Villarreal-Chiu J F, Quinn J P, Mcgrath J W. The genes and enzymes of phosphonate metabolism by bacteria, and their distribution in the marine environment[J]. Frontiers in Microbiology, 2012, 19(3): 19. |
 2018, Vol. 37
2018, Vol. 37