土壤中的磷、钾主要以难溶态的形式存在,难以被植物吸收利用。为了提高农业产量,大量化肥被施加到土壤中,肥料的不合理使用不仅破坏了土壤性状,降低了作物质量,还会严重污染农田和水体环境,不利于农业的可持续发展。因此,研究既能给予农作物充分的营养,又不污染农田生态环境的肥料是具有应用前景的[1]。植物根际促生菌PGPR(Plant GrowthPromoting Rhizobacteria)指存活于植物根际并且能够直接或者间接地促进植物生长的有益微生物。目前已经鉴定出多种PGPR菌株,其中主要种类包括假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、固氮菌属(Azotobacter)、克雷伯氏菌属(Klebsiella)、慢生型根瘤菌属(Bradyrhizobium)、产碱菌(Alcaligenes)等[2-3]。根际促生菌通过产生吲哚乙酸、赤霉素等生长物质或者分泌有机酸释放矿物中的磷、钾等养分以促进植物生长[4]。
PGPR在植物根际的定殖对于其充分发挥促进植物生长的作用至关重要。细菌定殖过程主要包括趋化作用、群游运动和生物膜形成3个步骤,其中趋化作用指细菌在外界环境的化学物质刺激下找寻最佳生长和生存环境所作出的趋向性反应,群游运动是表示细菌能够在表面快速移动的一种细菌运动学机制,它们是细菌在植物根部定殖的前提条件,生物膜形成过程是指细菌通过附着在植物根际周围形成生物膜来保护植物抵抗病原菌侵害的过程,细菌能否在植物根际成功定殖取决于这3种作用的强弱[5]。植物根系分泌物是一种营养物质和能量来源,能够促进细菌生长,同时也能够作为一种化学诱导剂,促使土壤微生物在植物根部成功定殖[2],其主要成分包括有机酸、氨基酸和多糖类物质[6]。本研究先采用摇瓶试验评估T29对难溶态磷和钾的活化能力,然后通过趋化、群游、体外实验以及盆栽实验探究不同种类的有机酸和氨基酸对T29在菜心根际定殖的影响,从中找到对于T29具有较好定殖效果的有机酸或氨基酸,即为其信号分子。研究结果可为磷钾贫瘠地区微生物肥料的施用提供依据,同时也能在一定程度上减少磷钾化肥的施用。
1 材料与方法 1.1 菌种的筛选及鉴定采集广州市郊区菜园土,风干,过100目筛。称取10 g新鲜土样于90 mL无菌水(内含玻璃珠)中包扎好,转移至摇床,于28 ℃、180 r·min-1振荡20 min,制成菌悬液。吸取1 mL的菌悬液于9 mL无菌水中,吹洗3次,摇匀即为稀释102倍的菌悬液,依次类推至107。用无菌移液管分别吸取0.1 mL稀释倍数为104、105、106、107的菌悬液于相应编号的平板内,用灭菌冷却后的三角刮刀在平板上旋转涂布于筛选培养基上,28 ℃倒置培养3~5 d。待平板上长出单菌落后,挑取具有溶钾圈的单菌落多次划线纯化,分离获得一株细菌并保存于斜面中,编号T29。筛选培养基[7]成分:NaCl 0.3 g;MgSO4·7H2O 0.534 3 g;MnSO4·H2O 0.022 7 g;(NH4)2SO4 0.5 g;FeSO4·7H2O 0.03 g;Na2HPO4 2 g;钾长石1.0 g;葡萄糖10 g;琼脂18~20 g;去离子水1000 mL;pH 7.0~7.5。
菌株T29的形态学及生理生化鉴定参照蔡妙英等[8]报道的方法。同时对菌株进行16S rDNA鉴定,首先用试剂盒提取T29菌株总DNA,选用16S rDNA的PCR反应通用引物(上游引物27F:5′ - AGAGTTT⁃ GATCATGGCTCAG;下游引物1492R:5′ - TACGGT⁃ TACCTTGTTACGACTT-3′)进行PCR扩增。PCR扩增反应体系总体积为20 μL,包括10.0 μL Taq酶,0.8 μL 27F引物,0.8 μL 1492R引物,1.0 μL DNA模板,7.4 μL双蒸水。PCR反应条件:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,进行35个循环,最后72 ℃延伸10 min,最终样品送至上海美吉生物公司测序。将所得序列与GenBank数据库现有基因进行比对,获取同源性较高的相邻属、种的16S rDNA序列。
1.2 土壤杆菌的富集及溶磷和溶钾实验从保存的斜面中挑取菌株T29,接种于LB培养基(液体)中,并于28 ℃恒温振荡培养18 h后取出,经4000 r·min-1离心10 min,倒掉上清液,用磷酸盐缓冲溶液洗涤管底沉淀的菌体,再用无菌水重悬菌体得到菌悬液。将此菌悬液按2%(2 mL)的接种量加入至100 mL发酵培养基作为处理组,同时设不加菌为对照,分别设置3个平行,共6个样品。将其转移至摇床于28 ℃、150 r·min-1富集培养7 d后,定容至100 mL容量瓶。将定容后的溶液经4000 r·min-1离心10 min后过0.22 μm滤膜,采用雷磁pH计、可见分光光度计和PE原子吸收分光光度仪分别测定滤液的pH、磷和钾的含量。两种培养基用于摇瓶中的溶磷和溶钾实验以及菌株的富集:(1)改良的pH为7.0~7.5的发酵培养基[7-9],成分为NaCl 0.3 g、MgSO4·7H2O 0.534 3 g、MnSO4·H2O 0.022 7 g、(NH4)2SO4 0.5 g、FeSO4·7H2O 0.03 g、Ca3(PO4)2 0.668 g、钾长石0.3 g、葡萄糖1 g、去离子水1000 mL;(2)pH为7.0~7.5的LB培养基[10],成分为胰蛋白胨10 g、酵母粉5 g、NaCl 10 g、去离子水1 L、琼脂10 g。
1.3 趋化实验用移液枪和注射器分别吸取100 μL富集后的T29菌悬液和200 μL 30 μmol·L-1的有机酸或氨基酸溶液,设定无菌水为对照。将注射器插入移液器枪头后,静置于超净台2 h,取出注射器中的有机酸溶液并用无菌水稀释10、102、103、104、105、106倍,涂布至LB培养基,放置于生化培养箱中,28 ℃培养2 d。设置3个平行,并计算平均值作为每种处理对T29趋化作用的影响值[11]。
1.4 群游实验配制含30 μmol·L-1有机酸或氨基酸(对照为无菌水)的LB固体培养基。放置8 mm的无菌滤纸片于固体培养基的中心并吸取5 mL富集后的T29菌悬液于滤纸片中央,然后放置于生化培养箱中于28 ℃培养4 d,从3个不同方向测量菌落直径。设置3个平行,并计算平均值作为每种处理对T29群游作用的影响值[11]。
1.5 体外实验配制1/4浓度的Hoagland营养液,每个组培瓶加入50 mL营养液与1%(0.5 g)的琼脂制成固体培养基。将菜心种子用2%次氯酸钠溶液浸泡30 min,放置于组培瓶中心处,培养2 d。待长出嫩叶后,吸取10 μL富集后的T29菌悬液于距植物根部2 mm处,并添加20 μL的30 μmol·L-1有机酸溶液(对照为无菌水)在菜心根表面处。培养2周后,收集菜心,剪掉根部,用无菌水洗涤根组织表面,称重,放入离心管中并加入1 mL无菌水于组织破碎仪中涡旋5 min,用无菌水稀释10、102、103、104、105、106倍,涂布至LB培养基,然后放置于生化培养箱中,28 ℃培养4 d。设置3个平行,并计算平均值作为每种处理对T29体外作用的影响值[11]。
1.6 盆栽实验盆栽土壤采自广州市郊区菜园0~20 cm深度的土壤。土壤基本理化性质是pH为6.28、全磷含量为2.01 g·kg-1、速效磷含量为94.03 mg·kg-1、全钾含量为2.52 g·kg-1、速效钾含量为98.44 mg·kg-1。由于课题组前期的研究发现菜心根系分泌物中葡萄糖酸较多[12],因而将菜心作为菌株定殖的研究材料。选取饱满的菜心种子于2%的次氯酸钠溶液浸泡30 min,播种于石英砂里并置于植物培养箱中,设定参数为白天25 ℃/16 h,黑夜18 ℃/8 h。待长出嫩叶后转至装有1.5 kg农田土的塑料盆里,每盆4株,每株加入5 mL富集后的T29菌悬液,隔20 d添加1次菌液(OD600= 1.0),设置不加菌为对照,定期浇水,60 d后收获,测量株高及根、茎叶的干质量。收集根际土经6000 r· min-1离心10 min得到根际溶液,然后将离心后的根际土烘干测定含水量,将收集的菜心的根和茎叶烘干,分别称取0.2 g根和茎叶的干样,加入10 mL浓硝酸与样品混匀,微波消解,同时消解过程中添加国家标准物质(GSV-1)对实验结果进行质控,后定容至25 mL容量瓶,将定容后的溶液过0.45 μm滤膜,获得滤液。采用PE火焰原子吸收光谱仪分别测定根际溶液与根、茎叶中钾的含量。可见分光光度计测定磷的含量。
1.7 数据处理利用Microsoft Excel 2010进行实验数据处理,SPSS 23对数据进行单因素方差分析,OriginPro 8绘制图形。菜心根际干土的速效磷、钾含量计算公式如下所示:
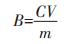
|
式中:B为菜心根际干土中的速效磷、钾浓度,mg· kg-1;C为根际溶液中的速效磷、钾浓度,mg·L-1;V为根际土的含水量,mL;m为根际土的干质量,g。
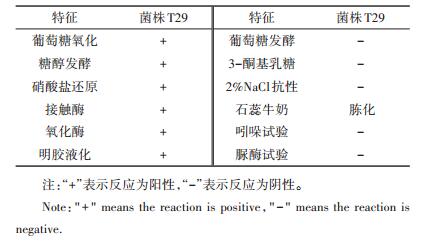
2 结果与分析 2.1 菌株的鉴定结果形态及生理生化特征:T29菌落呈圆形,边缘整齐,乳白色,表面光滑,菌体形状呈杆状,直径约为1~2 μm,革兰氏染色为阴性。生理生化特征如表 1所示。
|
|
表 1 菌株T29的生理生化特性 Table 1 Physiological and biochemical characteristics of strain T29 |
16S rDNA测序结果分析:将T29菌株的测序结果上传到NCBI中。并与NCBI中的Genebank数据库进行Blast比对,发现与根瘤菌属(Rhizobium sp.)以及土壤杆菌属(Agrobacterium sp.)相似性最高,都达到100%,结合其生理生化特性,可以确定该菌株为土壤杆菌属(Agrobacterium sp.)。
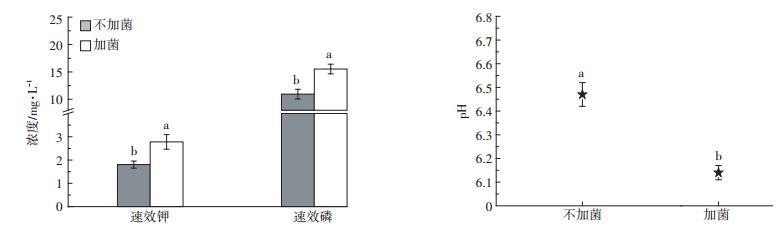
2.2 T29对难溶矿物中的磷和钾溶出量及培养液中pH的影响如图 1所示,在发酵培养基中,接种T29的培养液中速效钾和速效磷含量与不加菌相比都显著增大(P < 0.05),浓度分别为2.78 mg·L-1和15.53 mg·L-1,分别为不加菌的1.54倍和1.42倍,其溶磷率和溶钾率分别为11.9%和6.6%。不加菌条件下,培养液的pH为6.47,而接种菌液后,培养液中的pH下降至6.17。推测T29通过分泌代谢产物,如有机酸、氨基酸等物质,来活化矿物中的难溶态磷和难溶态钾。
|
不同小写字母代表不同处理间差异显著(P < 0.05)。下同 Different lowercase letters mean significant differences among different treatments(P < 0.05). The same below 图 1 T29在钾长石中的溶磷、溶钾能力及接菌处理下培养液中的pH值 Figure 1 The ability of T29 to mobilize phosphorus and potassium in K-feldspar and the pH value of the culture medium after inoculating bacteria |
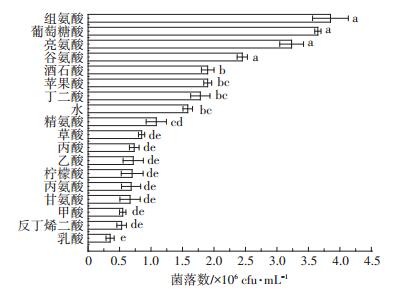
如图 2所示:乳酸、反丁烯二酸、甲酸、甘氨酸、丙氨酸、柠檬酸、乙酸、丙酸、草酸、谷氨酸、亮氨酸、葡萄糖酸、组氨酸吸引的菌落数与对照(水)相比均有显著差异(P < 0.05),其中乳酸、反丁烯二酸、甲酸、甘氨酸、丙氨酸、柠檬酸、乙酸、丙酸、草酸吸引的菌落数与对照相比显著减少,表现出负趋化作用。而谷氨酸、亮氨酸、葡萄糖酸、组氨酸吸引的菌落数与对照相比显著增大,其菌落数分别为2.45×106、3.23×106、3.65×106 cfu·mL-1和3.85×106 cfu·mL-1,相比对照分别增加了54.7%、104.2%、130.5%、143.1%,表现出正趋化作用。
|
图 2 不同有机酸对土壤杆菌趋化作用的影响 Figure 2 Effect of different organic acids on the chemotaxis of Agrobacterium species |
从趋化实验结果筛选出对于T29具有正趋化作用的4种物质进行群游实验。如图 3所示:在α=0.05水平时,谷氨酸、亮氨酸、组氨酸诱导下T29生长的菌落直径与对照相比均无明显变化,而在葡萄糖酸的诱导下T29长势良好,其菌落直径为2.18 cm,相比对照增大了54.6%。
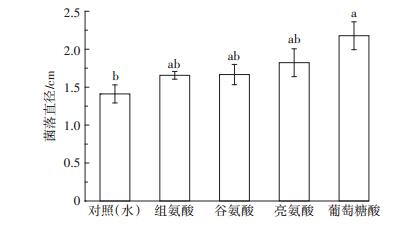
|
图 3 不同有机酸对于土壤杆菌群游作用的影响 Figure 3 Effect of different organic acids on the swarm of Agrobacterium species |
从趋化和群游实验结果得出葡萄糖酸对T29具有一定的吸引作用,进一步通过体外实验来评估葡萄糖酸对T29在菜心根际定殖的影响。如图 4所示,添加了葡萄糖酸在菜心根际后,其根部吸引的菌落数目为2.98×106 cfu·g-1,相比对照增加了29.1%。说明葡萄糖酸会促进T29在菜心根部表面形成生物膜。
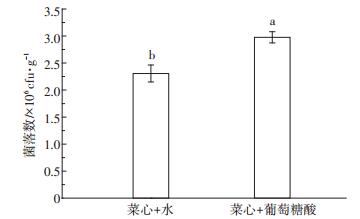
|
图 4 葡萄糖酸作用下菜心根部吸引菌落的水平 Figure 4 The population levels of colony recruited by Chinese flowering cabbages roots under the action of gluconic acid |
如图 5A和图 5B所示,加菌后菜心的生物量与不加菌相比显著提高(P < 0.05),其中根干质量为0.49 g,比不加菌增加了24.2%,茎叶干质量为3.96 g,比不加菌增加了50.2%。同时加菌处理根际土壤中的速效磷、速效钾含量也显著高于不加菌(P < 0.05),其含量分别为0.11 mg·kg-1和0.22 mg·kg-1,与不加菌相比,分别增加了37.5%和52.8%。如图 5C所示,接菌后菜心根部的磷、钾含量与不加菌相比没有显著变化,但是茎叶中的磷、钾含量相比不加菌均有显著提高(P < 0.05,其含量分别为6.36 g·kg-1和21.32 g·kg-1,与不加菌相比,分别增加了49.3%和56.4%。同时接菌条件下菜心的株高为37.9 cm,约为不加菌的1.48倍(图 5D)。
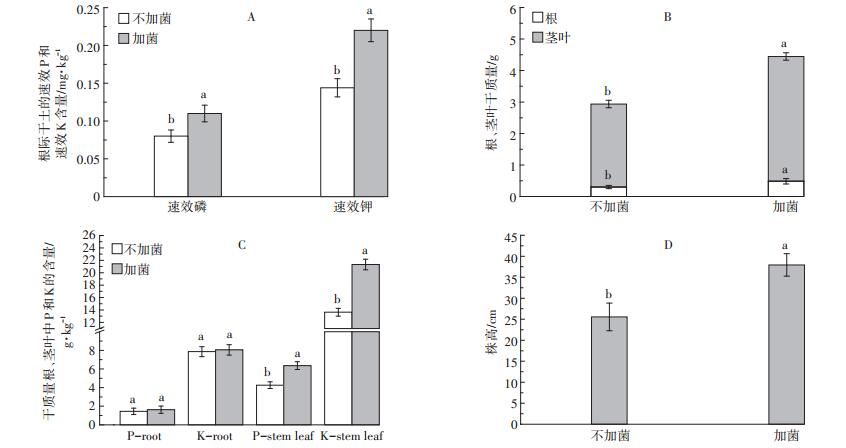
|
P-root:根部的磷含量;P-stem leaf:茎叶的磷含量;K-root:根部的钾含量;K-stem leaf:茎叶的钾含量 P-root: The content of phosphorus in the root; P-stem leaf: The content of phosphorus in the stems and leaves; K-root: The content of potassium in the root; K-stem leaf: The content of potassium in the stems and leaves 图 5 接菌处理下菜心根际干土的速效P和速效K含量、根与茎叶中的P和K含量及菜心的根与茎叶干质量和株高 Figure 5 The content of available phosphorus and potassium in dry Chinese flowering cabbages rhizosphere soil, the content of phosphorus and potassium in the dry root, stems and leaves, the dry weight of root and stems and leaves and the height after inoculating bacteria |
本研究从农田土中筛选出一株具有解钾能力的细菌T29,经过菌株形态特征、生理生化特性以及16S rDNA序列分析,鉴定为土壤杆菌属(Agrobacterium sp.)。摇瓶实验结果表明T29活化难溶态磷和难溶态钾的能力较强,具有作为微生物肥料的研究前景。另外有研究表明有机酸不仅能够作为根际促生菌的营养物质和能量来源,还能作为一种信号物质吸引细菌在植物根际定殖[13]。因此我们采用趋化、群游、体外和盆栽实验探究不同种类的有机酸和氨基酸对土壤杆菌在菜心根际定殖及其活化土壤中磷、钾的影响,从而确定对于T29具有较好定殖效果的有机酸或氨基酸为其信号分子。
趋化实验结果表明谷氨酸、亮氨酸、葡萄糖酸、组氨酸吸引的T29菌落数显著大于对照(P < 0.05),说明这几种物质能够作为化学诱导剂诱导T29作定向移动,对其具有一定的正趋化作用。赵大君等[14]也发现凤眼莲根分泌物中的组氨酸、甘氨酸等氨基酸对根际肠杆菌属(Rhizosphere Enterobacter sp.)F2具有一定的正趋化作用。另外不同的有机酸和氨基酸诱导下T29的趋化效果呈现明显差异,可能与细菌表面是否存在能够感知这些化学物质的受体蛋白有关,细菌通过受体蛋白来感知环境中的化学物质,并将收到的化学信号转化为细胞内信号,从而控制鞭毛的运动方式,表现出相应的趋化性[15]。Zhulin[16]也报道了大肠杆菌(Escherichia coli)的Tar受体蛋白能够感应谷氨酸的刺激并转变成相应的鞭毛马达反应。除趋化作用外,群游运动也是细菌在植物根系定殖的一个重要因素,它是一种促使细菌在表面快速移动的动力学机制,其能力的强弱被认为是细菌在根际定殖的重要前提[17]。实验结果表明葡萄糖酸诱导下T29生长的菌落直径与对照相比显著增大,说明在葡萄糖酸的作用下,T29的群游运动能力得到了显著提高(P < 0.05)。其主要原因可能是葡萄糖酸诱导下T29鞭毛数量的增加,一定程度上加强了其群游运动的能力。Park等[18]研究也发现桔霉素处理下鞭毛数量的增加促进了多黏类芽孢杆菌(P.polymyxa strain)E681群游能力的增强。趋化作用和群游运动只是细菌在植物根部表面定殖的先决条件,细菌在植物根部表面定殖时最终会形成生物膜,而生物膜作用是细菌附着和聚集在植物根际表面形成保护膜的过程。本研究通过体外实验来评估土壤杆菌T29在菜心根系定殖形成生物膜的能力。通过外源添加一定浓度的葡萄糖酸在菜心根际,得到其根际表面细菌数量显著高于对照(P < 0.05),这与葡萄糖酸的趋化和群游实验结果也是一致的。说明葡萄糖酸能够诱导T29在菜心根际定殖形成生物膜,其一定程度上促进了与生物膜形成有关的基因的表达。有研究表明生物膜形成过程中,epsD、yqxM是合成胞外多糖和TasA蛋白的关键的生物合成基因[19],Chen等[20]发现苹果酸会通过提高生物膜操纵子yqxM的表达,促进枯草芽孢杆菌(Bacillus subtilis)的生物膜形成。Yuan等[21]也报道了富马酸诱导下解淀粉芽孢杆菌生物膜的生物量出现显著提高,同时epsD和yqxM这两个与生物膜形成相关的基因的表达量也显著上调(P < 0.05)。盆栽实验中,接菌后菜心根际土中的速效磷和速效钾含量相比不接菌显著增加,其生物量与不加菌相比也显著增长(P < 0.05)。由于菜心根系分泌物中含有葡萄糖酸[12],并且综合趋化、群游与体外实验结果,推测葡萄糖酸作为一种信号分子能够有效吸引T29在菜心根际定殖,其代谢产物有助于将土壤中的难溶态磷和难溶态钾转化为生物有效态以供菜心吸收利用,从而促进了菜心的生长。
4 结论(1)本研究从农田土中筛选出一株解钾菌,结合其形态特征、生理生化特性及16S rDNA序列分析,鉴定为土壤杆菌属(Agrobacterium sp.)。
(2)摇瓶实验中,T29对难溶态磷和难溶态钾的活化量分别为15.53 mg·L-1和2.78 mg·L-1,分别为对照的1.42倍和1.54倍,其溶磷率和溶钾率分别为11.9%和6.6%,说明T29溶磷和溶钾效果较好,具有作为菌肥的发展前景。
(3)趋化、群游、体外和盆栽实验表明葡萄糖酸作为菌株T29的信号分子,能够吸引其在菜心根际定殖,从而将土壤中的难溶态磷和难溶态钾转化为生物有效态以供菜心吸收利用,促进菜心的生长。
| [1] |
马光庭. 生态有机肥与农业可持续发展[J]. 中国生态农业学报, 2004, 12(3): 191-193. MA Guang-ting. Ecological organic fertilizers and sustainable development of agriculture[J]. Chinese Journal of Eco-Agriculture, 2004, 12(3): 191-193. |
| [2] |
Ahmad F, Ahmad I, Khan M S. Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities[J]. Microbiological Research, 2008, 163(2): 173-181. DOI:10.1016/j.micres.2006.04.001 |
| [3] |
Cattelan A J, Hartel P G, Fuhrmann J J. Screening for plant growth-promoting rhizobacteria to promote early soybean growth[J]. Soil Science Society of America Journal, 1999, 63(6): 1670-1680. DOI:10.2136/sssaj1999.6361670x |
| [4] |
康贻军, 程洁, 梅丽娟, 等. 植物根际促生菌的筛选及鉴定[J]. 微生物学报, 2010, 50(7): 853-861. KANG Yi-jun, CHENG Jie, MEI Li-juan, et al. Screening and identification of plant growth-promoting rhizobacteria[J]. Acta Microbiologica Sinica, 2010, 50(7): 853-861. |
| [5] |
Fall R, Vivanco J M. Biocontrol of Bacillus subtilis against infection of arabidopsis roots by Pseudomonas syringae is facilitated by biofilm formation and surfactin production[J]. Plant Physiology, 2004, 134(1): 307-319. DOI:10.1104/pp.103.028712 |
| [6] |
Badri D V, Vivanco J M. Regulation and function of root exudates[J]. Plant Cell & Environment, 2009, 32(6): 666-681. |
| [7] |
李新新, 高新新, 陈星, 等. 一株高效解钾菌的筛选、鉴定及发酵条件的优化[J]. 土壤学报, 2014, 51(2): 381-388. LI Xin-xin, GAO Xin-xin, CHEN Xing, et al. Isolation and identification of an efficient strain of potassium-dissolving bacteria and opatimization of its incubation condition[J]. Acta Pedologica Sinica, 2014, 51(2): 381-388. |
| [8] |
蔡妙英, 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. CAI Miao-ying, DONG Xiu-zhu. Common bacterial system identification manual[M]. Beijing: Science Press, 2001. |
| [9] |
陈易, 程永毅, 郭涛, 等. 一株具紫色土亲和性解钾菌的筛选及促生效应[J]. 西南大学学报(自然科学版), 2016, 38(5): 58-65. CHEN Yi, CHENG Yong-yi, GUO Tao, et al. Screening and identification of a potassium-solubilizing bacterium strain with affinity for purplish soil and its plant-promoting effects[J]. Journal of Southwest University (Natural Science Edition), 2016, 38(5): 58-65. |
| [10] |
汤鹏, 胡佳频, 易浪波, 等. 钾长石矿区土壤解钾菌的分离与多样性[J]. 中国微生态学杂志, 2015, 27(2): 125-129. TANG Peng, HU Jia-pin, YI Lang-bo, et al. Isolation and phylogenetic analysis of potassium-solubilizing bacteria[J]. Chinese Journal of Microecology, 2015, 27(2): 125-129. |
| [11] |
Ling N, Raza W, Ma J, et al. Identification and role of organic acids in watermelon root exudates for recruiting Paenibacillus polymyxa SQR-21 in the rhizosphere[J]. European Journal of Soil Biology, 2011, 47(6): 374-379. DOI:10.1016/j.ejsobi.2011.08.009 |
| [12] |
陈惠君.磷形态对菜心根系活化、累积铁氧化物结合态Cd的影响[D].广州: 暨南大学, 2016. CHEN Hui-jun. Role of phosphate forms on mobilization and accumulation of Cd bound to iron oxides by roots of Chinese flowering cabbages[D]. Guangzhou: Jinan University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10559-1016734304.htm |
| [13] |
Dennis P G, Miller A J, Hirsch P R. Are root exudates more important than other sources of rhizodeposits in structuring rhizosphere bacterial communities?[J]. Fems Microbiology Ecology, 2010, 72(3): 313-327. DOI:10.1111/fem.2010.72.issue-3 |
| [14] |
赵大君, 郑师章. 凤眼莲根分泌物氨基酸组分对根际肠杆菌属F2细菌的趋化作用[J]. 应用生态学报, 1996, 7(2): 207-212. ZHAO Da-jun, ZHENG Shi-zhang. Chemotaxis of amino acids in root exudates from Eichhornia crassipes to its rhizospheric Enterobacter sp. F2[J]. Chinese Journal of Applied Ecology, 1996, 7(2): 207-212. |
| [15] |
杨姗姗, 马丽, 孙柏欣, 等. 细菌趋化性研究进展[J]. 中国农学通报, 2015, 31(6): 121-127. YANG Shan-shan, MA Li, SUN Bai-xin, et al. Progress in bacterial chemotaxis[J]. Chinese Agricultural Science Bulletin, 2015, 31(6): 121-127. |
| [16] |
Zhulin I B. The superfamily of chemotaxis transducers:From physiology to genomics and back[J]. Advances in Microbial Physiology, 2001, 45(4): 157-198. |
| [17] |
Kearns D B, Losick R. Swarming motility in undomesticated Bacillus subtilis[J]. Molecular Microbiology, 2003, 49(3): 581-590. |
| [18] |
Park S Y, Kim R, Ryu C M, et al. Citrinin, a mycotoxin from Penicillium citrinum, plays a role in inducing motility of Paenibacillus polymyxa[J]. Fems Microbiology Ecology, 2008, 65(2): 229-237. DOI:10.1111/fem.2008.65.issue-2 |
| [19] |
Rudrappa T, Czymmek K J, Paré P W, et al. Root-secreted malic acid recruits beneficial soil bacteria[J]. Plant Physiology, 2008, 148(3): 1547-1556. DOI:10.1104/pp.108.127613 |
| [20] |
Chen Y, Cao S G, Chai Y R, et al. A Bacillus subtilis sensor kinase involved in triggering biofilm formation on the roots of tomato plants[J]. Molecular Microbiology, 2012, 85(3): 418-430. DOI:10.1111/j.1365-2958.2012.08109.x |
| [21] |
Yuan J, Zhang N, Huang Q W, et al. Organic acids from root exudates of banana help root colonization of PGPR strain Bacillus amyloliquefaciens NJN-6[J]. Scientific Reports, 2015, 5(13438): 121-127. |
 2018, Vol. 37
2018, Vol. 37