银纳米(Ag NPs)颗粒由于其特殊的粒子尺寸(< 100 nm),而呈现出与宏观物体和单个原子不同的特异性[1-2]。得益于其独特的光学、催化和抗菌性能,Ag NPs已经广泛应用在日常生活和工业生产等多个领域[3-5]。据报道,目前市场上常见的1000多种纳米技产品中,使用或添加纳米银的产品大约占五分之一[6]。然而Ag NPs的广泛应用在给人类带来利益和便利的同时,大量的Ag NPs颗粒和Ag+通过多种途径被排放到环境中[7],随之带来的生物和环境效应也引起人们的高度重视。Impellitteri等[8]发现Ag NPs排放到水中后会使其中的有益菌失衡,危害湖泊和河流等淡水系统中水生生物的生存。在水环境中,金属纳米颗粒可以进入鱼类体内,并直接进入到食物链中[9]。另外,环境因素的易变性会影响Ag NPs形态的变化。有研究发现,溶液中的离子强度和pH值会影响Ag NPs在溶液中的稳定性:高离子强度(100 mmol·L-1)或者酸性(pH值为3)条件下,Ag NPs颗粒会发生团聚[10-12]。
考虑到在水环境中对污染物的去除能力、对外界能量的需求以及环境友好等诸多因素,吸附技术被认为是最适合除去污染物的方法之一[13]。杜欢等[14]研究了Ag NPs在4种不同土壤上的吸附行为,发现Ca2+能够促进土壤对Ag NPs的吸附,但是试验土壤对Ag NPs的吸附容量非常低,仅有0.08~0.16 mg·g-1,不能实现大量吸附Ag NPs的目的。生物炭(BC)、多壁碳纳米管(CNTs)和石墨烯(GP)作为几种比较常见的碳基材料,因为其具有巨大的比表面积、疏水性和优异的可负载性,被广泛用来吸附环境中的污染物[15-16],而且吸附能力远高于其他传统吸附剂[17]。随着技术的进步和设备的改善,BC、CNTs和GP的生产和应用越来越广泛。本研究使用这3种碳基材料作为吸附剂,探究Ag NPs在BC、CNTs和GP上的吸附行为和吸附容量,同时考察了不同环境因素(离子强度、离子种类、电解质pH)对吸附行为的影响,为今后去除不同理化性质的水环境中的Ag NPs颗粒提供理论支撑,同时也为评价Ag NPs在水环境中的毒害行为以及去除手段提供依据。
1 材料与方法 1.1 试验材料供试生物炭以水稻壳为原材料,采用山东农业大学研制的大型炭化炉进行烧制,在缺氧状态下缓慢升温至400 ℃,并保持3.0 h。烧制好的生物炭研磨后过60目筛网后保存。多壁碳纳米管和石墨烯分别购买自深圳市纳米港有限公司和中国科学院成都有机化学有限公司。公司提供的测试报告显示,CNTs的外径为20~40 nm,长度为5~15 μm;GP的厚度在1~3 nm,长度大于50 μm,GP片层少于3层。其他试验所用试剂纯度均为分析纯。
Ag NPs溶液是参考已有文献并加以优化进行合成的[18]。将0.787 4 g AgNO3溶解到200 mL去离子水中,然后加入0.501 2 g羧甲基纤维素钠(CMC)后冰浴1.0 h,随后将混合溶液加热到90 ℃。将20 mL含有0.500 6 g的NaBH4溶液逐滴加入到上述混合溶液中,90 ℃下保持4.0 h,然后冷却至室温即可得到Ag NPs的储备溶胶。整个合成过程在氩气保护和遮光条件下进行。使用原子吸收分光光度计测定合成的Ag NPs浓度,吸附试验时使用去离子水将Ag NPs稀释到设定浓度即可。
1.2 试验仪器Quantachrome NOVA 4000e高速比表面积测试仪BET法测定3种碳基材料的比表面积(SSA)。Mal⁃ vern Zetasizer Nano ZS90纳米粒径电位分析仪测定Ag NPs的水动力学直径和碳基材料的Zeta电位。El⁃ ementar Vario EL cube元素分析仪用于测定碳基材料的元素含量。Nabertherm L15/12马弗炉用于碳基材料灰分的测定。HITACHI SU8010场发射扫描电子显微镜测定合成的Ag NPs的形貌。岛津AA-7000型原子吸收分光光度计测定平衡体系中的Ag浓度。
1.3 批处理试验Ag NPs溶液在碳基材料上的吸附动力学试验和等温吸附试验都是通过批处理手段进行的,并且每个处理设置了3个重复试验。
吸附动力学试验:准确称取0.10 g吸附剂,分别放入50 mL聚丙烯离心管中,加入25 mL 500 mg·L-1的Ag NPs溶液(电解质为10 mmol·L-1的NaNO3,pH值为6.5±0.1)后,立刻放入恒温振荡机(25 ℃,150 r·min-1)中振荡进行吸附动力学试验,整个过程在遮光条件下进行。分别在30、60、120、240、480、720、1440、2880、4320 min取出一组处理,然后10 000 g 离心10 min,取上清液至10 mL试管中,加入30%的硝酸溶液硝化处理24 h,补充体积至10 mL后使用原子吸收分光光度计测定Ag离子浓度。
等温吸附试验:准确称取0.10 g吸附剂,分别放入50 mL聚丙烯离心管中,加入25 mL浓度为10~500 mg·L-1的Ag NPs溶液(电解质为10 mmol·L-1的NaNO3,pH值为6.5±0.1)后,立刻放入恒温振荡机(25 ℃,150 r·min-1)中振荡48 h,然后10 000 g 离心10 min,取上清液至10 mL试管中,加入30%的硝酸溶液硝化处理24 h,补充体积至10 mL后使用原子吸收分光光度计测定Ag离子浓度。空白对照处理组只加Ag NPs溶液,其他操作同上。
1.4 环境因素对Ag NPs吸附的影响利用单点吸附试验考察了离子强度、离子种类和电解质pH对Ag NPs的吸附影响。选取50 mg·L-1的Ag NPs溶液作为初始浓度,离子强度和离子种类的试验中,NaNO3溶液和Ca(NO3)2溶液的离子强度设置为20、40、60、80、100 mmol·L-1,电解质pH试验中pH设置为4、5、6、7、8、9、10。每个处理均设置3个重复试验。
1.5 数据分析试验所得数据经过Office 2007处理后使用SAS 8.0软件进行差异显著性检验(P < 0.05),并使用Ori⁃ gin 8.6软件整理并对结果进行经典模型拟合。
Ag NPs在碳基材料上的动力学试验结果使用准一级动力学模型和准二级动力学模型进行拟合:

|
(1) |

|
(2) |

|
(3) |
式中:qe和qt分别是吸附平衡时和在时间t时碳基材料的吸附量,mg·g-1;k1是准一级动力学模型的吸附速率常数,g·mg-1·min-1;k2是准二级动力学模型的吸附速率常数,g·mg-1·min-1;Ki是总扩散常数,mg·g-1·min-1/2;L是内扩散模型拟合线与纵轴的截距,mg·g-1。
Ag NPs在碳基材料上的吸附等温曲线分别用Langmuir模型和Freundlich模型进行拟合:

|
(4) |

|
(5) |
式中:qm是Ag NPs在吸附上的饱和吸附量,mg·g-1;qe是吸附剂吸附Ag NPs的平衡吸附量,mg·g-1;Ce是Ag NPs的平衡浓度,mg·L-1;kL是Langmuir模型的吸附平衡常数,L·mg-1;kF是Freundlich模型的吸附平衡常数,mg(1-1/n)·L1/n·g-1;n值反映吸附作用强度。
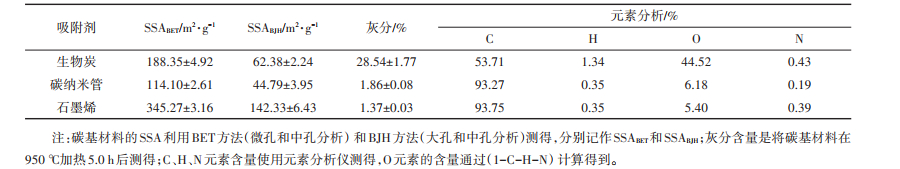
2 结果与讨论 2.1 碳基材料和Ag NPs的基本理化性质3种碳基材料的部分理化性质如表 1所示。GP的SSA最大,是CNTs的3倍多,BC的SSA次之,表明了在一定程度上GP的吸附潜力最大。BC的灰分含量要远高于CNTs和GP,这主要是水稻在生长发育时期吸收并积累了大量的矿质营养元素(K+、Mg2+、Ca2+等)造成的。通过分析3种碳基材料的元素含量,我们发现GP、CNTs和BC的(O+N)/C原子比依次升高,说明GP的极性最弱,疏水性最强,CNTs次之,BC的极性最强,疏水性最弱[19]。
|
|
表 1 3种碳基材料的部分理化性质 Table 1 Some physic-chemical properties of three kinds of carbon-based materials |
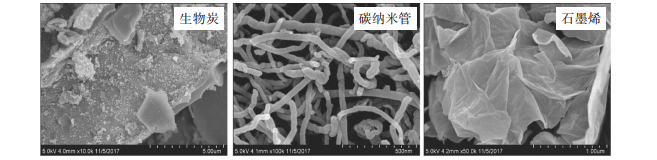
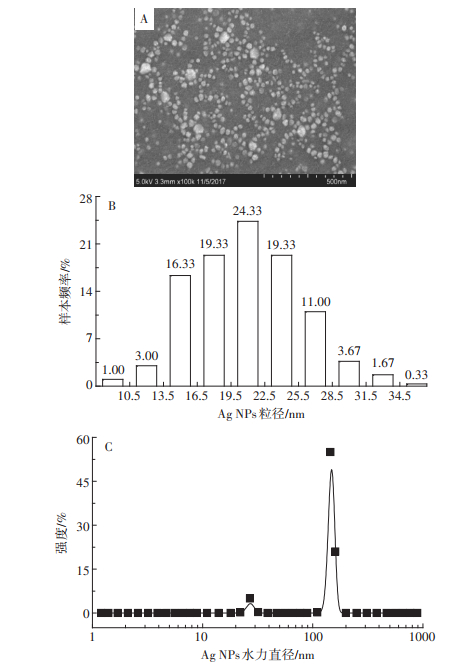
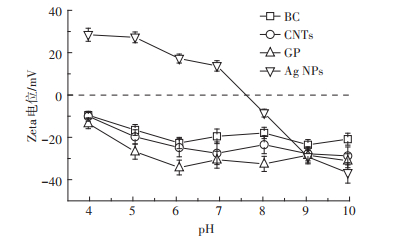
3种碳基材料的扫描电镜测试图像见图 1。通过图像可以看出水稻壳已经碳质化,转化成了BC,CNTs呈现出相互缠绕的形态,管身较直,而GP是单层的片状结构,并且有一定的褶皱,这些特征均有利于Ag NPs的吸附。通过对Ag NPs颗粒的扫描电镜测试(图 2A),发现Ag NPs的粒径符合正态分布(图 2B),超过90%的Ag NPs颗粒的粒径在13.5~28.5 nm之间,有少数的Ag NPs颗粒比较大,是因为部分Ag NPs颗粒发生了团聚。动态光散射结果显示Ag NPs颗粒的水动力学直径为145.4 nm(图 2C),显著大于扫描电子显微镜(SEM)的测试结果,这是由于动态光散射测定的结果不仅包含Ag NPs颗粒的直径,还有CMC包被层和结合水分子的厚度[12]。合成的Ag NPs的零电位点在pH 7~8之间(图 3),因此在进行等温吸附过程中,Ag NPs颗粒表面带正电荷。
|
图 1 碳基材料的扫描电镜图 Figure 1 The SEM of carbon based materials |
|
图 2 合成的Ag NPs扫描电镜图(×100 000倍)及粒径分布 Figure 2 The SEM of synthetic Ag NPs(×100 000 times)and size distribution |
|
数值是3次重复的平均值与标准误 Values are given as mean±SD from triplicate determinations 图 3 碳基材料和Ag NPs在不同pH介质中的Zeta电位 Figure 3 The zeta potentials of carbon-based materials and Ag NPs at different pH mediums |
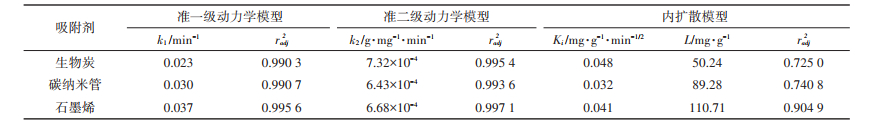
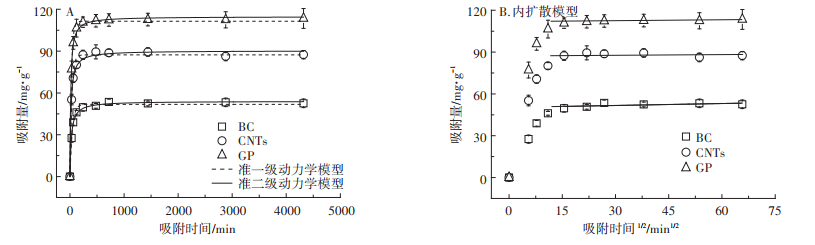
吸附动力学试验对于吸附研究具有重要意义,因为它可以预测Ag NPs在水环境中吸附到碳基材料表面上的速率和达到吸附平衡的反应时间,为理解吸附反应机理提供有价值的依据。图 4展示了Ag NPs在BC、CNTs和GP上的吸附动力学结果,尽管Ag NPs的吸附过程均经历一个快速吸附、吸附减缓和吸附平衡的过程,但是GP达到吸附平衡需要的时间最少,其次是CNTs,BC达到吸附平衡所需时间最多。此外,利用准一级动力学模型、准二级动力学模型和内扩散模型对动力学结果进行拟合,相关参数如表 2所示。通过比较准一级和准二级动力学模型的调整后的相关系数(radj2),发现准二级动力学模型能够更好地拟合Ag NPs在BC、CNTs和GP上的吸附过程。如图 4A所示,在0~60 min内是一个非常快速的吸附行为,这个阶段已经完成了4/5的吸附过程,主要归因于反应刚开始进行时,碳基材料表面具有大量“空闲”的吸附位点,可以快速吸附溶液中的Ag NPs。随后Ag NPs的吸附速率减缓,最终在240 min达到吸附平衡。出现这种现象是由于经过前期的吸附,多数碳基材料表面的吸附位点被Ag NPs占据,碳基材料剩余的吸附位点减少,导致单位时间内吸附到碳基材料表面的Ag NPs数量减少,即吸附速率降低[20]。
|
图 4 Ag NPs在不同碳基材料上的准一级与准二级动力学模型和内扩散模型拟合结果 Figure 4 The sorption kinetics of Ag NPs on different carbon-based materials |
|
|
表 2 准一级动力学、准二级动力学模型和内扩散模型的参数 Table 2 Simulated parameters of pseudo-first-order model and pseudo-second-order model |
从图 4B中可以明显看出Ag NPs的吸附拟合过程可以分成两个区域:0~15.49 min1/2的弯曲部分(表面吸附过程)和21.91~65.73 min1/2的直线部分(内扩散过程),并且在3种材料上的直线部分都没有经过原点。这表明了Ag NPs在碳基材料上的吸附速率受内扩散和其他过程共同控制。
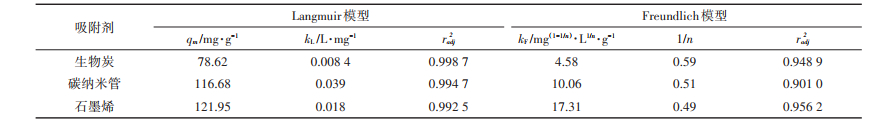
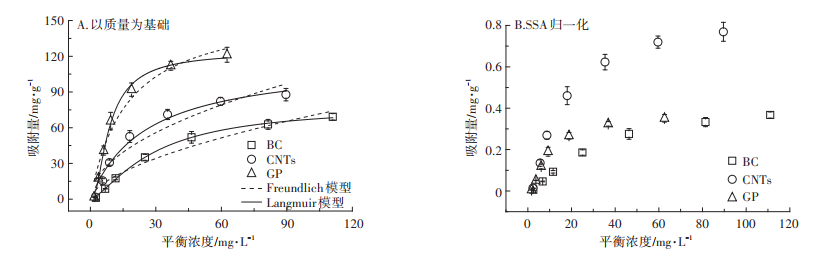
2.3 等温吸附特征Ag NPs在BC、CNTs和GP上的等温吸附特性如图 5A所示,Ag NPs在碳基材料上的吸附量均随着溶液中Ag NPs浓度的增大而升高。虽然Ag NPs在碳基材料上的吸附趋势相似,但是BC、CNTs和GP的最大吸附量有显著性差异。在试验范围内,Ag NPs在BC、CNTs和GP上的最大吸附量分别为69.15、87.78、121.21 mg·g-1,GP对Ag NPs的吸附量接近BC的两倍。等温吸附试验的结果利用Langmuir模型和Freundlich模型进行拟合,相关参数列于表 3。从两个模型的radj2来看,Langmuir模型的拟合结果更符合Ag NPs在碳基材料上的吸附特性,因此接下来的讨论均是基于Langmuir模型的分析。
|
图 5 Ag NPs在BC、CNTs和GP上的吸附特征 Figure 5 Adsorption isotherms of Ag NPs on BC, CNTS and GP |
|
|
表 3 Langmuir模型和Freundlich模型的部分参数 Table 3 Simulated parameters of Ag NPs adsorption on carbon-based materials by Langmuir and Freundlich models |
Langmuir模型假设一旦吸附质分子占据了吸附剂的一个吸附位点,就不会在这个位置发生进一步的吸附,这表明Ag NPs粒子是单层形式吸附于3种碳基材料的表面,因此材料的SSA是影响其吸附能力的一个重要因素,而且本试验使用的3种碳基材料的SSA相差很大(表 1),因此我们对吸附剂进行了SSA归一化处理,结果如图 5B所示。经过SSA归一化处理后,BC和GP达到吸附饱和后的吸附量基本相同,这说明SSA是影响BC和GP吸附Ag NPs的唯一因素。反观CNTs对Ag NPs的吸附量,与BC和GP的吸附量出现了明显的差异,说明对于CNTs来说,SSA不是影响Ag NPs吸附的唯一因素,这可能与CNTs特殊的结构有关。CNTs在生产过程中管壁会出现一些缺陷,导致CNTs的内管壁暴露在外,为Ag NPs提供了大量的吸附位点[21],而BC尽管保留了原材料的蜂窝状结构,使得大孔(孔径 > 50 nm)成为BC孔的主要存在形式,但是微孔(孔径 < 2 nm)贡献了BC的大部分SSA[22],导致BC的“有效SSA”比CNTs的小,因此CNTs对Ag NPs的吸附量比BC和GP的高。
2.4 环境因素对Ag NPs吸附的影响 2.4.1 离子强度和离子种类对Ag NPs吸附的影响本试验选取了环境中非常具有代表性的Na+和Ca2+,探究了不同离子强度和离子种类对碳基材料吸附Ag NPs的影响,结果如图 6所示。对于不同Na+强度(图 6A),随着Na+强度的增加,BC、CNTs和GP对Ag NPs的吸附量分别升高了13.81%、22.21%和9.98%。但是Na+强度的变化对BC、CNTs和GP吸附Ag NPs没有显著性影响。然而Ca2+的试验中出现了完全相反的现象(图 6B),即随着Ca2+强度的增加,BC、CNTs和GP对Ag NPs的吸附量降低,分别降低了3.20%、1.95%和12.23%,而且Ca2+强度在40 mmol·L-1和100 mmol·L-1时GP对Ag NPs的吸附量出现了显著性降低(P < 0.05),但是Ca2+强度的变化对BC和CNTs没有显著性影响。
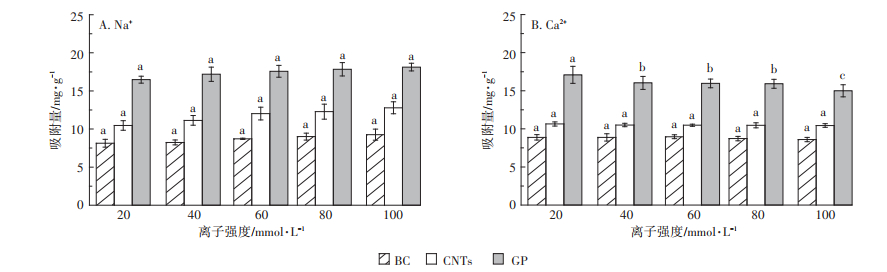
|
柱上不同的小写字母表示差异显著(P < 0.05)。下同 图 6 不同离子强度和离子种类对Ag NPs在吸附剂上的吸附特征 Figure 6 Effect of ionic strength and ionic species on Ag NPs adsorption |
离子强度可以从两方面来影响Ag NPs在吸附剂上的吸附。一方面,增加离子强度可以促进BC、CNTs和GP形成紧凑致密的结构(挤压效应)[23],因此减少吸附剂对Ag NPs的吸附量。另一方面,Fontecha[1]Cámara等[24]发现由于静电屏蔽效应或者盐析效应,离子强度的增加会促进吸附剂的吸附。因此离子强度对吸附的净影响依赖上述两个相反效应的相对贡献。随着Na+强度的增加,碳基材料对Ag NPs的吸附量增加,但是没有显著性的变化,因此在本试验中Na+强度变化(20~100 mmol·L-1)不会显著性影响碳基材料对Ag NPs的吸附。而增加Ca2+强度时,Ca2+被表面带负电荷的碳基材料吸附,致使碳基材料因静电斥力降低而产生挤压效应,同时GP在较低离子强度(10 mmol·L-1)下已经达到了自身的临界凝聚浓度[25],非常容易发生团聚,导致GP对Ag NPs的吸附量出现了显著性降低。
2.4.2 电解质pH对Ag NPs吸附的影响电解质pH变化对碳基材料吸附Ag NPs的影响如图 7。随着电解质pH值的升高,碳基材料对Ag NPs的吸附量逐渐减少,在pH 10表现出了非常低的吸附水平,与pH 4时相比,BC、CNTs和GP的吸附量分别降低了10.15%、24.90%和22.65%。由于Ag NPs的零电位点在pH 7~8之间,因此电解质pH高于8时,Ag NPs颗粒表面发生去质子化反应,使其呈现电负性,因此表面均携带负电荷的碳基材料产生静电排斥,致使Ag NPs的吸附量降低。随着pH的降低,Ag NPs颗粒的表面由于质子化反应而带有大量的正电荷,与呈现电负性的碳基材料之间形成较强的静电引力,使得Ag NPs颗粒相对容易地被吸附在碳基材料上,从而增加了吸附量。不同pH值条件下,CNTs和GP对Ag NPs的吸附量变化比BC的大,是由于前二者表面的官能团含量较后者的少(表 1),对于H+浓度变化起到的“缓冲作用”较弱。
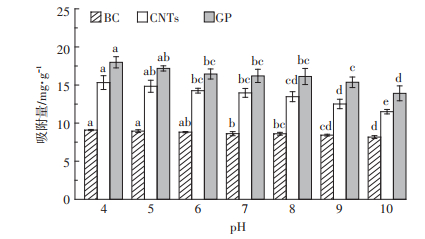
|
图 7 pH对Ag NPs在BC、CNTs和GP上的吸附影响 Figure 7 Effect of pH on the Ag NPs adsorption on BC, CNTs and GP |
CNTs和GP由于其合成方式和固有的结构,不会含有CO32-、PO43-等阴离子和K+、Mg2+等阳离子,因此CNTs和GP吸附Ag NPs时不会发生沉淀作用和离子交换作用。通过表 1的元素分析,CNTs和GP表面的含氧官能团数量要比BC的少,所以官能团与Ag NPs之间发生络合作用而固定的Ag NPs比较少。以前的科学研究发现,吸附过程,特别是纳米颗粒和吸附剂表面之间的吸附过程中,静电相互作用被认为是最重要的吸附作用[26]。本试验中的CNTs和GP的表面与Ag NPs颗粒表面带有相反的电荷,可以通过静电引力将Ag NPs固定到CNTs和GP上。另外,Zhang等[27]发现金纳米颗粒可以通过范德华力和碳纳米管相互作用,而银和金是同族元素,外层电子排布相似,因此Ag NPs颗粒可能通过范德华力和CNTs与GP相互作用。由于CNTs管壁缺陷导致孔道的开放,形成了CNTs的分子筛效应,使CNTs的内外管壁均可以吸附Ag NPs颗粒,同时使粒径较小的Ag NPs能够进入CNTs内,并短暂存留,因此,整体上提高了CNTs的吸附性能;而占BC主要形式的大孔的比例比较低,使BC的“有效SSA”降低;GP由于是单原子层的准二维材料,主要依靠裸露的吸附位点吸附Ag NPs粒子。因此在SSA归一化后CNTs对Ag NPs的吸附量最高,而不是BC和GP。
水稻在生长过程中会从外界吸收大量的K+、Ca2+、Mg2+等营养元素满足自身所需,造成水稻壳中积聚了大量的矿质元素,经过高温热解处理,BC不仅表面会出现羟基、羧基等官能团,而且还会有大量的矿质元素残留在其中。在pH 7.0左右时,BC的表面呈现电负性,而Ag NPs颗粒表面被正电荷包覆,因此BC上的含氧官能团能和Ag NPs颗粒通过络合作用、BC裸露表面和Ag NPs颗粒通过静电作用结合在一起[28]。由于Ag NPs颗粒能够向环境中释放更小的纳米颗粒和Ag+[29],因此Ag+可以和BC中含有的Na+、K+、Mg2+等矿质元素发生离子交换,使Ag+被固定到BC上[28],进而使溶液中的Ag NPs颗粒不断地向溶液释放Ag+。同时,BC所含有的一些阴离子(CO32-、PO43-等)能够与Ag+和Ag NPs颗粒发生沉淀作用而被固定到BC上。
3 结论(1)Ag NPs颗粒在碳基材料上更加符合准二级动力学模型,整个吸附过程包括快速吸附和缓慢吸附两个阶段,并且吸附240 min后能够达到吸附平衡;Ag NPs在碳基材料上的吸附速率主要受内扩散和其他过程控制。
(2)Langmuir模型较Freundlich模型能够更好地拟合等温吸附试验结果,表明Ag NPs在碳基材料上是单层吸附,而且Ag NPs在BC、CNTs和GP上的吸附容量依次升高;BC是利用络合作用、离子交换作用、沉淀作用以及静电作用吸附溶液中的Ag NPs,而CNTs和GP主要是通过静电作用和范德华力固定Ag NPs颗粒。
(3)离子强度和离子种类主要通过静电屏蔽效应影响Ag NPs在碳基材料上的吸附,而介质的pH主要是通过改变Ag NPs的表面电荷来改变其与碳基材料的静电相互作用力影响吸附。
| [1] |
张立德, 牟季美. 纳米材料和纳米结构[M]. 北京: 科学出版社, 2001, 1-3. ZHANG Li-de, MOU Ji-mei. Nanomaterials and nanostructures[M]. Beijing: The Science Publishing Company, 2001, 1-3. |
| [2] |
Brust M, Kiely C J. Some recent advances in nanostructure preparation from gold and silver particles:A short topical review[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2002, 202(2/3): 175-186. |
| [3] |
Konował E, Sybis M, Modrzejewskasikorska A, et al. Synthesis of dextrin-stabilized colloidal silver nanoparticles and their application as modifiers of cement mortar[J]. International Journal of Biological Macromolecules, 2017, 104: 165-172. DOI:10.1016/j.ijbiomac.2017.06.011 |
| [4] |
Bhoir S A, Chawla S P. Silver nanoparticles synthesized using mint extract and their application in chitosan/gelatin composite packaging film[J]. International Journal of Nanoscience, 2017, 16: 1650022. DOI:10.1142/S0219581X16500228 |
| [5] |
Solomon M M, Gerengi H, Umoren S A. Carboxymethyl cellulose/silver nanoparticles composite:Synthesis, characterization and application as a benign corrosion inhibitor for St37 steel in 15% H2SO4 medium[J]. Applied Materials and Interfaces, 2017, 9(7): 6376-6389. DOI:10.1021/acsami.6b14153 |
| [6] |
Sheng Z, Liu Y. Effects of silver nanoparticles on wastewater biofilms[J]. Water Research, 2011, 45(18): 6039-6050. DOI:10.1016/j.watres.2011.08.065 |
| [7] |
Li Y, Qin T C, Ingle T, et al. Differential genotoxicity mechanisms of silver nanoparticles and silver ions[J]. Archives of Toxicology, 2017, 91(1): 1-11. DOI:10.1007/s00204-016-1805-9 |
| [8] |
Impellitteri C A, Tolaymat T M, Scheckel K G. The speciation of silver nanoparticles in antimicrobial fabric before and after exposure to a hypochlorite/detergent solution[J]. Journal of Environmental Quality, 2009, 38(4): 1528-1530. DOI:10.2134/jeq2008.0390 |
| [9] |
Jiang H S, Yin L, Ren N N, et al. The effect of chronic silver nanoparticles on aquatic system in microcosms[J]. Environmental Pollution, 2017, 223: 395-402. DOI:10.1016/j.envpol.2017.01.036 |
| [10] |
Peretyazhko T S, Zhang Q, Colvin VL. Size-controlled dissolution of silver nanoparticles at neutral and acidic pH conditions:Kinetics and size changes[J]. Environmental Science and Technology, 2014, 48(20): 11954-11961. DOI:10.1021/es5023202 |
| [11] |
Li X, Lenhart J J. Aggregation and dissolution of silver nanoparticles in natural surface water[J]. Environmental Science and Technology, 2012, 46(10): 5378-5386. DOI:10.1021/es204531y |
| [12] |
Badawy A M E, Luxton T P, Silva R G, et al. Impact of environmental conditions(pH, ionic strength, and electrolyte type)on the surface charge and aggregation of silver nanoparticles suspensions[J]. Environmental Science and Technology, 2010, 44(4): 1260-1266. DOI:10.1021/es902240k |
| [13] |
Li C L, Schäffer A, Séquaris J M, et al. Surface-associated metal catalyst enhances the sorption of perfluorooctanoic acid to multi-walled carbon nanotubes[J]. Journal of Colloid and Interface Science, 2012, 377(1): 342-346. DOI:10.1016/j.jcis.2012.03.038 |
| [14] |
杜欢, 王玉军, 李程程, 等. 纳米Ag在四种不同性质土壤上的吸附行为研究[J]. 农业环境科学学报, 2015, 34(6): 1069-1075. DU Huan, WANG Yu-jun, LI Cheng-cheng, et al. Sorption of silver nanoparticles on four soils with different characteristics[J]. Journal of Agro-Environment Science, 2015, 34(6): 1069-1075. |
| [15] |
Yakout A A, Elsokkary R H, Shreadah M A, et al. Cross-linked graphene oxide sheets via modified extracted cellulose with high metal adsorption[J]. Carbohydrate Polymers, 2017, 172: 20-27. DOI:10.1016/j.carbpol.2017.05.004 |
| [16] |
Abdi J, Vossoughi M, Mahmoodi N M, et al. Synthesis of metal-organic framework hybrid nanocomposites based on GO and CNT with high adsorption capacity for dye removal[J]. Chemical Engineering Journal, 2017, 326: 1145-1158. DOI:10.1016/j.cej.2017.06.054 |
| [17] |
Zare K, Gupta V K, Moradi O, et al. A comparative study on the basis of adsorption capacity between CNTs and activated carbon as adsorbents for removal of noxious synthetic dyes:A review[J]. Journal of Nanostructure in Chemistry, 2015, 5(2): 227-236. DOI:10.1007/s40097-015-0158-x |
| [18] |
Conde-González J E, Peña-Méndez E M, Rybáková S, et al. Adsorption of silver nanoparticles from aqueous solution on copper-based metal organic frameworks(HKUST-1)[J]. Chemosphere, 2016, 150: 659-666. DOI:10.1016/j.chemosphere.2016.02.005 |
| [19] |
王定美, 王跃强, 余震, 等. 污泥与稻秆共热解对生物炭中碳氮固定的协同作用[J]. 环境科学学报, 2015, 35(7): 2202-2209. WANG Ding-mei, WANG Yue-qiang, YU Zhen, et al. Synergistic effect on carbon and nitrogen fixation of biochar during co-pyrolysis of sewage sludge and rice straw[J]. Acta Scientiae Circumstantiae, 2015, 35(7): 2202-2209. |
| [20] |
Apul O G, Shao T, Zhang S, et al. Impact of carbon nanotube morphology on phenanthrene adsorption[J]. Environmental Toxicology and Chemistry, 2012, 31(1): 73-78. DOI:10.1002/etc.705 |
| [21] |
Ji L, Chen W, Duan L, et al. Mechanisms for strong adsorption of tetracycline to carbon nanotubes:a comparative study using activated carbon and graphite as adsorbents[J]. Environmental Science and Technology, 2009, 43(7): 2322-2327. DOI:10.1021/es803268b |
| [22] |
Lehmann J. Bio-energy in the black[J]. Frontiers in Ecology and the Environment, 2007, 5(7): 381-387. DOI:10.1890/1540-9295(2007)5[381:BITB]2.0.CO;2 |
| [23] |
Cho H H, Huang H, Schwab K. Effects of solution chemistry on the adsorption of ibuprofen and triclosan onto carbon nanotubes[J]. Langmuir, 2011, 27(21): 12960-12967. DOI:10.1021/la202459g |
| [24] |
Fontecha-Cámara M A, López-Ramón M V, Alvarez-Merino M A, et al. Effect of surface chemistry, solution pH, and ionic strength on the removal of herbicides diuron and amitrole from water by an activated carbon fiber[J]. Langmuir, 2007, 23(3): 1242-1247. DOI:10.1021/la062200f |
| [25] |
Su Y, Yang G, Lu K, et al. Colloidal properties and stability of aqueous suspensions of few-layer graphene:Importance of graphene concentration[J]. Environmental Pollution, 2017, 220(Part A): 469-477. |
| [26] |
Brenner T, Paulus M, Schroer M A, et al. Adsorption of nanoparticles at the solid-liquid interface[J]. Journal of Colloid and Interface Science, 2012, 374(1): 287-290. DOI:10.1016/j.jcis.2012.02.010 |
| [27] |
Zhang Y, Franklin N W, Chen R J, et al. Metal coating on suspended carbon nanotubes and its implication to metal-tube interaction[J]. Chemical Physics Letters, 2000, 331(1): 35-41. DOI:10.1016/S0009-2614(00)01162-3 |
| [28] |
Xu X Y, Zhao Y H, Sima J, et al. Indispensable role of biochar-inherent mineral constituents in its environmental applications:A review[J]. Bioresour Technol, 2017, 241: 887-899. DOI:10.1016/j.biortech.2017.06.023 |
| [29] |
Gicheva G, Yordanov G. Removal of citrate-coated silver nanoparticles from aqueous dispersions by using activated carbon[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2013, 431(33): 51-59. |
 2018, Vol. 37
2018, Vol. 37