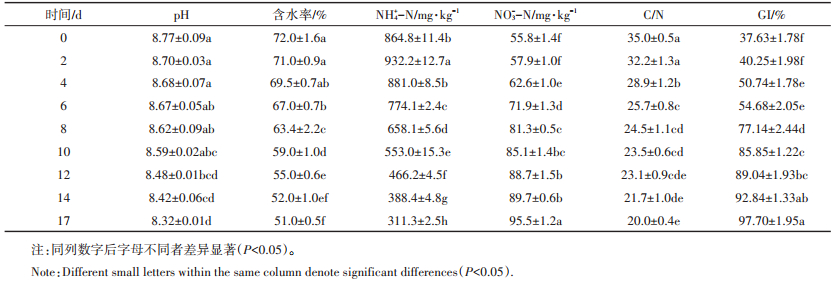
静态堆肥由于不需要扰动堆体结构,不仅可以减少机械能(翻堆、通风等)的消耗,还可以减少以铵态氮为主的含氮化合物的挥发,提高堆肥肥效[1]。但是,由于自然状态下静态堆肥的堆体中温度和氧气分布不均一,堆肥过程中会出现堆体表面温度低、堆体深层厌氧的现象,导致表层和深层堆肥效果不佳。本研究针对这一现象,设计了一种静态发酵装置(如图 1所示),通过人为地提高环境温度,同时降低堆体的厚度,旨在保持静态堆肥固有优点的同时,克服其“堆体表面温度低、堆体深层厌氧”等技术缺陷。
|
图 1 堆肥装置的横截面 Figure 1 Cross section of the composting system |
堆肥实质上是一个微生物演替过程,其微生物类群和丰度决定了堆肥的质量[2]。细菌在堆肥过程中种类繁多,数量庞大,相关报道较多[3]。真菌作为堆肥微生物群落的重要组成部分,在堆肥过程中也起着重要的作用[4]。但是,目前国内外对堆肥过程中真菌群落变化规律的研究报道还比较少[5]。
近年来,研究者采用T-RFLP[6]、PCR-DGGE[7-10]、16S rRNA克隆文库[11]等方法分析了堆肥过程中微生物群落结构的变化,但是这些分子生物学方法分辨率较低,不能全面和准确地反映堆肥微生物群落结构。高通量测序技术的出现,可以使人们更准确地描述微生物群落的动态变化及多样性、研究高度复杂的微生物类群[12]。
本研究采用一种新型的静态堆肥技术处理奶牛粪污,通过测定堆肥过程中温度、pH、碳氮比和种子发芽指数(GI)等指标评价堆肥产品的腐熟程度。利用高通量测序技术分析堆肥过程中真菌的群落结构,揭示新型静态堆肥过程中真菌群落组成的动态变化,并探讨群落组成与堆肥理化指标及GI指标之间的相关关系。
1 材料与方法 1.1 试验装置本试验装置的截面如图 1所示。装置由两个拼接在一起的由铁丝网编织成的同轴圆筒组成,距离地面高20 cm。其内筒直径60 cm,外筒直径180 cm,高为160 cm。堆肥原料填充在两个圆筒的夹层中间(堆肥物料厚度为60 cm),形成一个中空的圆柱体(可以容纳3.62 m3堆肥原料),这样堆肥原料的内表面和外表面都能接触空气,保证堆体内的氧气充足。将该装置置于发酵仓内,发酵仓内温度保持在40 ℃左右,并定期通风,保持仓内空气新鲜。
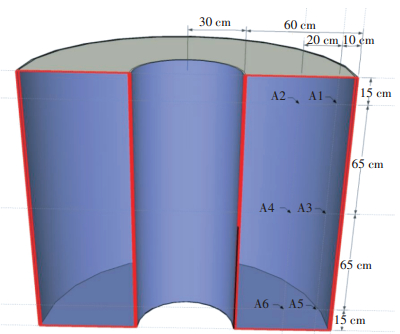
1.2 堆肥原料及样品采集堆肥的原料为充分混匀的新鲜牛粪与切碎至长度为3 cm左右的水稻秸秆(表 1),其初始碳氮比为35:1。堆肥持续17 d。分别在第0、2、4、6、8、10、12、14 d和17 d时进行取样。取样时,分别从堆体的三个不同层(分别为:距离堆体底部15 cm—A5和A6点;距离堆体底部80 cm—A3和A4点;距离堆体底部145 cm—A1和A2点),以及每一层的两个不同深度(外层:距离堆体外表面10 cm—A1、A3和A5点;中心:距离堆体外表面30 cm—A2、A4和A6点)进行取样(图 1),每个取样点三次重复,所有点的样品充分混匀后,为这个时期的样品。另外,第0 d(初始期)、第2 d(升温期)、第6 d(高温期)、第12 d(高温期后期)和第17 d(腐熟期)不同层及不同深度的混合后样品置于-80 ℃环境下保存,用于后续分子实验分析,并分别命名为C0、C2、C6、C12和C17样品。
|
|
表 1 堆肥材料的主要成分 Table 1 Properties of raw materials for composting |
在堆体不同深度(距离堆体外表面10 cm和30 cm)的上、中、下三层(距离堆体底部15、80 cm和145 cm)的6个不同位置,每日使用精密温度计分别测其温度并取外层(距离堆体外表面10 cm)及中心(距离堆体外表面30 cm)的不同层温度的平均值,同时记录上、中、下三层的环境温度。含水率的测定采用恒重法,将混匀后的堆肥样品在105 ℃下烘干至恒质量,然后进行计算,得出含水率数值。pH的测定是将堆肥样品按1:10(质量浓度)比例加入去离子水,振荡过滤后的滤液用数字pH仪测定。全碳和全氮分别采用重铬酸钾容量法和凯氏定氮法[13]测定,两者的比值即为碳氮比(C/N)。水溶性铵态氮和硝态氮的测定是将堆肥样品以2 mol·L-1氯化钾溶液浸提,采用连续流动分析仪(SAN++ SYSTEM,荷兰)测定其含量。种子发芽指数使用独行菜(Lepidium sativum L.)种子[14]测定。方法为将堆肥样品按1:7.5(质量浓度)比例加入去离子水,取5 mL提取液滴入含有滤纸的培养皿中,并将20粒种子均匀分布在滤纸上,在25 ℃黑暗条件下培养48 h。根据计算公式:GI=处理平均发芽率×处理平均根长(/对照平均发芽率×对照平均根长)× 100%,计算种子发芽指数。以上除温度外的其他指标,每个样品均进行三次重复测定。
1.4 真菌ITS基因测序使用OMEGA的Soil DNA Isolation Kit(Omega Bio-Tek,Inc.,GA,USA)提取堆肥样品总DNA,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。然后进行堆肥真菌总DNA-ITS序列的PCR检测。ITS序列引物[15]为ITS1F:5′ - CTTGGTCATTTAGAGGAAGTAA-3′;ITS2R:5′-GCTGCGTTCTTCATCGATGC-3′。扩增条件为:95 ℃预变性3 min,接着进行35个循环,包括95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,循环结束后72 ℃最终延伸10 min。PCR产物用2%琼脂糖凝胶电泳检测。高通量测序在上海美吉生物医药科技有限公司的Illumina Miseq PE300平台进行。原始数据提交至NCBI数据库,登录号为:SRP121517。
1.5 生物信息处理利用Mothur(V.1.36.1)对原始DNA序列进行过滤处理,去除嵌合体,得到优化序列;按照97%相似性将优化序列划分可操作分类单元(OTU,Operational Taxonomic Units);基于OTU进行稀释性曲线分析,并计算Chao1丰富度指数,覆盖度(Coverage)和Shannon多样性指数等。利用主成分分析(PCA)分析各样间OTU相似性。对比Unite(Release 6.0 http://unite.ut.ee/index.php)的真菌数据库,采用RDP分类器(Version 2.2 https://rdp.cme.msu.edu/)贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并在各个分类水平上统计每个样品的群落组成;利用Spearman相关性矩阵研究堆肥样品的理化及GI指标与真菌群落的关系。
1.6 统计分析采用Microsoft Excel 2016软件对数据进行处理和分析。用SPSS 22.0软件的单因素方差分析(ANOVA)进行差异显著性检验(Tukey HSD法),差异显著性水平为0.05。
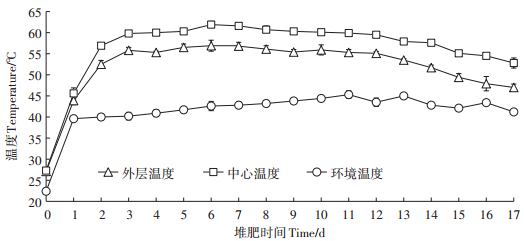
2 结果与讨论 2.1 堆肥过程中理化及GI指标的变化堆肥过程中,微生物快速分解有机质,产生CO2和水,并释放出大量的热,使堆肥物料的温度上升。堆肥过程中温度的变化可反映微生物活性的变化和有机质的降解程度,并影响最终堆肥产品的成熟度和质量[16]。图 2表示堆肥过程中温度的变化,从图中可以看出,外层和中心温度在堆肥开始后均迅速升高,在第3 d分别达到55.8 ℃和59.8 ℃;然后温度保持上升趋势并都在第6 d达到最高温度,分别为56.9 ℃和61.9 ℃。外层和中心的温度从第3 d直到第12 d均保持在55 ℃以上,在第12 d后,温度呈缓慢降低趋势。堆肥过程中温度的变化表明了三个阶段:(1)升温期(第0~2 d);(2)高温期(第3~12 d,>55 ℃);(3)降温及腐熟期(第13~17 d)。根据国家粪便无害化卫生标准(GB 7959—1987)规定,堆肥过程的温度必须达50~55 ℃,并持续5~7 d。本研究中,外层和中心温度连续9 d保持在55 ℃以上,所以无论堆肥物料的外层还是中心部分,其温度均符合标准。
|
图 2 堆肥过程中温度的变化 Figure 2 Changes of temperature during composting process |
堆肥过程中除温度外的其他指标如表 2所示。随着堆肥的进程,pH保持下降的变化趋势,与堆肥初始阶段的8.77相比,堆肥结束后,pH显著下降至8.32(P < 0.05),主要由于堆肥中的微生物的代谢作用造成有机酸的大量积累[17]。有报道称,腐熟堆肥的pH范围在7.0~8.5[18]。本实验最终堆肥产物的pH在此范围内,故其pH符合腐熟堆肥的标准;堆肥过程中含水率保持降低的趋势,堆料水分由最初的72.0%显著降低至51.0%(P < 0.05),但是一般腐熟的堆肥产品含水量为40%左右[19-20]。这是由于本研究使用新型静态好氧堆肥,在堆肥过程中无需进行翻堆,水分损失较少,因此最终堆肥产物含水率相对略高。
|
|
表 2 堆肥过程中理化及GI指标的变化 Table 2 Changes of physicochemical and GI indices during composting process |
随着堆肥的进程,铵态氮含量变化呈现先升后降的趋势。在第0~2 d,铵态氮含量从864.8 mg·kg-1显著上升至932.2 mg·kg-1(P < 0.05),从第4 d开始,铵态氮含量呈显著下降趋势(P < 0.05),并在堆肥结束后达到最低,为311.3 mg·kg-1。这是由于在堆肥前期,微生物氨化作用及矿化作用加速了氮素的分解,所以铵态氮含量不断上升。而堆肥后期由于硝化作用,部分铵态氮转化为硝态氮,加之氨气挥发和转化导致铵态氮含量的下降[21]。堆肥过程中硝态氮含量呈上升的趋势,由初始阶段55.8 mg·kg-1的硝态氮含量显著上升至堆肥结束后的95.5 mg·kg-1(P < 0.05)。可能是由于过高的温度抑制了硝化微生物的活性[22-23],使硝态氮生成和积累的速度缓慢。
碳氮比(C/N)是评价堆肥腐熟的重要指标[21],并且可以影响堆肥过程中微生物群落的组成[24]。本研究中初始C/N为35.0,堆肥结束时显著降低至20.0(P < 0.05),依据Xiao等[25]提出的堆肥腐熟度C/N标准,此堆肥产物达到腐熟堆肥的碳氮比的标准。种子发芽指数(GI)是指示堆肥腐熟程度的直接指标[21]。一般认为,GI达到80.0%意味着植物毒性的丧失和堆肥的腐熟[21, 26]。本实验中GI从37.63%显著上升至97.70%(P < 0.05),表明最终堆肥产物已经丧失植物毒性,并符合腐熟堆肥的GI标准。
根据堆肥过程中温度、pH、碳氮比(C/N)和种子发芽指数(GI)等指标综合推断,本实验中采用的新型静态堆肥技术处理牛粪+稻草秸秆,在堆肥17 d可以使牛粪堆肥达到腐熟。该技术采用中空网状的圆柱体装载堆肥物料,可以保证空气从内外两个表面进入堆体,在控制堆体厚度的前提下(60 cm),保证了堆体中氧气的供应。同时通过提高环境温度,避免了堆体表面低温层的出现。这样,就保证了整个堆体处于高温和好氧的状态,可以加速堆肥的进程。另外,每个堆体(空心圆柱体)的容积为3.62 m3,在实际生产中可以通过增加堆体的数量来增加该技术的处理能力。因此,该技术在生产实践中具有一定的使用价值。
2.2 静态堆肥过程中真菌群落的丰富度及多样性表 3为5个堆肥样品中的优化序列、OTU数量及覆盖率。5个堆肥样品的高通量测序共获得191 499条高质量序列。其中,C0、C2、C6、C12和C17样品高质量序列分别有35 854、40 426、39 689、41 227条和34 303条。以97%相似度划分,共得到301个OTUs。其中,C2样品的OTU数量最高(216),其次为C0(168),C12(126)和C6(120),C17(44)最低。以上数据表明随着堆肥的进程,检测到OTU的数量呈先增加后减少的趋势。各样品文库的覆盖率(Coverage)均超过99.9%,说明堆肥样品中基因序列被检出的概率很高,本次测序结果能够代表堆肥中真菌群落的真实情况。
|
|
表 3 堆肥样品中真菌丰富度与多样性 Table 3 Fungal richness and diversity in composting samples |
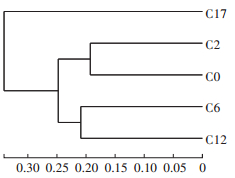
根据5个堆肥样品中OTU的组成进行样本聚类分析(图 3),堆肥初始样本(C0)与升温期样本(C2)之间的距离最近,表明两者OTU组成相近;高温期样本(C6)与高温期末期样本(C12)的OTU组成也相近,差异性略大于C0与C2;C0、C2与C6、C12样本间差异较大,但差异性远小于堆肥腐熟期样本(C17)与其他四个样本。结果表明堆肥初始样本(C0)与升温期样本(C2)OTU水平相似,腐熟期样本(C17)与其他样本真菌菌群的相似性较低。
|
图 3 不同堆肥时期样品中真菌群落组成的聚类图 Figure 3 Hierarchical clustering figure of fungal communities in different compost samples |
本研究共获得4门17纲43目72科118属。在门分类水平上属于4个类群(图 4A),主要包括:子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)和未分类真菌界(Unclassified Fungi)。其中,子囊菌门在所有样本中的相对丰度为6.25%~ 90.83%。从堆肥的初始阶段(C0)至升温期(C2),子囊菌门的相对丰度由6.25%增加至47.42%,成为最优势类群;在高温期时(C6)达到最高(90.83%),并且随着堆肥进程的推进,其相对丰度一直保持在75.00%以上。随着堆肥进程,子囊菌门逐渐成为最优势类群,其主要原因是子囊真菌能够分泌多种纤维素、半纤维素降解酶,能高效地利用堆肥中的营养元素[27-28]。担子菌门的相对丰度变化与子囊菌门相反,其在堆肥初始阶段(C0)相对丰度最高(83.13%),当堆肥进程达到高温期(C6)时,下降至7.97%。从高温期末期(C12)开始,其相对丰度有所上升并保持在22.00%左右。此结果表明,担子菌门真菌受温度影响较大,随着堆体温度升高,担子菌门相对丰度下降。接合菌门仅在升温期(C2)和高温期末期(C12)被检测到,其相对丰度分别为0.06%和0.04%。
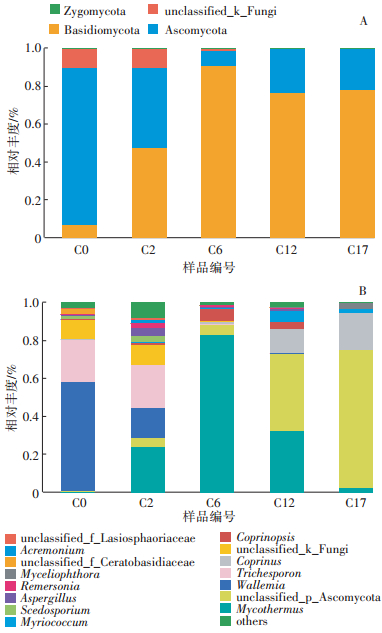
|
图 4 堆肥样品中真菌在门(A)及属(B)分类水平上群落组成的动态变化 Figure 4 Dynamic changes of community composition of fungi during composting process at the level of phylum(A)and genus(B) |
在属分类水平上(图 4B),优势类群主要包括(至少在一个样品中相对丰度>1.0%):嗜热链球菌属(Mycothermus)、未分类的子囊菌门(Unclassified Ascomycota)、节担菌属(Wallemia)、毛孢子属(Trichosporon)、鬼伞属(Coprinus)、未分类的真菌(Unclassified Fungi)、拟鬼伞属(Coprinopsis)、团丝核属(Myriococcum)、散孢霉属(Scedosporium)、曲霉属(Aspergillus)、Remersonia(粪壳菌纲中地位未定的属)、毁丝霉属(Myceliophthora)、未分类的角担菌科(Unclassified Ceratobasidiaceae)、枝顶孢属(Acremonium)和未分类的毛球壳科(Unclassified Lasiosphaeriaceae)。其中,嗜热链球菌属的相对丰度在堆肥进程的前期随温度的升高而增加,在高温期达到了83.15%,随后其相对丰度逐渐降低,腐熟期时仅占2.39%。嗜热链球菌属是一种嗜热真菌,能产生具有热稳定性的木质纤维素酶[29]。它耐热的特性使其在堆肥的高温期占据绝对优势,并起着降解木质纤维素的作用。节担菌属是一种广泛存在于农业环境中的半知菌,可能导致人类患病[30]。毛孢子属也被认为是人类致病真菌[3]。在堆肥的初始样品(C0)中,节担菌属与毛孢子属的相对丰度分别占57.41%和22.29%;升温期(C2)时,节担菌属下降至16.08%,毛孢子属几乎没有变化;当堆肥进程进行到高温期(C6),节担菌属和毛孢子属仅分别含有0.17%、0.63%;在堆肥进程结束时,这两个属几乎检测不到。鬼伞属在堆肥的高温期(C6)开始出现,相对丰度仅为0.62%,到高温期末期(C12)急剧增加至12.39%,随后在腐熟期(C17)达到19.50%。Klamer和Bååth在马粪与稻草堆肥的后期发现了鬼伞的子实体[31]。Novinscak等也报道称在堆肥的中后期发现了鬼伞属[5]。根据本研究结果与这些报道推测,堆肥后期物料的养分、pH和水分等理化参数适合鬼伞属的生长。未分类的子囊菌门在腐熟期相对丰度较大,说明其在堆肥进程的后期发挥着重要作用。未分类的真菌在堆肥进程的各个时期均有分布,表明堆肥中的营养成分、含水率、pH等条件适宜其生长,并且其对于堆肥腐熟起到至关重要的作用。综上所述,节担菌属和毛孢子属在堆肥的初期占据优势,当堆肥进程到达高温期时,嗜热链球菌属成为最优势类群,随着温度的降低,鬼伞属和未分类的子囊菌门成为腐熟期优势类群。
2.4 堆肥过程中真菌群落组成与理化及GI指标的相关关系探讨15个优势属(至少在一个样品中相对丰度> 1.0%)与理化及GI指标之间的Spearman相关性热图如图 5所示。结果表明节担菌属、未分类的真菌和毛孢子属与含水率、全碳(TOC)、C/N和铵态氮之间呈显著正相关(P < 0.05),但与全氮(TN)、硝态氮和种子发芽指数(GI)呈显著负相关(P < 0.05)。鬼伞属和未分类的子囊菌门与这3个属相反,它们与全氮、硝态氮和种子发芽指数呈显著正相关,与含水率、全碳、C/N和铵态氮呈显著负相关。节担菌属和毛孢子属同属于担子菌门中的伞菌亚门,它们与理化指标以及GI指标之间的相关性一致。鬼伞属属于担子菌门中的盘菌亚门,与各指标的相关性却与节担菌属和毛孢子属相反。此结果表明相同门水平中的真菌对于各指标的响应可能相反。嗜热链球菌属与温度呈极显著正相关(P < 0.001),这与本文中相对丰度部分研究结果一致。
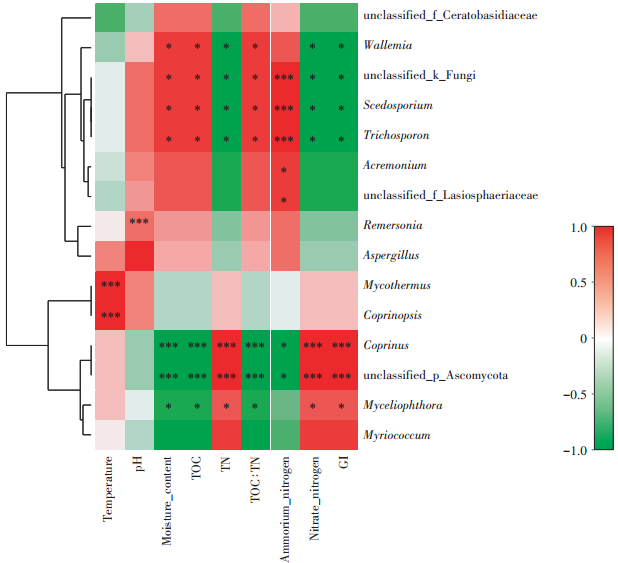
|
*代表 P<0.05,**代表 P<0.01,***代表 P<0.001 *Significant at P<0.05,** Significant at P<0.01,*** Significant at P<0.001 图 5 堆肥中真菌群落组成与理化及GI指标的相关性热图 Figure 5 Correlation heatmap between community composition of fungi and physicochemical and GI indices in composting |
研究表明,特殊类群的微生物可以作为堆肥腐熟度的生物标记。Tortosa等[32]依据堆肥过程中细菌属的相对丰度变化及其与理化参数之间的相关性,发现了两个细菌属可作为堆肥达到腐熟的生物标记。但是,作为堆肥达到腐熟标准的真菌生物标记却鲜有报道。本研究中,鬼伞属的相对丰度在堆肥过程结束时达到了19.50%,成为优势类群。其他学者研究表明,该属也在堆肥的腐熟期出现频率较高[5, 31]。此外,根据Spearman相关系数得到,鬼伞属与多数理化及GI指标的相关性较大(R2>0.80)。综上,推测鬼伞属可能作为堆肥达到腐熟期的真菌生物标记。但是,仍需通过进一步研究加以证实。
3 结论(1) 堆肥进程结束后,物料性质满足腐熟堆肥的各项指标。堆肥过程中理化及GI指标表明,新型静态堆肥技术下,堆肥达到腐熟的时间缩短至17 d左右。
(2) 真菌群落结构分析表明堆肥过程中真菌群落变化明显,节担菌属和毛孢子属在堆肥的初始期和升温期占优势,嗜热链球菌属为堆肥高温期的优势类群,鬼伞属和未分类的子囊菌门在腐熟期时相对丰度较大。
(3) Spearman相关性分析表明,鬼伞属与全氮、硝态氮和种子发芽指数呈显著正相关(P < 0.05),与含水率、全碳、碳氮比和铵态氮呈显著负相关(P < 0.05),其与多数理化及GI指标的相关性较大(R2>0.80)。
| [1] |
Szanto G L, Hamelers H V, Rulkens W H, et al. NH3, N2O and CH4 emissions during passively aerated composting of straw-rich pig manure[J]. Bioresource Technology, 2007, 98(14): 2659-2670. DOI:10.1016/j.biortech.2006.09.021 |
| [2] |
Hss S, Lyons G, Chambers J. Comparison of the changes in mushroom (Agaricus bisporus) compost during windrow and bunker stages of phase Ⅰ and Ⅱ[J]. Annals of Applied Biology, 2015, 136(1): 59-68. |
| [3] |
Bonito G, Isikhuemhen O S, Vilgalys R. Identification of fungi associated with municipal compost using DNA-based techniques[J]. Bioresource Technology, 2010, 101(3): 1021-1027. DOI:10.1016/j.biortech.2009.08.109 |
| [4] |
Adrian L, Urooj Z, Alan H, et al. Fungal succession in an in-vessel composting system characterized using 454 pyrosequencing[J]. FEMS Microbiology Ecology, 2014, 88(2): 296-308. DOI:10.1111/fem.2014.88.issue-2 |
| [5] |
Novinscak A, Decoste N J, Surette C, et al. Characterization of bacterial and fungal communities in composted biosolids over a 2 year period using denaturing gradient gel electrophoresis[J]. Canadian Journal of Microbiology, 2009, 55(4): 375-387. DOI:10.1139/W08-152 |
| [6] |
Tiquia S M.Using Terminal Restriction Fragment Length Polymorphism (T-RFLP)analysis to assess microbial community structure in compost systems[M]//Bioremediation: Humana Press, 2010: 89-102.
|
| [7] |
Wang S L, Liu Y Q, Liu Y, et al. PCR-DGGE analysis of the bacterial community in composting of agriculture and forestry wastes with different microbial agents[J]. Advanced Materials Research, 2014, 1010-1012(4): 966-972. |
| [8] |
Shemekite F, Frankewhittle I H, Praehauser B, et al. Coffee husk composting:An investigation of the process using molecular and non-molecular tools[J]. Waste Management, 2014, 34(3): 642-652. DOI:10.1016/j.wasman.2013.11.010 |
| [9] |
Asano R, Otawa K, Ozutsumi Y, et al. Development and analysis of microbial characteristics of an acidulocomposting system for the treatment of garbage and cattle manure[J]. Journal of Bioscience & Bioengineering, 2010, 110(4): 419-425. |
| [10] |
Knerr A, Tripepi R R. Changes in bacterial communities in dairy manure during nine months of composting as determined by denaturing gradient gel electrophoresis[J]. International Environmental Agreements Politics Law & Economics, 2012, 12(4): 327-342. |
| [11] |
Lee Y H, Kim S K, Yong H K, et al. Archaeal diversity during composting of pig manure and mushroom cultural waste based on 16S rRNA sequence[J]. Journal of the Korean Society for Applied Biological Chemistry, 2010, 53(2): 230-236. DOI:10.3839/jksabc |
| [12] |
De G V, Eudoxie G, Hickey W J. Prokaryotic successions and diversity in composts as revealed by 454-pyrosequencing[J]. Bioresource Technology, 2013, 133(2): 573-580. |
| [13] |
鲍士旦. 土壤农化分析[M]. 三版. 北京: 中国农业出版社, 2008, 39-89. BAO Shi -dan. Soil and agriculture chemistry analysis[M]. 3rd Edition. Beijing: China Agriculture Press, 2008, 39-89. |
| [14] |
Zucconi F, Pera A, Forte M, et al. Evaluating toxicity of immature compost[J]. Biocycle, 1981, 22(2): 54-57. |
| [15] |
Bokulich N A, Mills D A. Improved selection of internal transcribed spacer-specific primers enables quantitative, ultra-high-throughput profiling of fungal communities[J]. Applied & Environmental Microbiology, 2013, 79(8): 2519-2526. |
| [16] |
Ren G M, Xu X H, Qu J J, et al. Evaluation of microbial population dynamics in the co-composting of cow manure and rice straw using high throughput sequencing analysis[J]. World Journal of Microbiology & Biotechnology, 2016, 32(6): 1-11. |
| [17] |
López-González J A, Suárez-Estrella F, Vargas-García M C, et al. Dynamics of bacterial microbiota during lignocellulosic waste composting:Studies upon its structure, functionality and biodiversity[J]. Bioresource Technology, 2015, 175: 406-416. DOI:10.1016/j.biortech.2014.10.123 |
| [18] |
Aulinas M M, Bonmatí B A. Evaluation of composting as a strategy for managing organic wastes from a municipal market in Nicaragua[J]. Bioresource Technology, 2008, 99(11): 5120-5124. DOI:10.1016/j.biortech.2007.09.083 |
| [19] |
Abdel-Rahman M A, El-Din M N, Refaat B M, et al. Biotechnological application of thermotolerant cellulose-decomposing bacteria in composting of rice straw[J]. Annals of Agricultural Sciences, 2016, 61(1): 135-143. DOI:10.1016/j.aoas.2015.11.006 |
| [20] |
Azeem M, Chaudhry A N, Faheem M, et al. Nutrients release pattern during co-composting of poultry litter and different sources of fast food wastes[J]. International Journal of Biosciences, 2014, 5: 105-115. DOI:10.12692/ijb/5.12.105-115 |
| [21] |
Wang X, Selvam A, Chan M, et al. Nitrogen conservation and acidity control during food wastes composting through struvite formation[J]. Bioresource Technology, 2013, 147(8): 17-22. |
| [22] |
Bernal M P, Alburquerque J A, Moral R, et al. Composting of animal manures and chemical criteria for compost maturity assessment:A review[J]. Bioresource Technology, 2009, 100(22): 5444-5453. DOI:10.1016/j.biortech.2008.11.027 |
| [23] |
Tiquia S M, Tam N F Y. Characterization and composting of poultry litter in forced-aeration piles[J]. Process Biochemistry, 2002, 37(8): 869-880. DOI:10.1016/S0032-9592(01)00274-6 |
| [24] |
Li H, Duan M, Gu J, et al. Effects of bamboo charcoal on antibiotic resistance genes during chicken manure composting[J]. Ecotoxicology & Environmental Safety, 2017, 140: 1-6. |
| [25] |
Xiao Y, Zeng G M, Yang Z H, et al. Continuous thermophilic composting(CTC)for rapid biodegradation and maturation of organic municipal solid waste[J]. Bioresource Technology, 2009, 100(20): 4807-4813. DOI:10.1016/j.biortech.2009.05.013 |
| [26] |
Paredes C, Cegarra J, Bernal M P, et al. Influence of olive mill wastewater in composting and impact of the compost on a Swiss chard crop and soil properties[J]. Environment International, 2005, 31(2): 305-312. DOI:10.1016/j.envint.2004.10.007 |
| [27] |
Salar R K, Aneja K R. Thermophilic fungi:Taxonomy and biogeography[J]. Journal of Agricultural Technology, 2007, 3(1): 77-107. |
| [28] |
Singh S, Madlala A M, Prior B A. Thermomyces lanuginosus:Properties of strains and their hemicellulases[J]. FEMS Microbiology Reviews, 2003, 27(1): 3-16. DOI:10.1016/S0168-6445(03)00018-4 |
| [29] |
Natvig D O, Taylor J W, Tsang A, et al. Mycothermus thermophilus gen.et comb.nov.a new home for the itinerant thermophile Scytalidium thermophilum(Torula thermophila)[J]. Mycologia, 2015, 107(2): 319-327. DOI:10.3852/13-399 |
| [30] |
Zeng Q Y, Westermark S O, Rasmusonlestander A, et al. Detection and quantification of Wallemia sebi in Aerosols by Real-Time PCR, conventional PCR, and cultivation[J]. Applied & Environmental Microbiology, 2004, 70(12): 7295-7302. |
| [31] |
Klamer M, Bååth E. Microbial community dynamics during composting of straw material studied using phospholipid fatty acid analysis[J]. FEMS Microbiology Ecology, 1998, 27(1): 9-20. DOI:10.1111/fem.1998.27.issue-1 |
| [32] |
Tortosa G, Castellano-Hinojosa A, Correa-Galeote D, et al. Evolution of bacterial diversity during two-phase olive mill waste("alperujo") composting by 16S rRNA gene pyrosequencing[J]. Bioresource Technology, 2016, 224: 101-111. |
 2018, Vol. 37
2018, Vol. 37