随着牲畜养殖业规模的扩大,集约化和机械化程度的提高,牲畜养殖过程中产生的废弃物,尤其是病害牲畜尸体将会日益增多。截至2015年,我国牲畜养殖量已达8.7亿头(包括猪、牛、山羊、绵羊等)[1],按照正常的病死率3%~5%计算,每年就有约3480万头病死牲畜需要处理。而当牲畜疫病(如疯牛病、口蹄疫、猪瘟等)爆发时,会有更多的牲畜尸体产生。这些病害牲畜尸体若不妥善处理,会引起严重的环境污染事件,如2013年的“黄浦江死猪漂浮”事件。该事件中,大量未经处理的病死猪被随意抛弃于河道中,这些死猪身上所携带的病原体与致病微生物会混入水体,造成河流的严重污染[2],引发了环境公共危机。因此,做好病害牲畜尸体无害化处置,不仅能够保证牲畜养殖业的可持续发展,还能够保护人类健康与维持社会稳定。
目前,关于病害牲畜尸体处理的研究包括填埋[3]、焚烧[4]、堆肥/厌氧分解[5-6]、高温蒸煮[7]和提炼生物油[8-9]。而作为一种高温条件下的热处理方法,热解法不但能够有效地缩短处理时间,杀灭病菌,而且还会产生可再利用的生物炭、热解油和热解气,具有良好的应用前景。作为病害牲畜尸体的主要组成成分,脂肪的热解会产生大量的烃类、羧酸、酯类等物质,并可用作生物柴油[10]。而蛋白质的热解则会依据氨基酸种类的不同,通过不同的反应路径产生不同种类的含氮物质(如腈类、酰胺、肟类以及含氮杂环等物质)[11]。此外,尸体当中水分的存在也会影响热解产物的构成[12]。但是关于这三类物质的研究均不能准确地代表病害牲畜尸体的热解过程,且针对于病害牲畜尸体本身的研究较少[13]。因此,本文着重于研究病害牲畜尸体本身的热解特征,为以后的回转窑-二燃室相结合的两段式焚烧炉的设计提供依据。该两段式焚烧炉的原理是在回转窑内营造缺氧氛围,使得病害牲畜尸体在其中经历热解和气化过程,产生的热解产物随后进入富氧的二燃室内继续焚烧,从而实现热解产物的利用。
为了更好地进行上述焚烧炉中回转窑部分设计,并利用回转窑热解焚烧炉实现对病害牲畜尸体的大规模处理,需要对病害牲畜尸体的热解特征有比较全面的了解。为此,本文采用TG-FTIR法来深入了解牲畜尸体的热解特性[14]。TG-FTIR方法既可以求得热解原料的动力学参数,如活化能与指前因子,又能够了解热解产物随着温度不断变化的特征,在物质热解特性研究中应用非常广泛。早先的研究已经利用该方法对煤粉[15-16]、生物质[17-19]、藻类[20-21]、生活垃圾与工业垃圾[22-24]等物质的热解特征做了比较全面的分析。本文中,考虑到我国牲畜养殖业主要以养猪业为主,选择猪肉作为牲畜尸体的代表,通过TG-FTIR法研究猪肉的热解过程,来反映病害牲畜尸体的热解特征。虽然死猪不同的器官组织的形貌有很大差异,但是其化学物质的组成差异不大,主要为水、脂肪与蛋白质。因此通过研究这三者,尤其是脂肪和蛋白质的热解特性,进而根据不同组织部位这三者的含量,可以推出不同死猪不同部位肉类的热解特性。所以,将猪肉分为水、脂肪与蛋白质来进行研究十分有必要。
为了能够更真实地反映出脂肪和蛋白质在热解过程中的影响,本次研究把脂肪与蛋白质从猪肉样品中分离出来。通过比对猪肉原样,脱水猪肉以及分离出来的脂肪与蛋白质的 TG-FTIR 试验结果,来分析水、脂肪与蛋白质三个主要成分对猪肉热解特性的影响。
1 材料与方法 1.1 热解原料的制备本次研究采用的猪肉样品取自死猪的腹部与腿部。将样品预先切碎混合,在液氮中研磨至粉状,得到猪肉原样。液氮的作用主要体现在快速冷冻样品中的水分,使样品变得坚硬易磨。
将研磨后的猪肉原样放置于冷冻干燥机中,在-25 ℃、0.63 mbar(1 mbar=100 Pa)的条件下干燥24 h,采用冷冻干燥可以保护蛋白质和脂肪的结构,不在脱水过程中发生变性。
采用索氏提取法从冻干样品中提取脂肪。每2 g冻干样品用150 mL正己烷来萃取脂肪,控制提取温度在70 ℃左右,保持12 h。萃取后的溶液在50 ℃、370 mbar(1 mbar=100 Pa)的条件下旋转蒸发,得到最后的脂肪样品。
(1) 制备TCA/丙酮溶液[含10%(m/V)TCA的丙酮溶液,使用前加入二硫苏糖醇(DTT)至0.01 mol· L-1]。每0.04 g冻干样品溶入1.5 mL TCA/丙酮溶液,并于-20 ℃低温静置1 h。
(2) 静置后的溶液在4 ℃,15 000 × g的条件下离心5 min,弃上清,保留沉淀。
(3) 重复步骤(1)和(2)直到沉淀变为白色。
(4) 将步骤(3)中的沉淀用1.5 mL冷丙酮溶液清洗,并在4 ℃,15 000 × g的条件下离心5 min,除去蛋白质分子中的TCA。
(5) 重复步骤(4)三次,最后的沉淀在空气中自然风干,得到纯净的蛋白质样品。
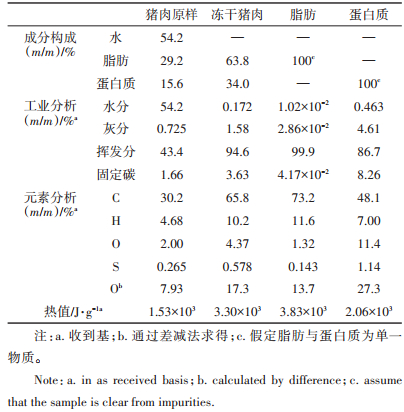
根据上述方法分别制得的猪肉原样、冻干猪肉、脂肪和蛋白质样品,对应的工业分析、元素分析、热值以及水、脂肪和蛋白质在猪肉原样中的含量见表 1。
|
|
表 1 猪肉原样的成分构成以及猪肉原样、冻干猪肉、脂肪和蛋白质的工业分析、元素分析与热值 Table 1 Component analysis and corresponding proximate analysis, ultimate analysis and calorific values of raw pork, freezedried pork, fat, and protein |
TG-FTIR系统由NETZSCH公司的STA 499 F3 Jupiter热分析仪与Bruker Tensor 27光谱仪构成。热重实验中,样品质量分别为10 mg左右,以5 ℃·min-1的升温速率从室温加热至800 ℃。热解载气为高纯氮,流量为70 mL·min-1。FTIR仪器的分辨率设定为4 cm-1,扫描频率为20次·min-1,扫描的光谱范围为4000~650 cm-1。
1.3 热解动力学参数求取一般认为,样品的热解失重过程遵循式(1):
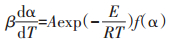
|
(1) |
式中,β为升温速率,K·min-1;α为转化率,表示为α= (m0-mt)/(m0-m∞),m0、mt、m∞分别为初始质量、当前质量和结束质量,mg;T为温度,K;A为指前因子,min-1;E为样品的活化能,kJ·mol-1;R为理想气体常数,8.314 J·mol-1·K-1;f(α)为热解的反应模型。热解动力学分析就是根据实验得到的TG数据与DTG数据来求得最能够描述样品热解过程的反应模型f(α),以及相应的反应活化能E和指前因子A。
对于热解反应过程,反应模型可由式(2)表示:
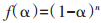
|
(2) |
把式(2)带入式(1)中,移项,两边取对数可得式(3):
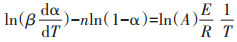
|
(3) |
根据线性模型拟合方法(Linear model-fitting methods)[26],不同的n值决定了式(3)左侧多项式与1/T线性相关程度r2。当r2最接近于1时,对应的n值为最优解。考虑到在不同热解样品热解区域段的不同,对于猪肉原样,较大和较小α下可能带来的误差,本次α选取的范围在0.10~0.90之间,最优的n值采用Matlab中的patternsearch函数求得。之后,根据Coats-Redfern近似法[19],可以得到转化率α与热解温度T的关系。
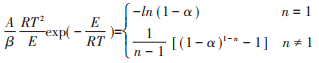
|
(4) |
考虑到热重实验样品质量仅为10 mg,且均匀分布在坩埚中。该过程模型可以考虑薄层干燥数学模型,本次选用的干燥模型为改良的Page模型[27],由式(5)表示:
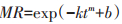
|
(5) |
式中,MR为归一化的含水率,表示为MR=Mt/M0,Mt,M0分别表示当前含水率与初始含水率,t为时间,min;k,m,b为Page模型的相关参数,最优的k,m,b值采用Matlab中的Curve Fitting Tool求得。
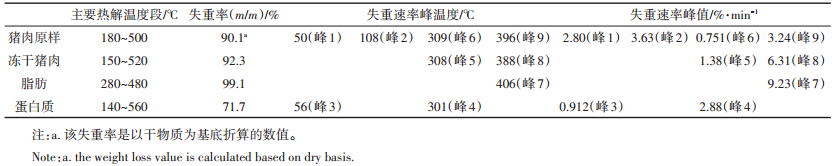
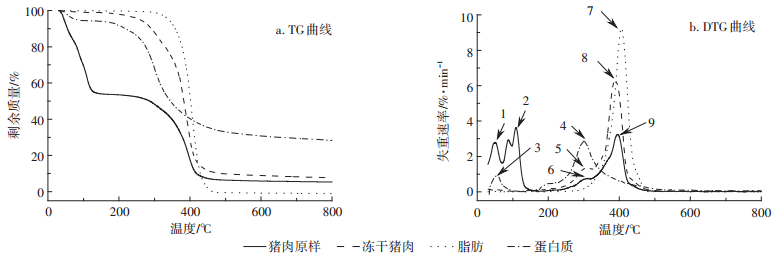
2 结果与讨论 2.1 样品的热重分析图 1展示了猪肉原样、冻干猪肉、脂肪和蛋白质样品在5 ℃·min-1下的热解TG与DTG曲线,主要的热解数据归纳总结在表 2中。结合图 1(a)和表 2可以看出,蛋白质的热解温度范围较宽,热解过程中会产生残炭,失重率仅有71.7%。与蛋白质相反,脂肪的热解过程比较集中,由于脂肪含有99.9%的挥发分(见表 1),热解后只有约0.9%的残渣剩余。作为脂肪和蛋白质自然混合的物质,冻干猪肉的主要热解温度段与失重率均介于脂肪和蛋白质之间。因为脂肪热解后几乎没有焦炭的产生,所以冻干猪肉热解后产生的焦炭可以看成全部由蛋白质产生。通过对比猪肉原样与冻干猪肉可以发现,水的存在并不会减少猪肉原样的焦炭产量并因此增加猪肉原样的失重率。这与之前文献中提到的热解过程中水的参与会减少焦炭产量[28-29]是相违背的。具体原因是因为实验中较低的升温速率(5 ℃·min-1)使得水蒸气在热解低温区(< 180 ℃)有足够的时间蒸发并被载气带走,剩余物质仍以蛋白质或脂肪的形式存在着。而当温度升高开始形成焦炭时(>500 ℃),热解气氛中水蒸气含量很低,并不会有大量的焦炭以焦炭气化反应(char gasification reaction,C+H2O→CO+H2)的形式被消耗掉,从而猪肉原样的失重率与冻干猪肉相仿。研究表明[30],虽然该热解焦炭的比表面积较低,并不适合于用作活性吸收剂,但焦炭中含有较高含量的N、P与K元素(N含量4%~7%;P含量26 mg·kg-1;K含量529 mg·kg-1),可以用作肥料从而提高土壤肥力。
|
图 1 猪肉原样、冻干猪肉、脂肪和蛋白质样品在5 ℃·min-1下的热解曲线 Figure 1 Pyrolytic curves of raw pork, freeze-dried pork, fat, and protein at 5 ℃·min-1 |
|
|
表 2 猪肉原样、冻干猪肉、脂肪和蛋白质在5 ℃·min-1下的主要热解数据 Table 2 Thermal analysis data of raw pork, freeze-dried pork, fat, and protein at 5 ℃·min-1 |
结合图 1(b)和表 2可以看出,在50~60 ℃范围内,可以观察到猪肉原样与蛋白质有明显的失重峰。该失重主要是干燥过程,样品放入热解装置内时,由于N2载气含水量极低,样品中的水会扩散至载气中,造成样品质量的减少。猪肉原样因为本身含水,所以能在该温度区间观察到此峰。而蛋白质也能观察到此峰则是因为蛋白质作为极性物质,是容易吸附少量空气中的水分的。但这些水分存在的形式不稳定,在干燥环境中又容易脱附。除了水分之外,蛋白质高温下变性也会造成少量小分子多肽,氨基酸的挥发,进一步促进蛋白质在热解前段的失重过程。因此,对于猪肉原样来说,该阶段的失重不仅有水分的蒸发,还有蛋白质变性带来的小分子多肽的挥发过程。在110 ℃左右,只有猪肉原样能观察到失重峰,说明该峰主要是由于肉中水分的蒸发而形成的。当温度继续上升到300~310 ℃时,蛋白质的热解失重速率达到最高,为2.88%·min-1。与此同时,在冻干猪肉与猪肉原样的DTG曲线上也能够观察到此峰,说明这两种样品在该温度下失重是由蛋白质的热解造成的。当温度继续上升至390~410 ℃时,脂肪的热解速率达到最大,为9.23%·min-1。冻干猪肉同样也达到最大失重速率,为6.31%·min-1。而且,猪肉原样在该温度范围内也有一个失重峰值。这说明脂肪的热解是冻干猪肉与猪肉原样该段温度下失重的主要因素。
综合上述分析,根据总结的水、脂肪与蛋白质在猪肉原样热解过程中所起到的作用,将猪肉热解的过程分为干燥与小分子有机物挥发过程(初始至70 ℃),水分蒸发过程(70~180 ℃),蛋白质热解过程(180~500 ℃)、脂肪热解过程(280~480 ℃)和碳化过程(500 ℃及以上)。其中,脂肪热解过程与蛋白质热解过程相重叠,构成了猪肉的主要有机物挥发分解阶段,蛋白质的分解主要发生在热解低温阶段(180~300 ℃),而脂肪的分解主要发生在热解的高温阶段(300~500 ℃)。因此,在焚烧炉的设计运行过程中,应保证回转窑内部的烟气温度不低于500 ℃,才能保证病害牲畜尸体的完全热解。
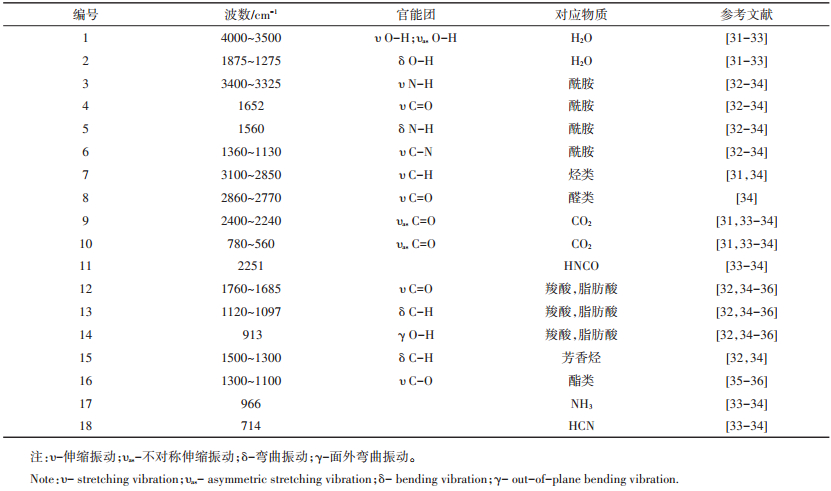
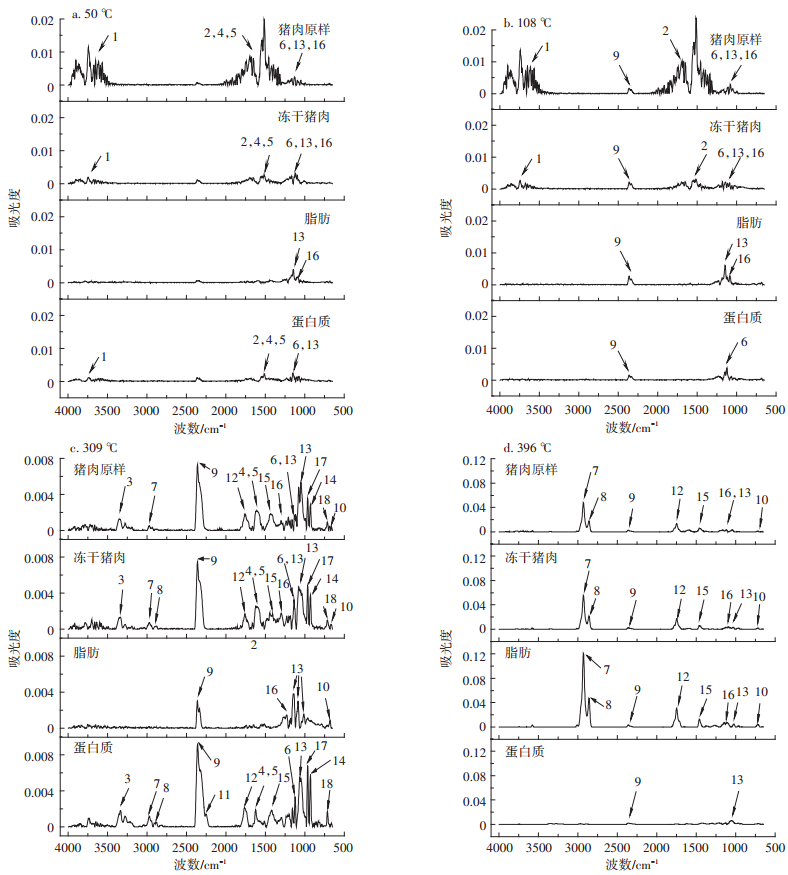
2.2 样品的FTIR分析根据猪肉原样的DTG曲线,特意选取了上述四种样品在50、108、309 ℃和396 ℃下的FTIR图(图 2)。图 2中每个峰编号对应的产物如表 3所示。
|
图 2 猪肉原样、冻干猪肉、脂肪和蛋白质在不同温度的FTIR图 Figure 2 FTIR spectrums of raw pork, freeze-dried pork, fat, and protein at different temperature |
|
|
表 3 参考文献中不同官能团的红外谱带对照表 Table 3 Functional groups of the main identified bands according to published FTIR data |
在热解的开始阶段,当温度达到50 ℃时(图 2a)。热解气体中只有猪肉原样在4000~3500 cm-1和1875~1275 cm-1左右出现较强的吸收峰,说明此时有大量的水分从样品中蒸发出来。此外,对于蛋白质来说,在1875~1130 cm-1这一区间段有微弱的吸收峰,除了表明热解气体中含有少量的水之外,还有少部分的酰胺,这些酰胺多为易挥发的小分子多肽,说明蛋白质的变性已经开始。这与图 1中蛋白质的TG与DTG相吻合。而对于脂肪,吸收峰15、16的存在则说明少量的易挥发游离脂肪酸与酯类已经开始产生,但是该反应造成的失重现象在脂肪的热解TG与DTG曲线上表现很不明显(如图 1),说明这些易挥发的游离脂肪酸与酯类含量相对于脂肪较低。总的来说,上述现象表示当猪肉原样热解温度达到50 ℃时,不仅仅是水分的蒸发过程,还有少量的小分子多肽、脂肪酸与酯类的挥发过程。
当热解温度升至108 ℃时(图 2b),除了50 ℃时能观察到的吸收峰外,还能观察到较弱的CO2吸收峰9(2400~2200 cm-1)。说明热解过程在此时已经开始有CO2的生成。
当热解温度到达猪肉原样的第三个失重峰温度309 ℃时,除了脂肪以外,其他三种样品的FTIR图谱均有大量的吸收峰(图 2c)。对于猪肉原样来说,相较于其他的吸收峰,水的吸收峰已经不明显,而最突出的是CO2的吸收峰9与10。除此之外,还有较强的对应着酰胺、羧酸、芳香烃、酯类、NH3和HCN的约12个吸收峰。而这12个吸收峰中,除了酯类造成的峰16,其他的主要是由原样中的蛋白质造成的。这是因为在309 ℃时,猪肉原样热解气体的FTIR光谱与原样中提取的蛋白质的FTIR光谱有高度的一致性。尤其是NH3和HCN这两个蛋白质热解产物中所独有物质的吸收峰(966 cm-1和714 cm-1),同时在蛋白质和猪肉原样中被观察到,说明蛋白质的热解是造成猪肉原样第三个失重峰的主要原因。另外,在该温度下,开始有少量的烃类和醛类物质生成,并在FTIR图谱上反应出较弱的吸收峰7和8。值得一提的是,蛋白质热解时生成的HNCO(峰11,2251 cm-1)并没有在冻干猪肉和猪肉原样的热解中观察到,说明脂肪的存在抑制了HNCO的生成。
除此之外,脂肪与蛋白质之间的相互反应也不可忽略。文献[11, 37]指出,在热解过程中,脂肪会通过水解作用生成大量的羧酸(峰13,1120~1097 cm-1),蛋白质则会通过脱羧作用生成胺类物质,或者通过脱氨作用生成NH3(峰17,966 cm-1)。这些羧酸与胺类物质(或氨气)会发生反应形成酰胺。因而在图 2c中,猪肉原样与冻干猪肉FTIR关于酰胺物质的峰(尤其是峰4,1652 cm-1与峰5,1560 cm-1)相比蛋白质更宽。说明在猪肉原样与冻干猪肉热解过程中,除了蛋白质自身产生的酰胺类物质之外,还存在部分蛋白质与脂肪相互反应生成酰胺物质。
当热解温度升到396 ℃时,在蛋白质的FTIR图上已经观察不到明显的吸收峰了,只有极少量的CO2吸收峰9和羧酸的吸收峰13。此时,影响猪肉原样热解的主要因素集中在脂肪上。从图 2d可以看出,猪肉原样的FTIR图上的吸收峰与脂肪FTIR的吸收峰高度吻合,主要包括烃类物质(峰7)、醛类物质(峰8)、脂肪酸(峰12,13)与芳香烃(峰15),还包括少量的CO2(峰9,10)和酯类(峰16)。
通过上述分析可以看出,猪肉热解的过程首先是水分的蒸发,此时伴随着少量的小分子多肽、脂肪酸与酯类的挥发。当温度达到108 ℃时,水分蒸发速率达到峰值,此时开始有CO2的生成。当水分蒸发结束后,蛋白质率先开始热解,产生大量的CO2,并生成如酰胺、羧酸、芳香烃、NH3和HCN等热解产物,蛋白质的热解在309 ℃时达到峰值。在此阶段,部分蛋白质已经开始与脂肪发生反应,生成一些酰胺类物质。随后,脂肪开始超越蛋白质成为影响猪肉热解的关键因素,其热解产物的产量,如烃类、醛类、脂肪酸与芳香烃等物质,也跟随着脂肪的热解在不断地增长。当温度达到396 ℃时,脂肪的热解达到最高峰,而后热解过程逐渐结束。可以预见,焚烧炉的运行过程中,回转窑的出口烟气中不仅含有大量的可燃有机气体,为二燃室进一步焚烧提供原料,还含有如NH3和HCN这样的NOx的前驱物质,这需要焚烧炉中添加脱硝装置以保证烟气的达标排放。
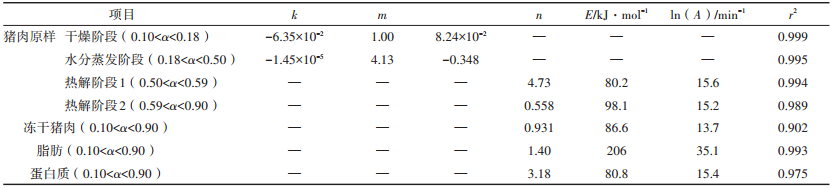
2.3 样品的热解动力学分析根据章节2.1中的分析,本文将猪肉原样热解过程分为四个阶段,分别为干燥阶段(0.10 < α < 0.18),水分蒸发阶段(0.18 < α < 0.50),热解阶段1(0.50 < α < 0.59)和热解阶段2(0.59 < α < 0.90)。其中,干燥阶段与水分蒸发阶段的动力学参数按照章节1.4中的方法求取。热解阶段1与2的动力学参数则按照章节1.3中的热解动力学参数方法求取。此外,由于冻干猪肉、脂肪和蛋白质中不含水分,这三者的热解动力学参数也按照章节1.3中的方法求取。求得的参数结果总结于表 4中。
|
|
表 4 猪肉原样、冻干猪肉、脂肪与蛋白质失重过程中相关的动力学参数 Table 4 Kinetic parameters of raw pork, freeze-dried pork, fat, and protein |
对脂肪与蛋白质来说,线性拟合度良好,可以分别达到0.993与0.975。蛋白质的活化能为80.8 kJ· mol-1,小于脂肪的206 kJ·mol-1。说明蛋白质相比脂肪而言,更容易分解。对于冻干猪肉来说,线性拟合度仅有0.902。这表明作为由脂肪与蛋白质所构成的混合物,冻干猪肉的热解过程并不能使用单一的反应模型f(α)=(1-α)0.931来表示。
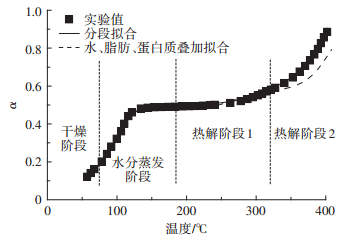
同理,猪肉原样也不能用单一的反应模型表示。本次研究将猪肉原样的热解过程分为上述提到的四个阶段,对每个阶段分别求取相关的动力学参数,采用分段拟合,最后归纳出一条完整的拟合曲线,见图 3中实线部分。此外,通过表 4可以看出,水分的干燥和蒸发阶段的动力学参数是不同的,这表明控制猪肉原样中水分的干燥和蒸发的机理是不同的,前者的水分是被动地扩散到环境中,而后者则是由温度的升高而导致的主动失水过程。这与2.1章中热重分析的结果相一致。
|
图 3 猪肉原样转化率实验结果与模拟结果比较 Figure 3 Comparison of α between experimental results and simulated results for raw pork |
此后,观察两个热阶段的动力学参数数据可以发现,阶段1中所求得的活化能与指前因子的数值与蛋白质的相近,说明此时的热解过程由蛋白质主导。而阶段2相应的数值与脂肪相差较多,这说明阶段2中不单单是脂肪的热解过程,还受到未反应完毕的蛋白质的影响。
考虑到猪肉原样是由水、脂肪与蛋白质三者所构成。因此根据表 1中水、脂肪和蛋白质在猪肉原样中的含量,可以将水的失重曲线和脂肪、蛋白质的失重曲线根据式(6)相叠加,从而推算出猪肉原样的失重过程,见图 3中虚线部分。
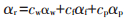
|
(6) |
式中,c代表物质的组分含量,F代表热解过程中的物质最后剩余的含量,而下标r,w,f,p分别代表猪肉原样、水、脂肪与蛋白质,∞则代表了结束状态。
但是,通过叠加的方法获得的模拟数据从热解阶段2开始出现模拟结果普遍小于实验值。这说明在猪肉原样热解时,内部的脂肪与蛋白质热解过程并不是简单叠加,两者的相互反应加剧了彼此的热解。这也从质量损失的角度印证了脂肪与蛋白质之间存在着生成酰胺的相互反应。所以,在同样温度下,叠加法获得的理论值小于实验值。与此同时,脂肪与蛋白质存在的相互反应使得猪肉原样的热解过程比脂肪单独热解变得迅速,由此带来的猪肉原样在热解阶段2失重峰相较脂肪来说,向低温段移动,该情况在图 1(b)中也可以观察到。
3 结论本文以猪肉为代表,通过比对猪肉原样、冻干猪肉、脂肪和蛋白质的TG-FTIR实验结果,从而归纳总结出水、脂肪与蛋白质在猪肉热解过程中分别起到的作用。
(1) 热解开始阶段(< 180 ℃)不仅存在水分的蒸发,还伴随着脂肪与蛋白质的初步分解,尤其是小分子多肽、脂肪酸与酯类的挥发。
(2) 蛋白质的分解集中于热解过程低温阶段(180~300 ℃),并伴随着CO2、NH3和HCN等无机气体的释放,以及酰胺、羧酸和芳香类等有机物质的产生。
(3) 脂肪的热解主要集中于热解高温阶段(300~500 ℃),并产生烃类、醛类、脂肪酸与芳香烃等可燃有机气体。
(4) 热解过程中,脂肪与蛋白质之间也会发生反应,生成大量酰胺类物质,并加速病死猪的热解过程。
通过此次研究,可以获得病害牲畜尸体在回转窑内的热解特征,为后续回转窑热解焚烧炉的设计,以及利用该焚烧炉实现对病害牲畜尸体的大规模处理提供理论依据。
| [1] |
国家统计局.牲畜饲养年度数据[EB/OL].[2016-07-07].http://data.stats.gov.cn/easyquery.htm?cn=C01 National Bureau of Statistics of the People's Republic of China.Annual data of livestock breeding[EB/OL].[2016-07-07].http://data.stats.gov.cn/easyquery.htm?cn=C01 |
| [2] |
Hu Y, Feng Y, Huang C, et al. Occurrence, source, and human infection potential of Cryptosporidium and Enterocytozoon bieneusi in drinking source water in Shanghai, China, during a pig carcass disposal incident[J]. Environmental Science & Technology, 2014, 48(24): 14219-14227. |
| [3] |
Gwyther C L, Jones D L, Golyshin P N, et al. Bioreduction of sheep carcasses effectively contains and reduces pathogen levels under operational and simulated breakdown conditions[J]. Environmental Science & Technology, 2013, 47(10): 5267-5275. |
| [4] |
Staroń P, Kowalski Z, Staroń A, et al. Thermal treatment of waste from the meat industry in high scale rotary kiln[J]. International Journal of Environmental Science and Technology, 2017, 14(6): 1-12. |
| [5] |
Jie W, Du X, Zhang Y, et al. Effect of substrate on identification of microbial communities in poultry carcass composting and microorganisms associated with poultry carcass decomposition[J]. Journal of Agricultural & Food Chemistry, 2016, 64(36): 6838-6847. |
| [6] |
Rodríguez-abalde Á, Flotats X, Fernández B. Optimization of the anaerobic co-digestion of pasteurized slaughterhouse waste, pig slurry and glycerine[J]. Waste Management, 2017, 61: 521-528. DOI:10.1016/j.wasman.2016.12.022 |
| [7] |
Ramirez A D, Humphries A C, Woodgate S L, et al. Greenhouse gas life cycle assessment of products arising from the rendering of mammalian animal byproducts in the UK[J]. Environmental Science & Technology, 2012, 46(1): 447-453. |
| [8] |
Zheng J, Zhu M, Wu H. Alkaline hydrothermal liquefaction of swine carcasses to bio-oil[J]. Waste Management, 2015, 43: 230-238. DOI:10.1016/j.wasman.2015.05.010 |
| [9] |
Zhang Z, Ji J. Waste pig carcasses as a renewable resource for production of biofuels[J]. Sustainable Chemistry & Engineering, 2015, 3(2): 204-209. |
| [10] |
Hassen-Trabelsi A B, Kraiem T, Naoui S, et al. Pyrolysis of waste animal fats in a fixed-bed reactor:Production and characterization of bio-oil and bio-char[J]. Waste Management, 2014, 34(1): 210-218. DOI:10.1016/j.wasman.2013.09.019 |
| [11] |
Debono O, Villot A. Nitrogen products and reaction pathway of nitrogen compounds during the pyrolysis of various organic wastes[J]. Journal of Analytical & Applied Pyrolysis, 2015, 114: 222-234. |
| [12] |
Demirbas A. Effect of initial moisture content on the yields of oily products from pyrolysis of biomass[J]. Journal of Analytical and Applied Pyrolysis, 2004, 71(2): 803-815. DOI:10.1016/j.jaap.2003.10.008 |
| [13] |
Gwyther C L, Williams A P, Golyshin P N, et al. The environmental and biosecurity characteristics of livestock carcass disposal methods:A review[J]. Waste Management, 2011, 31(4): 767-778. DOI:10.1016/j.wasman.2010.12.005 |
| [14] |
Zhu H, Yan J, Jiang X, et al. Study on pyrolysis of typical medical waste materials by using TG-FTIR analysis[J]. Journal of Hazardous Materials, 2008, 153(1/2): 670-676. |
| [15] |
Song H, Liu G, Zhang J, et al. Pyrolysis characteristics and kinetics of low rank coals by TG-FTIR method[J]. Fuel Processing Technology, 2017, 156: 454-460. DOI:10.1016/j.fuproc.2016.10.008 |
| [16] |
Yang J, Chen H, Zhao W, et al. TG-FTIR-MS study of pyrolysis products evolving from peat[J]. Journal of Analytical & Applied Pyrolysis, 2016, 117(1): 296-309. |
| [17] |
Meng A, Zhou H, Qin L, et al. Quantitative and kinetic TG-FTIR investigation on three kinds of biomass pyrolysis[J]. Journal of Analytical & Applied Pyrolysis, 2013, 104(11): 28-37. |
| [18] |
Liu Q, Zhong Z, Wang S, et al. Interactions of biomass components during pyrolysis:A TG-FTIR study[J]. Journal of Analytical & Applied Pyrolysis, 2011, 90(2): 213-218. |
| [19] |
彭云云, 武书彬. TG-FTIR联用研究半纤维素的热裂解特性[J]. 化工进展, 2009, 28(8): 1478-1484. PENG Yun-yun, WU Shu-bin. Characteristics and kinetics of sugarcana bagasse hemicellulose pyrolysis by TG-FTIR[J]. Chemical Industry and Engineering Progress, 2009, 28(8): 1478-1484. DOI:10.3321/j.issn:1000-6613.2009.08.037 |
| [20] |
Ma Y, Wang J, Zhang Y. TG-FTIR study on pyrolysis of Enteromorpha prolifera[J]. Biomass Conversion & Biorefinery, 2017, 1-7. |
| [21] |
Peng X W, Ma X Q, Lin Y S, et al. Co-pyrolysis between microalgae and textile dyeing sludge by TG-FTIR:Kinetics and products[J]. Energy Conversion & Management, 2015, 100(2): 391-402. |
| [22] |
Hao J, Che Y, Tian Y, et al. Study on thermal cracking characteristics and kinetics of oil sand bitumen and its SARA fractions by TG-FTIR[J]. Energy & Fuels, 2017, 31(2): 1295-1309. |
| [23] |
Ma Y, Wang J, Zhang Y. TG-FTIR study on pyrolysis of waste printing paper[J]. Journal of Thermal Analysis & Calorimetry, 2017, 129(2): 1125-1232. |
| [24] |
Tian L, Shen B, Xu H, et al. Thermal behavior of waste tea pyrolysis by TG-FTIR analysis[J]. Energy, 2016, 103: 533-542. DOI:10.1016/j.energy.2016.03.022 |
| [25] |
Wu X, Xiong E, Wang W, et al. Universal sample preparation method integrating trichloroacetic acid/acetone precipitation with phenol extraction for crop proteomic analysis[J]. Nature Protocol, 2014, 9(2): 362-374. DOI:10.1038/nprot.2014.022 |
| [26] |
Vyazovkin S, Burnham A K, Criado J M, et al. ICTAC kinetics committee recommendations for performing kinetic computations on thermal analysis data[J]. Thermochimica Acta, 2011, 520(1/2): 1-19. |
| [27] |
郭泗勇.炼焦煤流化床干燥动力学研究及数值模拟[D].武汉: 华中科技大学, 2016. GUO Si-yong.The coking coal in fluidized bed drying dynamics research and numerical simulation[D].Wuhan: Huazhong University of Science & Technology, 2016. |
| [28] |
Li C, Suzuki K. Tar property, analysis, reforming mechanism and model for biomass gasification-An overview[J]. Renewable and Sustainable Energy Reviews, 2009, 13: 594-604. DOI:10.1016/j.rser.2008.01.009 |
| [29] |
Shahbaz M, Yusup S, Inayat A, et al. The influence of catalysts in biomass steam gasification and catalytic potential of coal bottom ash in biomass steam gasification:A review[J]. Renewable & Sustainable Energy Reviews, 2017, 73: 468-476. |
| [30] |
Cascarosa E, Gea G, Arauzo J. Thermochemical processing of meat and bone meal:A review[J]. Renewable & Sustainable Energy Reviews, 2012, 16: 942-957. |
| [31] |
Fang S, Yu Z, Ma X, et al. Co-pyrolysis characters between combustible solid waste and paper mill sludge by TG-FTIR and Py-GC/MS[J]. Energy Conversion & Management, 2017, 144: 114-122. |
| [32] |
Fan H, He K, Wang J. Study of sewage sludge pyrolysis liquids using comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J]. Fuel, 2016, 185: 281-288. DOI:10.1016/j.fuel.2016.07.118 |
| [33] |
Gómez-siurana A, Marcilla A, Beltrán M, et al. TGA/FTIR study of tobacco and glycerol-tobacco mixtures[J]. Thermochimica Acta, 2013, 573: 146-157. DOI:10.1016/j.tca.2013.09.007 |
| [34] |
Lazdovica K, Liepina L, Kampars V. Catalytic pyrolysis of wheat bran for hydrocarbons production in the presence of zeolites and noble-metals by using TGA-FTIR method[J]. Bioresource Technology, 2016, 207: 126-133. DOI:10.1016/j.biortech.2016.01.117 |
| [35] |
Rohman A, Sismindari, Erwanto Y, et al. Analysis of pork adulteration in beef meatball using Fourier transform infrared(FTIR)spectroscopy[J]. Meat Science, 2011, 88(1): 91-95. DOI:10.1016/j.meatsci.2010.12.007 |
| [36] |
Kraiem T, Hassen-trabelsi A B, Naoui S, et al. Characterization of the liquid products obtained from Tunisian waste fish fats using the pyrolysis process[J]. Fuel Processing Technology, 2015, 138: 404-410. DOI:10.1016/j.fuproc.2015.05.007 |
| [37] |
Douda J, Basiuk V A. Pyrolysis of amino acids:Recovery of starting materials and yields of condensation products[J]. Journal of Analytical & Applied Pyrolysis, 2000, 56(1): 113-121. |
 2018, Vol. 37
2018, Vol. 37