Pb是一种具有蓄积性、多亲和性的重金属元素,植物吸收过多的Pb后不仅会带来粮食减产[1-2],最终会通过食物链危害人体健康。据我国郊区菜地土壤重金属污染状况研究表明我国土壤重金属Pb污染形势十分严峻[3-4],此外相当一部分污染土壤伴随着土壤盐渍化[5]和营养元素生物有效性低[6]等情况。人们在关注土壤中重金属污染问题上偏重于对土壤中重金属含量和形态的关注,而忽视了土壤中其他因素对植物吸收累积重金属元素可能带来的潜在风险。研究报道,部分污染土壤盐渍化[7-8]和Zn、Fe元素缺乏[9-10]以及Ca元素吸收受到抑制[11]都会影响植物对重金属的吸收,但目前为止,这类工作大多数仅限于对重金属Cd的研究,而同样对农产品安全造成严重威胁的重金属Pb却鲜有报道。
Pb是植物体内非必需元素,主要通过必需金属元素的运输蛋白进入植物根系细胞和参与地上转运过程[12],而在植物元素缺乏或过多时,会通过调控该类运输蛋白的表达来维持植物体内各个部位的金属元素平衡,同时也影响着植物对重金属的吸收转运能力。余丹萍等[13]通过水培实验推断锌铁转运蛋白IRT1缺Fe/Zn环境下的高表达增加了白梗尖叶苋菜对重金属的吸收累积。李楠[14]发现大豆在Cd胁迫下会降低二价金属转运蛋白Nramp5的表达来减少对Cd的吸收。目前为止研究者通过异源表达,基因沉默和过表达等分子生物学技术分离并鉴定出与Pb吸收转运相关的运输蛋白有AtHMA3[15]、NtLCT1[16]、OsHMA9[17]、AtPDR12[18]、AtCNGC1[19]和NtCBP4[20],其中AtHMA3定位在液泡膜上,将Pb区隔于液泡中;NtLCT1、AtCNGC1和NtCBP4定位在质膜上,转运Pb2+至细胞质中;OsHMA9、AtPDR12定位在质膜上,将Pb2+排出至根际。上述研究基本停留在功能鉴定阶段,而关于调控这些蛋白的基因在不同环境下的响应与Pb的吸收累积关系则鲜有报道。将上述基因序列在NCBI番茄基因库[Lycopersicon esculentum(taxid:4081)]中进行同源性比对,仅获得AtCNGC1和NtCBP4的同源基因CNGC1以及AtHMA3的同源基因HMA3。研究这两个基因的表达与Pb吸收累积的关系对揭示不同环境下植物吸收累积Pb的分子机理具有重要意义。
综上,通过分析不同胁迫下对植物吸收累积Pb的影响与CNGC1和HMA3基因表达的关系,探究蔬菜植物对Pb分子吸收累积规律,揭示不同胁迫下蔬菜植物对Pb的吸收累积机制,对相应环境下农产品安全具有重要意义。因此,不同胁迫环境下植物对Pb吸收转运机制是值得研究的课题。
至今为止,番茄是少有的已经完成全基因组测序的蔬菜模式植物,选择番茄作为研究对象,为进一步的分子机理验证提供可能。
1 材料与方法 1.1 试验材料选择台湾黄圣女品种进行实验,供试种子购于广州市场。白沙购于河源市英川有限责任公司。
Hoagland营养液含量为4.0 mmol·L-1 Ca(NO3)2· 4H2O,2.0 mmol·L-1 MgSO4·7H2O,5 mmol·L-1 KNO3,1 mmol·L-1 NH4NO3,1.0 mmol·L-1 KH2PO4,0.132 mmol· L-1 MnSO4·4H2O,0.1 mmol·L-1 H3BO3,0.03 mmol·L-1 ZnSO4·7H2O,0.1 μmol·L-1 CuSO4·5H2O,0.1 μmol·L-1 CoCl2,1.0 μmol·L-1 Na2MoO4·2H2O,5.0 μmol·L-1 KI和0.1 mmol·L-1 EDTA·FeNa[21]。
1.2 试验设计将洗净经灭菌的白沙铺满在育苗板后放置于塑料框中,供试种子经30%双氧水浸泡10 min消毒后用去离子水冲洗数次,并播种于育苗板中。4 d后开始在塑料框中浇灌30%的Hoagland营养液;3周后选取长势均匀的番茄幼苗移于水培盆中,经9 d的100%霍格兰德营养液稳定培养后,其中每3 d更换1次营养液,选取长势均匀的番茄植株开始进行处理,共3个处理。缺Ca:全营养液缺Ca(全营养液中不添加Ca元素)+Pb;缺Fe:全营养液缺Fe(全营养液中不添加Fe元素)+Pb;加盐:全营养液+NaCl+Pb;全液:全营养液+Pb。其中全液为对照组,其余3组为实验组,Pb以Pb(NO3)2的形式加入,Pb浓度设置为0.5 μmol·L-1,盐分浓度为0.3%氯化钠。每个处理设3个重复,每3 d更换1次营养液并持续曝气,7 d处理后收获植物。
1.3 样品预处理及测定方法收获的植物样品用去离子水洗净,并用剪刀把茎叶和根部分开,取部分根尖的鲜样经液氮速冻后置于-80 ℃冰箱保存,根部经10 mmol·L-1 EDTA·Na2浸泡超声洗涤5 min,并重复3次,以除去细胞壁所吸附Pb等金属元素,茎叶和根部分别用信封包好放置于60 ℃烘箱中烘干至恒质量。将烘干的组织样经人工研磨至粉末状后,称取0.1~0.3 g于消解罐中,加入10 mL优级纯硝酸进行微波消解(CEM corporation,MARS5),经中速滤纸过滤后,用于测定Pb、Ca、Na等金属元素的含量。元素测定使用等离子体发射光谱仪(美国PE公司,OPTIMA2000DV)测定。
使用NRAiso Plus Trizol试剂(宝生物公司)提取植物根尖总RNA并通过凝胶电泳检验RNA的完整性,经gDNA Erase处理去除基因组,用PrimeScript RT reagent Kit cDNA反转录试剂盒(宝生物公司)合成cDNA第一条链,并以Actin作为内参基因[22],以全液处理组作为对照组,通过实时荧光定量PCR仪(BioRad,CFX96)测定CNGC1和HMA3基因的相对表达水平。引物根据番茄CNGC1(NCBI GenBank:LOC101244669)基因、HMA3(NCBI GenBank:XP_010323360)基因和Actin(NCBI GenBank:LOC101262163)基因的序列设计,并由上海生工生物工程有限公司合成,采用PAGE纯化方式。
1.4 数据处理利用SPSS 19.0软件对数据进行标准方差分析以及显著性差异分析,显著性差异分析选用Duncan统计方法。
为了评价根部Pb吸收能力和Pb地上转运能力的大小,分别用单位质量根Pb净吸收量和转运系数来表示:
单位质量根Pb净吸收量(μg·g-1)=平均每株植物Pb净吸收总量(μg)/平均每株根干质量(g)
转运系数=植株地上部Pb含量(mg·kg-1)/植株地下部Pb含量(mg·kg-1)
CNGC1活性水平=CNGC1相对表达量/根部Ca含量
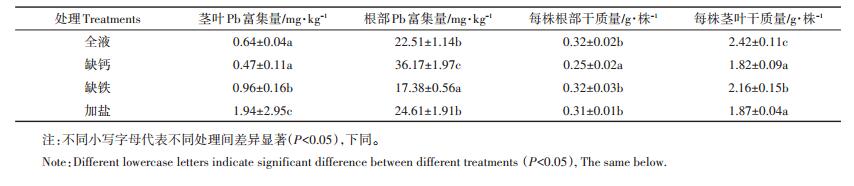
2 结果与分析 2.1 缺Ca/Fe及盐分胁迫对植物Pb富集及生物量的影响缺Ca/Fe及盐分胁迫对植物生物量的影响主要在茎叶部分(表 1),与对照组相比,分别下降了24.8%、10.7%、22.7%;缺Ca处理下根部生物量下降了21.9%,其他处理均无显著性差异。三种处理下植物对Pb富集呈现不同的规律,其中缺Ca处理下,与对照组相比较,根部Pb元素增加了60.6%,而茎叶中Pb下降了26.6%;缺Fe处理下,与对照组相比较,根部Pb元素下降了22.8%,而茎叶中Pb增加了50%;盐分胁迫下,根部Pb元素与对照组无显著差异,但茎叶Pb含量较对照组增加了203.1%。
|
|
表 1 不同处理下植物Pb富集及生物量 Table 1 Enrichment and biomass of plant Pb under different treatments |
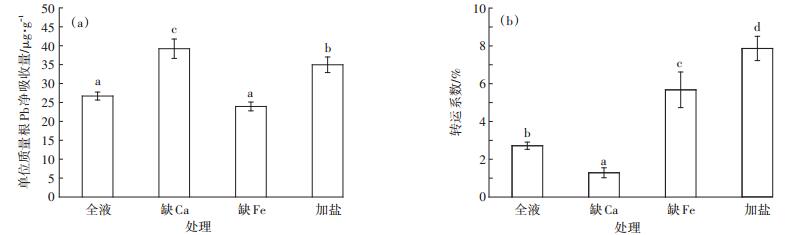
如图 1(a)可见,缺Ca及盐分胁迫下,植物单位质量根Pb吸收能力较对照组均有显著提高,其单位质量根Pb净吸收量分别增加了46.9%和31.0%。而缺Fe胁迫下,植物单位质量根Pb净吸收量有所下降,但未达到显著水平。
|
图 1 不同处理下番茄单位质量根Pb净吸收量(a)和Pb地上转运系数(b) Figure 1 Pb uptake by per unit root mass (a)and Pb translocation factor (b)in tomato under different treatments |
由图 1(b)可知,Pb主要富集在根部,番茄对Pb的转运能力比较低,不同处理下其转运系数在1.29%~ 7.86%之间,其中缺Ca处理植物的Pb转运系数最小,较对照组下降了52.5%;缺Fe及盐分胁迫下,植物的Pb转运系数显著增大,分别增加了109.4%和190.1%。
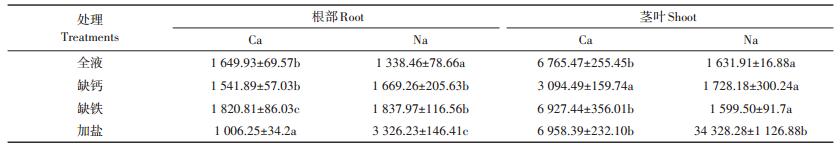
2.3 缺Ca/Fe及盐分胁迫对番茄其他金属元素的影响由表 2可知,缺Ca条件下,根部Ca含量较对照组并无显著性差异,而茎叶部分Ca含量则显著低于对照组,茎叶中Ca含量较对照组下降了54.26%。盐分胁迫下,植物根部Ca含量下降了39.0%,显著低于对照组,茎叶部分钙含量则与对照组无显著性差异。盐分胁迫下,植物体内Na+含量较对照组显著增加,其中根部增加了148.5%,茎叶中增加了约20倍。
|
|
表 2 番茄茎叶和根部金属元素的含量(mg·kg-1干质量) Table 2 Content of mineral elements in shoot and roots of tomato(mg·kg-1 DW) |
由图 2可知,不同胁迫条件会引起植物根部相关基因差异表达。其中CNGC1基因的表达量在缺钙处理下,较对照组显著上调了150%,盐分胁迫下CNGC1表达量虽有所下调,但未达到显著性差异;根部HMA3基因的表达量在缺钙处理下较对照组显著上调70%,而在缺铁及盐分胁迫下,则较对照组下调了65%和50%。
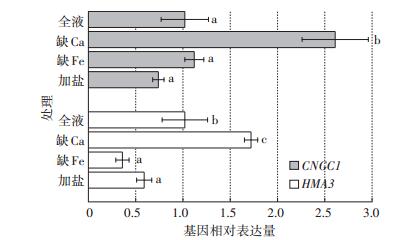
|
图 2 不同处理下植物根部CNGC1和HMA3的相对表达量 Figure 2 Relative expression of CNGC1 and HMA3 in plant roots under different treatments |
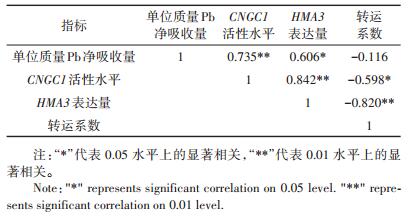
由表 3可知,不同处理下番茄根部单位质量Pb净吸收量与CNGC1活性水平呈现极显著正相关(P < 0.01);番茄Pb转运系数与HMA3的表达量呈现极显著负相关(P < 0.01),CNGC1活性水平与HMA3的表达量呈现极显著正相关(P < 0.01)。
|
|
表 3 不同处理下番茄相关指标的相关性分析 Table 3 Correlation analysis of tomato related indexes under different treatments |
植物根系通过质外体和共质体两种途径吸收外界环境中有效态的毒性元素[23-24]。因以被动吸收为机制的质外体途径受到内、外皮层细胞形成的凯氏带屏障的限制[25],使得以主动吸收为机制的共质体途径成为了最主要的吸收方式。共质体吸收途径包括离子通道、转运蛋白和内吞作用三种方式,其中以前两者为主。因而研究Pb通道蛋白基因的表达与Pb吸收转运的关系,对全面掌握蔬菜Pb吸收累积规律,发展绿色蔬菜,保障人类健康具有重要意义。
CNGC离子通道,定位在细胞质膜上,其核心由6个α-螺旋跨膜区和CNBD结合域组成,因其通道的“门”受到环核苷酸(正调控)和Ca调素调控(负调控),该离子通道被命名为环核苷酸Ca调素门控非选择性阳离子通道[26]。故该离子通道运输金属离子的能力不仅受到表达量的影响,还受到了细胞内环核苷酸和钙调素作用的影响,而其中Ca调素起着主要的调控作用。研究报道,细胞中过高的Ca浓度会激活Ca调素并与环核苷酸竞争CNGC离子通道的CNBD结合域,阻碍了该通道“门”的打开,从而降低了该蛋白对金属离子的跨膜运输能力[27]。因此引入CNGC1离子通道活性水平来表示CNGC离子通道在根部细胞中运输金属离子能力的大小。目前为止CNGC家族在拟南芥中已经发现了20个家族成员,其功能大多数已经被分离鉴定,在抗病、花粉管生长、对Ca2+响应、抵抗重金属离子毒害和抗盐等多种信号中发挥着重要作用[28]。其中AtCNGC1离子通道被鉴定出与Pb、Ni元素的吸收相关[19]。本次试验,通过同源性比获得了番茄中AtCNGC1的同源基因CNGC1,并分析了缺Ca/Fe及盐分胁迫下植物根部Pb吸收能力与植物根部CNGC1离子通道活性水平的关系,结果显示,不同胁迫处理下,植物根部Pb吸收能力与CNGC1活性水平呈极显著正相关(P < 0.01),推测CNGC1离子通道活性的增加促进了植物对Pb的吸收。但CNGC1离子通道并不是植物吸收Pb唯一运输蛋白,Sunkar等[19]在拟南芥中通过T - DNA插入技术,获得了AtCNGC1缺失植株,结果显示AtCNGC1缺失植株吸收Pb较对照组显著下降,但下降幅度不超过50%。故笔者认为,缺Ca/Fe及盐分胁迫下,CNGC1离子通道在番茄的Pb吸收过程起着重要作用。
HMA又称P1B-ATPase,重金属转运ATP酶,属于运输蛋白中的离子泵,它既能选择性地输入和泵出植物必需的金属离子,也能转运重金属离子,它能够通过水解ATP获得能量,为跨膜转运阳离子提供能量,该家族成员在植物抗逆机制中起着重要作用[29]。余刚[30]发现对四翅滨藜进行重金属(Fe、Cu、Ni、Cd和Pb),PEG6000和NaHCO3等胁迫处理可高度诱导四翅滨藜中AcHMA1转录水平上调,但是低温和NaCl胁迫使四翅滨藜中AcHMA1的表达受到抑制。在酵母表达系统中过表达AcHMA1能够显著增加酵母细胞对过量Fe离子的抗性。AcHMA1同时也对提高酵母细胞应对盐、碱、干旱和氧胁迫等胁迫的能力起到重要作用,其中AtHMA3被鉴定出参与Pb区隔过程[15]。本次试验中,番茄根部HMA3在缺Ca条件下被诱导高表达,增强了Pb区隔于液泡中的能力,从而阻碍了Pb往地上转运;缺Fe及盐分胁迫下,HMA3在根部的表达受到抑制,降低了根部细胞对Pb的区隔能力,间接地增强了Pb地上转运的能力,从而促进了植物地上部Pb的累积。试验中发现盐分胁迫较缺Fe处理Pb转运能力强,这可能是由于细胞中Pb的迁移性增强导致的结果,侯晓龙等[31]通过透射电子显微镜(TEM)发现Pb进入到植物根部细胞后,会以难溶态形式聚集在液泡膜表面,降低了Pb在胞内的可迁移性,阻碍了Pb木质部装载过程。徐劼等[32]通过化学试剂逐步提取法,提取不同处理茶树根中各种形态的Pb含量,各个处理中的氯化钠提取态仅次于盐酸提取态,占了Pb总量的34.7%~41.4%,其结果表明氯化钠溶液会增加Pb的迁移性。当植物受盐分胁迫时,大量的Cl-进入到根系细胞体内与Pb形成[PbCl4]2-可迁移态络合物[33],增加了Pb在根部细胞内的迁移性,使更多的Pb可以参与木质部的装载过程,从而促进Pb的地上转运。
4 结论(1)缺Ca胁迫更容易导致Pb在根部的累积,缺Fe胁迫促进Pb往地上部累积,而盐分胁迫显著增强了Pb在不同组织中的含量。
(2)缺Ca及盐分胁迫显著增强了根对Pb的吸收能力,而缺Fe胁迫则表现出了显著的抑制效应。
(3)HMA3离子泵的高表达导致更多Pb转入根部液泡中,从而显著抑制其往地上部转运过程。CNGC1离子通道的高表达显著促进Pb的根部吸收过程,且CNGC1的活性受细胞内的Ca浓度负调控。
| [1] |
胡方洁, 张健, 杨万勤, 等. Pb胁迫对红椿(Toona ciliata Roem)生长发育及Pb富集特性的影响[J]. 农业环境科学学报, 2012, 31(2): 284-291. HU Fang-jie, ZHANG Jian, YANG Wan-qin, et al. Effects of Pb stress on the growth, development and Pb enrichment properties of Toona ciliata Roem saplings[J]. Journal of Agro-Environment Science, 2012, 31(2): 284-291. |
| [2] |
陈梦妮, 杜天庆, 张泽宇, 等. 苗期甜高粱和玉米对土壤Pb胁迫的响应及抗性评价[J]. 中国农业大学学报, 2016, 21(11): 17-23. CHEN Meng-ni, DU Tian-qing, ZHANG Ze-yu, et al. Resistance evaluation and response of sweet sorghum and corn during seedling stage under Pb stress[J]. Journal of China Agricultural University, 2016, 21(11): 17-23. |
| [3] |
蔡立梅, 黄兰椿, 周永章, 等. 东莞市农业土壤和蔬菜铅含量特征分析[J]. 环境科学与技术, 2010, 33(2): 122-125. CAI Li-mei, HUANG Lan-chun, ZHOU Yong-zhang, et al. Characteristic analysis of lead concentration in agricultural topsoil and vegetables of Dongguan Guangdong Province[J]. Environmental Science and Technology, 2010, 33(2): 122-125. DOI:10.3969/j.issn.1003-6504.2010.02.028 |
| [4] |
雷琼, 马文哲, 王文光. 我国蔬菜重金属铅污染研究进展与防治措施[J]. 农产品加工(学刊), 2012(9): 105-107. LEI Qiong, MA Wen-zhe, WANG Wen-guang. The heavy metal lead pollution progress and control measures of the vegetables in China[J]. Academic Periodical of Farm Products Processing, 2012(9): 105-107. |
| [5] |
Gabrijel O, Davor R, Zed R, et al. Cadmium accumulation by muskmelon under salt stress in contaminated organic soil[J]. Science of the Total Environment, 2009, 407(7): 2175-2182. DOI:10.1016/j.scitotenv.2008.12.032 |
| [6] |
介明. 盐碱地的危害与改良研究[J]. 绿色科技, 2016(7): 122-124. JIE Ming. Effects of nitrogen-phosphate fertilization on camellia[J]. Journal of Green Science and Technology, 2016(7): 122-124. DOI:10.3969/j.issn.1674-9944.2016.07.049 |
| [7] |
李取生, 楚蓓, 石雷, 等. 珠江口滩涂湿地土壤重金属分布及其对围垦的影响[J]. 农业环境科学学报, 2007, 26(4): 224-228. LI Qu-sheng, CHU Bei, SHI Lei, et al. Heavy metal distribution in tidal wetland soils and its effect on reclamation in the Pearl River Estuary[J]. Journal of Agro-Environment Science, 2007, 26(4): 224-228. |
| [8] |
胡妮, 陈柯罕, 李取生, 等. 盐胁迫下苋菜品种有机酸变化对Cd累积和耐盐性的影响[J]. 农业环境科学学报, 2016, 35(5): 858-864. HU Ni, CHEN Ke-han, LI Qu-sheng, et al. Effects of salinity-inducted organic acid variation on Cd accumulation and salinity tolerance of edible amaranth[J]. Journal of Agro-Environment Science, 2016, 35(5): 858-864. |
| [9] |
陈秀玲, 张磊. 小麦/花生不同间作方式对花生吸收积累Cd的影响[J]. 环境化学, 2014, 33(9): 1469-1475. CHEN Xiu-ling, ZHANG Lei. Influence on cadmium uptake by peanut of wheat/peanut intercropping modes[J]. Environmental Chemistry, 2014, 33(9): 1469-1475. |
| [10] |
Kizhaerals S, Virgine T, Kaliyaperumal J, et al. Biochemical changes and zinc fractions in arbuscular mycorrhizal fungus(Glomus intraradices)inoculated and uninoculated soils under differential zinc fertilization[J]. Applied Soil Ecology, 2009, 43(1): 32-39. DOI:10.1016/j.apsoil.2009.05.009 |
| [11] |
陈惠君, 谭玲, 李取生, 等. Cr/Pb低累积菜心品种筛选及其根际机理研究[J]. 农业环境科学学报, 2016, 35(7): 1249-1256. CHEN Hui-jun, TAN Ling, LI Qu-sheng, et al. Screening and preliminary rhizosphere mechanisms of low Cr/Pb accumulation cultivars of Chinese flowering cabbages(Brassica parachinensis L.)[J]. Journal of Agro-Environment Science, 2016, 35(7): 1249-1256. |
| [12] |
Cuypers A, Smeets K, Vangronsveld J. Heavy metal stress in plants[M]//Plant stress biology: From genomics to systems biology. WileyVCH Verlag GmbH & Co. KGaA, 1999: 161-178.
|
| [13] |
余丹萍, 李取生, 王立立, 等. 缺Fe/Zn及盐胁迫下苋菜对Cd及矿质元素的吸收与IRT1表达的关系[J]. 农业环境科学学报, 2016, 35(2): 234-239. YU Dan-ping, LI Qu-sheng, WANG Li-li, et al. Cadmium and mineral element accumulation and IRT1 gene expression of Amaranth hybidus L. under iron/zinc deficiencies or salt stress[J]. Journal of AgroEnvironment Science, 2016, 35(2): 234-239. |
| [14] |
李楠.大豆NRAMP家族基因的克隆及其功能研究[D].北京: 中国科学院大学, 2016. LI Nan. Cloning and function study of soybean NRAMP family gene[D]. Beijing: University of Chinese Academy of Sciences, 2016. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y3054147 |
| [15] |
Morel M, Crouzet J, Gravot A, et al. AtHMA3, a P1B-ATPase allowing Cd/Zn/Co/Pb vacuolar storage in Arabidopsis[J]. Plant Physiology, 2009, 149(2): 894-904. |
| [16] |
Wojas S, Ruszczyńska A, Bulska E, et al. Ca2+-dependent plant response to Pb2+, is regulated by LCT1[J]. Environmental Pollution, 2007, 147(3): 584-592. |
| [17] |
Lee S, Kim Y Y, Lee Y, et al. Rice P1B-type heavy-metal ATPase, OsHMA9, is a metal efflux protein[J]. Plant Physiology, 2007, 145(3): 831-842. DOI:10.1104/pp.107.102236 |
| [18] |
Lee Y. AtPDR12 contributes to lead resistance in Arabidopsis[J]. Plant Physiology, 2005, 138(2): 827-836. DOI:10.1104/pp.104.058107 |
| [19] |
Sunkar R, Kaplan B, Bouch N, et al. Expression of a truncated tobacco NtCBP4 channel in transgenic plants and disruption of the homologous Arabidopsis CNGC1 gene confer Pb2+ tolerance[J]. Plant Journal, 2000, 24(4): 533-542. DOI:10.1046/j.1365-313x.2000.00901.x |
| [20] |
Arazi T, Sunkar R, Kaplan B, et al. A tobacco plasma membrane calmodulin-binding transporter confers Ni2+, tolerance and Pb2+, hypersensitivity in transgenic plants[J]. The Plant Journal, 1999, 20(2): 171-182. DOI:10.1046/j.1365-313x.1999.00588.x |
| [21] |
Mei X, Li S, Li Q, et al. Sodium chloride salinity reduces Cd uptake by edible amaranth(Amaranthus mangostanus L.)via competition for Ca channels[J]. Ecotoxicology & Environmental Safety, 2014, 105(7): 59-64. |
| [22] |
李仁, 吴新新, 李蔚, 等. 番茄水通道蛋白基因SIAQP的克隆与序列分析[J]. 中国农业科学, 2012, 45(2): 302-310. LI Ren, WU Xin-xin, LI Wei, et al. Cloning and sequence analysis of the aquaporins gene SlAQP in tomato[J]. Scientia Agricultura Sinica, 2012, 45(2): 302-310. DOI:10.3864/j.issn.0578-1752.2012.02.012 |
| [23] |
Sterckeman T, Redjala T, Morel J L. Influence of exposure solution composition and of plant cadmium content on root cadmium shortterm uptake[J]. Environmental & Experimental Botany, 2011, 74(1): 131-139. |
| [24] |
Ye J, Yan C, Liu J, et al. Effects of silicon on the distribution of cadmium compartmentation in root tips of Kandelia obovata(S. L.)Yong.[J]. Environmental Pollution, 2012, 162(5): 369-373. |
| [25] |
Marek V, Cornelia K, Ingrid L, et al. Root anatomy and element distribution vary between two Salix caprea isolates with different Cd accumulation capacities[J]. Environmental Pollution, 2012, 163(1): 117-126. |
| [26] |
王月, 侯和胜. 植物环核苷酸门控通道(CNGC)基因家族的结构与功能[J]. 植物生理学报, 2007, 43(1): 1-8. WANG Yue, HOU He-sheng. Structure and function of plant cyclic nucleotide -gated channel (CNGC) gene family[J]. Plant Physiology Journal, 2007, 43(1): 1-8. DOI:10.3321/j.issn:1671-3877.2007.01.001 |
| [27] |
Kaplan B, Sherman T, Fromm H. Cyclic nucleotide-gated channels in plants[J]. Febs Letters, 2007, 581(12): 2237-2246. DOI:10.1016/j.febslet.2007.02.017 |
| [28] |
刘海娇, 杜立群, 林金星, 等. 植物环核苷酸门控离子通道及其功能研究进展[J]. 植物学报, 2015, 50(6): 779-789. LIU Hai-jiao, DU Li-qun, LIN Jin-xing, et al. Recent advances in cyclic nucleotide-gated ion channels with their functions in plants[J]. Chinese Bulletin of Botany, 2015, 50(6): 779-789. |
| [29] |
Argüello J M, Eren E, Gonzálezguerrero M. The structure and function of heavy metal transport P1B-ATPases[J]. Biometals, 2007, 20(3/4): 233. |
| [30] |
余刚.四翅滨藜抗逆相关基因的筛选及其通道蛋白功能解析[D].长春: 吉林大学, 2016. YU Gang. Functional isolation of stress-responsive genes from Atriplex canescens and functional characterization of multiple transporters[D]. Changchun: Jilin University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10183-1016089758.htm |
| [31] |
侯晓龙, 陈加松, 刘爱琴, 等. Pb胁迫对金丝草体内Pb化学形态及细胞分布的影响[J]. 生态与农村环境学报, 2012, 28(3): 271-276. HOU Xiao-long, CHEN Jia-song, LIU Ai-qin, et al. Effects of Pb stress on fractionation and distribution of Pb in Pogonatherum crinitum[J]. Journal of Ecology and Rural Environment, 2012, 28(3): 271-276. DOI:10.3969/j.issn.1673-4831.2012.03.009 |
| [32] |
徐劼, 于明革, 陈英旭, 等. 铅在茶树体内的分布及化学形态特征[J]. 应用生态学报, 2011, 22(4): 891-896. XU Jie, YU Ming-ge, CHEN Ying-xu, et al. Characteristic of distribution and chemical forms of Pb in tea plant varieties[J]. Chinese Journal of Applied Ecology, 2011, 22(4): 891-896. |
| [33] |
孙伟安, 李以圭, 陈新明. 金属配合物溶液的热力学研究Ⅰ. Pb (Ⅱ) -Cl-配位体系[J]. 深圳大学学报, 1992(增刊2): 37-45. SUN Wei -an, LI Yi -gui, CHEN Xin-ming. Thermodynamics of the metal complexes in aqueous solutions Ⅰ. Pb(Ⅱ) -Cl-complex system[J]. Journal of Shenzhen University Science and Engineering, 1992(Suppl 2): 37-45. |
 2019, Vol. 38
2019, Vol. 38