2. 浙江大学环境与资源学院, 杭州 310058
2. College of Environmental and Resources Sciences, Zhejiang University, Hangzhou 310058, China
近年来,我国养猪业发展迅猛,由此产生的大量养猪废水给猪场周边生态环境和居民健康带来严重威胁。目前,国内外大型养猪场基本利用厌氧发酵处理系统对养猪废水进行初步处理。养猪废水经厌氧发酵系统处理后得到的沼液中有机物含量明显降低[1],但是氮磷等营养盐的含量仍然较高[2],且碳氮比严重失调,不利于生化处理,是一种难处理的污水[3]。目前,猪场沼液的净化方式主要包括还田利用[4]、自然生态净化技术(如人工湿地、氧化塘等)[5-6]和工业化处理方法(包括生物法和物理化学法)[7-8]等。传统的还田利用及生态净化技术虽然具有投资小、运行成本低、管理方便等优点,但也存在处理效率低、占地面积大、启动时间长、受季节影响较大且操作不当易引起二次污染等缺点。工业化处理方法虽然处理效率高,但运行成本较高,这对收益回报不算高的养猪业来说难以接受。因此,寻找一种经济有效的猪场沼液净化技术显得尤为必要。
微藻作为一类光合效率很高的初级生产者,能够吸收大量的氮、磷维持其生长与增殖过程,成为生物质能源生产关注的焦点。猪场沼液中含有丰富的碳氮磷营养元素,可作为微藻生长良好的养分来源。将微藻培养与猪场沼液净化结合起来,可在培养微藻的同时实现沼液的净化。与其他处理技术相比,基于微藻培养的猪场沼液净化技术具有独特的优势:如无需添加化学物质、具有自产氧及二氧化碳减排能力、生产高附加值生物质产品等[9]。最近,很多学者发现将微藻和好氧细菌共同培养用于废水处理较微藻单独培养更有优势。因为好氧细菌的存在会消耗微藻光合作用产生的氧气,消除因溶解氧过高对微藻生长的抑制,同时将废水中有机物分解成二氧化碳,为微藻光合作用提供碳源[10]。细菌和微藻的协同作用不仅可以提高微藻生物量产量,还能省去曝气操作。对于一般的生物处理来说,曝气所需的成本能够占到整个处理的50%[11]。故利用藻菌系统来处理废水能极大降低运行成本。因此,藻-菌共生体在去除废水中营养盐方面具有很大的优势。目前许多学者已经开展有关藻菌互作方面的研究,这些研究主要集中在探明基于微藻的废水处理系统中存在的优势微生物,以及废水中主要成分被吸收或分解的基本机理方面[12-14],但对影响藻菌系统协同脱氮除磷的相关条件研究较少,它们如何影响微生物的分解过程和微藻的光合作用,对废水中氮磷的迁移转化产生怎样的影响?目前影响机制尚不明朗。
本文以对养猪废水具有较好净化效果的近具刺链带藻为研究对象,向其中加入商业化有机物降解菌剂,人为构建藻-菌共培养系统,分析其对猪场沼液的净化效果,同时探讨温度和光照强度对该系统中碳氮磷去除效果的影响,为实现藻-菌系统资源化利用猪场沼液提供依据。
1 材料与方法 1.1 藻种及菌种本文所用的微藻为对养猪废水净化能力强的近具刺链带藻(Desmodesmus sp. CHXl),由课题组从养猪废水中分离获得[15]。将微藻在BG11培养基中培养至对数期,经1 μm滤膜过滤后,用超纯水洗净再次过滤备用。微藻接种量为0.1 g·L-1(干质量)。
所用的菌剂为对废水中有机物具有较好降解效果的商业化菌剂(购自上海普罗生物技术有限公司)。菌剂中优势菌属为蓝细菌(Cyanobacteria)、节杆菌(Arthrobacter)、芽孢杆菌(Bacillus)和根瘤菌(Rhizobiales)等。菌剂接种量为1 g·L-1。
1.2 废水所用废水为模拟沼液,在BG11培养基的基础上改进配制而成。其中有机物、氨氮和总磷主要由无水乙酸钠、硫酸铵、磷酸二氢钾配制而成。废水基本理化性质见表 1。
|
|
表 1 模拟废水基本理化性质(mg·L-1,pH除外) Table 1 The ingredients of synthetic wastewater (mg·L-1, except pH) |
本试验设3个处理:(1)未添加有机物降解菌微藻培养系统(MMS)、(2)有机物降解菌单独培养系统(MBS)、(3)添加有机物降解菌微藻培养系统(ABS)。其中MMS和MBS为对照处理,每个处理设3个重复。将微藻和菌剂接种至装有800 mL废水的1 L锥形瓶中,其中MMS和MBS处理分别只接种微藻或菌剂。将锥形瓶置于光照培养箱中进行培养,瓶口用棉花塞住以防止虫子等杂物进入,每个锥形瓶底部配有磁力搅拌器,用于混匀废水。培养条件为温度30±1 ℃、光暗周期24 h/0 h、光照强度为100 μmol photons·m-2· s-1,搅拌速率为1000 r·min-1、菌藻接种比例为1:1。
1.3.2 温度对藻-菌系统污染物净化能力的影响根据文献及预试验结果,设置20、30、40 ℃ 3个不同温度梯度,每个处理设3个重复。将微藻和菌剂接种至装有800 mL废水的1 L锥形瓶中,置于光照培养箱中进行培养。锥形瓶口呈敞开状态,每个锥形瓶底部有磁力搅拌器,用于混匀藻液。培养条件为光照强度100 μmol photons·m-2·s-1、光暗周期24 h/0 h、搅拌速率为1000 r·min-1。
1.3.3 光照强度对藻-菌系统污染物净化能力的影响根据文献及预试验结果,设置光照强度为100、400、600 μmol photons·m-2·s-1 3个梯度,每个处理设3个重复。将微藻和菌剂接种至装有800 mL废水的1 L锥形瓶中,置于光照培养箱中进行培养。锥形瓶口呈敞开状态,每个锥形瓶底部有磁力搅拌器,用于混匀藻液。培养条件为温度20 ℃、光暗周期24 h/0 h、搅拌速率为1000 r·min-1。
1.4 分析方法水质指标测定:溶解氧(DO)采用HQ30D溶解氧仪(美国哈希公司)测定;pH采用PHS-3B酸度计(美国哈希公司);总有机碳(TOC)采用TOC-VCHP分析仪(日本岛津公司);氨氮(NH4-N)采用纳氏试剂分光光度法测定、硝氮(NO3-N)采用紫外分光光度法测定、亚硝氮(NO2-N)采用分子吸收分光光度法测定、总氮(TN)采用碱性过硫酸钾紫外分光光度法测定、总磷(TP)采用钼酸铵分光光度法测定,具体参照《水和废水监测分析方法(第四版)》。
微藻生物量测定:通过测定近具刺链带藻细胞个数来确定其生物量,藻细胞个数采用血球计数板和显微镜测定[16]。在微藻纯培养条件下获得微藻生物量(干质量,g·L-1)和微藻细胞个数之间的拟合关系为:
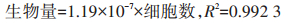
|
利用Excel 2013对数据进行处理,各组实验数据的显著性差异分析利用SPSS 20.0软件进行,显著水平为0.05。
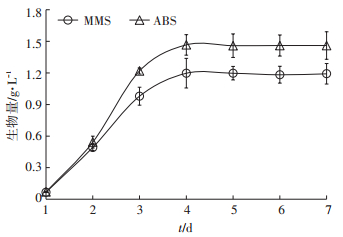
2 结果与讨论 2.1 藻-菌共培养系统对猪场沼液中碳氮磷的去除效果研究添加有机物降解菌条件下微藻生长情况见图 1。结果表明,MMS和ABS处理中微藻自接种后迅速进入对数生长期,并从第4 d开始逐渐进入稳定期。其中ABS处理中微藻生长情况明显优于MMS(P < 0.05)。ABS中微藻生物量最大值为1.47 g·L-1,较MMS(1.19 g·L-1)提高了23.53%。微藻和细菌之间的相互作用可分为共处、互生、共生、拮抗、竞争、捕食和寄生等方面,且与微藻和细菌种类有关[17]。本文结果表明添加有机物降解菌可以明显促进近具刺链带藻的生长(P < 0.05)。培养7 d后,细菌强化处理中微藻生物量是未强化处理的1.23倍(图 1)。前人研究也表明,好氧细菌可以促进微藻的生长[16, 18]。细菌不仅可以通过分解水中有机物产生二氧化碳为微藻的光合作用提供充足的碳源,还能降低培养液中溶解氧浓度,从而避免因溶解氧浓度过高而抑制微藻光合作用[19]。微藻在充足的碳源供给和无溶解氧抑制的条件下生长情况明显得到改善,因而具有更高的生物量[20]。此外,细菌也会分泌一些生长促进因子来促进微藻生长,如维生素(如生物素、硫胺素和维生素B12)和铁载体(微藻在铁缺乏条件下生长所需的一种重要的螯合剂)[21]。
|
图 1 有机物降解菌共培养对微藻生长的影响 Figure 1 Effect of organic pollutant degradation bacteria on growth of Desmodesmus sp. CHXl |
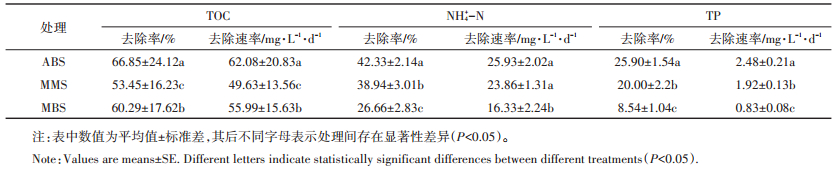
ABS处理中TOC去除率和去除速率分别为66.85%和62.08 mg·L-1·d-1,均显著高于MMS和MBS处理(表 2,P < 0.01),3个处理中TOC去除率由大到小依次为ABS(66.85%) > MBS(60.29%) > MMS(53.45%),表明微藻和有机物降解菌共培养可以提高废水中有机物的去除效果。向微藻培养系统中加入有机物降解菌后,废水中有机物被其分解产生二氧化碳供微藻进行光合作用,这促进了微藻的生长(图 1)[16],从而产生更多的氧气供有机物降解菌进行呼吸作用,因而提高了TOC的去除率。本文废水中氮素主要以氨氮形式存在,其占总氮的比例为92.32%。因此主要探讨氨氮的去除过程。ABS处理中氨氮去除率显著高于MMS和MBS处理(表 2,P < 0.05),3个处理氨氮去除率由大到小排序为ABS(42.33%) > MMS(38.94%) > MBS(26.66%)。废水中氨氮的主要去除途径包括微藻吸收、氨挥发和硝化作用等[22-24],向微藻培养系统中加入有机物降解菌可以促进微藻的生长,因而增加微藻对氨氮的吸收量,使氨氮去除率升高。ABS处理中总磷的去除率(25.90%)及去除速率(2.48 mg·L-1·d-1)显著高于MMS和MBS处理(表 2,P < 0.05)。磷素的去除途径主要包括微藻吸收[25]和化学沉淀[26]两种形式,其中化学沉淀主要出现在高pH(9~11)和钙镁离子含量的废水中,本文废水pH(低于9)和钙镁离子浓度均较低(表 1),不利于磷沉淀的发生,因而磷素的主要去除途径为微藻吸收。ABS处理中微藻生物量最高(图 1),故其对磷的去除效果最好。
|
|
表 2 藻-菌系统对废水中碳氮磷的去除效果 Table 2 Nutrient removal from wastewater by microalgae-bacteria system |
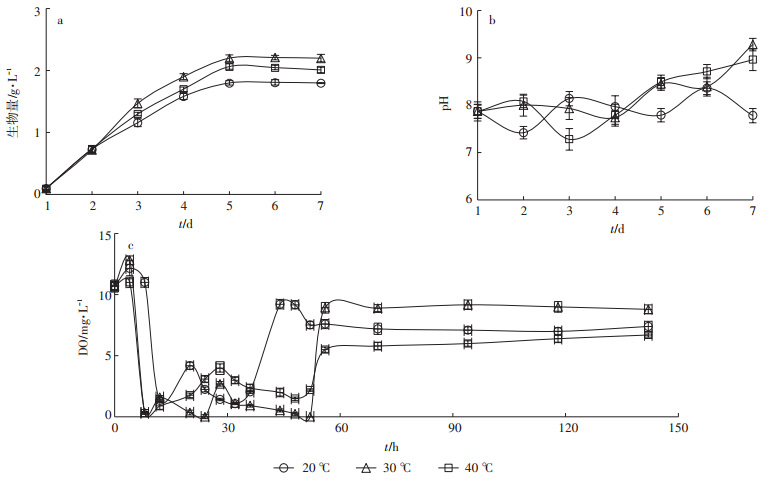
根据前期试验结果,近具刺链带藻在35 ℃时对养猪废水中氮磷的去除效果优于15 ℃和25 ℃[27],但不能确定当温度高于35 ℃时微藻对氮磷的去除效果是否会随温度升高而增强,故本文设置了20、30、40 ℃ 3个温度梯度来探讨温度对藻-菌共培养系统废水净化能力的影响。结果表明,温度为20 ℃和30 ℃的藻菌系统中TOC浓度在前3 d下降较快,随后基本保持稳定,这是因为微藻和细菌在前几日处于生长对数期,因而对TOC的去除效率较高。而40 ℃处理中TOC浓度在前5 d一直呈缓慢下降趋势,从第5 d到第6 d下降较快,随后略微上升(图 2a)。从去除率来看,30 ℃时废水中有机物的去除效果最好,将TOC从614 mg· L-1降至168 mg· L-1,去除率为72.64%,其次是20 ℃处理(去除率为61.73%),而40 ℃处理TOC去除率最低仅为42.83%,显著低于前二者(P < 0.01,表 3)。

|
图 2 不同温度条件下藻-菌系统对废水中碳氮磷去除效果 Figure 2 Purification of piggery digestate by microalgae-bacteria system under different temperature conditions |
|
|
表 3 藻-菌系统在不同温度和光照条件下对废水中碳氮磷的去除率(%) Table 3 Nutrient removal efficiency by microalgae-bacteria system under different temperature and light conditions(%) |
3种温度条件下,系统中氨氮去除效果由高到低依次为40 ℃ > 30 ℃ > 20 ℃。氨氮浓度前3 d下降较快,从第4 d开始呈缓慢下降趋势(图 2b)。试验结束时40 ℃系统中氨氮浓度从363.31 mg·L-1降至172.55 mg·L-1,去除率为52.51%;温度为30 ℃系统中氨氮浓度从363.31 mg· L-1降至198.33 mg· L-1,去除率为45.41%;温度为20 ℃系统中氨氮浓度从363.31 mg·L-1降至234.57 mg·L-1,去除率为35.43%(表 3)。各处理中总氮的变化趋势与氨氮一致,即前3 d下降较快,从第4 d开始基本保持稳定(图 2c),最终40 ℃条件下总氮去除率最高,为53.27%,其次为30 ℃(45.97%)和20 ℃(37.22%)两个处理(表 3)。
总磷去除效果方面,温度为30 ℃处理显著强于温度为20 ℃和40 ℃处理(P < 0.05),40 ℃处理和20 ℃处理间不存在显著性差异(P > 0.05)(图 2d,表 3)。各系统中总磷浓度在前3 d迅速下降,第4 d后下降速度减缓,到第6 d时不再下降,其中30 ℃处理稳定在42 mg·L-1左右(去除率约26%),40 ℃处理稳定在45 mg· L-1左右(去除率约20%),20 ℃处理稳定在46 mg·L-1左右(去除率约18%)(表 3)。
温度会影响藻菌系统中微藻的生长和细菌的活性,从而影响污染物的去除效果。不同藻种的最适温度范围也有所不同。一般低温藻株的最适温度范围为25~30 ℃[28-29];而高温藻株的最适温度范围为35~ 40 ℃。当温度高于或低于其最适温度时,微藻的生长就会受到影响。废水中的有机物既能被细菌分解,也能被微藻直接吸收利用。本研究中微藻在30 ℃时生长情况最好(图 3a),故其光合产氧能力最强(图 3c),提供给细菌的氧气充足,因而有机物降解效果最好(图 2a)。氮素去除方面,温度为40 ℃系统中微藻生长情况虽不是3个处理中最好的,但此温度条件下系统中氮素(包括氨氮和总氮)去除效果最好。这与该处理中温度高,氨氮易以游离氨的形式挥发有关。因为水中游离氨浓度主要取决于氨氮浓度、温度及pH[30-31],在pH(图 3b)和初始氨氮浓度一致的情况下,温度升高对游离氨的挥发起决定作用。对不同温度条件下废水中游离氨挥发所占比例采用如下公式[32]进行计算:
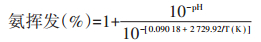
|
|
图 3 不同温度条件下微藻生长生物量、废水中溶解氧和pH变化情况 Figure 3 Variation of microalgae biomass, DO and pH in the wastewater at different temperatures |
发现温度为30 ℃处理中氨挥发所占比例为50.26%,而温度为40 ℃处理中氨挥发所占比例为71.51%,明显高于30 ℃处理。并且将温度控制在30 ℃时,更有利于硝化作用的进行,故一部分氨氮转化为硝氮或亚硝氮。因此不论从氨氮还是总氮去除效果来看,40 ℃处理均优于30 ℃处理。温度为20 ℃处理中不论生物量、碳氧供给能力还是温度,均是最低,故该系统中氮素去除效果最差。磷素去除方面,由于其去除方式主要有藻体吸收[25]、吸附[33]和沉降[26] 3种方式,故影响总磷去除效果的因素主要有微藻生长情况、废水pH及金属离子含量等。各个处理中废水初始pH和金属离子含量基本一致,故微藻生物量是影响磷素去除的主要因素。本研究中当温度控制在30 ℃时微藻生物量最大,故其磷素去除效果最好。综合考虑氮磷的去除效果、二次污染、微藻生长情况等因素,40 ℃虽然氮素去除效果最好,氮素更多的是以氨挥发的形式去除,易造成二次污染,且微藻生长情况并不是最好。而将温度控制在30 ℃时,微藻生长、磷素去除效果均是最好的,故可将30 ℃作为藻-菌系统运行的较优温度。
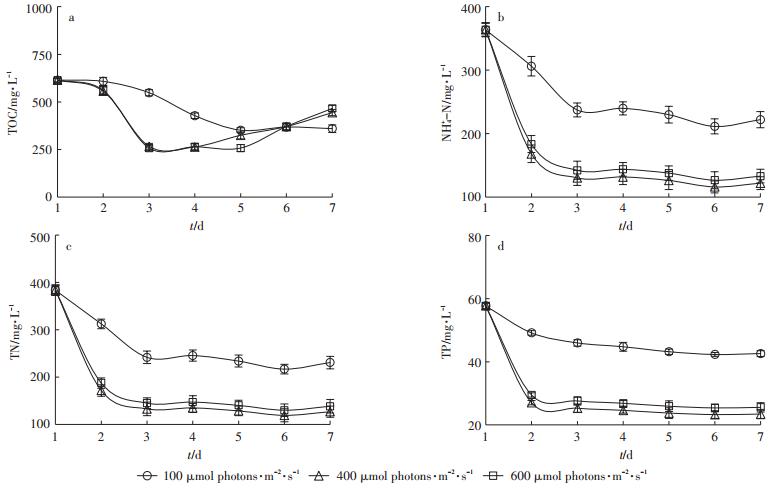
2.3 光照强度对藻-菌共培养系统碳氮磷净化能力的影响对不同光照强度下废水中有机物降解情况进行探讨,结果表明,光照强度为400 μmol photons·m-2·s-1和600 μmol photons·m-2·s-1两个处理中TOC变化趋势基本一致(图 4a),即前3 d下降较快,在第3 d时降至最低值(去除率约为57%,表 3),从第4 d开始,TOC含量开始上升。而光强为100 μmol photons·m-2·s-1处理中TOC在前5 d一直呈下降趋势,从第5 d开始基本保持稳定,去除率稳定在40%左右。到试验结束时(第7 d),TOC去除效果最好的处理变成光强100 μmol photons·m-2·s-1处理(41.44%),而光照强度400 μmol photons·m-2·s-1和600 μmol photons·m-2·s-1两个处理中TOC去除率分别为27.77%和24.24%。400 μmol photons·m-2·s-1和600 μmol photons·m-2·s-1两处理中TOC含量出现增加的情况可能是由于藻体向水体中分泌有机物造成的[34],因为光照是影响EPS产生的关键因子,较高的光照强度条件下会使藻体分泌的EPS含量显著增加[35],因而造成TOC含量上升。
|
图 4 不同光照强度下藻-菌系统对废水中碳氮磷去除效果 Figure 4 Purification of piggery digestate by microalgae-bacteria system under different light conditions |
对不同光照强度下藻-菌系统中氮磷去除效果进行研究,结果表明低光照强度处理(100 μmol photons·m-2·s-1)中氮磷去除效果明显不如高光照强度处理(400 μmol photons·m-2·s-1和600 μmol photons·m-2· s-1)(图 4,P < 0.01),而光照强度为600 μmol photons· m-2 ·s-1和400 μmol photons·m-2·s-1处理间氮磷去除效果不存在显著性差异(P > 0.05)。各处理中氨氮浓度在前3 d迅速下降,随后基本保持稳定,其中100 μmol photons·m-2·s-1处理稳定在220 mg·L-1左右(去除率约为35%,表 3),400 μmol photons·m-2·s-1和600 μmol photons·m-2·s-1处理稳定在130 mg·L-1左右(去除率约65%左右,表 3)。各处理中总氮与氨氮有着相同的变化趋势即前3 d迅速下降,随后开始基本保持稳定,光强为100、400 μmol photons·m-2·s-1和600 μmol photons·m-2·s-1 3个处理中总氮分别稳定在230、128 mg·L-1和140 mg·L-1,去除率维持在37%、65%和63%左右(表 3)。各处理总磷浓度在前2 d迅速下降,从第3 d开始光强为100 μmol photons·m-2·s-1处理中总磷呈缓慢下降,到第6 d基本稳定在42 mg· L-1左右(去除率约为26%)。而400 μmol photons· m-2 ·s-1和600 μmol photons·m-2·s-1两处理中总磷从第3 d开始基本保持稳定,其值为24 mg·L-1和26 mg·L-1左右,去除率约为56%和52%(表 2)。
光照是藻细胞进行光合作用的前提条件,光照强度能够影响藻细胞的光合作用效率,进而对光合产氧能力产生影响。在低光强时,随光照强度的增强,微藻生物量和产氧量增多,超过饱和光照强度时,微藻生长受到抑制,光合产氧量也趋向稳定[36]。本研究中光强为400 μmol photons·m-2·s-1时微藻生物量(图 5a)和光合产氧量最高(图 5c),可认为近具刺链带藻Desmodesmus sp. CHXl的光饱和点可能在400 μmol photons·m-2·s-1附近。通过分析不同光照强度下微藻生物量(图 5a)、产氧特征(图 5c)和有机物降解特征(图 4a)可知,当光照强度接近光饱和点附近时(400 μmol photons·m-2·s-1),微藻的生物量和光合产氧能力达到最大值,此时废水中有机物被细菌分解或微藻吸收的量最大,去除效果最好;继续增加光照强度(如600 μmol photons·m-2·s-1)并不能增加微藻生物量和提供光合产氧量,因而有机物去除效果并没有提升;然而降低光照强度(如100 μmol photons·m-2·s-1)时,系统中微藻生物量和光合产氧能力明显下降,有机物去除效果也随之下降。

|
图 5 不同光照强度条件下微藻生长生物量、废水中溶解氧和pH变化情况 Figure 5 Variation of microalgae biomass, DO and pH in the wastewater under different light conditions |
猪场沼液中的氮素主要以氨氮的形式存在,其在藻-菌共培养系统中的去除途径主要包括微藻吸收、氨挥发、硝化作用等。由于光照强度为400 μmol photons·m-2·s-1和600 μmol photons·m-2·s-1时,藻-系统中微藻生物量(图 5a)、光合产氧能力(图 5c)和pH(图 5b)明显高于光强为100 μmol photons·m-2·s-1条件下,造成氨氮的3个去除过程(微藻吸收、氨挥发和硝化作用)在高光强下的表现更好,因此藻-菌系统在光照强度为400 μmol photons·m-2·s-1和600 μmol photons· m-2 ·s-1时对氨氮的去除效果要明显优于光强为100 μmol photons·m-2·s-1条件下(P < 0.01,图 4b)。光强为400 μmol photons·m-2·s-1和600 μmol photons·m-2·s-1两个系统中由于在微藻生物量、光合产氧能力和pH等方面均无显著性差异(P > 0.05),故其氨氮去除效果也基本一致(图 4b)。总磷去除方面,其去除途径主要有藻体吸收[25]、吸附[33]和沉降[26] 3种方式,故影响总磷去除效果的因素主要有微藻生长情况、废水pH及金属离子含量等。由上述分析可知,光照强度对微藻生长和pH影响较大,故其可通过影响藻-菌系统中微藻对磷的吸收及磷沉淀过程来影响总磷的去除效果。由于光强为400 μmol photons·m-2·s-1和600 μmol photons·m-2·s-1两个系统中微藻生物量和pH间均无显著性差异(P > 0.05),故其对总磷的去除效果相当。而光强为100 μmol photons·m-2·s-1处理中不论是微藻生物量还是pH条件均显著低于前者,故其总磷去除效果也明显更差(P < 0.01)。
3 结论(1)添加有机物降解菌不仅有助于促进微藻的生长,还能促进废水中碳氮磷的去除效果,其中总有机碳、氨氮和总磷的去除率分别提高了13.40%、3.39%和5.90%。
(2)将藻-菌系统温度控制在30 ℃时更利于近具刺链带藻生长和沼液的净化,其中微藻生物量、TOC、NH4+-N和TP去除率最高值分别为2.21 g·L-1、72.64%、45.41%和26.66%。
(3)将藻-菌系统光照强度控制在400 μmol photons·m-2·s-1时系统中微藻生长情况及氮磷去除效果最佳,其中微藻生物量、TOC、NH4+-N和TP去除率最高值分别为2.35 g·L-1、57.03%、68.01%和59.66%。
| [1] |
Park J, Jin H F, Lim R, et al. Ammonia removal from anaerobic digestion effluent of livestock waste using green alga Scenedesmus sp.[J]. Bioresource Technology, 2010, 101(22): 8649-8657. DOI:10.1016/j.biortech.2010.06.142 |
| [2] |
Uludag-demirer S, Demirer G N, Frear C, et al. Anaerobic digestion of dairy manure with enhanced ammonia removal[J]. Journal of Environmental Management, 2008, 86(1): 193-200. |
| [3] |
Tricase C, Lombardi M. State of the art and prospects of Italian biogas production from animal sewage:Technical-economic considerations[J]. Renewable Energy, 2009, 34(3): 477-485. DOI:10.1016/j.renene.2008.06.013 |
| [4] |
武立叶, 郑佩佩, 赵吉祥, 等. 沼液灌溉对大白菜产量、品质及土壤养分含量的影响[J]. 中国沼气, 2014, 32(3): 90-93. WU Li-ye, ZHENG Pei-pei, ZHAO Ji-xiang, et al. The effect of biogas slurry irrigation on Chinese cabbage Beassica pekinensis L. and the soil quality[J]. China Biogas, 2014, 32(3): 90-93. DOI:10.3969/j.issn.1000-1166.2014.03.020 |
| [5] |
刘国, 胡凤妹, 汤景鹏, 等. 不同基质的人工湿地去除猪场沼液中磷的性能[J]. 环境工程, 2014, 32(10): 55-60. LIU Guo, HU Feng-mei, TANG Jing-peng, et al. Removal of phosphous from biogas slurry of pig farm by artificial wetlands filled different materials[J]. Water Pollution Control, 2014, 32(10): 55-60. |
| [6] |
王振, 张彬彬, 向衡, 等. 垂直潜流人工湿地堵塞及其运行效果影响研究[J]. 中国环境科学, 2015, 35(8): 2494-2502. WANG Zhen, ZHANG Bin-bin, XIANG Heng, et al. Clogging of vertical subsurface flow constructed wetland and its effects on purifying efficiency[J]. China Environmental Science, 2015, 35(8): 2494-2502. DOI:10.3969/j.issn.1000-6923.2015.08.030 |
| [7] |
隋倩雯.氨吹脱与膜生物反应器组合工艺处理猪场厌氧消化液研究[D].北京: 中国农业科学院, 2014. SUI Qian-wen. Combined of ammonia stripping and membrane bioreactor processes for anaerobically digested swine wastewater treatment[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. http://cdmd.cnki.com.cn/Article/CDMD-82101-1014326346.htm |
| [8] |
Garcia M C, Szogi A A, Vanotti M B, et al. Enhanced solid-liquid separation of dairy manure with natural flocculants[J]. Bioresource Technology, 2009, 100(22): 5417-5423. DOI:10.1016/j.biortech.2008.11.012 |
| [9] |
Wang J H, Zhang T Y, Dao G H, et al. Microalgae-based advanced municipal wastewater treatment for reuse in water bodies[J]. Applied Microbiology & Biotechnology, 2017, 101(7): 1-17. |
| [10] |
Riedel T E, Berelson W M, Nealson K H, et al. Oxygen consumption rates of bacteria under nutrient-limited conditions[J]. Applied & Environmental Microbiology, 2013, 79(16): 4921-4931. |
| [11] |
Guo Z, Tong Y W. The interactions between Chlorella vulgaris and algal symbiotic bacteria under photoautotrophic and photoheterotrophic conditions[J]. Journal of Applied Phycology, 2014, 26(3): 1483-1492. DOI:10.1007/s10811-013-0186-1 |
| [12] |
Ramanan R, Kim B H, Cho D H, et al. Algae-bacteria interactions:Evolution, ecology and emerging applications[J]. Biotechnology Advances, 2016, 34(1): 14-29. DOI:10.1016/j.biotechadv.2015.12.003 |
| [13] |
Subashchandrabose S R, Ramakrishnan B, Megharaj M, et al. Consortia of Cyanobacteria/microalgae and bacteria:Biotechnological potential[J]. Biotechnology Advances, 2011, 29(6): 896. DOI:10.1016/j.biotechadv.2011.07.009 |
| [14] |
Risgaardpetersen N, Nicolaisen M H, Revsbech N P, et al. Competition between ammonia-oxidizing bacteria and benthic microalgae[J]. Applied & Environmental Microbiology, 2004, 70(9): 5528-5537. |
| [15] |
Cheng H X, Tian G M. Identification of a newly isolated microalga from a local pond and evaluation of its growth and nutrients removal potential in swine breeding effluent[J]. Desalination & Water Treatment, 2013, 51(13/14/15): 2768-2775. |
| [16] |
Watanabe K, Takihana N, Aoyagi H, et al. Symbiotic association in Chlorella culture[J]. Fems Microbiology Ecology, 2005, 51(2): 187-196. DOI:10.1016/j.femsec.2004.08.004 |
| [17] |
Jung S W, Kim B H, Katano T, et al. Pseudomonas fluorescens HYK0210-SK09 offers species-specific biological control of winter algal blooms caused by freshwater diatom Stephanodiscus hantzschii[J]. Journal of Applied Microbiology, 2008, 105(1): 186-195. DOI:10.1111/jam.2008.105.issue-1 |
| [18] |
de-bashan L E, Bashan Y, Moreno M, et al. Increased pigment and lipid content, lipid variety, and cell and population size of the microalgae Chlorella spp. when co-immobilized in alginate beads with the microalgae-growth-promoting bacterium Azospirillum brasilense[J]. Canadian Journal of Microbiology, 2002, 48(6): 514-521. DOI:10.1139/w02-051 |
| [19] |
Mouget J, Dakhama A, Lavoie M C, et al. Algal growth enhancement by bacteria:Is consumption of photosynthetic oxygen involved?[J]. FEMS Microbiology Ecology, 1995, 18(1): 35-43. DOI:10.1016/0168-6496(95)00038-C |
| [20] |
Posadas E, Garcíaencina P A, Soltau A, et al. Carbon and nutrient removal from centrates and domestic wastewater using algal-bacterial biofilm bioreactors[J]. Bioresource Technology, 2013, 139(13): 50. |
| [21] |
Demmig-Adams B, Adams W W. The role of xanthophyll cycle carotenoids in the protection of photosynthesis[J]. Trends in Plant Science, 1996, 1(1): 21-26. |
| [22] |
Markou G, Vandamme D, Muylaert K. Ammonia inhibition on Arthrospira platensis in relation to the initial biomass density and pH[J]. Bioresource Technology, 2014, 166(14): 4900-4916. |
| [23] |
González-Fernández C, Molinuevo-Salces B, García-González M C. Nitrogen transformations under different conditions in open ponds by means of microalgae-bacteria consortium treating pig slurry[J]. Bioresource Technology, 2011, 102(2): 960-966. DOI:10.1016/j.biortech.2010.09.052 |
| [24] |
Karya N G A I, Van Der Steen N P, Lens P N L. Photo-oxygenation to support nitrification in an algal-bacterial consortium treating artificial wastewater[J]. Bioresource Technology, 2013, 134(2): 244-250. |
| [25] |
Su Y, Mennerich A, Urban B. Municipal wastewater treatment and biomass accumulation with a wastewater-born and settleable algal-bacterial culture[J]. Water Research, 2011, 45(11): 3351-3358. DOI:10.1016/j.watres.2011.03.046 |
| [26] |
Larsdotter K, Ji J, Dalhammar G. Phosphorus removal from wastewater by microalgae in Sweden-a year-round perspective[J]. Environmental Technology, 2010, 31(2): 117-123. |
| [27] |
Luo L, Shao Y, Luo S, et al. Nutrient removal from piggery wastewater by Desmodesmus sp. CHX1 and its cultivation conditions optimization[J]. Environmental Technology, 2018, 1-8. |
| [28] |
Renaud S M, Thinh L V, Lambrinidis G, et al. Effect of temperature on growth, chemical composition and fatty acid composition of tropical Australian microalgae grown in batch cultures[J]. Aquaculture, 2002, 211(1): 195-214. |
| [29] |
Schnurr P J, Espie G S, Allen D G. Algae biofilm growth and the potential to stimulate lipid accumulation through nutrient starvation[J]. Bioresource Technology, 2013, 136C(5): 337-344. |
| [30] |
Azov Y, Goldman J C. Free ammonia inhibition of algal photosynthesis in intensive cultures[J]. Applied & Environmental Microbiology, 1982, 43(4): 735-739. |
| [31] |
Pérez N M, Ames W M, Nilsson H, et al. Ammonia binding to the oxygen-evolving complex of photosystem Ⅱ identifies the solvent-exchangeable oxygen bridge(μ-oxo)of the manganese tetramer[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(39): 15561-15566. DOI:10.1073/pnas.1304334110 |
| [32] |
Hansen K H, Angelidaki I, Ahring B K. Anaerobic digestion of swine manure:Inhibition by ammonia[J]. Water Research, 1998, 32(1): 5-12. |
| [33] |
Martinez M E, Sánchez S, Jiménez J M, et al. Nitrogen and phosphorus removal from urban wastewater by the microalga Scenedesmus obliquus[J]. Bioresource Technology, 2000, 73(3): 263-272. DOI:10.1016/S0960-8524(99)00121-2 |
| [34] |
Mujtaba G, LEE K. Treatment of real wastewater using co-culture of immobilized Chlorella vulgaris and suspended activated sludge[J]. Water Research, 2017, 120: 174-184. DOI:10.1016/j.watres.2017.04.078 |
| [35] |
Rebolloso Fuentes M M, Garcia Sánchez J L, Fernández Sevilla J M, et al. Outdoor continuous culture of Porphyridium cruentum in a tubular photobioreactor: Quantitative analysis of the daily cyclic variation of culture parameters[C]//Osinga R, Tramper J, Burgess J G, et al. Progress in industrial microbiology, Amsterdam: Elsevier, 1999: 271-288.
|
| [36] |
席婷婷.城市污水培养藻类系统中影响藻类供氧效能的因素研究[D].哈尔滨: 哈尔滨工业大学, 2012. XI Ting-ting. Factors influencing oxygen supply efficiency of algae on system of algae culture from municipal wastewater[D]. Harbin: Harbin Institute of Technology, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10213-1013039230.htm |
 2019, Vol. 38
2019, Vol. 38