2. 九江学院化学与环境工程学院, 江西 九江 332005;
3. 宁波大学海洋学院, 浙江 宁波 315211;
4. 江西省九江市濂溪区农业局, 江西 九江 332005
2. School of Chemical and Environmental Engineering, Jiujiang University, Jiujiang 332005, China;
3. School of Marine Sciences, Ningbo University, Ningbo 315211, China;
4. Bureau of Agriculture, Lianxi District, Jiujiang City, Jiangxi Province, Jiujiang 332005, China
随着沼气工程的发展,畜禽养殖业粪污资源化取得了明显的成效。但是在提供清洁能源的同时,也产生了大量的沼渣和沼液废水。大量富营养的猪粪沼液废水对水体环境以及人类健康都造成了严重危害[1-2]。猪粪沼液废水是一种较难处理的有机废水,除了富含N、P等营养物质外,还有少量重金属、抗生素等成分。未得到妥善处理的猪粪沼液会导致水体富营养化、人类饮用水源污染等问题,严重破坏水体生态环境[3]。
目前处理沼液废水的方法主要有还田应用、物理化学法及厌氧发酵等工艺[4-5]。还田应用在一定程度上实现了畜禽粪污的资源化利用,但农田作物对畜禽粪污的接纳能力有限,不能与畜禽排放量完全同步,进而引起水体及土壤累积性污染。物理化学法与厌氧发酵技术虽然能去除沼液废水中部分有机、无机污染物,但对沼液废水中的N、P等大量物质的去除效果不明显,并且具有成本高、不易操作等缺点[6]。
微藻是一种单细胞光合自养生物,其生长所需要的营养成分较为简单,可利用沼液废水中营养物质进行生长[7]。利用微藻净化污水或处理猪粪沼液废水的技术已得到国内外学者的认可[8]。微藻在处理沼液废水过程中,由于自身细胞的增殖与营养物质的积累,在降低培养基成本的同时也实现了沼液废水的无害化、资源化利用[9]。但实际情况中养猪沼液过高浓度的NH4+-N超出了微藻的耐受性,抑制了藻细胞的生长。Min等[10]通过淡水稀释的方法降低NH4+-N浓度,Deng等[11]利用厌氧消化预处理降低NH4+-N浓度,均达到了一定的效果。但这些技术手段在应用中却面临高成本等问题。因此,利用藻类处理养猪沼液还需进一步研究[12]。
养猪沼液成分复杂,富含COD、有机物等物质,导致水体的光强和光质随着水体透明度发生变化,抑制甚至损害藻类的生长。光是调控藻类植物生长发育的关键因子之一,藻类对可见光的吸收波长主要集中在400~510 nm的蓝紫光区和610~720 nm的红橙光区。大量研究发现光质对藻类的生长发育、形态、光合作用和物质代谢等具有重要的调控作用,如蛋白核小球藻(Chlorella pyrenoidosa)在蓝光下的生长效果最佳[13],而红光则能促进等鞭金藻的藻细胞生长[14]。光质是光的重要属性,因此光质应被优先考虑。探究不同光质条件对藻类处理养猪沼液废水的影响具有一定的理论意义。
在藻类培养处理沼液废水过程中NH4+-N浓度是限制微藻-沼液资源化利用的重要因素。利用藻类培养深度净化沼液废水,解决废水中高浓度NH4+-N问题很关键。微藻在处理NH4+-N同时也为自身生长提供氮源,而铵盐是藻细胞优先利用的氮源,在氮吸收调节过程中起到重要作用[15]。由于实际猪业养殖过程中,猪饲料Cu元素的存在可以促进猪肠道对营养物质的吸收,而猪本身却对Cu2+的吸收率仅为10%左右,大部分Cu2+随猪尿排出[16]。因此,Cu2+是养猪沼液废水中普遍存在的金属元素。藻类去除重金属的机制比较明确,但沼液废水中存在的一些金属元素是否影响NH4+-N在藻细胞内的吸收代谢目前尚不清楚,还需进一步研究。
基于上述背景,本文以筛选得到耐污能力强的栅藻(Scenedesmus obliquus)为研究对象,采集江西九江境内养殖场厌氧发酵后的典型沼液废水,研究不同光质条件(红光、蓝光、白光)对栅藻处理沼液废水的影响。同时以养猪沼液中NH4+-N、Cu2+浓度为参照,在BG11培养基中考察不同浓度的NH4+-N及金属Cu2+对栅藻生长的影响,以期为微藻-沼液废水资源化利用提供理论基础。
1 材料与方法 1.1 藻种与培养基本实验所用栅藻(Scenedesmus obliquus)由实验室筛选并驯化保藏。栅藻种子液培养及NH4+-N、Cu2+浓度对栅藻生长实验所用培养基为BG11培养基[17]。
栅藻培养所用反应器为玻璃柱式反应器,内直径0.05 m,柱高0.55 m,反应体积0.9 L。反应器内部布置直径5 mm的玻璃通气管,混合有1.5% CO2(V/V)的压缩空气(0.1 MPa)以100 mL·min-1的速率通过通气管从反应器底部曝气,使藻液搅动并补充碳源。前期研究证实,光照强度80~100 μmol photons·m-2·s-1下栅藻细胞生长较好。为了考察栅藻生长最高效率,栅藻培养过程中连续光照,培养柱表面光强100 μmol photons·m-2·s-1,培养温度(25±1)℃。
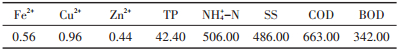
1.2 沼液废水本文栅藻培养所用沼液废水取自江西九江境内某养殖场经厌氧发酵后的典型沼液废水,取水时间为2017年9月12日10:00。废水经自然沉降2 d后,取上清液测定其初始氨氮(NH4+-N)、Cu2+、总磷(TP)、COD等指标,结果见表 1。
|
|
表 1 沼液废水的参数指标(mg·L-1) Table 1 The features of the raw piggery wastewater(mg·L-1) |
本实验以稀释两倍的养猪沼液废水作为栅藻培养液。取自然沉降后的沼液上清液1000 mL,再加入1000 mL蒸馏水,制成培养液。将培养至对数期的栅藻种子液接入配制好的培养液中,在玻璃柱式反应器中进行培养。在LED光源仪器下接受不同光质(蓝光、红光、白光)条件的培养,其中蓝光波长范围为455~475 nm,红光波长范围为580~630 nm,白光波长范围为400~760 nm,采用连续光照,光照强度均为100 μmol·m-2·s-1,培养温度为(25± 1)℃。每2 d称量藻体生物量,重复3次,培养周期为10 d。
同时,在不同光质条件培养过程中取培养液,分别测定2、4、6、10 d的培养液中NH4+-N浓度变化情况。NH4+-N测量采用纳氏试剂分光光度法(HJ 535— 2009)。
1.3.2 不同NH4+-N、Cu2+浓度对栅藻生长的影响以取自厌氧发酵的养猪沼液废水中NH4+-N(506 mg·L-1)、Cu2+浓度(0.96 mg·L-1)为参照对象,在BG11培养基中以NH4Cl替代NaNO3作为氮源,分别设置NH4+-N浓度为50、100、500、2000 mg·L-1,并以BG11培养基作为对照,考察栅藻生物量积累情况;同时在BG11培养基中分别设置不同Cu2+浓度为0.5、1.0、2.0 mg·L-1,并与正常培养基比较,考察栅藻生物量积累情况。
1.4 藻细胞生物量测定与生物产率计算将孔径0.45 μm、直径50 mm、面积为0.001 m2的醋酸纤维滤膜煮沸3次后,在105 ℃烘箱中烘至恒质量(W1),将待测藻细胞用移液器取15 mL藻样到抽滤装置内,抽滤至已称质量的滤膜上,将附着藻的滤膜放入105 ℃烘箱中烘至恒质量(W2),用分析天平称量,并计算藻细胞的生物量(DW,g·L-1)。
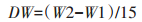
|
基于本研究培养时间为10 d,栅藻生物产率(BP,g·L-1·d-1)计算公式如下:

|
数据采用统计软件SPSS 10.0进行单因素方差分析(One-way ANOVA)。
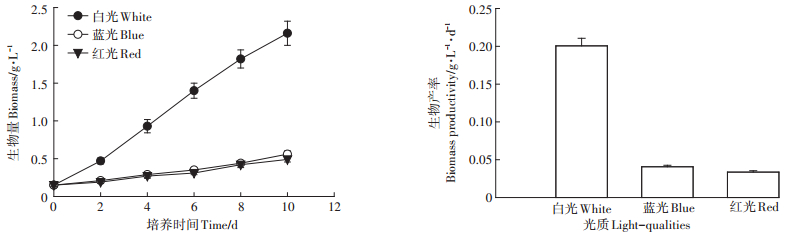
2 结果与分析 2.1 红光、蓝光、白光条件下沼液废水培养栅藻生长及NH4+-N去除效果培养10 d后测定栅藻的生长情况,结果如图 1所示,在3种光质条件下栅藻均能在沼液废水中生长,但在蓝光和红光下的生长状况不佳,尤其是培养至后期,藻细胞增长趋于平缓。而白光条件下藻细胞的生长速率最快,明显高于蓝光和红光,其生物产率分别为0.21、0.04、0.03 g·L-1·d-1。
|
图 1 不同光质条件下栅藻在沼液废水中的生长状况 Figure 1 The growth of Scendesmus dimorphus with different light qualities in swine wastewater |
在光照强度100 μmol·m-2·s-1的不同光质条件下培养栅藻,经测定,稀释1倍后的沼液中NH4+-N浓度为326 mg·L-1。一个培养周期内测定的培养液中NH4+-N浓度见图 2。由图 2可知,相同培养条件中,白光光质条件下栅藻去除沼液废水中NH4+-N能力最强,由初始的NH4+-N浓度326 mg·L-1降到29 mg·L-1,去除率为91.1%。不同取样时间下,蓝光和红光光质条件中的NH4+-N浓度变化不大,培养10 d后去除效率分别为72.4%和66.9%。对比图 1与图 2可知,栅藻在不同光质条件下对沼液废水中NH4+-N去除效率与栅藻细胞生长状况相对应。

|
图 2 不同光质条件下沼液废水中NH4+-N浓度变化 Figure 2 Concentrations and removal efficiency of NH4+-N with different light qualities in swine wastewater |
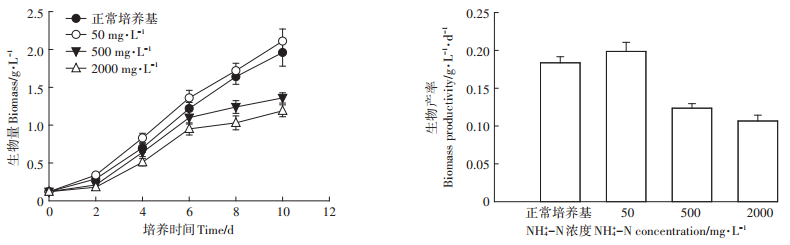
不同NH4+-N浓度对栅藻生长的影响结果(图 3)表明,栅藻在50 mg·L-1低NH4+-N浓度下生长较好,其生物产率为0.20,优于正常BG11培养基的0.18 g· L-1·d-1。但是在NH4+-N浓度500、2000 mg·L-1下,栅藻生长不理想,生物产率分别为0.12、0.11 g·L-1·d-1。这说明利用栅藻培养处理沼液废水,高NH4+-N浓度是限制藻类生长的重要因素。
|
图 3 NH4+-N对栅藻细胞生长的影响 Figure 3 Effects of ammonia nitrogen on growth of Scenedesmus obliquus |
不同Cu2+浓度对栅藻生长的影响结果如图 4所示。由图 4a可知,在培养前4 d内栅藻在不同Cu2+浓度下生长速率与正常培养基相差不大。随着培养时间的延长,培养10 d时,Cu2+浓度越高栅藻生物产率越低,0.5、1.0、2.0 mg·L-1 Cu2+浓度分别为0.18、0.15、0.13 g·L-1·d-1,都低于正常培养下的生物产率0.19 g· L-1·d-1。因此,养猪沼液中存在的金属Cu2+也是限制藻类生长的重要因素。

|
图 4 Cu2+对栅藻细胞生长的影响 Figure 4 Effects of copper on growth of Scenedesmus obliquus |
以沼液废水中506 mg·L-1 NH4+-N浓度为标准,在BG11培养基中设置500 mg·L-1的NH4+-N浓度,然后将栅藻分别培养于额外添加Cu2+浓度0.5、1.0、2.0 mg·L-1的培养液中。培养10 d后,结果(图 5)表明,添加Cu2+浓度0.5、1.0 mg·L-1的培养液中栅藻生物产率分别为0.18、0.19 g·L-1·d-1,与正常培养基相近。而高Cu2+浓度(2.0 mg·L-1)下,栅藻生长较差,生物产率为0.13 g·L-1·d-1。但将图 5与图 4b比较表明,一定的NH4+-N存在下,栅藻能耐受较高的Cu2+浓度。
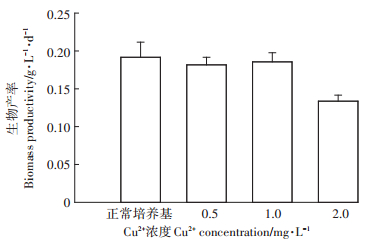
|
图 5 NH4+-N存在下Cu2+对栅藻生长的影响 Figure 5 Effects of copper on growth of Scenedesmus obliquus with ammonia nitrogen coexistence |
光是藻类生长发育过程中重要的环境因子之一。本研究将栅藻分别置于不同光质条件(白光、红光、蓝光)的沼液废水中培养,结果显示栅藻在白光下生长状况要显著优于其他两类光质条件。这说明不同波长的光源会影响栅藻细胞组分在沼液废水中的合成。同样,相比于其他两种光质,白光条件下栅藻对沼液废水中NH4+-N去除效率更高。不同光质条件对不同藻类的生长影响不同,这主要是因为不同藻种门类其色素体结构与组成不同,微藻光合细胞中捕获光能主要由光合色素完成,所以光环境(包括光质)的改变对微藻光合色素形成具有重要影响[18-20]。可能基于光质条件对栅藻细胞形态建成、光合特性及生理代谢等广泛的调控作用[21],栅藻在白光光质下培养并处理养猪沼液是相对较好的条件。
养猪沼液中N元素主要以NH4+-N形式存在,所以净化沼液废水解决NH4+-N问题很关键。本实验研究将栅藻培养于不同NH4+-N浓度的BG 11培养基中,在与沼液废水NH4+-N浓度相近的500 mg·L-1下栅藻生长并不理想。在一定NH4+-N浓度范围内,藻类生长速率随着NH4+-N浓度的增加而增加,但是超过这一范围,随着NH4+-N浓度的增加藻类生长速率反而递减,藻细胞甚至漂白死亡[22]。高NH4+-N对藻的毒害作用主要是破坏了藻细胞的光合系统作用[23]。利用藻类处理养猪沼液或许还需借助其他手段包括藻种筛选、改造或将低NH4+-N的其他废水与养猪沼液混合等,进而缓解高NH4+-N影响藻类生长的问题[24-25]。
金属Cu2+在养猪沼液中存在是因为Cu2+等金属元素在预防和治疗疾病、促进猪生长以及提高饲料利用效率等方面发挥了显著的作用,成为养猪产业不可或缺的金属元素。然而,猪等畜禽对Cu2+等金属元素的吸收效率很低,大部分随尿液排出,这也是养猪沼液中重金属Cu2+存在的主要原因[16]。在一定浓度范围内,藻类在响应重金属胁迫过程中,会建立起一系列的适应机制,通过控制重金属吸收、吸附、转运、解毒,使藻细胞组分中的重金属维持在正常浓度范围。但当培养液中金属浓度过高时就会抑制藻细胞的生长。这也印证了本研究中当培养基Cu2+浓度大于1.0 mg·L-1后,栅藻细胞生长速率变缓,生物产率低于正常培养及低浓度Cu2+(0.5 mg·L-1)下的生物产率(图 4)。
利用藻类培养处理养猪沼液的研究需要考虑众多因素的影响[26]。本研究主要侧重于沼液中存在的主要物质NH4+-N与Cu2+两种因素,考察它们同时存在下对藻类培养的影响。通过比较图 3与图 4发现:相比于单因素金属Cu2+存在下(图 4),栅藻在含高浓度NH4+-N沼液中更能耐受较高的Cu2+浓度。这或许说明一定的NH4+-N浓度促进了栅藻对Cu2+的富集或吸收。藻类去除重金属的机制比较明确,但沼液废水中存在的一些金属元素是否影响NH4+-N在细胞内的代谢目前尚不清楚,后续还需进一步研究。利用藻类培养处理养猪沼液废水,既可降低藻类的培养成本,又可净化废水,保护生态环境,是一条资源化利用的途径。
4 结论白光是栅藻处理养猪沼液较好的光质条件。高浓度的NH4+-N与Cu2+都会影响栅藻细胞的生长,但是培养液中一定的高浓度NH4+-N可以促进栅藻细胞对重金属Cu2+的吸收。
一定浓度NH4+-N与一定浓度金属Cu2+共存或许有益于藻细胞对沼液废水的处理,但NH4+-N与金属Cu2+共同作用对栅藻生长影响的机制还需进一步研究。
| [1] |
Chen X, Luo A C, Kuniaki S, et al. An introduction of a multi-soil-layering system:A novel green technology for wastewater treatment in rural areas[J]. Water and Environment Journal, 2009, 23(4): 255-262. DOI:10.1111/wej.2009.23.issue-4 |
| [2] |
Zhao J, Zhang K, Wang F, et al. Influence of livestock wastewater irrigation on nitrogen compounds contents in groundwater[J]. Ecology and Environmental Sciences, 2011, 20(1): 149-153. |
| [3] |
吴盼盼.基于微藻养殖的养猪沼液预处理技术研究[D].南昌: 南昌大学, 2015. WU Pan-pan. Study on piggery biogas slurry pretreatment based on microalgae culturing[D]. Nanchang: Nanchang University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10403-1016027667.htm |
| [4] |
Zhu L D, Hiltunen E. Application of livestock waste compost to cultivate microalgae for bioproducts production:A feasible framework[J]. Renewable and Sustainable Energy Reviews, 2016, 54: 1285-1290. DOI:10.1016/j.rser.2015.10.093 |
| [5] |
刘刈, 宋立, 邓良伟. 我国规模化养殖场粪便污水处理利用现状及对策[J]. 猪业科学, 2011, 28(6): 30-33. LIU Yi, SONG Li, DENG Liang-wei. Present situation and countermeasures of fecal sewage treatment and utilization of large-scale farm in China[J]. Swine Industry Science, 2011, 28(6): 30-33. DOI:10.3969/j.issn.1673-5358.2011.06.023 |
| [6] |
Sturm B S M, Lamer S L. An energy evaluation of coupling nutrient removal from wastewater with algal biomass production[J]. Applied Energy, 2011, 88(10): 3499-3506. DOI:10.1016/j.apenergy.2010.12.056 |
| [7] |
卫丹, 万梅, 刘锐, 等. 嘉兴市规模化养猪场沼液水质调查研究[J]. 环境科学, 2014, 35(7): 2650-2657. WEI Dan, WAN Mei, LIU Rui, et al. Study on the quality of digested piggery wastewater in large-scale farms in Jiaxing[J]. Environmental Science, 2014, 35(7): 2650-2657. |
| [8] |
Cai T, Park S Y, Li Y. Nutrient recovery from wastewater streams by microalgae:Status and prospects[J]. Renew Sust Energy Rev, 2013, 19: 360-369. DOI:10.1016/j.rser.2012.11.030 |
| [9] |
Kumar M S, Miao Z H, Wyatt S K. Influence of nutrient loads, feeding frequency and inoculum source on growth of Chlorella vulgaris in digested piggery effluent culture medium[J]. Bioresource Technology, 2010, 101(15): 6012-6018. DOI:10.1016/j.biortech.2010.02.080 |
| [10] |
Min M, Hu B, Mohr M J, et al. Swine manure-based pilot-scale algal biomass production system for fuel production and wastewater treatment:A case study[J]. Applied Biochemistry and Biotechnology, 2014, 172(3): 1390-1406. DOI:10.1007/s12010-013-0603-6 |
| [11] |
Deng X Y, Gao K, Zhang R C, et al. Growing Chlorella vulgaris on thermophilic anaerobic digestion swine manure for nutrient removal and biomass production[J]. Bioresource Technology, 2017, 243: 417-425. DOI:10.1016/j.biortech.2017.06.141 |
| [12] |
Deng X Y, Gao K, Addy M, et al. Cultivation of Chlorella vulgaris on anaerobically digested swine manure with daily recycling of the postharvest culture broth[J]. Bioresource Technology, 2017, 247: 716-723. |
| [13] |
苗洪利, 孙丽娜, 田庆震, 等. LED单色光谱及复合光谱对赤潮优势种中肋骨条藻生长的作用[J]. 中国海洋大学学报, 2011, 41(10): 107-110. MIAO Hong-li, SUN Li-na, TIAN Qing-zhen, et al. Effects of mochromatic and combination spectra of LED on the gowth of the Skeletonema costatum in red tide[J]. Periodical of Ocean University of China, 2011, 41(10): 107-110. |
| [14] |
柴雨, 吴垠, 赵慧慧. 光质对湛江等鞭金藻生长和脂肪酸组成的影响[J]. 植物生理通讯, 2009, 45(6): 571-574. CHAI Yu, WU Yin, ZHAO Hui-hui. Effects of light qualities on growth and fatty acid composition of Isochrysis zhanjiangensis Hu & Liu[J]. Plant Physiology Communications, 2009, 45(6): 571-574. |
| [15] |
Fernandez E, Galvan A. Nitrate assimilation in chlamydomonas[J]. Eukaryotic Cell, 2008, 7(4): 555-559. DOI:10.1128/EC.00431-07 |
| [16] |
卢信, 罗佳, 高岩, 等. 畜禽养殖废水中抗生素和重金属的污染效应及其修复研究进展[J]. 江苏农业学报, 2014, 30(3): 671-681. LU Xin, LUO Jia, GAO Yan, et al. A review in ecotoxic effect of antibiotics and heavy metals co-contamination in livestock and poultry breeding wastewater and its remediation[J]. Jiangsu Journal of Agricultural Sciences, 2014, 30(3): 671-681. DOI:10.3969/j.issn.1000-4440.2014.03.036 |
| [17] |
王愿珠, 程鹏飞, 刘德富, 等. 生物膜贴壁培养小球藻净化猪粪沼液废水的效果[J]. 环境科学, 2017, 38(8): 3354-3361. WANG Yuan-zhu, CHENG Peng-fei, LIU De-fu, et al. Purification effect of piggery wastewater with Chlorella pyrenoidosa by immobilized biofilm -attached culture[J]. Environmental Science, 2017, 38(8): 3354-3361. |
| [18] |
韩军军, 钟晨辉, 何培民, 等. 不同光质LED光源对坛紫菜自由丝状体生长和生理特性的影响[J]. 水产学报, 2017, 41(2): 230-239. HAN Jun-jun, ZHONG Chen-hui, HE Pei-min, et al. Effects of different light-qualities on growth and physiological characteristics of free living conchocelis of Pyropia haitanensis[J]. Journal of Fisheries of China, 2017, 41(2): 230-239. |
| [19] |
Wang C Y, Fu C C, Liu Y C. Effects of using light-emitting diodes on the cultivation of Spirulina platensis[J]. Biochemical Engineering Journal, 2007, 37(1): 21-25. DOI:10.1016/j.bej.2007.03.004 |
| [20] |
韩博平, 韩志国, 付翔. 藻类光合作用机理与模型[M]. 北京: 科学出版社, 2003. HAN Bo-ping, HAN Zhi-guo, FU Xiang. Algae photosynthesis:Mechanisms and models[M]. Beijing: Science Press, 2003. |
| [21] |
郑洁, 胡美君, 郭延平. 光质对植物光合作用的调控及其机理[J]. 应用生态学报, 2008, 19(7): 1619-1624. ZHENG Jie, HU Mei-jun, GUO Yan-ping. Regulation of photosynthesis by light quality and its mechanism in plants[J]. Chinese Journal of Applied Ecology, 2008, 19(7): 1619-1624. |
| [22] |
Lu Q, Chen P, Addy M. Carbon-dependent exploration[J]. Bioresource Technology, 2017, 249: 9. |
| [23] |
Dai G Z, Qiu B S, Forchhammer K. Ammonium tolerance in the cyanobacterium Synechocystis sp. strain PCC 6803 and the role of the psbA multigene family[J]. Plant, Cell & Environment, 2014, 37(4): 840-851. |
| [24] |
Ayre J M, Moheimani N R, Borowitzka M A. Growth of microalgae on undiluted anaerobic digestate of piggery effluent with high ammonium concentrations[J]. Algal Research, 2017, 24: 218-226. DOI:10.1016/j.algal.2017.03.023 |
| [25] |
Wen Y M, He Y J, Ji X W, et al. Isolation of an indigenous Chlorella vulgaris from swine wastewater and characterization of its nutrient removal ability in undiluted sewage[J]. Bioresource Technology, 2017, 243: 247-253. DOI:10.1016/j.biortech.2017.06.094 |
| [26] |
程鹏飞, 王艳, 杨期勇, 等. 微藻贴壁培养对沼液废水的处理效果[J]. 浙江农业学报, 2017, 29(9): 1564-1569. CHENG Peng-fei, WANG Yan, YANG Qi-yong, et al. Purification effect for swine wastewater with attached culture of microalgae[J]. Acta Agriculturae Zhejiangensis, 2017, 29(9): 1564-1569. DOI:10.3969/j.issn.1004-1524.2017.09.20 |
 2019, Vol. 38
2019, Vol. 38