2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
N2O是一种重要的温室气体,大气中的N2O浓度已由工业革命前的~270 ppbv增加到~320 ppbv,其增加量主要来自于人类的农业和工业生产活动,其中农田土壤中氮肥施用产生的N2O约占人为源的40%~ 60%[1]。进入到大气中的N2O非常稳定,其存留时间可以长达120 a,其主要去向在大气平流层光解而消耗臭氧,这也使得N2O成为了臭氧层的主要破坏者[2-3]。全面深入地理解N2O产生过程是我们准确估算其产生量和制定减排措施的基础。
微生物的反硝化过程是N2O的最重要来源,反硝化过程产生的N2O约占全球农业的60%[4]。微生物反硝化是指在缺氧或厌氧条件下异养微生物将硝酸盐或者亚硝酸盐逐步还原为N2O和N2的过程。这是一个异养过程,有机碳源分解中产生电子被NO3-或NO2-接受而发生还原反应。但以往的研究中主要关注的影响因素包括土壤含水量、土壤通气性、土壤温度、土壤pH和氮肥的种类等[5-9]。对于有机碳的研究,研究人员通常在土壤中添加大量的有机物料[10-12],往往忽视了在实际野外条件下植物根系分泌物的影响。根系分泌物一些特点也增加了研究的困难:例如种类繁多,包括各种氨基酸、有机酸、糖类等各种小分子物质,以及脂肪、蛋白质等结构复杂的大分子物质[13-14];此外土壤中单一种类的有机碳含量非常少(< 1 μmol C·g-1)[15]。尽管如此,有研究表明,根系分泌物可以显著地影响到土壤中N2O的排放。Henry等向土壤中添加了不同组分的有机小分子(150 μg C·g-1),土壤产N2O潜势是对照组的8~11倍,而土壤中的微生物的丰度和群落结构并没有发生明显的变化[16]。也有学者发现,有机碳源的种类也会影响土壤N2O的还原过程[17-18]。最近,Guyonnet等发现土壤N2O的产生量与根际土壤中丁酸和琥珀酸的相对含量呈正相关而与木糖的含量呈负相关[19]。
以上的研究都说明,根系分泌物可以显著地影响土壤N2O的排放。然而这些研究中,单一有机碳源的添加量都比较大(> 5 μmol C·g-1)[16-18]。实际上这些小分子物质在根系土壤中的含量是非常低的,某一种有机小分子通常不到1 μmol C·g-1[15, 20],实验中高量的添加外源有机物不能反映土壤中真实情况。另外,土壤中添加的有机碳源形态主要是含碳原子数2~6的有机酸,葡萄糖和其他含氮氨基酸,这些小分子多数都是可以参加到微生物体内广泛存在的三羧酸循环(TCA循环),并具有相似的电子传递体系[21]。因此选择这一类小分子缺乏一定的代表性。针对这两个问题,本实验选择低剂量(≤1 μmol C·g-1)添加有机碳源进行室内培养实验来探究有机小分子对土壤N2O的影响。有机碳选择了葡萄糖和甲酸盐。葡萄糖代表以往实验中的一般碳源,可以被大多数微生物利用;甲酸盐是一种特殊的碳源,只能被特定的微生物利用,并且可以直接参加某些真菌反硝化的过程[22-23]。
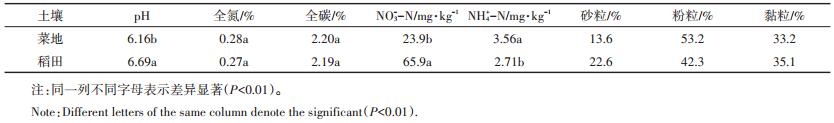
1 材料与方法 1.1 土壤采集保存与理化性质测定土样采自江苏常熟市辛庄镇(N31°32′,E120° 41′),根据S点法布点,采集0~15 cm深度土壤。采样后的鲜土过2 mm筛,置于4 ℃条件下保存备用。其中水稻土采自常熟生态系统国家野外科学观测研究站的育秧土壤,施肥量为每年300 kg N·hm-2;菜地土壤采自当地的大棚蔬菜地,施肥量约每年1044 kg N· hm-2,大棚蔬菜地由水稻田改制而来,种植年限已有6年。我们的取样时间是2017年2月17号。采样的时候稻田处于休闲期,设施菜地处于作物生长期。菜地种植的是上海青,并且即将收获上市。
培养实验之前测定土壤理化性质。土壤NH4+和NO3-含量测定使用全自动化学分析仪(AMS,荷兰),测样时,鲜土用2 mol·L-1 KCl浸提,土壤和浸提液的比率是1:5。土壤全C和全N的测定使用Vario碳氮元素分析仪(Elementar,德国),测定样品之前,鲜土需风干后再过100目筛。土壤粒径的测定使用激光粒度仪(LS 13320,美国),测定样品之前,鲜土需风干后再过2 mm筛。土壤pH是在土壤和蒸馏水混合液中测定,土水比为1:2.5,测定仪器是pH计(Sartorius,美国)。主要的理化性质见表 1。
|
|
表 1 菜地和稻田土壤的理化性质 Table 1 The chemical properties of soils from the vegetable field and paddy soils |
土壤预培养:从4 ℃冰箱中取出适量土样置于250 mL烧杯中,用封口膜(parafilm)密封,在25 ℃培养箱中预先培养3 d。
土壤培养:称取干质量为5 g的鲜土于120 mL的血清瓶中,另保存4~5 g鲜土于-80 ℃的冰箱中用于DNA提取。以溶液形式向土壤中添加不同浓度的无机氮源和有机碳源,并调节含水量至75%WHC(最大可持水量)。实验分为两个施氮水平(以KNO3-N计)50、250 mg·kg-1。每个施氮水平下,根据外加有机碳的含量和种类不同分为5个处理:(1)不外加碳源,(2)添加0.5 μmol甲酸钠-C·g-1干土,(3)添加1 μmol甲酸钠-C·g-1干土,(4)0.5 μmol葡萄糖-C·g-1干土,(5)1 μmol葡萄糖-C·g-1干土。完成溶液添加后,用钳口铝盖密封血清瓶。真空泵抽真空5 min后,放入新鲜空气,置于25 ℃培养箱,每个实验处理有3个重复。每24 h用注射器采集气样,并置换血清瓶内空气,损失的水分通过称重法补齐。培养时间为4 d。
气体样品的测定在采样后24 h内完成。使用仪器为Agilent 7890A气相色谱仪。高纯氮气作为载气,流速25 mL·min-1,使用不锈钢分离柱(内径为2 mm,长度3 m),由Porapak Q材料(80~100目)填充分离柱,分离柱工作温度为55 ℃。检测器是电子俘获检测器(ECD),检测器工作温度为330 ℃。
气体排放速率计算公式如下:
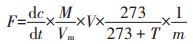
|
(1) |
式中:F是单位质量干土的N2O排放速率,μg N·kg-1· h-1;dc/dt为24 h内N2O的浓度平均变化率,μL·L-1·h-1;M为N2O-N的摩尔质量,28 g·mol-1;Vm是标准状态下气体的摩尔体积,22.4 L·mol-1;V 是血清瓶的有效空间体积,L;T是培养时的温度,25 ℃;m为血清瓶中的实际干土质量,5 g。
1.3 微生物丰度和群落结构称取0.5 g菜地和稻田鲜土,使用Fast DNA SPIN试剂盒(MP Biomedical,美国),根据说明书步骤提取土壤DNA。每种土壤有3个重复。提取完成后,DNA样品分装成3份,置于-80 ℃冰箱中保存,用于荧光定量PCR和高通量测序。
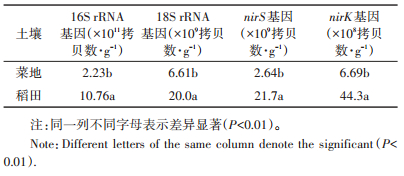
真菌(18S rRNA genes)、细菌(16S rRNA genes)以及反硝化细菌(nirS,nirK)的丰度由荧光定量PCR测定,所用仪器为Applied Biosystems QuantStudio 3 Real-Time PCR系统。真菌和细菌的引物序列和PCR反应条件参照Wang等[24];nirS,nirK 的引物序列和PCR的反应条件参照Rousk等[25]。具体的反应体系(20 μL)如下:10 μL SYBR GreenⅠ荧光染料(Takara,日本),1 μL上下游引物(5 μmol·L-1),0.08 μL ROX参比染料,2 μL DNA样品。加样前,DNA样品稀释了20倍,以消除腐植酸等杂质的影响。
高通量测序用于分析细菌和真菌的群落结构,测序平台是北京诺禾致源公司的IlluminaHiSeq2500。细菌和真菌的测序区域分别是16S V4和18S ITS 1,所选的扩增引物分别为带有识别码的515F-806R和1373F-2043R[26-27]。PCR扩增中高保真反应体系选用纽英伦生物公司(New England Biolabs)的Phusion® High-Fidelity PCR Master Mix。PCR所获的扩增子经过切胶纯化后上机测序。
1.4 数据分析对高通量测序获得的优质序列利用Uparse软件(V7.0.1001,http://drive5.com/uparse/)进行聚类分析,相似度为97%的序列划归到一个可操作分类单元中(OTUs)。使用QIIME(V1.7.0, http://qiime.org/scripts/assign_taxonomy.html)计算得到的Coverage指数(http://www.mothur.org/wiki/Coverage)表明测序深度满足后续分析。利用RDP分类器(V2.2,http://sourceforge.net/projects/rdp-classifier/)与GreenGene数据库(http://greengenes.lbl.gov/cgi-bin/nph-index.cgi)比对获得每个细菌OTU的分类学信息。利用QIIME软件(V1.7.0)中的Blast算法与Unite数据库(https://unite.ut.ee/)比对获得每个真菌OTU的分类学信息。反硝化细菌和反硝化真菌的种类参考已发表文献[28-29]。
使用SPSS 16.0对实验处理间进行方差分析和多重比较。Origin 2015用于实验作图。
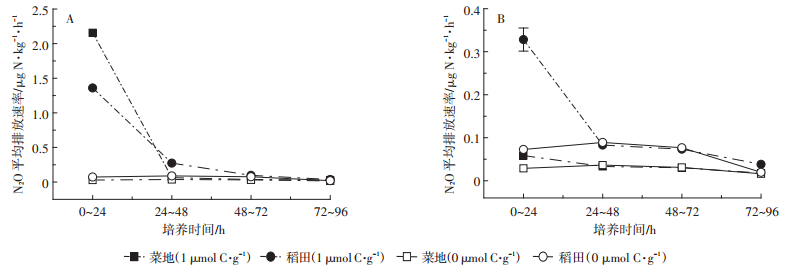
2 结果与分析 2.1 土壤N2O排放速率外源有机质的添加可以显著地刺激土壤中N2O的排放(图 1)。其他剂量的有机碳和无机氮添加下土壤中的N2O的排放趋势与此类似,N2O的排放速率在24 h很快达到平稳。从最大N2O排放速率来看,甲酸盐的刺激效应远大于葡萄糖,这种差异在菜地土壤中更加明显。在添加甲酸盐处理中,菜地最大N2O排放速率(2.16 μg N·kg-1·h-1)几乎是稻田(1.36 μg N· kg-1·h-1)的1.6倍。然而当添加的有机碳源变为葡萄糖后,菜地的最大排放速率(0.06 μg N·kg-1·h-1)却远远小于稻田(0.33 μg N·kg-1·h-1)。当外源有机碳消耗完毕,N2O排放趋于平稳,菜地释放N2O速率(0.02~0.03 μg N·kg-1·h-1)也显著小于稻田(0.04 μg N·kg-1·h-1)。
|
施氮量为50 mg NO3-N·kg-1,有机碳源添加量为0或者1 μmol C·g-1 The dosage of nitrogen is 50 mg NO3-N·kg-1 and the dosage of organic carbon is 0 or 1 μmol C·g-1 图 1 添加甲酸盐(A)和葡萄糖(B)土壤N2O平均排放速率 Figure 1 The average N2O emission rate from soils following the addition of formate (A) or glucose(B) |
由图 2A和2B可以看出土壤N2O的累计排放量随着甲酸盐浓度的提高而增加;相比于稻田土壤,菜地土壤的N2O增长幅度更快,当甲酸盐浓度达到1 μmol C·g-1时,菜地土壤的N2O累计排放量超过了稻田土壤。而葡萄糖对N2O排放的激发程度远远小于甲酸盐(图 2C和2D),在葡萄糖的添加下,菜地土壤的N2O累计排放量也显著低于稻田土壤。

|
图A和图C的施氮量为50 mg NO3-N·kg-1,图B和图D的施氮量为250 mg NO3-N·kg-1;误差棒长短代表标准差大小(n=3);不同字母表示两种土壤N2O排放差异显著,P < 0.01 The dosage of nitrogen is 50 mg NO3-N·kg-1(A & C)and 250 mg NO3-N·kg-1(B & D). Error bars represent the standard errors(n=3). Columns with different letters denote significant differences(P < 0.01)between two soils 图 2 添加不同浓度甲酸盐和葡萄糖后土壤N2O累计排放量 Figure 2 The cumulative emissions of N2O from soils amended with different dosage of formate or glucose |
由图 2A与图 2B对比可以发现,施氮量由50 mg NO3-N·kg-1增加到250 mg NO3-N·kg-1,土壤中N2O的累计排放量并没有明显增加,甚至在甲酸盐浓度为1 μmol C·g-1时,施氮量的增加导致了土壤中N2O的排放量减少,其中菜地土壤由54.86 μg N·kg-1减少至44.66 μg N·kg-1,稻田土壤由42.4 μg N·kg-1降为33.61μg N·kg-1。当添加的葡萄糖浓度为1 μmol C·g-1时,施氮的增加也没有显著增加土壤N2O的排放(图 2C和图 2D)。
2.3 土壤微生物数量表 2是荧光定量PCR的结果,可以看出,菜地土壤的微生物拷贝数都显著低于稻田土壤(P < 0.01)。稻田土壤中总的细菌拷贝数(16S rRNA)是菜地土壤的4.8倍,其中反硝化细菌nirK 和nirS基因是菜地土壤的6.6倍和8.2倍。相对于细菌的拷贝数,真菌(18S rRNA)在两种土壤中数量差异相对较少,稻田土壤的真菌拷贝数是菜地土壤的3倍左右。
|
|
表 2 土壤细菌(16S rRNA)、真菌(18S rRNA)和反硝化细菌(nirK & nirS)拷贝数 |
目前在环境中发现的反硝化细菌有50多属,高通量的测序结果显示,本研究中的土壤含有其中的20属(表 3)。总体来说,菜地土壤中的反硝化细菌属的相对丰度显著高于稻田土壤(P < 0.01)。土壤中的反硝化细菌属的相对丰度基本都在1%以下。若以相对丰度占0.5%的菌属为优势属,菜地土壤中的优势属是芽孢杆菌属(Bacillus,1.031%)和链霉菌属(Streptomyces,0.896%),稻田土壤中的优势属是短根瘤菌属(Bradyrhizobium,0.803%)和链霉菌属(Streptomyces,0.568%)。
|
|
表 3 土壤典型反硝化细菌属相对丰度 Table 3 The relative abundance ratios of denitrifying bacteria genus in soils |
目前在环境中发现的反硝化真菌有60属,在本研究中的土壤我们发现了29属(表 4)。总体来说,菜地土壤的反硝化真菌相对丰度显著高于稻田土壤(P < 0.01),尤其是菜地土壤中画线壳属(Monographella,35.4%)和镰刀属(Fusarium,9.5%),分别是稻田土壤的81倍和13倍,这两种真菌也是常见的植物致病菌。若以相对丰度占0.5%的菌属为优势属,稻田土壤中只有芽枝霉属(Cladosporium)的相对丰度(1.316%)大于菜地土壤。
|
|
表 4 土壤典型反硝化真菌属相对丰度 Table 4 The relative abundance ratios of denitrifying fungi genus in soils |
微生物体内的反硝化过程实际上是包括有机质的氧化过程和NO3-的还原过程,即有机质的氧化过程产生的电子被NO3-等无机氮接受。不同反硝化微生物会有不同的电子传递体系[29],即使同一种反硝化微生物也会因为有机碳源的不同,电子会沿着不同的路径传递[22]。因此有机碳的添加可以显著地刺激土壤N2O的排放,刺激程度也会因为有机碳的种类不同而不同(图 1,图 2)。
本研究中我们向土壤中添加了少量的葡萄糖和甲酸盐。与葡萄糖相比,甲酸盐对N2O的刺激作用是葡萄糖的1.7~3.38倍,这一现象主要与碳源的种类和土壤微生物群落有关。葡萄糖作为一种广谱碳源可以被多种微生物利用。除了土壤中少量的反硝化微生物利用葡萄糖外,其他异养微生物也会与反硝化微生物竞争有限的碳源。而甲酸盐只能被特定的微生物利用,其中包括某些反硝化真菌。通过高通量测序发现,本研究中的两种土壤中都存在反硝化真菌(表 3)。
有研究结果表明反硝化真菌中,NO3-还原酶(narG)与甲酸盐脱氢酶(UQFdh)耦合的电子传递体系中,NO3-可以高效接受电子而还原成N2O[30-31],而目前在反硝化细菌中并没有发现这种耦合关系[32]。另外,值得注意的是,反硝化真菌缺少N2O还原酶,这一特点增加了土壤中N2O积累的可能性。通过高通量测序发现,在菜地土壤中反硝化真菌相对丰度是稻田土壤的8.2倍(表 4),这也解释了虽然菜地微生物数量显著低于稻田土壤,但在甲酸盐(1 μmol C·g-1)的添加下,菜地土壤N2O排放量显著高于稻田土壤(图 2A,图 2B)。
在自然界中,植物根系分泌物是土壤有机质的重要来源,有研究报道植物光合作用产物的20%都可以进入根系分泌物中[33]。因此野外条件下土壤微生物有着持续的有机质供应,而室内研究一般都忽略了根系分泌物的作用,或者在研究中加入了过量单一的有机碳如葡萄糖[10-11, 34]。本研究中,我们添加的外源有机碳含量接近野外条件土壤根系分泌物。虽然有机质的添加量是微量的,但却显著地刺激土壤中的N2O排放,并且其排放的强度受有机碳源的种类和微生物群落结构的影响。这些结果说明,在土壤培养实验中,我们应当考虑根系分泌物对N2O排放的影响,例如,氮肥的使用是否会通过刺激植株生长进而间接地影响土壤中N2O的排放。另外,外源有机质的添加对N2O排放的影响也是不能忽视的。例如,Xia等[35]通过数据整合分析表明,有机肥等量替代化肥后,N2O排放既可能增加也可能减少,因而有机肥施用没有显著的减排潜力,我们认为这可能与土壤中有机肥的成分以及土壤微生物的群落结构有关。对这些问题的探究有助于制定N2O减排策略。未来需要结合盆栽以及田间实验来开展相关研究。
3.2 土壤中反硝化微生物群落大小及其对N2O排放的贡献利用底物诱导法研究土壤微生物量的结果表明土壤中真菌和细菌的生物量相当[36]。然而在真菌和细菌各自的微生物群落中,反硝化微生物的相对含量却不一样。本研究中通过荧光定量PCR发现,反硝化细菌拷贝数只占到细菌总数的1.48%~2.05%(表 2),而高通量测序也表明反硝化细菌在细菌群落中的相对丰度是2.3%~3.3%(表 3)。在真菌群落中,反硝化真菌的相对丰度是6.6%~53.8%(表 4);也有研究结果表明产N2O的真菌达到可培养真菌的33%~ 45%[37-38]。这些结果表明环境中反硝化真菌的生物量可能高于反硝化细菌,在酸性土壤中尤其如此,因为真菌有着更强的耐酸能力[25],例如本研究中的设施菜地土壤。另外在设施菜地中,往往由于连作障碍会导致有害真菌的增加[39];本研究中,菜地土壤中画线壳属(Monographella)和镰刀属(Fusarium)的相对丰度显著高于稻田土壤,这两种真菌也是常见的植物致病菌(表 4)。
微生物的纯培养实验表明反硝化细菌产N2O能力约是反硝化真菌的10~100 000倍,而土壤培养实验表明,反硝化真菌对N2O贡献率与反硝化细菌相当甚至超过了后者[29]。对于这一矛盾的结果,Mothapo等认为虽然土壤培养实验中使用的抑制剂法可能会高估真菌的贡献率,但土壤真菌反硝化还是不能忽视的,因为纯培养实验的条件不能真实反映土壤的环境,而且可供培养的微生物只占到总微生物量很少的一部分[29]。本研究中我们发现了土壤中反硝化真菌的广泛存在,其生物量在某些条件下可能大于反硝化细菌;另外,环境中不同的有机碳源可能高效地促进反硝化真菌的活动。鉴于此,未来的研究中我们还需要完善一些新的N2O溯源方法[40],用来研究土壤中反硝化真菌对土壤N2O的贡献及其影响因素。
4 结论(1)有机小分子物质的微量添加(≤1μmol C·g-1)可以显著刺激土壤N2O排放,不同种类的有机碳刺激结果也不一样;与葡萄糖相比,甲酸盐对N2O的刺激作用是葡萄糖的1.7~3.38倍。
(2)菜地土壤的反硝化细菌数量只有稻田土壤的12%~15%,但在甲酸盐的刺激下,菜地土壤最大的N2O的排放速率可以达到稻田土壤的1.6倍。菜地土壤中存在的大量反硝化真菌,其高效耦合甲酸盐氧化和NO3-还原过程很可能是菜地土壤排放大量N2O的主要原因。
| [1] |
IPCC. Climate change(2013) The physical science basis:Working Group I contribution to the fifth assessment report of the intergovernmental panel on climate change[M]. Cambridge, UK/New York, NY, USA: Cambridge University Press, 2013.
|
| [2] |
Fleming E L, Jackman C H, Stolarski R S, et al. A model study of the impact of source gas changes on the stratosphere for 1850-2100[J]. Atmospheric Chemistry and Physics, 2011, 11(16): 8515-8541. DOI:10.5194/acp-11-8515-2011 |
| [3] |
Ravishankara A R, Daniel J S, Portmann R W. Nitrous oxide(N2O):The dominant ozone-depleting substance emitted in the 21st century[J]. Science, 2009, 326(5949): 123-125. DOI:10.1126/science.1176985 |
| [4] |
Smith P, Martino D, Cai Z, et al. Agriculture. In climate change 2007:Mitigation. contribution of working group Ⅲ to the fourth assessment report of the intergovernmental panel on climate change[M]. Cambridge, UK/New York, NY, USA: Cambridge University Press, 2007.
|
| [5] |
席瑞泽, 付庆灵, 杨永强, 等. 氮肥品种和含水量对水稻土N2O排放速率及排放过程的影响[J]. 农业环境科学学报, 2017, 36(12): 2553-2560. XI Rui-ze, FU Qing-ling, YANG Yong-qiang, et al. Effects of nitrogen fertilization and water content on the process and rate of N2O emission in paddy soils[J]. Journal of Agro-Environment Science, 2017, 36(12): 2553-2560. DOI:10.11654/jaes.2017-0768 |
| [6] |
韩东亮, 朱新萍, 胡毅, 等. 不同水分条件下巴音布鲁克天鹅湖高寒湿地土壤有机碳特征[J]. 湿地科学, 2017, 15(4): 509-515. HAN Dong-liang, ZHU Xin-ping, HU Yi, et al. Characteristics of soil organic carbon at Bayinbuluke Swan Lake alpine wetland under different water levels[J]. Wetland Science, 2017, 15(4): 509-515. |
| [7] |
石洪艾, 李禄军, 尤孟阳, 等. 不同土地利用方式下土壤温度与土壤水分对黑土N2O排放的影响[J]. 农业环境科学学报, 2013, 32(11): 2286-2292. SHI Hong-ai, LI Lu-jun, YOU Meng-yang, et al. Impact of soil temperature and moisture on soil N2O emission from mollisols under different land-use types[J]. Journal of Agro-Environment Science, 2013, 32(11): 2286-2292. DOI:10.11654/jaes.2013.11.026 |
| [8] |
Zhu X, Burger M, Doane T A, et al. Ammonia oxidation pathways and nitrifier denitrification are significant sources of N2O and NO under low oxygen availability[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(16): 6328-6333. DOI:10.1073/pnas.1219993110 |
| [9] |
Hu H W, Chen D, He J Z. Microbial regulation of terrestrial nitrous oxide formation:Understanding the biological pathways for prediction of emission rates[J]. Fems Microbiology Reviews, 2015, 39(5): 729-749. DOI:10.1093/femsre/fuv021 |
| [10] |
王琳, 周晓丽, 马银丽, 等. 铵态氮源和碳源对土壤N2O, CO2释放的影响[J]. 农业资源与环境学报, 2016, 33(1): 23-28. WANG Lin, ZHOU Xiao-li, MA Yin-li, et al. Effect of ammonium nitrogen source on the CO2 and N2O emissions of soil[J]. Journal of Agricultural Resources and Environment, 2016, 33(1): 23-28. |
| [11] |
高洁, 朱思佳, 高人, 等. 有机碳源对森林土壤真菌/细菌活性产生的N2O通量的影响[J]. 亚热带资源与环境学报, 2016, 11(4): 29-36. GAO Jie, ZHU Si-jia, GAO Ren, et al. Effects of exogenous organic carbons on N2O emissions attributable to forest soil fungal/bacterial activities[J]. Journal of Subtropical Resources and Environment, 2016, 11(4): 29-36. DOI:10.3969/j.issn.1673-7105.2016.04.005 |
| [12] |
Senbayram M, Chen R, Budai A, et al. N2O emission and the N2O/(N2O + N2)product ratio of denitrification as controlled by available carbon substrates and nitrate concentrations[J]. Agriculture Ecosystems & Environment, 2012, 147: 4-12. |
| [13] |
罗永清, 赵学勇, 李美霞. 植物根系分泌物生态效应及其影响因素研究综述[J]. 应用生态学报, 2012, 23(12): 3496-3504. LUO Yong-qing, ZHAO Xue-yong, LI Mei-xia. Ecological effect of plant root exudates and related affecting factors:A review[J]. Chinese Journal of Applied Ecology, 2012, 23(12): 3496-3504. |
| [14] |
耿贵.作物根系分泌物对土壤碳, 氮含量, 微生物数量和酶活性的影响[D].沈阳: 沈阳农业大学, 2011. GENG Gui. Effect of crop root exudates on carbon and nitrogen contents, microorganisms quantity and enzyme in soil[D]. Shenyang: Shenyang Agricultural University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10157-1012302285.htm |
| [15] |
Baziramakenga R, Simard R R, Leroux G D. Determination of organicacids in soil extracts by ion chromatography[J]. Soil Biology & Biochemistry, 1995, 27(3): 349-356. |
| [16] |
Henry S, Texier S, Hallet S, et al. Disentangling the rhizosphere effect on nitrate reducers and denitrifiers:Insight into the role of root exudates[J]. Environmental Microbiology, 2008, 10(11): 3082-3092. DOI:10.1111/emi.2008.10.issue-11 |
| [17] |
Morley N J, Richardson D J, Baggs E M. Substrate induced denitrification over or under estimates shifts in soil N2/N2O Ratios[J]. PloS One, 2014, 9(9): e108144. DOI:10.1371/journal.pone.0108144 |
| [18] |
Giles M E, Daniell T J, Baggs E M. Compound driven differences in N2 and N2O emission from soil, the role of substrate use efficiency and the microbial community[J]. Soil Biology & Biochemistry, 2017, 106: 90-98. |
| [19] |
Guyonnet J P, Vautrin F, Meiffren G, et al. The effects of plant nutritional strategy on soil microbial denitrification activity through rhizosphere primary metabolites[J]. Fems Microbiology Ecology, 2017, 93(4): fix022. |
| [20] |
Magdziak Z, Mleczek M, Rutkowski P, et al. Diversity of low-molecular weight organic acids synthesized by salix growing in soils characterized by different Cu, Pb and Zn concentrations[J]. Acta Physiologiae Plantarum, 2017, 39(6): 137. DOI:10.1007/s11738-017-2434-5 |
| [21] |
Yin X, Li J H, Shin H D, et al. Metabolic engineering in the biotechnological production of organic acids in the tricarboxylic acid cycle of microorganisms:Advances and prospects[J]. Biotechnology Advances, 2015, 33(6): 830-841. DOI:10.1016/j.biotechadv.2015.04.006 |
| [22] |
Ma W, Farrell R, Siciliano S. Soil formate regulates the fungal nitrous oxide emission pathway[J]. Applied and Environmental Microbiology, 2008, 74(21): 6690-6696. DOI:10.1128/AEM.00797-08 |
| [23] |
Feng Y Z, Lin X G, Jia Z J, et al. Identification of formate-metabolizing bacteria in paddy soil by DNA-based stable isotope probing[J]. Soil Sci Soc Am J, 2012, 76(1): 121-129. DOI:10.2136/sssaj2011.0216 |
| [24] |
Wang C, Lu H, Dong D, et al. Insight into the effects of biochar on manure composting:Evidence supporting the relationship between N2O emission and denitrifying community[J]. Environmental Science & Technology, 2013, 47(13): 7341-7349. |
| [25] |
Rousk J, Baath E, Brookes P C, et al. Soil bacterial and fungal communities across a pH gradient in an arable soil[J]. Isme Journal, 2010, 4(10): 1340-1351. DOI:10.1038/ismej.2010.58 |
| [26] |
Evans C C, LePard K J, Kwak J W, et al. Exercise prevents weight gain and alters the gut microbiota in a mouse model of high fat diet-induced obesity[J]. PloS One, 2014, 9(3): e92193. DOI:10.1371/journal.pone.0092193 |
| [27] |
Cheung M K, Au C H, Chu K H, et al. Composition and genetic diversity of picoeukaryotes in subtropical coastal waters as revealed by 454 pyrosequencing[J]. The ISME Journal, 2010, 4(8): 1053-1059. DOI:10.1038/ismej.2010.26 |
| [28] |
Philippot L, Hallin S, Schloter M. Ecology of denitrifying prokaryotes in agricultural soil[J]. Advances in Agronomy, 2007, 96: 249-305. DOI:10.1016/S0065-2113(07)96003-4 |
| [29] |
Mothapo N, Chen H H, Cubeta M A, et al. Phylogenetic, taxonomic and functional diversity of fungal denitrifiers and associated N2O production efficacy[J]. Soil Biology and Biochemistry, 2015, 83: 160-175. DOI:10.1016/j.soilbio.2015.02.001 |
| [30] |
Uchimura H, Enjoji H, Seki T, et al. Nitrate reductase-formate dehydrogenase couple involved in the fungal denitrification by Fusarium oxysporum[J]. The Journal of Biochemistry, 2002, 131(4): 579-586. DOI:10.1093/oxfordjournals.jbchem.a003137 |
| [31] |
Takaya N, Kuwazaki S, Adachi Y, et al. Hybrid respiration in the denitrifying mitochondria of Fusarium oxysporum[J]. Journal of Biochemistry, 2003, 133(4): 461-465. DOI:10.1093/jb/mvg060 |
| [32] |
Shoun H, Fushinobu S, Jiang L, et al. Fungal denitrification and nitric oxide reductase cytochrome P450nor[J]. Philosophical Transactions of the Royal Society B-Biological Sciences, 2012, 367(1593): 1186-1194. DOI:10.1098/rstb.2011.0335 |
| [33] |
Nguyen C. Rhizodeposition of organic C by plants:Mechanisms and controls[J]. Agronomie, 2003, 23(5-6): 375-396. DOI:10.1051/agro:2003011 |
| [34] |
倪玉雪, 孙卓玲, 尹兴, 等. 外加可溶性碳源对华北典型农田土壤N2O, CO2排放的影响[J]. 水土保持学报, 2013, 27(4): 222-227. NI Yu-xue, SUN Zhuo-ling, YIN Xing, et al. Influence of soluble carbon on N2O and CO2 emissions from soil of typical farm-land in north China[J]. Journal of Soil and Water Conversation, 2013, 27(4): 222-227. |
| [35] |
Xia L, Lam S K, Yan X, et al. How does recycling of livestock manure in agroecosystems affect crop productivity, reactive nitrogen losses, and soil carbon balance?[J]. Environmental Science & Technology, 2017, 51(13): 7450-7457. |
| [36] |
吴金水, 林启美, 黄巧云, 等. 土壤微生物生物量测定方法及其应用[M]. 北京: 气象出版社, 2006. WU Jin-shui, LIN Qi-mei, HUANG Qiao-yun, et al. Soil microbial biomass-methods and application[M]. Beijing: China Meterorological Press, 2006. |
| [37] |
Mothapo N V, Chen H H, Cubeta M A, et al. Nitrous oxide producing activity of diverse fungi from distinct agroecosystems[J]. Soil Biology and Biochemistry, 2013, 66: 94-101. DOI:10.1016/j.soilbio.2013.07.004 |
| [38] |
Maeda K, Spor A, Edel-Hermann V, et al. N2O production, a widespread trait in fungi[J]. Scientific Reports, 2015, 5: 9697. DOI:10.1038/srep09697 |
| [39] |
刘松涛, 李辉, 李茜. 设施蔬菜连作障碍的研究进展[J]. 安徽农学通报, 2013, 19(增刊1): 56-58. LIU Song-tao, LI Hui, LI Qian. Research advances in effect of continuous cropping obstacles on facility vegetable[J]. Anhui Agri Sci Bull, 2013, 19(Suppl 1): 56-58. |
| [40] |
Decock C, Six J. How reliable is the intramolecular distribution of 15N in N2O to source partition N2O emitted from soil?[J]. Soil Biology and Biochemistry, 2013, 65: 114-127. DOI:10.1016/j.soilbio.2013.05.012 |
 2019, Vol. 38
2019, Vol. 38