2. 黑龙江省农业科学院农产品质量安全研究所, 哈尔滨 150086
2. Safety and Quality Institute of Agricultural Products, Heilongjiang Academy of Agricultural Sciences, Harbin 150086, China
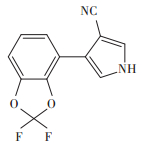
咯菌腈(Fludioxonil)又名氟咯菌腈,其化学名为4-(2,2-二氟-1,3-苯并二氧杂环戊烯-4-基)吡咯- 3-腈,结构式见图 1[1]。咯菌腈是由瑞士诺华公司(现为先正达作物保护有限公司)开发的非内吸性苯基吡咯类杀菌剂,以商品名“适乐时”(2.5%咯菌腈悬浮种衣剂)、“亮盾”(6.25%精甲霜灵·咯菌腈悬浮种衣剂)、“卉友”(50%咯菌腈可湿性粉剂)等单剂和混剂在我国获得登记,用于种子处理和作物叶面喷雾。咯菌腈是一种触杀性杀菌剂,主要通过抑制病原真菌渗透信号传导中丝裂原活化蛋白激酶/组氨酸激酶的磷酸化,导致菌体中的甘油等多醇类增加,从而抑制分生孢子萌发、芽管伸长及菌丝生长,最终导致病菌死亡[2]。咯菌腈具有广谱、高效、用量少、毒性低、持效期长、不易与其他杀菌剂发生交互抗性[3]等特点,对子囊菌、担子菌、半知菌等病原菌引起的种传和土传病害有良好的防效,尤其对灰葡萄孢(Botrytis cinerea)引起的灰霉病有特效[4-6]。咯菌腈在番茄灰霉病[7]、叶霉病[8]、灰叶斑病[9]、晚疫病[10]等病害的防治中具有一定的应用潜力。
|
图 1 咯菌腈的化学结构式 Figure 1 Chemical structure of fludioxonil |
关于咯菌腈的残留分析,目前已报道的方法包括气相色谱法(GC)[11-13]、高效液相色谱法(HPLC)[14-17]、气相色谱-质谱法(GC-MS)[18-23]、高效液相色谱-质谱法(HPLC-MS)[24-25]和酶联免疫吸附分析法(ELISA)[26]。这些方法或灵敏度、准确度较低,或操作费时,或分析成本较高,而且分析对象大多为葡萄、葡萄酒、果汁、人参等。咯菌腈在番茄中残留的分析方法,国内外虽有少量报道[12-13, 25],但这些方法的分析时间都较长,有的灵敏度还较低。鉴于咯菌腈在防治番茄多种病害方面的应用前景,本文建立了一种快速、准确、灵敏的超高效液相色谱-串联质谱(UPLC-MS/MS)分析方法,以测定咯菌腈在番茄和土壤中的残留,为研究其在番茄和土壤中的残留消解动态奠定基础,也为测定其在其他样品中的残留提供参考。
1 材料与方法 1.1 材料及试剂番茄:宇番一号,产于黑龙江省肇东市试验地;土壤:取自种植番茄的试验地。
药剂与仪器:咯菌腈原药(纯度98.2%),苏州市奥特莱化工有限公司;乙腈(色谱纯),美国Dikma公司;甲酸(色谱纯),美国Dikma公司;氯化钠(分析纯),天津科密欧化学试剂有限公司;N-丙基乙二胺(PSA)净化剂,天津博纳艾杰尔科技有限公司;硅镁型吸附剂(Florisil),国药集团化学试剂有限公司。ACQUITY超高效液相色谱-质谱联用仪(电喷雾离子源),美国Waters公司;LXJ-ⅡB高速离心机,上海安亭科学仪器设备厂;HS501振荡器、T18高速匀浆仪、MS1涡旋混合仪,德国IKA公司。
1.2 试验方法 1.2.1 标准曲线的制作准确称取咯菌腈原药,用乙腈配制成100 mg·L-1的标准储备液。然后用乙腈将其稀释,分别配制成0.01、0.05、0.10、0.20、2.00 mg·L-1的标准溶液。分别取上述溶液10 μL,用UPLC-MS/MS测定。以咯菌腈浓度(x)为横坐标、峰面积(y)为纵坐标,绘制标准曲线。
1.2.2 样品提取番茄:称取10.00 g番茄样品,匀浆后置于50 mL离心管中,再加入10 mL乙腈。用振荡器振荡30 min后,加入5 g氯化钠,再振荡10 min,3000 r·min-1离心2 min。静置后,取上层乙腈相约1 mL,待净化。
土壤:称取10.00 g土壤样品,置于50 mL离心管中,加入10 mL乙腈及10 mL蒸馏水。用振荡器振荡30 min,加入5 g氯化钠,再振荡10 min,3000 r·min-1离心2 min。静置后,取上层乙腈相约1 mL,待净化。
1.2.3 样品净化将待净化的乙腈溶液转移至盛有50 mg PSA净化剂和50 mg硅镁型吸附剂的离心管中,涡旋30 s,10 000 r·min-1离心3 min。静置后,将上清液用0.22 μm滤膜过滤,待UPLC–MS/MS测定。
1.2.4 色谱条件色谱柱:ACQUITY UPLC BEH C18柱(2.1 mm × 50 mm,1.7 μm);流动相:乙腈(A)及0.1%(体积分数)的甲酸水溶液(B)。梯度洗脱程序:0~1.00 min,10%A;1.00~3.00 min,10%A~90%A;3.00~3.10 min,90%A~10%A;3.10~5.00 min,10%A。流速:0.30 mL· min-1;柱温:35 ℃;进样量:10 μL。
1.2.5 质谱条件离子源:电喷雾离子源;扫描方式:负离子方式;监测方式:多重反应监测(MRM);毛细管电压:4.0 kV;离子源温度:20 ℃;脱溶剂温度:350 ℃;脱溶剂气流量:650 L·h-1;锥孔气流量:50 L·h-1。其他质谱条件如表 1所示。
|
|
表 1 咯菌腈多重反应监测的串联质谱条件 Table 1 UPLC/ESI-–MS/MS parameters for fludioxonil in MRM mode |
取空白番茄和空白土壤样品各10.00 g,分别向其中添加咯菌腈标准溶液,添加水平分别为0.01、0.10、2.00 mg·kg-1,每个添加水平进行5次重复。按照上述提取和净化步骤处理后进行测定,计算番茄和土壤样品的平均添加回收率和相对标准偏差(RSD)。
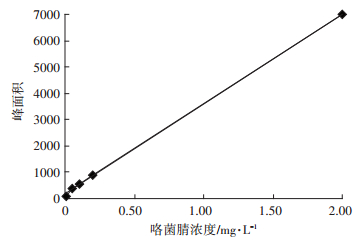
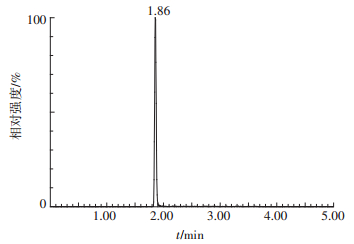
2 结果与分析 2.1 分析时间和灵敏度UPLC-MS/MS法测定咯菌腈残留量的标准曲线如图 2所示,曲线的回归方程为:y=3 412.6x+163.95,r2=0.999 5。可见,在0.01~2.00 mg·L-1范围内,峰面积(y)与咯菌腈浓度(x)呈良好的线性关系。由咯菌腈标准品的MRM色谱图(图 3)可知,咯菌腈的保留时间为1.86 min。按照S/N(信号/噪声)=3计算,番茄和土壤中咯菌腈的检出限(Limit of detection,LOD)均为0.4 μg·kg-1;按照S/N=10计算,相应的定量限(Limit of quantification,LOQ)分别为1.4 μg·kg-1和1.3 μg· kg-1;最小检出量分别为4.1×10-3 ng和3.8×10-3 ng。由此可见,本研究建立的UPLC-MS/MS法分析时间短,灵敏度高。
|
图 2 UPLC-MS/MS法测定咯菌腈残留量的标准曲线 Figure 2 Standard curve for the determination of fludioxonil residue by UPLC-MS/MS |
|
图 3 咯菌腈标准品的MRM色谱图 Figure 3 MRM chromatogram of standard fludioxonil |
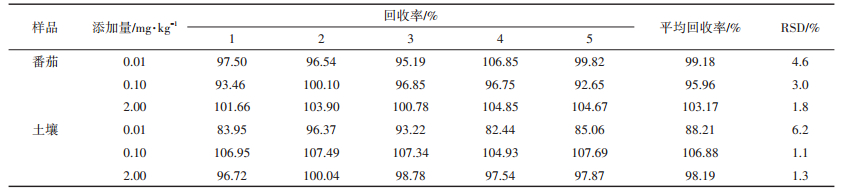
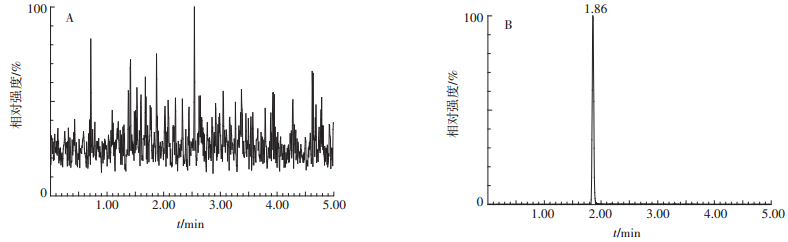
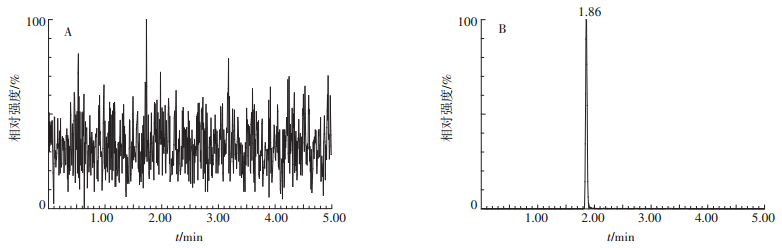
咯菌腈在番茄和土壤中添加回收试验的MRM色谱图分别见图 4和图 5,添加回收试验的结果见表 2。可以看出,咯菌腈在番茄和土壤中的平均添加回收率分别在95.96%~103.17%和88.21%~106.88%之间,RSD分别在1.8%~4.6%和1.1%~6.2%之间。上述结果表明,用此方法测定番茄和土壤中咯菌腈的残留,准确度和精密度均较好。
|
图 4 空白番茄(A)及添加0.05 mg·kg-1咯菌腈标准品番茄(B)的MRM色谱图 Figure 4 MRM chromatograms of blank tomato (A) and fortified tomato with fludioxonil at 0.05 mg·kg-1(B) |
|
图 5 空白土壤(A)及添加0.05 mg·kg-1咯菌腈标准品土壤(B)的MRM色谱图 Figure 5 MRM chromatograms of blank soil (A) and fortified soil with fludioxonil at 0.05 mg·kg-1(B) |
|
|
表 2 咯菌腈在番茄和土壤中的添加回收率(n=5) Table 2 Recoveries of fludioxonil in tomato and soil samples(n=5) |
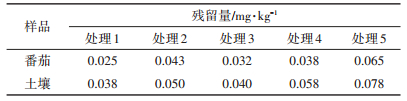
为验证所建立方法的可靠性,在当地市场上购置了番茄及相应的种植土壤样品各3种,按本研究建立的方法,测定其中咯菌腈的含量。结果显示,这些样品中都未检出咯菌腈。此外,也对试验田中按5种方案施用咯菌腈的番茄及相应的土壤样品进行了咯菌腈残留的分析,结果如表 3所示。其中,番茄样品处理1、2、3、4、5的施药剂量分别为54、54、54、108、108 g a.i.·hm-2(a.i.为活性成分),施药次数分别为2、3、3、2、3次,采样距最后一次施药的间隔分别为3、3、5、3、5 d。土壤样品处理1、2、3、4、5的田间试验方案分别与相应的番茄样品相同。表 3中的数据显示,番茄及相应土壤中咯菌腈的残留量,随施药次数、施药剂量的增加而增加,随采样距最后一次施药间隔的缩短而增加。这表明该分析结果真实地反映了番茄和土壤中咯菌腈的残留情况,说明本研究建立的检测方法是可靠的。
|
|
表 3 咯菌腈在番茄和土壤中的残留量(n=3) Table 3 Residues of fludioxonil in tomato fruit and soil samples (n=3) |
咯菌腈为苯基吡咯类化合物,在已报道的其残留检测方法中,大多以乙腈为提取溶剂[16, 18, 22-23, 25]。为此,本研究也以乙腈为溶剂,参考刘绍文[23]的方法并稍加修改,从番茄和土壤中提取咯菌腈。在提取过程中加入氯化钠,是为通过盐析作用而使水相和乙腈相分离,去除水及水溶性杂质,并增加咯菌腈在乙腈相中的分配比[14]。本试验研究了振荡时间对咯菌腈提取效果的影响。结果表明,振荡时间少于30 min时,由于咯菌腈不能充分溶解于乙腈中而使其提取率较低;振荡时间超过30 min时,提取率与30 min时接近。因此,确定振荡时间为30 min。番茄中含有糖类、有机酸、色素等杂质,用乙腈提取后需进一步净化。在测定番茄中咯菌腈残留时,韦典[13]用Florisil、Jankowska等[25]用PSA作为样品前处理的净化剂。本研究中发现,在对样品进行前处理时将二者联用,净化效果良好。
根据咯菌腈的理化性质和极性,本试验选择填料粒径为1.7 μm的ACQUITY UPLC BEH C18柱为分析柱。与填料粒径为5 μm或3.5 μm的色谱柱相比,该柱的柱效更高,分离能力更强。用高效液相色谱法分析咯菌腈残留时,乙腈-水[14-15]、乙腈-0.1%甲酸水溶液[16]经常被用作流动相。本试验发现,以乙腈-0.1%甲酸水溶液为流动相时,咯菌腈保留时间短,色谱峰峰形尖锐、对称,分离效果好,灵敏度高,质谱响应信号强而稳定。因此,选择乙腈-0.1%甲酸水溶液为流动相。咯菌腈极性较弱,在反相色谱柱上有较强的保留,直接采用高比例乙腈进行等度洗脱时,共流出杂质多,分离效果不好。因此,在分析咯菌腈残留时,经常采用梯度洗脱方式[14-15]。本试验以乙腈-0.1%甲酸水溶液为流动相,按照设定的程序进行梯度洗脱,使极性较强的杂质先被洗脱,最终使咯菌腈的分离度高,峰形好,保留时间短。
质谱的锥孔电压、碰撞能量等参数对咯菌腈的裂解有重要影响。本试验所用的质谱监测模式为全扫描模式。在电喷雾负离子模式下,先以流动注射方式对0.05 mg·L-1咯菌腈标准溶液进行一级质谱扫描,确定质荷比(m/z)246.9的离子为咯菌腈的母离子。通过优化锥孔电压等参数,使母离子峰信号最强。然后以特征碎片离子m/z 180.1和m/z 126.1为目标进行子离子扫描,优化碰撞能量,使子离子m/z 180.1和m/z 126.1丰度最高。选择m/z 180.1的子离子为定量离子,m/z 126.1的子离子为定性离子。用MRM扫描方式优化后的各质谱参数见表 1。
占绣萍等[17]建立了同时测定番茄等蔬菜中咯菌腈等3种农药残留的HPLC法。咯菌腈的保留时间是7.711 min,最低检出浓度为0.02 mg·kg-1,最小检出量为1 ng。韦典[13]建立的检测咯菌腈等13种农药在番茄中残留的GC法中,咯菌腈的保留时间是17.063 min,LOQ为0.05 mg·kg-1。Cabizza等[12]用GC法测定了番茄中咯菌腈等12种杀菌剂的残留消解情况,咯菌腈的保留时间是16.7 min,LOQ为0.04 mg·kg-1。Jankowska等[25]用LC-MS/MS法检测了番茄中咯菌腈等6种杀菌剂的残留,咯菌腈的保留时间是13.32 min,LOD为0.002 mg·kg-1,LOQ为0.005 mg·kg-1。本研究中,咯菌腈的保留时间为1.86 min,番茄和土壤中咯菌腈的LOD均为0.4 μg·kg-1,LOQ分别为1.4 μg·kg-1和1.3 μg·kg-1,最小检出量分别为4.1×10-3 ng和3.8×10-3 ng。通过和上述方法比较可以看出,本方法的分析时间大大缩短,灵敏度也有较大幅度提高。我国尚未规定番茄中咯菌腈的最大残留限量(Maximum residue limit,MRL),而美国、日本等国都已进行了不同的规定。国际食品法典委员会(Codex Alimentarius Commission,CAC)规定,番茄中咯菌腈的MRL为0.50 mg·kg-1[27]。由此可见,本方法的灵敏度完全能够满足检测需要。
在刘振库等[16]、占绣萍等[17]、韦典[13]、Cabizza等[12]、Jankowska等[25]建立的方法中,咯菌腈的平均添加回收率分别为81.85%~92.43%、85.0%~95.0%、83.5%~ 93.6%、95%~108%和85.53%~98.49%,RSD分别为3.68%~7.90%、0.4%~8.2%、7.2%~9.4%、3%~7%和20%以下。本研究中,咯菌腈在番茄和土壤中的平均添加回收率分别为95.96%~103.17%和88.21%~ 106.88%,RSD分别为1.8%~4.6%和1.1%~6.2%。通过和上述方法比较可以看出,本方法的准确度和精密度均有一定程度提高。
4 结论本研究建立了测定番茄和土壤中农药咯菌腈残留的UPLC-MS/MS分析方法。番茄样品以乙腈提取,土壤样品以乙腈水溶液提取,经PSA和Florisil净化,通过ACQUITY UPLC BEH C18柱分离后,用超高效液相色谱-质谱联用仪检测。该方法线性关系良好,分析时间短,灵敏度高,准确度好,操作简便,应用价值较高。
| [1] |
黄晓瑛, 尚宇, 王列平, 等. 杀菌剂咯菌腈的合成及表征[J]. 农药, 2014, 53(9): 633-635. HUANG Xiao-ying, SHANG Yu, WANG Lie-ping, et al. Synthesis and characterization of fungicide fludioxonil[J]. Agrochemicals, 2014, 53(9): 633-635. |
| [2] |
Hagiwara D, Asano Y, Marui J, et al. Transcriptional profiling for Aspergillus nidulans HogA MAPK signaling pathway in response to fludioxonil and osmotic stress[J]. Fungal Genetics and Biology, 2009, 46(11): 868-878. DOI:10.1016/j.fgb.2009.07.003 |
| [3] |
赵建江, 张小风, 马志强, 等. 番茄灰霉病菌对咯菌腈的敏感基线及其与不同杀菌剂的交互抗性[J]. 农药, 2013, 52(9): 684-685. ZHAO Jian-jiang, ZHANG Xiao-feng, MA Zhi-qiang, et al. Baselinesensitivity of Botrytis cinerea on tomato to fludioxonil and cross-resistance against diverse fungicides[J]. Agrochemicals, 2013, 52(9): 684-685. |
| [4] |
Kanetis L, Christodoulou S, Iacovides T. Fungicide resistance profile and genetic structure of Botrytis cinerea from greenhouse crops in Cyprus[J]. European Journal of Plant Pathology, 2017, 147(3): 527-540. DOI:10.1007/s10658-016-1020-9 |
| [5] |
Bardas G A, Veloukas T, Koutita O, et al. Multiple resistance of Botrytis cinerea from kiwifruit to SDHIs, QoIs and fungicides of other chemical groups[J]. Pest Management Science, 2010, 66(9): 967-973. DOI:10.1002/ps.v66:9 |
| [6] |
Zhao H, Kim Y K, Huang L, et al. Resistance to thiabendazole and baseline sensitivity to fludioxonil and pyrimethanil in Botrytis cinerea populations from apple and pear in Washington State[J]. Postharvest Biology and Technology, 2010, 56(1): 12-18. DOI:10.1016/j.postharvbio.2009.11.013 |
| [7] |
刘圣明, 海飞, 车志平, 等. 4种杀菌剂及其复配剂对番茄灰霉病菌的毒力[J]. 植物保护, 2017, 43(2): 230-234. LIU Sheng-ming, HAI Fei, CHE Zhi-ping, et al. Toxicity of four fungicides and their mixtures to Botrytis cinerea from tomato[J]. Plant Protection, 2017, 43(2): 230-234. DOI:10.3969/j.issn.0529-1542.2017.02.042 |
| [8] |
禾丽菲, 陈乐乐, 肖斌, 等. 番茄叶霉病菌对咯菌腈敏感基线的建立及田间防治效果评价[J]. 中国农业科学, 2018, 51(8): 1475-1483. HE Li-fei, CHEN Le-le, XIAO Bin, et al. Establishment of sensitivity baseline and evaluation of field control efficacy of fludioxonil against Fulvia fulva[J]. Scientia Agricultura Sinica, 2018, 51(8): 1475-1483. |
| [9] |
李戌清, 田忠玲, 郑积荣, 等. 番茄灰叶斑病病原菌生物学特性及杀菌剂筛选[J]. 浙江农业学报, 2015, 27(11): 1953-1959. LI Xu-qing, TIAN Zhong-ling, ZHENG Ji-rong, et al. Biological characteristics and fungicide screening of Stemphylium lycopersici causing tomato grey leaf spot[J]. Acta Agriculturae Zhejiangensis, 2015, 27(11): 1953-1959. DOI:10.3969/j.issn.1004-1524.2015.11.15 |
| [10] |
张雪, 王晓梅, 逯忠斌, 等. 16种杀菌剂及其复配对番茄晚疫病的室内毒力测定及温室防效[J]. 吉林蔬菜, 2016(5): 43-45. ZHANG Xue, WANG Xiao-mei, LU Zhong-bin, et al. Toxicity determination and greenhouse efficacy of several fungicides to phytophthora infestans[J]. Jilin Vegetable, 2016(5): 43-45. |
| [11] |
Ko A Y, Abd El-Aty A M, Jang J, et al. Detecting fludioxonil residues in brown rice and rice straw using gas chromatography-nitrogen phosphorus detector[J]. Journal of the Korean Society for Applied Biological Chemistry, 2015, 58(6): 213-217. |
| [12] |
Cabizza M, Dedola F, Satta M. Residues behavior of some fungicides applied on two greenhouse tomato varieties different in shape and weight[J]. Journal of Environmental Science and Health, Part B, 2012, 47(5): 379-384. DOI:10.1080/03601234.2012.648531 |
| [13] |
韦典.番茄农药多残留检测方法开发及广西田阳县番茄农药残留监测[D].南宁: 广西大学, 2016: 9-28. WEI Dian. The method development of pesticide residue detection in the tomato and pesticide residue monitoring of tomato in Tianyang County of Guangxi[D]. Nanning: Guangxi University, 2016: 9-28. http://cdmd.cnki.com.cn/Article/CDMD-10593-1016198549.htm |
| [14] |
You X, Chen X, Liu F, et al. Ionic liquid-based air-assisted liquidliquid microextraction followed by high performance liquid chromatography for the determination of five fungicides in juice samples[J]. Food Chemistry, 2018, 239: 354-359. DOI:10.1016/j.foodchem.2017.06.074 |
| [15] |
Chen X, Zhang X, Liu F, et al. Binary-solvent-based ionic-liquid-assisted surfactant-enhanced emulsification microextraction for the determination of four fungicides in apple juice and apple vinegar[J]. Journal of Separation Science, 2017, 40(4): 901-908. DOI:10.1002/jssc.201601001 |
| [16] |
刘振库, 张雪, 张浩. 氰霜唑和咯菌腈在番茄上降解规律研究[J]. 吉林蔬菜, 2017(10): 37-38. LIU Zhen-ku, ZHANG Xue, ZHANG Hao. Degradation kinetics of the cyazofamid and fludioxonil in tomato[J]. Jilin Vegetable, 2017(10): 37-38. |
| [17] |
占绣萍, 余淑红. 液相色谱法测定蔬菜中咯菌腈、溴虫腈和虱螨脲等农药的残留量[J]. 农药科学与管理, 2012, 33(4): 31-34. ZHAN Xiu-ping, YU Shu-hong. Simultaneous determination of fludioxonil, chlorfenapyr and lufenuron residues in vegetables and soil by HPLC[J]. Pesticide Science and Administration, 2012, 33(4): 31-34. DOI:10.3969/j.issn.1002-5480.2012.04.016 |
| [18] |
Nagashima H, Hirao A, Tokuda Y, et al. Simultaneous determination of seven kinds of fungicides in citrus fruits by gas chromatograghy/mass spectrometry[J]. Shokuhin Eiseigaku Zasshi, 2016, 57(4): 101-106. DOI:10.3358/shokueishi.57.101 |
| [19] |
Chu S P, Tseng W C, Kong P H, et al. Up-and-down-shaker-assisted dispersive liquid-liquid microextraction coupled with gas chromatography-mass spectrometry for the determination of fungicides in wine[J]. Food Chemistry, 2015, 185: 377-382. DOI:10.1016/j.foodchem.2015.04.015 |
| [20] |
Lee K G, Jo E K. Multiresidue pesticide analysis in Korean ginseng by gas chromatography-triple quadrupole tandem mass spectrometry[J]. Food Chemistry, 2012, 134(4): 2497-2503. DOI:10.1016/j.foodchem.2012.04.094 |
| [21] |
Rodriguez-Cabo T, Rodriguez I, Ramil M, et al. Dispersive liquid-liquid microextraction using non-chlorinated, lighter than water solvents for gas chromatography-mass spectrometry determination of fungicides in wine[J]. Journal of Chromatography A, 2011, 1218(38): 6603-6611. DOI:10.1016/j.chroma.2011.07.054 |
| [22] |
韩梅, 侯雪, 郭灵安. 气相色谱-串联质谱法测定葵花籽中28种农药残留[J]. 农药学学报, 2016, 18(1): 93-100. HAN Mei, HOU Xue, GUO Ling-an. Determination of 28 pesticide residues in sunflower seeds by gas chromatography-tandem mass spectrometry[J]. Chinese Journal of Pesticide Science, 2016, 18(1): 93-100. |
| [23] |
刘绍文.葡萄及相关基质中农药残留分析方法建立与应用研究[D].北京: 中国农业大学, 2016: 20-61. LIU Shao-wen. Development and application of pesticide residue analytical methods in grape and related matrices[D]. Beijing: China Agricultural University, 2016: 20-61. http://cdmd.cnki.com.cn/Article/CDMD-10019-1016085508.htm |
| [24] |
Kovacova J, Hrbek V, Kloutvorova J, et al. Assessment of pesticide residues in strawberries grown under various treatment regimes[J]. Food Additives and Contaminants Part A, 2013, 30(12): 2123-2135. DOI:10.1080/19440049.2013.850537 |
| [25] |
Jankowska M, Kaczynski P, Hrynko I, et al. Dissipation of six fungicides in greenhouse-grown tomatoes with processing and health risk[J]. Environmental Science and Pollution Research International, 2016, 23(12): 11885-11900. DOI:10.1007/s11356-016-6260-x |
| [26] |
Mercader J V, Abad-Fuentes A, Agulló C, et al. Development of a sensitive and specific enzyme-linked immunosorbent assay for the determination of fludioxonil residues in fruit juices[J]. Analytical Methods, 2014, 6(22): 8924-8929. DOI:10.1039/C4AY01756K |
| [27] |
杨玉柱, 焦必宁. 新型杀菌剂咯菌腈研究进展[J]. 现代农药, 2007, 6(5): 35-39. YANG Yu-zhu, JIAO Bi-ning. Advances in the research of a new fungicide fludioxonil[J]. Modern Agrochemicals, 2007, 6(5): 35-39. DOI:10.3969/j.issn.1671-5284.2007.05.012 |
 2019, Vol. 38
2019, Vol. 38