2. 锰锌钒产业技术协同创新中心, 湖南 吉首 416000;
3. 锰锌矿业重金属污染综合防治技术湖南省工程实验室, 湖南 吉首 416000
2. The Collaborative Innovation Center of Manganese-Zinc-Vanadium Industrial Technology, Jishou 416000, China;
3. Hunan Provincial Engineering Laboratory of Control and Remediation of Heavy Metal Pollution from Mn-Zn Mining, Jishou 416000, China
锰(Mn)是植物代谢过程中必需的微量元素, 当Mn含量超标时, 植物会发生Mn毒反应, 对植物的产量、生长发育、光合作用、矿质营养吸收等生理代谢活动均产生负面的影响[1-2]。Mn毒害也被认为是限制植物在酸性及渍水土壤生长的重要因素[3]。在我国南方地区的酸性土壤中、pH较低的水稻土壤中以及Mn矿区及尾渣库区的土壤中, Mn离子大量积累, 对农作物生长及农产品环境安全造成巨大的危害[4]。尤其是在矿区, Mn元素可以通过各种途径进入农田土壤中[5], 灌溉农田土壤中Mn含量可达5700 mg·kg-1, 其最大值可达10 000 mg·kg-1。矿渣堆周边的农田土壤Mn含量也接近1000 mg·kg-1, 蔬菜中的Mn含量超过正常值5~80倍, 亟待治理[6-7]。
近年来, 重金属植物修复技术日益受到社会的重视和关注[8]。香根草[Vetiveria zizanioides(L.)Nash]是禾本科香根草属多年生C4类草本植物, 根系发达、生物量大, 每年干草产量可达100 t·hm-2。能够适应旱涝、酸碱等多种环境, 并对多种重金属都有较强的耐受和积累能力, 已广泛应用于环境修复领域[9-10]。其在农田生态系统中也有较广泛的应用。通过与作物间作, 香根草可以防止农田水土流失、诱集作物害虫、修复多环芳烃污染土壤等[11-12]。所以, 香根草在农业及废弃地的生态修复领域有着良好的应用前景。但目前对于采用植物修复技术治理高Mn污染的基础和应用研究较少, 香根草对高Mn胁迫耐受和生理响应也未见报道。所以, 本文采用实验室水培试验, 研究高Mn胁迫对香根草矿质元素吸收和光合系统的影响, 揭示香根草对高Mn胁迫的耐受范围、Mn积累特征及生理响应, 以期为香根草用于高Mn污染地区环境修复提供科学依据。
1 材料与方法 1.1 供试材料试验所用香根草由试验室长年种植在未受污染的苗圃中, 在试验准备阶段, 将分蘖繁殖得到的香根草幼苗单株培养, 挑选长势健壮的香根草(苗龄5个月)置于1/2Hoagland营养液中培养, 待其恢复生长后进行Mn胁迫处理。
1.2 试验设计每3株香根草固定于1个500 mL塑料盆中, 以1/ 2Hoagland营养液作为培养液, Mn以MnSO4·H2O的形式直接加入营养液中。以1/2Hoagland营养液作为对照处理, 其他处理组的Mn浓度分别为:15、30、60、120 mmol·L-1, 营养液pH调节至5.8, 并隔日更换。于植物培养箱中生长60 d。培养条件为昼夜温度分别为(28±2)℃和(22±2)℃;白昼16 h·d-1;光照强度1000 μmol·m-2·s-1。每处理设置3个重复(即每处理3盆9株苗)。
1.3 含水率、株高、SPAD值、植株干物质质量的测定将植物用去离子水多次冲洗, 吸干表面水分称鲜质量。分离根、叶组织, 在105 ℃下杀青20 min, 70 ℃下烘48 h至恒质量, 冷却至室温后称干质量(即整个植株干物质质量)。植物含水率= (鲜质量-干质量) /鲜质量×100%。植物株高用卷尺测量基部到叶片最高点的高度。采用SPAD-502叶绿素仪(Konica Minolta Sensing, 日本)夹取植物倒3或倒4叶的1/4处和3/4处测量植物SPAD值。
1.4 Mn及矿质元素含量的测定将香根草干样粉碎过60目筛。称取0.1 g并加入HNO3和HClO4(V:V=4:1)静置6~8 h, 然后于石墨消解仪消煮至溶液澄清, 冷却并定容于25 mL, 再经滤纸过滤, 于安捷伦240fs火焰原子吸收光谱仪(安捷伦, 美国)测定矿质元素含量[13];以24种金属元素混合标准液(GSB04-1767-2004)配制5个梯度浓度的标准液, 制作标准曲线。每测定5~10个样品, 将仪器重新置零, 并测量一个浓度的标准品, 以监测仪器的稳定性。
1.5 Mn富集系数与转移系数的测定[14]

|
式中:Csolution表示培养液中的Mn含量;Croot表示根中的Mn含量;Cleaf表示叶中的Mn含量;Wroot表示根的干物质量;Wleaf表示叶的干物质量。
1.6 光合作用参数的测定采用Li-6400便携式光合仪(LICOR, 美国)于9:30—11:00进行测定, 植物先在阳光下进行充分光诱导, 然后进行光合测量。叶室光强根据环境光强设置为1300 μmol·m-2·s-1, 净光合速率(Pn)、气孔导度(Cond)、胞间二氧化碳浓度(Ci)、蒸腾速率(Trmmol)均从仪器直接读取。
1.7 叶绿素荧光参数的测定采用PAM-2500(Walz, 德国)于20:00以后进行测定, 植物先放置在黑暗环境下进行30 min暗适应。梯度作用光强为8、16、32、90、165、245、325、430、580、770、1100、1400、1700 μmol·m-2·s-1, 测定间隔为30 s。PSⅡ最大光化学效率(Fv /Fm)、潜在最大电子传导率(ETRmax)直接从仪器上读取, PSⅡ实际光化学效率[Y(Ⅱ)]、调节性主动耗散[Y(NPQ)]、非调节性被动能量耗散[Y (NO)]均通过系统自动拟合得出。
1.8 数据分析以上试验数据使用SPSS 20.0进行Tukey算法以及多重比较分析, 显著性水平为P < 0.05, 数据均以平均值±标准误表示。并采用该软件中Pearson相关系数和双侧显著性检验进行相关性分析。
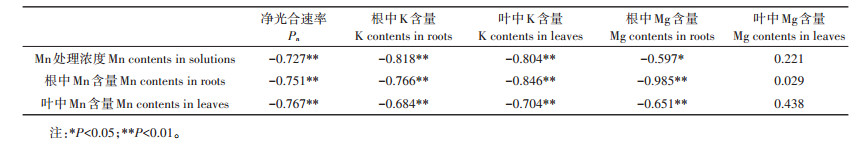
2 结果与分析 2.1 Mn对香根草SPAD、含水率、株高、植株干物质质量的影响与对照相比, 15、30 mmol·L-1Mn处理中, SPAD略微下降, 但未达到显著差异水平;当Mn处理浓度在60 mmol·L-1和120 mmol·L-1时其出现显著性下降, 且在120 mmol·L-1时, SPDA值最低, 仅为对照的35.5% (图 1A)。而香根草的含水率、株高、植株干物质质量在Mn处理浓度≥30 mmol·L-1时即出现明显的降低, 株高、植株干物质质量下降已达到显著差异水平。随着Mn处理浓度的增加, 3个参数下降的幅度更大。在120 mmol·L-1时, 其分别为对照组的51.5%、70.3%和50.5% (图 1B、图 1C、图 1D)。
|
不同小写字母表示处理间差异显著(P < 0.05)。下同 The different lowercase letters indicate significant differences among treatments(P < 0.05). The same below 图 1 不同浓度Mn对香根草SPAD值(A)、叶片含水率(B)、株高(C)和植株干物质质量(D)的影响 Figure 1 Effects of different concentrations of manganese on SPAD(A), leaf water content (B), plant height (C)and plant dry weight (D)of vetiver grass |
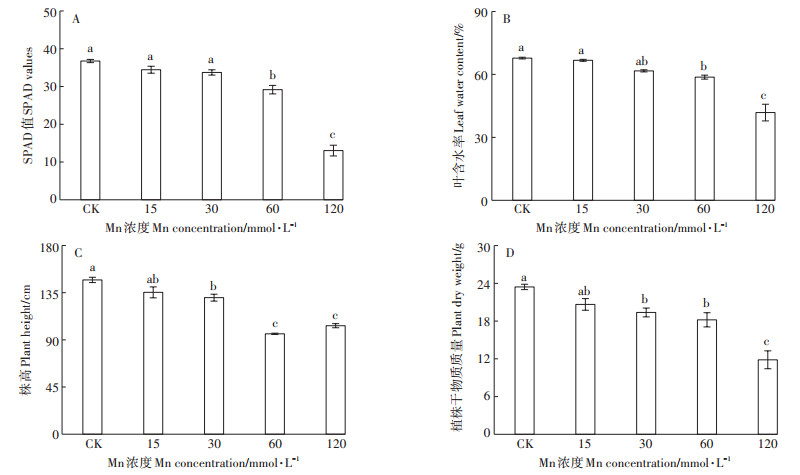
Mn处理的根、叶中Mn含量均显著高于对照。在根部, 30~120 mmol·L-1处理组间的Mn含量没有明显差异, 且显著高于15 mmol·L-1 Mn处理组(图 2A)。而在叶中, 15~60 mmol·L-1处理组间的Mn含量没有明显差异, 但在120 mmol·L-1 Mn处理时出现大幅度上升(图 2B)。其转移系数的变化与叶片中的Mn含量变化一致。在15~60 mmol·L-1Mn处理下, 转移系数为24.5%~28.1%, 在120 mmol·L-1时, 转移系数增加至66.5% (图 2C)。香根草根系对Mn的富集系数随着Mn处理浓度的增加而显著降低, 在120 mmol·L-1时降至2.9;Mn处理下根系的Mn富集系数始终大于1 (图 2D)。而富集量则在99.9~135.1 mg·株-1间波动。其中, 120 mmol·L-1处理下的富集量要显著高于30、60 mmol·L-1处理(图 2E)。
|
图 2 不同浓度Mn对香根草根叶中锰含量、富集系数和转移系数的影响 Figure 2 Effects of different concentrations of manganese on manganese content in roots and leaves, and transfer coefficients enrichment coefficients and bioaccumulation quantity |
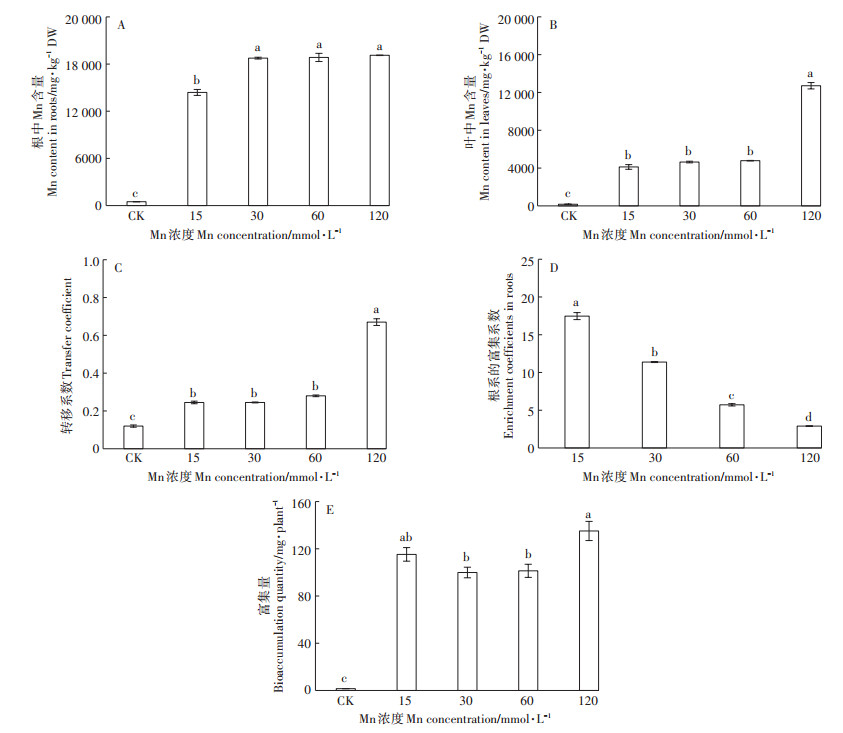
Mn处理的根、叶中K含量呈现下降的趋势, 当处理浓度≥30 mmol·L-1时, 达到显著性差异, 其中, 根中K含量的下降幅度远大于叶中(图 3A)。根中的Mg含量在Mn处理下显著下降, 仅为对照的25.5%~ 39.4%, 且Mn处理组之间的变化较小(图 3B)。根的Fe含量则与Mg的变化相反, 在Mn处理下呈现出不同程度的增幅, 比对照组增加了1.9~3.9倍(图 3C)。与对照相比, 叶中Mg和Fe的含量在各处理组有上升和下降不同的变化, 但变化幅度总体不大(图 3B、图 3C)。
|
图 3 不同浓度Mn对香根草K、Mg、Fe吸收的影响 Figure 3 Effect of different concentrations of manganese on the absorption of K, Mg and Fe in vetiver grass |
与对照组相比, Mn处理下Pn显著降低了37.3%~ 81.0%, 并随着Mn浓度的增加而总体呈下降趋势。尤其在120 mmol · L-1处理组, 其Pn值仅为对照的19.0%(图 4A)。与Pn变化趋势相反, Ci在Mn处理下显著高于对照, 且Mn处理组间的Ci较为相似(图 4C)。Trmmol和Cond的变化趋势一致, 在15 mmol· L-1处理组中, 其与对照组无明显变化, 在30、60 mmol·L-1处理下则出现一定程度的增加, 但在120 mmol·L-1处理下则出现大幅度的下降, 并显著低于对照水平(图 4B、图 4D)。
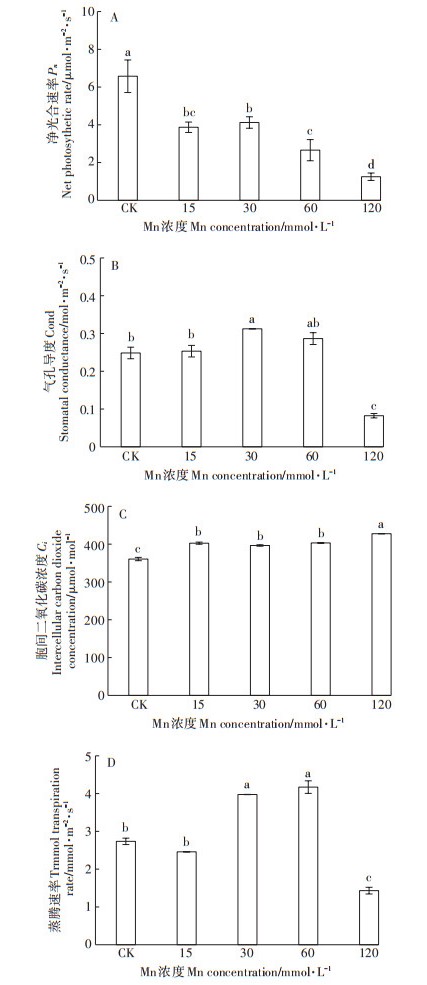
|
图 4 不同浓度Mn对香根草净光合速率、气孔导度、胞间二氧化碳浓度、蒸腾速率的影响 Figure 4 Effect of different concentrations of manganese on net photosynthetic rate (Pn), stomatal conductance (Cond), intercellular carbon dioxide concentration(Ci)and transpiration rate (Trmmol)of vetiver grass |
Mn处理下香根草的Fv /Fm和ETRmax均呈现下降的趋势。ETRmax在15 mmol·L-1处理下即出现显著的下降, 在60~120 mmol·L-1下降的幅度更大(图 5B)。而Fv /Fm在15~30 mmol·L-1处理下保持稳定, 当Mn浓度上升至60、120 mmol·L-1时, 其显著低于对照组(图 5A)。随着光强的增加, Y(Ⅱ)呈现下降的趋势, 而Y(NPQ)呈现上升的趋势, Y(NO)基本保持稳定。Mn处理组的Y(Ⅱ)均低于对照, 而Y(NO)均高于对照(图 5C、图 5E);15、30 mmol·L-1Mn胁迫下, Y(NPQ)接近或低于对照;而30~120 mmol·L-1Mn胁迫下, Y(NPQ)总体高于对照(图 5D)。
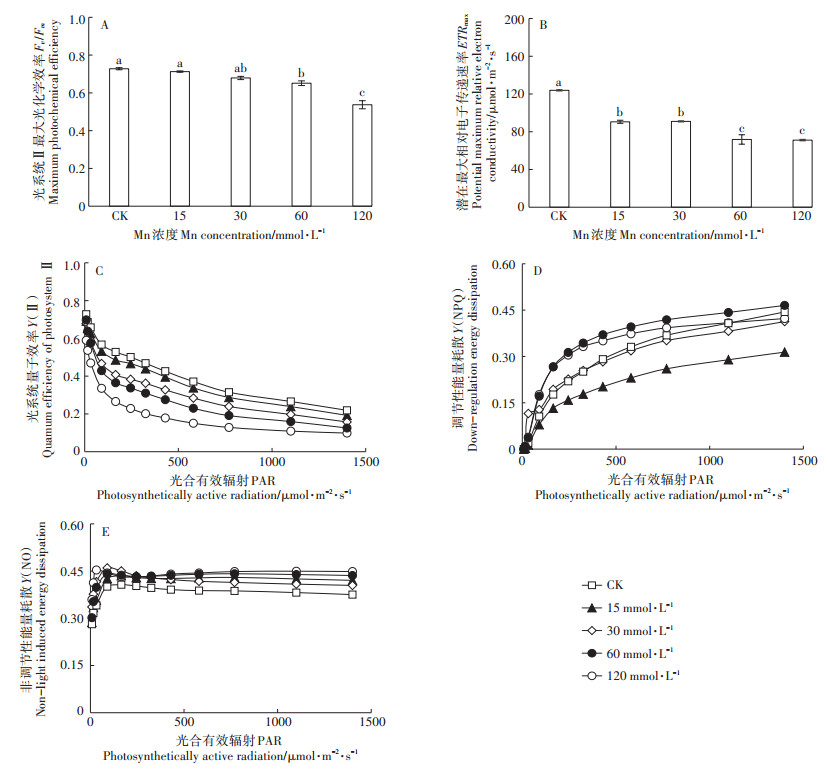
|
图 5 不同浓度Mn对香根草光系统Ⅱ最大光化学效率(Fv /Fm)、潜在最大相对电子传递速率(ETRmax)、光系统量子效率[Y(Ⅱ)]、光系统Ⅱ调节性能量耗散[Y(NPQ)]、光系统Ⅱ非调节性能量耗散[Y(NO)]的影响 Figure 5 Effects of different concentrations of manganese on maximum photochemical efficiency(Fv /Fm), potential maximum relative electron conductivity (ETRmax), quantum efficiency of photosystem Ⅱ [Y(Ⅱ)], down-regulation energy dissipation [Y(NPQ)], non-light induced energy dissipation[Y(NO)] of vetiver grass |
过量的Mn会对植物产生一系列的生理毒害作用, 多数植物对Mn的耐受浓度通常低于15 mmol· L-1。仅有水蓼[15]、木荷[16]等Mn超富集植物能够耐受高浓度的Mn胁迫。考虑到矿区土壤中可能存在高浓度的Mn离子, 所以, 本研究中设置的Mn处理浓度达到了120 mmol·L-1, 与金政等[16]在木荷研究使用Mn浓度接近。PSⅡ的最大量子产量(Fv /Fm)是衡量原初光能捕获的最大能力的指标, 植物处于逆境下, Fv /Fm下降, 其直接反映植物受到外界胁迫程度[17]。植物叶绿素含量降低也是高Mn导致的胁迫伤害症状之一[18]。诸多研究表明在Mn胁迫下植物的Fv /Fm和叶绿素含量会明显下降[19-20]。本研究发现, 香根草Fv /Fm(图 5A)和SPAD(图 1A)在15~60 mmol·L-1内接近正常水平, 植株干物质量(图 1D)也能维持在对照的77.6%~ 88.1%。说明香根草能够耐受60 mmol·L-1以下的Mn环境, 具有良好的Mn耐受能力。在60 mmol·L-1以下的Mn处理中, 根和叶中的Mn含量分别为14 393~18 845 mg·kg-1和4118~4782 mg·kg-1;并且, 根中的Mn富集系数也大于1。总体而言, 香根草有良好的Mn积累能力, 远超于大多数植物(20~500 mg·kg-1) [19]。而且, 在15~60 mmol·L-1的Mn环境下, 根中的Mn含量已经达到Mn超积累植物的标准(Mn含量大于10 000 mg· kg-1) [19], 叶中的Mn含量达到该标准的40%。此外, 试验中香根草Mn的富集量在15~60 mmol·L-1的Mn环境中差异不显著, 可达99.9~115.2 mg·株-1。由于试验用苗是苗期, 其生物量并不大(对照组生物量仅23.4 g·株-1), 导致富集量偏小, 有研究报道在4株· m-2密度下, 经过8个月的生长, 香根草的每株生物量可达300 g[21], 据此推测, 香根草在高Mn环境中富集量相当可观, 显示其具有用于高Mn污染环境修复的潜力。
在Mn处理下, 香根草根部Mn的含量高于叶片, Mn转移系数为24.5%~28.1%(图 2A、图 2B、图 2D), 说明香根草的根部是富集Mn的主要器官, 刘云国等[22]的研究也表明香根草根部是Cd离子的主要富集部位。随着Mn浓度的增加, 根、叶中Mn含量表现出不一样的变化。在30~120 mmol·L-1Mn处理下根中的Mn含量保持稳定(图 2A)。在15~60 mmol·L-1处理下叶中的Mn含量和转移系数无显著差异;但在120 mmol·L-1处理下, 叶中Mn含量和转移系数均出现大幅度的增加(图 2B、图 2D)。结果表明在一定Mn浓度内, 香根草根、叶中的Mn离子并没有随着Mn处理浓度的增加而递增。在木荷的根中也发现了类似的现象[16]。这可能是在高Mn环境中, 香根草存在着限制Mn吸收和向叶片转运的机制。在超高Mn浓度下(120 mmol·L-1), 可能由于该机制受到破坏, 才导致Mn离子向地上部位运输增加, 叶中Mn离子大量积累。
3.2 光合系统和矿质元素吸收对高Mn胁迫的响应Mn过量会产生大量的活性氧, 破坏叶绿素, 影响PSⅠ与PSⅡ的活性, 降低植物的光合速率[23]。水稻等农作物在Mn毒害下光合速率会显著降低, 光合系统的有关基因表达会发生改变[24-25], 本研究发现, 香根草光合作用受抑制程度与Mn处理浓度、根、叶中Mn含量呈极显著负相关(表 1)。Pn显著下降, Ci显著增高(图 4A、图 4C), 同时, ETRmax、Y(Ⅱ)也显著下降(图 5B、图 5C), 这说明造成香根草光合速率下降的主要因素并不是气孔受限, 而是光合系统和光合代谢活动受到了损伤。在Mn胁迫下, 随着光照强度的增加, Y(NO)保持稳定, 而Y(NPQ)显著增加(图 5D、图 5E), 表明PSⅡ以热耗散等保护性调节机制消耗的光能增加。Y(NPQ)的增加是植物的一种保护机制[26]。梁文斌等[19]也认为是Mn超积累植物垂序商陆的保护机制之一。
|
|
表 1 处理溶液及根叶中Mn含量与香根草净光合速率、根叶中K、Mg含量的相关系数 Table 1 Correlation coefficients between Mn contents in solutions, roots, leaves and net photosynthetic rate or K and Mg contents in roots, leaves of vetiver grass |
植物体内矿质元素平衡是其正常生长发育的必要条件, 重金属胁迫会改变植物体内矿质元素的吸收与分布[27]。本研究选取了大量元素K、中量元素Mg、微量元素Fe作为阳离子矿质元素的代表进行分析, 结果显示, 在高浓度Mn胁迫下, 植物体内的3种元素在根、叶中表现出不同的变化趋势。在叶中, 除K含量有一定程度的降低外(图 3A), Mg和Fe的含量基本维持稳定(图 3B、图 3C)。但在根中, K和Mg的含量均出现大幅度下降(图 3A、图 3B), 而Fe则显著增加(图 3C)。相关性分析发现, 根、叶中的K含量和根中的Mg含量与根、叶中Mn的含量呈极显著负相关(表 1)。这可能是因为高Mn能抑制植物对K、Mg的吸收[28-29]。本试验发现根、叶中K含量与植株干物质质量和Fv /Fm呈极显著正相关(相关系数为0.675和0.674, 0.772和0.750), 暗示K营养在香根草耐受高Mn胁迫中具有重要的作用。此外, 有研究发现Mn胁迫下Mn耐受型水稻根、叶中的Fe含量增加[28]。香根草根中Fe含量的增加可能是Mn耐受力强的表现。但有关机制还未见报道。
4 结论香根草能够长时间耐受60 mmol·L-1以下的Mn环境, 并能够在根、叶中积累高含量的Mn, 具有修复Mn污染环境的潜力。限制Mn离子的吸收和转运、增加PSⅡ调节性能量耗散消耗、维持叶中Mg、Fe的相对稳定是香根草对高Mn胁迫的适应性响应。
| [1] |
Millaleo R, Reyes D M, Ivanov A G, et al. Manganese as essential and toxic element for plants:Transport, accumulation and resistance mechanisms[J]. Journal of Soil Science and Plant Nutrition, 2010, 10(4): 470-481. DOI:10.4067/S0718-95162010000200008 |
| [2] |
Santos E F, Kondo S, José M, et al. Physiological highlights of manganese toxicity symptoms in soybean plants:Mn toxicity responses[J]. Plant Physiology and Biochemistry, 2017, 113: 6-19. DOI:10.1016/j.plaphy.2017.01.022 |
| [3] |
Foy C D, Chaney R L, White M C. The physiology of metal toxicity in plants[J]. Annual Review of Plant Physiology, 1978, 29(1): 511-566. DOI:10.1146/annurev.pp.29.060178.002455 |
| [4] |
臧小平. 土壤Mn毒与植物Mn的毒害[J]. 土壤通报, 1999, 30(3): 139-141. ZANG Xiao-ping. Soil manganese toxicity and plant manganese toxicity[J]. Chinese Journal of Science, 1999, 30(3): 139-141. DOI:10.3321/j.issn:0564-3945.1999.03.016 |
| [5] |
贾赵恒, 罗瑶, 沈友刚, 等. 大冶龙角山矿区农田土壤重金属形态分布及其来源[J]. 农业环境科学学报, 2017, 36(2): 264-271. JIA Zhao-heng, LUO Yao, SHEN You-gang, et al. Speciation, distribution and sources of heavy metals in agricultural soils from the mining area of Longjiao Mountain in Daye City[J]. Journal of Agro-Environment Science, 2017, 36(2): 264-271. |
| [6] |
祝滔, 江长胜, 郝庆菊, 等. 重庆秀山Mn矿区土壤和植物Mn污染调查与评价[J]. 环境科学与技术, 2012, 35(9): 167-172. ZHU Tao, JIANG Chang-sheng, HAO Qing-ju, et al. Investigation and assessment of contaminated soils and plants by Mn in manganese mining area in Xiushan autonomous county of Chongqing[J]. Environmental Science and Technology, 2012, 35(9): 167-172. DOI:10.3969/j.issn.1003-6504.2012.09.035 |
| [7] |
黄小娟, 江长胜, 郝庆菊. 重庆溶溪Mn矿区土壤重金属污染评价及植物吸收特征[J]. 生态学报, 2014, 34(15): 4201-4211. HUANG Xiao-juan, JIANG Chang-sheng, HAO Qing-ju. Assessment of heavy metal pollutions in soils and bioaccumulation of heavy metals by plants in Rongxi Manganese mineland of Chongqing[J]. Acta Ecologica Sinica, 2014, 34(15): 4201-4211. |
| [8] |
Raskin I, Smith R D, Salt D E. Phytoremediation of metals:Using plants to remove pollutants from the environment[J]. Current Opinion in Biotechnology, 1997, 8(2): 221-226. DOI:10.1016/S0958-1669(97)80106-1 |
| [9] |
徐礼煜, 夏汉平. 香根草系统的理论与实践[M]. 北京: 中国广播电视出版社, 2008: 20-27. XU Li-yu, XIA Han-ping. Theory and practice of vetiver system[M]. Beijing: China Radio and Television Press, 2008: 20-27. |
| [10] |
周强, 胡淑宝, 王青青, 等. 6种生态型香根草光合光响应特征及光合参数日变化的比较[J]. 生态与农村环境学报, 2015, 31(5): 690-696. ZHOU Qiang, HU Shu-bao, WANG Qing-qing, et al. Comparison between six ecotypes of vetiver grasses in photosynthetic light response and diurnal variation of photosynthetic parameters[J]. Journal of Ecology and Rural Environment, 2015, 31(5): 690-696. |
| [11] |
鲁艳辉, 白琪, 郑许松, 等. 不同地理种群二化螟对诱集植物香根草的选择趋性比较[J]. 植物保护学报, 2017, 44(6): 968-972. LU Yan-hui, BAI Qi, ZHENG Xu-song, et al. Selective tropism of different geographical populations of Chilo suppressalis to the trapping vetiver grass, Vetiveria zizanioiaes[J]. Journal of Plant Protection, 2017, 44(6): 968-972. |
| [12] |
王娇娇, 呼世斌, 魏丽琼, 等. 甜菜与牧草间作对多环芳烃污染土壤的修复作用[J]. 农业环境科学学报, 2016, 35(6): 1090-1096. WANG Jiao-jiao, HU Shi-bin, WEI Li-qiong, et al. Phytoremediation of polycyclic aromatic hydrocarbons(PAHs)-contaminated soil by intercropped beet-grasses[J]. Journal of Agro-Environment Science, 2016, 35(6): 1090-1096. |
| [13] |
Zhou Q, Yu B J. Changes in content of free, conjugated and bound polyamines and osmotic adjustment in adaptation of vetiver grass to water deficit[J]. Plant Physiology and Biochemistry, 2010, 48(6): 417-425. DOI:10.1016/j.plaphy.2010.03.003 |
| [14] |
陈立, 王丹, 龙婵, 等. 三种螯合剂对芥菜修复铀镉复合污染土壤的影响[J]. 农业环境科学学报, 2018, 37(8): 1690-1697. CHEN Li, WANG Dan, LONG Chan, et al. Effects of three kinds of chelating agents on U and Cd phytoremediation in Brassica juncea L.[J]. Journal of Agro-Environment Science, 2018, 37(8): 1690-1697. |
| [15] |
王华, 唐树梅, 廖香俊, 等. 超积累植物水蓼吸收Mn的生理与分子机制[J]. 云南植物研究, 2008(4): 489-495. WANG Hua, TANG Shu-mei, LIAO Xiang-jun, et al. Physiological and molecular mechanisms of Mn uptake by hyperaccumulting plant Polygonum hydropiper(Polygonaceae)[J]. Acta Botanica Yunnanica, 2008(4): 489-495. DOI:10.3969/j.issn.2095-0845.2008.04.017 |
| [16] |
金政, 李俊凯, 刘群录. Mn胁迫对Mn超富集植物西南木荷矿质元素吸收的影响[J]. 上海交通大学学报(农业科学版), 2018, 36(1): 24-29. JIN Zheng, LI Jun-kai, LIU Qun-lu. Influence of Mn stress on mineral elements assimilation by Mn hyperaccumulator Schima wallichii[J]. Journal of Shanghai Jiaotong University, 2018, 36(1): 24-29. DOI:10.3969/J.ISSN.1671-9964.2018.01.005 |
| [17] |
Yamazaki J Y, Kamata K, Maruta E. Seasonal changes in the excess energy dissipation from photosystem Ⅱ antennae in overwintering evergreen broad-leaved trees Quercus myrsinaefolia and Machilus thunbergii[J]. Journal of Photochemistry and Photobiology B:Biology, 2011, 104(1/2): 348-356. |
| [18] |
Hauck M, Paul A, Gross S, et al. Manganese toxicity in epiphytic lichens:Chlorophyll degradation and interaction with iron and phosphorus[J]. Environmental and Experimental Botany, 2003, 49(2): 181-191. DOI:10.1016/S0098-8472(02)00069-2 |
| [19] |
梁文斌, 薛生国, 沈吉红, 等. Mn胁迫对垂序商陆光合特性及叶绿素荧光参数的影响[J]. 生态学报, 2010, 30(3): 619-625. LIANG Wen-bin, XUE Sheng-guo, SHEN Ji-hong, et al. Effects of manganese stress on photosythesis and chlorophyll fluorescence parameters of Phytolacca americana[J]. Acta Ecologica Sinica, 2010, 30(3): 619-625. |
| [20] |
Emamverdian A, Ding Y, Mokhberdoran F, et al. Heavy metal stress and some mechanisms of plant defense response[J]. Scientific World Journal, 2015, 756120. |
| [21] |
刘金祥, 张涛, 许小玉. 种植密度对香根草生长动态及生物量的影响[J]. 湖北农业科学, 2013, 52(17): 4126-4129. LIU Jin-xiang, ZHANG Tao, XU Xiao-yu. Effects of planting density on growth dynamics and biomass of vetiver[J]. Hubei Agricultural Sciences, 2013, 52(17): 4126-4129. DOI:10.3969/j.issn.0439-8114.2013.17.029 |
| [22] |
刘云国, 宋筱琛, 王欣, 等. 香根草对重金属镉的积累及耐性研究[J]. 湖南大学学报(自然科学版), 2010, 37(1): 75-79. LIU Yun-guo, SONG Xiao-chen, WANG Xin, et al. Study of the cadmium accumulation and tolerance of Vetiveria zizanioides[J]. Journal of Hunan University (Natural Sciences), 2010, 37(1): 75-79. |
| [23] |
Millaleo R, Reyes-Díaz M, Alberdi M, et al. Excess manganese differentially inhibits photosystem Ⅰ versus Ⅱ in Arabidopsis thaliana[J]. Journal of Experimental Botany, 2013, 64(1): 343-354. DOI:10.1093/jxb/ers339 |
| [24] |
Lidon F C, Barreiroc M G, Ramalhob J C. Manganese accumulation in rice:Implications for photosynthetic functioning[J]. Journal of Plant Physiology, 2004, 161: 1235-1244. DOI:10.1016/j.jplph.2004.02.003 |
| [25] |
Li P, Song A L, Li Z J, et al. Silicon ameliorates manganese toxicity by regulating both physiological processes and expression of genes associated with photosynthesis in rice(Oryza sativa L.)[J]. Plant and Soil, 2016, 397(1): 289-301. |
| [26] |
Badger M R, Von C S, Ruuska S, et al. Electron flow to oxygen in higher plants and algae:Rates and control of direct photoreduction (Mehler reaction)and rubisco oxygenase[J]. Philosophical Transactions of the Royal Society B:Biological Sciences, 2000, 355(1402): 1433-1446. DOI:10.1098/rstb.2000.0704 |
| [27] |
翁南燕, 周东美, 武敬, 等. 铜镉复合胁迫下温度对小麦幼苗生长及其对铜、镉和矿质营养元素吸收与各元素在亚细胞分布的影响[J]. 生态毒理学报, 2011, 6(6): 607-616. WENG Nan-yan, ZHOU Dong-mei, WU Jing, et al. Uptake, subcellular distributions of Cu, Cd and mineral elements, and plant growth for wheat seedlings under stress of Cu and Cd as affected by temperature[J]. Asian Journal of Ecotoxicology, 2011, 6(6): 607-616. |
| [28] |
李萍, 宋阿琳, 李兆君, 等. 硅对Mn胁迫下水稻吸收矿质元素的影响[J]. 环境科学学报, 2015, 35(10): 3390-3398. LI Ping, SONG A-lin, LI Zhao-jun, et al. Silicon-mediated mineral elements in rice(Oryza sativa L.)under excess manganese stress[J]. Acta Scientiae Circumstantiae, 2015, 35(10): 3390-3398. |
| [29] |
Pittman J K. Managing the manganese:Molecular mechanisms of manganese transport and homeostasis[J]. New Phytologist, 2005, 167(3): 733-742. DOI:10.1111/j.1469-8137.2005.01453.x |
 2019, Vol. 38
2019, Vol. 38