2. 江苏省水处理技术与材料协同创新中心, 江苏 无锡 214122
2. Jiangsu Cooperative Innovation Center of Technology and Material of Water Treatment, Wuxi 214122, China
近年来, 我国许多大型淡水湖泊和水库中蓝藻水华爆发频繁, 蓝藻细胞衰亡后会产生多种毒素[1]。其中, 微囊藻毒素(Microcystins, MCs)是出现频率最高、产量最大和危害最严重的一类藻毒素[2]。MCs通过灌溉等方式进入农田生态系统, 直接影响农作物生长和粮食生产。在灌溉水中, MCs浓度通常超过世界卫生组织(WHO)允许的标准值1 μg·L-1, 常见浓度范围为4~50 μg·L-1, 在蓝藻大量死亡的极端情况下甚至高达6500 μg·L-1[3]。近年来, 许多研究报道了MCs对陆地植物的影响, 包括抑制种子萌发、损害组织发育和降低作物产量[4-5], 涉及机理集中在抑制蛋白磷酸酶活性[6]、氧化应激和降低光合作用等方面[7]。本项目组前期研究表明低浓度MCs(1 μg·L-1)促进了水稻幼苗的生长, 与提高PSⅡ的光化学活性和光合电子传递及增加叶绿素含量有关。高浓度MCs(≥ 1000 μg·L-1)对水稻幼苗的生长造成不可逆伤害, 与膜脂过氧化和光合功能受损有关[8-10]。而植物中光合系统和抗氧化系统氧化与营养元素的吸收、分布和转运密切相关[11]。质膜H+-ATP酶是植物营养吸收的主宰酶, 通过水解ATP产生能量将H+泵出细胞, 在细胞膜两侧形成的质子驱动势, 为营养元素跨膜运输提供原初动力[12]。然而目前鲜有关于MCs对植物营养吸收的影响及其内在机制的报道。水稻作为第一大粮食作物, 其用水量大, 较其他作物更易受MCs污染的影响[13]。因此本研究以水稻为试材, 以质膜H+-ATP酶为切入点, 结合根系活力和ATP含量的变化, 探究MCs对植物营养吸收的影响。本文研究结果不仅为丰富MCs对植物的致毒机理提供新的佐证材料, 而且为减轻MCs对植物造成的伤害提供新的思考方向。
1 材料与方法 1.1 藻毒素的制备从无锡太湖打捞站取新鲜蓝藻, 将蓝藻烘干、制粉保存。称取1 g干燥的藻粉, 加入40 mL 5%的冰乙酸, 室温抽提2 h, 8000 r·min-1离心10 min, 沉淀用40 mL 5%冰乙酸继续抽提, 重复2次, 合并3次抽提的上清液, 调节pH为3.0, 离心去除杂质蛋白, 调节pH为7.0, 将粗提取液过Sep-pak C18柱固相萃取(500 mg· 6 mL-1, Waters corporation, 美国)。采用高效液相色谱法(Ultimate 3000, Dionex corporation, 美国)测定MCs的组成, 发现MC-LR、MC-RR和MC-YR有明显出峰, 且峰值稳定。采用酶联免疫法ELISA(Micro- cystins plate kit, Beacon Analytical Systems Inc, Saco, ME)测量粗提液中MCs的浓度[8]。
1.2 试材培养水稻(Oryza sativa)试验材料选择"淮稻8号"。选择籽粒饱满的水稻种子用HgCl2(0.1%, W/V)消毒10 min, 洗涤3次后在去离子水中浸泡8 h, 置于恒温培养箱(25℃)中催芽3 d。将幼芽置于蛭石中培养至两叶一心时转移至周转箱(6.88 L)中水培。营养液采用常规营养液配方, 其组分为150 mmol · L-1 (NH4)2SO4、24 mmol·L-1 KH2PO4、42 mmol·L-1 K2SO4、120 mmol·L-1 CaCl2·H2O、120 mmol·L-1 MgSO4·7H2O、60 mmol · L-1 Na2SiO3 · 9H2O、1.08 mmol · L-1 MnCl2 · 4H2O、2.4 mmol · L-1 H3BO3、2.40 mmol · L-1 Fe(Ⅲ)- EDTA, 46.82 μmol · L-1 Na2MoO4 · 2H2O、92.39 μmol · L-1 ZnSO4·7H2O、38.40 μmol·L-1 CuSO4·5H2O[14]。营养液每3 d更新一次。待幼苗长至4叶1心(此时已结束返青, 水稻生长旺盛, 是营养生长的关键时期)时, 进行MCs处理[15]。
1.3 试材处理将高浓度藻粉粗提液用营养液分别稀释成不同MCs浓度(1、10、100、1000 μg·L-1), 以不含MCs的营养液作为对照。将水稻幼苗在含有不同浓度MCs的营养液中连续培养7 d(胁迫期), 取样进行各指标的测定。将剩余水稻幼苗移至对照条件下培养7 d(恢复期), 再取样测定。
1.4 指标测定营养元素含量测定:用电感耦合等离子体发射光谱仪(Perkin Elmer Corp, Norwalk, CT, 美国)测定钾(K+)、钠(Na+)、钙(Ca2+)、镁(Mg2+)、铁(Fe2+)、锌(Zn2+)、铜(Cu2+)含量[16]。PO43-含量的测定用钼蓝比色法[17]; NH4+-N含量的测定采用靓酚蓝法[18]; NO3--N含量的测定采用水杨酸法[19]。根系活力采用氯化三苯基四氮唑(TTC)脱氢酶法[20]。ATP含量用高效液相色谱仪(Ultimate 3000, Dionex corporation, 美国)测定[17]。质膜H+-ATP酶活性的测定采用无机磷含量法[21]。于水稻幼苗根尖取样, 用Trizol试剂提取RNA, 以反转录合成的cDNA的第一链为模板, 进行PCR扩增循环。引物序列和扩增程序参照参考文献[17]。基因相对表达量采用2-ΔΔCT法进行计算。每个处理重复3次, 每次测定重复3次。
1.5 数据处理所有数据均为3次独立试验的平均值±标准差(Mean±SD)。试验数据采用SPSS 16.0和Origin 8.5软件进行统计分析和绘图, 不同字母表示差异显著(P < 0.05)
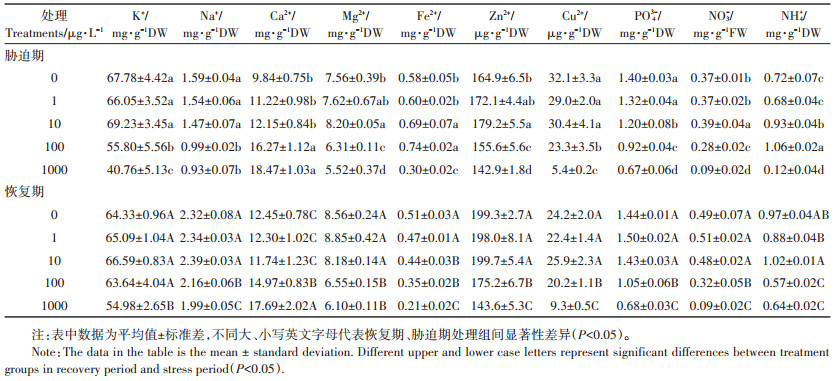
2 结果与讨论 2.1 MCs对水稻幼苗营养物质含量的影响矿质营养元素参与细胞的组成、酶的活化和调控生理过程[22]。如表 1所示, 胁迫7 d后, 1 μg·L-1 MCs组水稻幼苗中矿质营养(K+、Na+、Ca2+、Mg2+、Fe2+、Zn2+、Cu2+、PO43-、NO3-和NH4+)含量无显著变化。10 μg·L-1 MCs组水稻幼苗中Mg2+、Fe2+、Zn2+、NO3-和NH4+含量增加, PO43-含量降低。推测原因如下:10 μg·L-1 MCs增强了矿质元素跨膜运输的驱动; 植物中矿质元素的吸收与其转运通道及蛋白有关, 因此10 μg·L-1 MCs处理还可能通过影响Mg、Fe、Zn和N转运蛋白家族的表达来增强植物对MCs胁迫的适应性[23-24]。Mg2+、Fe2+和Zn2+是叶绿素生物合成和光合作用的必需元素[25], 10 μg·L-1 MCs胁迫下水稻中Mg2+、Fe2+和Zn2+含量的增加利于维持地上部光合作用以适应MCs胁迫。同时N元素的增加利于提高酶活性调节激素含量, 如生长素(IAA)和玉米素(ZT), 从而有助于调节水稻的生长[26]。由于植物中Fe、Zn与P存在竞争作用和拮抗作用[27-28], 该处理水稻中Fe2+、Zn2+含量的增加可能造成PO43-含量的降低。这些营养元素含量的变化是水稻幼苗对10 μg·L-1MCs胁迫的适应性机制之一。100 μg· L-1 MCs组水稻幼苗中K+、Na+、Mg2+、Zn2+、Cu2+、PO43-和NO3-的含量降低, Ca2+、Fe2+和NH4+含量增加, 造成营养元素失衡。Freitas等[29]用100 μg·L-1 MC-LR处理生菜, 10 d后发现叶中矿质元素(Mg、K、P、Mn、Fe、Zn、Cu和Mo)含量均降低。这表明MCs处理下植物中营养物质含量的变化并不一致, 可能与植物物种、发育阶段、毒素性质和暴露时间等有关。1000 μg·L-1 MCs组水稻幼苗中除Ca2+含量增加外, 其他元素含量均降低, 且降幅大于100 μg·L-1 MCs组。Ca作为植物信号传导的第二信使, 其含量的增加有助于与钙结合蛋白作用, 发挥Ca2+的传感器功能, 结合基因启动子中的顺式元件来调节植物对逆境的应激反应[30]。结合本项目组前期的报道[8-9], 高浓度MCs(100 μg · L-1和1000 μg·L-1)处理下矿质营养元素的失衡可能与水稻幼苗体内MCs的高积累有关, 是造成水稻幼苗光合作用和生物量积累受抑的又一重要原因。
|
|
表 1 MCs对水稻幼苗矿质营养含量的影响 Table 1 Effect of MCs on mineral element content of rice seedling |
恢复7 d后, 1 μg·L-1和10 μg·L-1 MCs组水稻幼苗中各矿质营养元素含量均在对照水平。100 μg·L-1 MCs组水稻幼苗中矿质元素含量较胁迫期有所恢复, 利于水稻生长的自我修复, 这与我们前期的研究相一致[8]。1000 μg·L-1 MCs组水稻幼苗中矿质元素含量较胁迫期恢复程度较小。由此表明, 解除MCs暴露后植物营养物质的恢复受MCs暴露浓度制约。
2.2 MCs对水稻幼苗根系活力的影响根系活力反映根系吸收水分和营养元素的能力[31]。如图 1所示, 胁迫7 d后, 1 μg·L-1 MCs组水稻幼苗根系活力增加, 这与我们前期研究结果相一致[8]。10 μg·L-1 MCs组水稻幼苗根系活力增加, 且增幅大于1 μg·L-1 MCs组, 推测此处理刺激了根系中物质的合成, 增强根系的代谢能力, 这可能是水稻幼苗对低浓度MCs胁迫的一种适应性机制。100 μg·L-1和1000 μg·L-1 MCs组根系活力显著降低, 且降低程度随着MCs浓度的增大而增强。此处理根系活力的降低可能与水稻根细胞功能受到破坏, 以及根表形貌和生长受到抑制有关[8], 进而不利于根系吸收水分和营养物质。
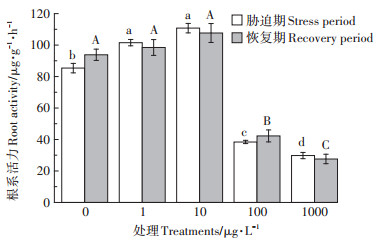
|
不同大、小写字母表示恢复期、胁迫期处理间差异显著(P<0.05)。下同 Different upper and lower case letters indicate significant difference among the treatments in recovery period and stress period(P<0.05). The same below 图 1 MCs对水稻幼苗根系活力的影响 Figure 1 Effect of MCs on root activity of rice seedling |
恢复7 d后, 1 μg·L-1和10 μg·L-1 MCs组水稻幼苗根系活力恢复至对照水平, 利于水稻营养吸收的正常进行。100 μg·L-1 MCs组水稻幼苗根系活力较胁迫期增加, 有利于水稻营养吸收能力的自我恢复。而1000 μg·L-1 MCs组根系活力低于对照且低于胁迫期, 表明高浓度MCs暴露对水稻幼苗根系功能造成了不可逆的伤害。
2.3 MCs对水稻幼苗根系ATP含量和质膜H+-ATP酶活性的影响质膜H+-ATPase通过水解ATP产生能量, 为营养物质跨膜运输提供电化学势梯度[12]。前期研究表明, 酸雨胁迫下植物营养元素的含量与质膜H+-ATPase的活性呈正相关关系[17]。如图 2所示, 胁迫7 d后, 1 μg·L-1 MCs组水稻根系ATP含量和质膜H+-ATPase活性无显著变化, 与该处理下营养元素无显著变化相一致。结合根系活力的变化, 表明1 μg·L-1 MCs处理下水稻中营养元素含量的变化可能主要受质膜H+- ATPase活性的调控。10 μg·L-1 MCs处理导致质膜H+-ATPase活性显著上升, 加快了ATP的水解, 泵出更多的H+增强电化学势梯度。陈颖等[32]发现, 在镉胁迫下龙葵通过调节质膜H+-ATPase活性改变体内N、P和K的含量, 从而起到对Cd胁迫的解毒作用。因此, 质膜H+-ATPase还可以通过调节营养元素(Mg2+、Fe2+、Zn2+和NO3-)的吸收来增强水稻幼苗对MCs胁迫的耐受性。100 μg·L-1与1000 μg·L-1 MCs处理导致ATP含量和质膜H+-ATPase活性显著降低, 且降低程度随着MCs浓度的增大而增强。推测高浓度MCs抑制了水稻根系中ATP的合成, 使质膜H+-ATPase活性降低, 泵运H+的功能受损, 不利于为矿质营养元素的跨膜运输提供能量[10]。
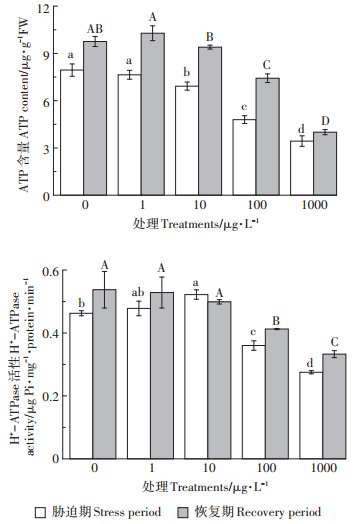
|
图 2 MCs对水稻幼苗根系ATP含量和质膜H+-ATPase活性的影响 Figure 2 Effect of MCs on the ATP content and the plasma membrane H+-ATPase activity in rice seedling roots |
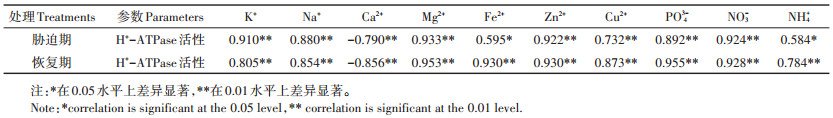
恢复7 d后, 10 μg·L-1 MCs组水稻根系质膜H+- ATPase活性和ATP含量恢复至对照水平, 是矿质营养元素恢复的又一重要原因。100 μg·L-1与1000 μg· L-1 MCs组H+-ATPase活性和ATP含量仍显著低于对照, 但较胁迫期有所增加, 其中1000 μg·L-1 MCs组较胁迫期增加程度较小。解除MCs暴露后植物营养吸收的恢复程度与MCs处理浓度、MCs积累量、不同生育期和不同器官等因素有关[33]。通过对矿质营养元素含量与质膜H+-ATPase活性进行相关性分析(表 2)发现, 在胁迫期和恢复期质膜H+-ATPase活性与Ca2+含量呈显著负相关, 与其他矿质元素均呈显著正相关。其中K+、Na+、Mg2+、Zn2+、PO43-、NO3-的吸收受质膜H+-ATP酶活性影响较大。上述结果表明, MCs胁迫导致的水稻幼苗中营养元素含量的变化受质膜H+- ATPase活性的调控。
|
|
表 2 水稻幼苗中矿质营养元素含量与质膜H+-ATPase活性的相关性 Table 2 Correlations between mineral element content and plasma membrane H+-ATPase activity in rice seedlings |
水稻中质膜H+-ATPase由多基因家族编码, 并且已鉴定出5个不同的亚家族Ⅰ(OSA1、2、3), Ⅱ(OSA5、7), Ⅲ(OSA9), Ⅳ(OSA4、6、10)和Ⅴ(OSA8)[34]。由图 3可知, 胁迫7 d后, 1 μg·L-1 MCs组水稻根系质膜H+- ATPase的编码基因OSA1、OSA3和OSA8的相对表达量虽显著上调, 但质膜H+-ATPase活性无变化。这可能由于质膜H+-ATPase的活性不仅与转录水平有关, 还受翻译和磷酸化修饰等过程的调控[35]。在正常条件下, 植物中亚家族Ⅰ(OSA1、2、3)和Ⅱ(OSA5、7)通常为高表达, Ⅲ(OSA9), Ⅳ(OSA4、6、10)和Ⅴ(OSA8)通常为低表达[36]。10 μg·L-1 MCs处理OSA1、OSA2、OSA3、OSA4、OSA6、OSA8、OSA9的相对表达显著上调, 这可能是水稻对MCs胁迫的一种适应性机制。结合该处理质膜H+-ATPase活性变化可知, 10 μg·L-1 MCs诱导亚家族Ⅰ(OSA1、2、3), Ⅲ(OSA9), Ⅳ(OSA4、6)和Ⅴ(OSA8)的表达上调可能是质膜H+- ATPase活性增加的原因。100 μg · L-1 MCs组除OSA2、OSA3和OSA9外, 其他基因的相对表达量均显著下调。结合质膜H+-ATPase活性降低可知, 亚家族Ⅰ(OSA1), Ⅱ(OSA5、7), Ⅳ(OSA4、6、10)和Ⅴ(OSA8)的表达下调可能是质膜H+-ATPase活性降低的原因。1000 μg·L-1 MCs组各基因的相对表达量均显著下调, 且下调幅度大于100 μg·L-1 MCs处理组, 与1000μg·L-1 MCs组质膜H+-ATPase活性低于100 μg·L-1 MCs组的结果相一致。结合之前的报道可知[9], MCs (100 μg·L-1和1000 μg·L-1)胁迫水稻根系质膜H+- ATP酶基因表达下调, 不利于质膜H+-ATP酶活性增加, 进而阻碍植物对矿质元素的吸收, 是高浓度MCs处理下水稻生物量下降的重要原因之一。
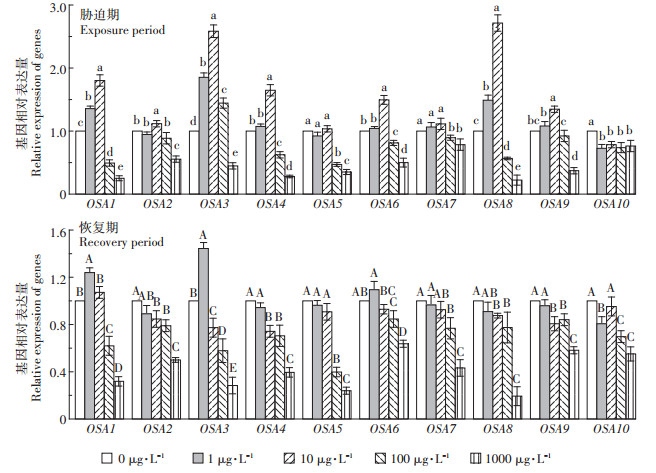
|
图 3 MCs对水稻幼苗根系质膜H+-ATPase基因表达的影响 Figure 3 Effect of MCs on the expression levels of genes encoding plasma membrane H+-ATPase in rice seedling roots |
恢复7 d后, 1 μg·L-1 MCs组水稻根系中OSA1和OSA3相对表达量仍高于对照而低于胁迫期, OSA10相对表达量仍低于对照组。10 μg·L-1 MCs处理组OSA2、OSA3、OSA4、OSA8和OSA9的相对表达量显著低于对照且低于胁迫期, 其他基因表达恢复至对照水平, 利于调节根系质膜H+-ATPase活性的自我恢复。100 μg · L-1 MCs组OSA1、OSA4、OSA5、OSA6和OSA8相对表达量较胁迫期增加, 与质膜H+-ATPase活性较胁迫期增加一致。1000 μg· L-1 MCs OSA1、OSA4、OSA6相对表达量较胁迫期增加, 而OSA3、OSA5、OSA7和OSA10相对表达量低于胁迫期。推测高浓度MCs损伤了质膜H+-ATPase的构象和功能[17], 对编码H+-ATPase的基因转录水平造成了不可逆的抑制, 进而不利于质膜H+-ATPase活性的增加。通过对比质膜H+-ATPase基因表达和质膜H+-ATPase活性的一致性, 发现亚家族Ⅰ(OSA1), Ⅳ(OSA4、6)和Ⅴ(OSA8)能较好地响应MCs胁迫, 对调控质膜H+-ATPase活性的变化具有重要作用。
3 结论(1) 低浓度MCs(1 μg·L-1)对水稻幼苗质膜H+- ATPase和矿质营养含量无影响。10 μg·L-1 MCs处理组质膜H+-ATPase基因表达的上调有益于质膜H+- ATPase活性上升, 促进水稻对矿质营养的吸收, 增强了水稻幼苗对MCs胁迫的适应性, 经7 d后恢复至对照水平。
(2) 高浓度MCs(100 μg·L-1和1000 μg·L-1)处理组通过下调质膜H+-ATPase基因表达量来降低质膜H+-ATPase活性, 阻碍了水稻对矿质元素的吸收。恢复7 d后100 μg·L-1 MCs组各项指标优于胁迫期, 而1000 μg·L-1 MCs对水稻根系营养吸收造成不可逆伤害。表明恢复效果与MCs浓度有关。
(3) MCs胁迫下质膜H+-ATPase活性变化调节了根系对营养元素的吸收, 进而增强了植物对MCs胁迫的适应性。
| [1] |
Hu L, Shan K, Lin L, et al. Multi-year assessment of toxic genotypes and microcystin concentration in northern lake Taihu, China[J]. Toxins, 2016, 8(1): 1-14. DOI:10.3923/rjt.2016.1.7 |
| [2] |
乐亚玲, 刘利平. 微囊藻毒素毒理学的研究进展[J]. 环境与健康杂志, 2011, 28(6): 553-556. YUE Ya-ling, LIU Li-ping. Progress on toxicological studies on Microcystins[J]. Journal of Environment and Health, 2011, 28(6): 553-556. |
| [3] |
Machado J, Campos A, Vasconcelos V, et al. Effects of microcystin-LR and cylindrospermopsin on plant-soil systems:A review of their relevance for agricultural plant quality and public health[J]. Environmental Research, 2017, 153: 191-204. DOI:10.1016/j.envres.2016.09.015 |
| [4] |
Corbel S, Mougin C, Martin-Laurent F, et al. Evaluation of phytotoxicity and ecotoxicity potentials of a cyanobacterial extract containing microcystins under realistic environmental concentrations and in a soilplant system[J]. Chemosphere, 2015, 128: 332-340. DOI:10.1016/j.chemosphere.2015.02.008 |
| [5] |
El Khalloufi F, El Ghazali I, Saqrane S, et al. Phytotoxic effects of a natural bloom extract containing microcystins on Lycopersicon esculentum[J]. Ecotoxicology and Environmental Safety, 2012, 79: 199-205. DOI:10.1016/j.ecoenv.2012.01.002 |
| [6] |
Garda T, Kónya Z, Tándor I, et al. Microcystin-LR induces mitotic spindle assembly disorders in Vicia faba by protein phosphatase inhibition and not reactive oxygen species induction[J]. Journal of Plant Physiology, 2016, 199: 1-11. DOI:10.1016/j.jplph.2016.04.009 |
| [7] |
Wang Z, Zhang J, Li E, et al. Combined toxic effects and mechanisms of microsystin-LR and copper on Vallisneria Natans(Lour.)Hara seedlings[J]. Journal of Hazardous Materials, 2017, 328: 108-116. DOI:10.1016/j.jhazmat.2016.12.059 |
| [8] |
王娓敏, 邓玙, 邹华, 等. 微囊藻毒素对水稻根系生长和抗氧化系统的影响[J]. 环境科学, 2014, 35(4): 1468-1472. WANG Wei-min, DENG Yu, ZOU Hua, et al. Effects of microcystins on growth and antioxidant system of rice roots[J]. Environmental Science, 2014, 35(4): 1468-1472. |
| [9] |
Liang C, Wang W. Response and recovery of rice(Oryza sativa)seedlings to irrigation with microcystin-contaminated water[J]. Environmental Earth Sciences, 2015, 73(8): 4573-4580. DOI:10.1007/s12665-014-3746-z |
| [10] |
Liang C, Ge Y, Su L, et al. Response of plasma membrane H+-ATPase in rice(Oryza sativa)seedlings to simulated acid rain[J]. Environment Science and Pollution Research, 2015, 22(1): 535-545. DOI:10.1007/s11356-014-3389-3 |
| [11] |
Gutiérrez-Praena D, Campos A, Azevedo J, et al. Exposure of Lycopersicon esculentum to microcystin-LR:Effects in the leaf proteome and toxin translocation from water to leaves and fruits[J]. Toxins, 2014, 6(6): 1837-1854. DOI:10.3390/toxins6061837 |
| [12] |
Palmgren M G. Plant plasma membrane H+-ATPases:Powerhouses for nutrient uptake[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 2001, 52: 817-845. DOI:10.1146/annurev.arplant.52.1.817 |
| [13] |
FAOSTAT. Food and Agriculture Organization of the United Nations URL.[EB/OL] [2010-9-7]. http://www.fao.org/faostat/en/.
|
| [14] |
Zhu Y, Di T, Xu G, et al. Adaptation of plasma membrane H+-ATPase of rice roots to low pH as related to ammonium nutrition[J]. Plant Cell and Environment, 2009, 32(10): 1428-1440. DOI:10.1111/j.1365-3040.2009.02009.x |
| [15] |
王传凯, 牛建行. 移栽期对水稻不同生育期生长发育规律和产量的影响[J]. 华北农学报, 2018, 33(4): 157-163. WANG Chuan-kai, NIU Jian-hang. Effect of transplanting period on growth and yield of rice at different growth stages[J]. Acta Agriculturae Boreali-Sinica, 2018, 33(4): 157-163. |
| [16] |
Pinto E, Almeida A, Aguiar A, et al. Changes in macrominerals, trace elements and pigments content during lettuce(Lactuca sativa L.) growth:Influence of soil composition[J]. Food Chemistry, 2014, 152(2): 603-611. |
| [17] |
Zhang B, Bu J, Liang C. Regulation of nitrogen and phosphorus absorption by plasma membrane H+-ATPase in rice roots under simulated acid rain[J]. International Journal of Environmental Science and Technology, 2017, 14(1): 101-112. DOI:10.1007/s13762-016-1125-x |
| [18] |
吕伟仙, 葛滢, 吴建之, 等. 植物中硝态氮、氨态氮、总氮测定方法的比较研究[J]. 光谱学与光谱分析, 2004, 24(2): 204-206. LÜ Wei-xian, GE Ying, WU Jian-zhi, et al. Study on the method for the determination of nitric nitrogen, ammoniacal nitrogen and total nitrogen in plant[J]. Spectroscopy and Spectral Analysis, 2004, 24(2): 204-206. DOI:10.3321/j.issn:1000-0593.2004.02.023 |
| [19] |
于立红.蔬菜中硝态氮速测方法及硝酸盐污染评价的研究[D].长春: 吉林农业大学, 2005. YU Li-hong. Study on fast determination method of nitrate nirtogen and nitrate pollution evaluate in vegetable[D]. Changchun: Jilin Agricultural University, 2005. |
| [20] |
张蜀秋, 韩玉珍, 李云. 植物生理学实验技术教程[M]. 北京: 科学出版社, 2011. ZHANG Shu-qiu, HAN Yu-zhen, LI Yun. Course on experimental technology of plant physiology[M]. Beijing: Science Press, 2011. |
| [21] |
狄廷均, 朱毅勇, 仇美华, 等. 水稻根系细胞膜H+-ATPase对铵硝营养的响应差异[J]. 中国水稻科学, 2007, 21(4): 360-366. DI Ting-jun, ZHU Yi-yong, QIU Mei-hua, et al. Response of plasma membrane H+-ATPase of rice root to ammonium and nitrate nutrition[J]. Chinese Journal of Rice Science, 2007, 21(4): 360-366. DOI:10.3321/j.issn:1001-7216.2007.04.006 |
| [22] |
Etienne P, Diquelou S, Prudent M, et al. Macro and micronutrient storage in plants and their remobilization when facing scarcity:The case of drought[J]. Agriculture-Basel, 2018, 8(1): 1-17. |
| [23] |
陈迪, 潘伟槐, 周哉材, 等. 植物营养元素运输载体的功能及其调控机制研究进展[J]. 浙江大学学报(农业与生命科学版), 2018, 44(3): 283-293. CHEN Di, PAN Wei-huai, ZHOU Zai-cai, et al. Research progresses on functional roles and regulation mechanisms of nutrient element transporters in plants[J]. Journal of Zhejiang University(Agriculture and Life Sciences), 2018, 44(3): 283-293. |
| [24] |
张标金, 张祥喜, 罗林广. 与植物镉吸收转运相关的主要基因家族[J]. 基因组学与应用生物学, 2013, 32(1): 127-134. ZHANG Biao-jin, ZHANG Xiang-xi, LUO Lin-guang. The major gene families related to cadmium absorption and transportation in plants[J]. Genomics and Applied Biology, 2013, 32(1): 127-134. |
| [25] |
叶小齐.不同光照水平下植物对氮、镁元素的差异性吸收和利用[D].重庆: 西南师范大学, 2005. YE Xiao -qi. Differential absorption and utilization of nitrogen and magnesium by plants under different light irradiation levels[D]. Chongqing: Southwestern Normal University, 2005. |
| [26] |
宁倩. IAA对水稻苗期生理特性和N、P养分吸收利用的影响[D].西安: 西安建筑科技大学, 2013. NING Qian. Effect of IAA on physiological characteristics and N, P absorption and utilization in rice seedling[D]. Xi'an: Xi'an University of Architecture and Technology, 2013. |
| [27] |
Bouain N, Shahzad Z, Rouached A, et al. Phosphate and zinc transport and signalling in plants:Toward a better understanding of their homeostasis interaction[J]. Journal of Experimental Botany, 2014, 65(20): 5725-5741. DOI:10.1093/jxb/eru314 |
| [28] |
都韶婷. 不同供磷水平对饭豆体内铁有效性的影响[J]. 植物营养与肥料学报, 2010, 16(1): 247-251. DU Shao-ting. Effect of phosphorus supply on iron efficiency in rice bean(Vigna umbellata)[J]. Journal of Plant Nutrition and Fertilizer, 2010, 16(1): 247-251. |
| [29] |
Freitas M, Azevedo J, Pinto E, et al. Effects of microcystin-LR, cylindrospermopsin and a microcystin-LR/cylindrospermopsin mixture on growth, oxidative stress and mineral content in lettuce plants(Lactuca sativa L.)[J]. Ecotoxicology and Environmental Safety, 2015, 116: 59-67. DOI:10.1016/j.ecoenv.2015.02.002 |
| [30] |
Verma V, Ravindran P, Kumar P P. Plant hormone-mediated regulation of stress responses[J]. BMC Plant Biology, 2016, 16(1): 1-10. DOI:10.1186/s12870-015-0700-5 |
| [31] |
段九菊, 郭世荣, 康云艳, 等. 盐胁迫对黄瓜幼苗根系生长和多胺代谢的影响[J]. 应用生态学报, 2008, 19(1): 57-64. DUAN Jiu-ju, GUO Shi-rong, KANG Yun-yan, et al. Effects of salt stress on cucumber seedlings root growth and polyamine metabolism[J]. Chinese Journal of Applied Ecology, 2008, 19(1): 57-64. |
| [32] |
陈颖, 刘柿良, 杨容孑, 等. 镉胁迫对龙葵生长、质膜ATP酶活性及氮磷钾吸收的影响[J]. 应用与环境生物学报, 2015, 21(1): 121-128. CHEN Ying, LIU Shi-liang, YANG Rong-jie, et al. Effects of cadmium on growth, plasma membrane ATPase activity, and absorption of N, P and K in Solanum nigrum L. seedlings[J]. Chinese Journal of Applied and Environmental Biology, 2015, 21(1): 121-128. |
| [33] |
王娓敏.微囊藻毒素对不同生育期水稻生长和光合的影响[D].无锡: 江南大学, 2014. WANG Wei-min. Effects of microcystins on growth and photosynthesis in rice at different stages[D]. Wuxi: Jiangnan University, 2014. |
| [34] |
Michelet B, Boutry M. The plasma-membrane H+-ATPase(a highly regulated enzyme with multiple physiological functions)[J]. Plant Physiology, 1995, 108(1): 1-6. DOI:10.1104/pp.108.1.1 |
| [35] |
Kabala K, Janicka-Russak M, Klobus G. Different responses of tonoplast proton pumps in cucumber roots to cadmium and copper[J]. Journal of Plant Physiology, 2010, 167(16): 1328-1335. DOI:10.1016/j.jplph.2010.03.020 |
| [36] |
Arango M, Gévaudant F, Oufattole M, et al. The plasma membrane proton pump ATPase:The significance of gene subfamilies[J]. Planta, 2003, 216(3): 355-365. |
 2019, Vol. 38
2019, Vol. 38