2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
抗生素是一类近些年来被大量报道的新兴污染物, 其可在低浓度下有效地杀灭病原菌, 被广泛用于临床医疗、水产养殖和畜禽饲养中。常见抗生素包括磺胺类(SAs)、四环素类(TCs)、喹诺酮类(QNs)、大环内酯类(MLs)等[1], 其中四环素类抗生素因其价格低廉而在世界范围内被大量使用, 且在农田、园地以及饲养场附近土壤中TCs的检出率和含量均较高[2-3]。这些抗生素通过各种途径进入到土壤环境中并在其中积累, 对环境造成一系列危害并最终威胁到人体健康[4]。
塑料制品被广泛应用于人类的生产和生活中, 据报道2017年全球塑料的生产量达到了3.48亿t·a-1[5]。然而, 越来越多的塑料垃圾被排放到环境中, 由于难降解导致其在环境中长期残留, 并进一步被风化裂解成比表面积更大且不易观察的微塑料颗粒(< 5 mm)。常见的微塑料类型包括聚乙烯、聚丙烯、聚苯乙烯、聚氯乙烯、聚酰胺等, 这些微塑料分布在空气[6]、土壤[7]、水体[8]和饮用水[9]中。目前微塑料在水体环境中的研究已得到普遍的关注, 而土壤中微塑料污染的研究和风险防范才刚刚起步[10]。有学者指出, 陆地中微塑料丰度可能是海洋中的4~23倍, 农田每年输入的微塑料的量远超过全球海洋[11]。
微塑料在环境中不仅会释放自身的添加剂(如塑化剂等), 而且还可能会吸附污染物。Van Sebille等[12]通过调查美国加利福尼亚圣迭戈沙滩上的塑料碎片发现发泡型聚苯乙烯中多环芳烃浓度达到300~1900 ng·g-1, 而另一项针对葡萄牙海岸沙滩上收集的树脂颗粒的研究在树脂颗粒上检测到了多环芳烃(53~ 44 800 ng·g-1)、多氯联苯(2~223 ng·g-1)等有机污染物[13]。进一步的研究也表明微塑料可作为污染物和致病菌的载体而使污染物更容易进入到动物和人体中造成危害[14]。Laganà等[15]曾研究发现微塑料可作为多种抗生素耐药性传播的载体, 微塑料的表面会定殖很多耐药细菌。微塑料对污染物的吸附行为是影响其环境行为和生物毒性的关键因素。当前对于微塑料吸附抗生素的研究以TCs为主, 包括四环素(TC)和土霉素(OTC)[16-17], 但主要是针对海水环境, 而海水与土壤或土壤溶液在化学组成上存在很大差异。Xu等[16]在研究不同环境因素对微塑料吸附抗生素的影响研究中设置的溶解性有机碳最高浓度仅为20 mg· L-1, 这一浓度明显低于实际土壤溶液中80 mg·L-1的浓度[18-19]。此外在海水环境的研究中一般仅考虑了钠离子不同浓度的影响, 而未研究土壤环境中常见的钙镁离子对微塑料吸附抗生素的影响[16-17]。因此, 有必要对不同土壤环境因素(pH、Ca2+、Mg2+和可溶性有机物等)影响下微塑料对抗生素的吸附行为开展研究。
本研究选用三种在环境中常见[5]并在吸附试验中广泛应用的塑料[聚乙烯(PE)、聚苯乙烯(PS)和聚酰胺(PA)] [20-21]为供试材料。以四环素(TC)为目标抗生素, 通过批平衡试验研究不同pH、不同浓度的钙镁离子和可溶性有机物对微塑料吸附TC的影响。该研究有助于更好地了解微塑料对TC的吸附行为, 为进一步研究微塑料作为抗生素载体对土壤环境和生物可能带来的潜在危害奠定基础。
1 材料与方法 1.1 试验材料选用3种不同类型的微塑料颗粒, 分别是聚酰胺(PA)、聚乙烯(PE)和聚苯乙烯(PS), 其中PA购买自阿拉丁生化科技股份有限公司, PE和PS购买自苏州程鑫喆塑化有限公司。四环素盐酸盐(Sigma公司)纯度98%, -20℃保存。试验中所使用的叠氮化钠为分析纯, 乙腈是色谱纯, 其他化学试剂都是优级纯且都使用Milli-Q纯水机(Millipore Ltd., USA)制备的超纯水配制溶液。为去除微塑料表面可能存在的杂质, 使用前将微塑料放入烧杯中, 加入超纯水搅拌并超声10 mins, 重复3次, 50℃烘干待用。所有的容器在10%的硝酸中浸泡24 h后用去离子水洗净烘干备用。
1.2 吸附试验方法 1.2.1 吸附等温线称取适量的四环素盐酸盐溶于超纯水中, 配制成100 mg·L-1的四环素储备液, 避光放入4℃冰箱保存现配现用, 储备液和稀释液中同时含有10 mmol·L-1的氯化钠作为电解质以及0.02%的叠氮化钠(消除微生物对TC降解的干扰)。添加不同体积的储备液和稀释液配制成不同浓度的四环素溶液, 调节pH值到6, 试验设置6个四环素浓度梯度(0.2、0.5、0.8、1、2、5 mg·L-1)。准确称取0.100 g微塑料, 置于棕色玻璃瓶中, 加入不同处理的四环素溶液25 mL。将玻璃瓶置于避光的振荡箱中, 在25℃下设定转速200 r·min-1, 往复振荡24 h[16-17]。振荡后用0.22 μm滤膜过滤待测。试验设置对照组和空白组, 对照组只含有四环素溶液而不含微塑料; 空白组只含有微塑料, 加入等量的超纯水, 每处理3个平行。
1.2.2 不同环境因素对微塑料吸附抗生素的影响(1) 不同pH值条件下微塑料对四环素的吸附:设置的pH值分别为4、5、6、7、8、9。溶液分别用HCl和NaOH调节pH, 四环素浓度为1 mg·L-1, 其他操作同1.2.1。
(2) 不同浓度阳离子对微塑料吸附四环素的影响:选用Ca2+和Mg2+这两种常见的阳离子, 参照土壤溶液中Ca2+和Mg2+的实际浓度[22], 分别用CaCl2和MgCl2配制成浓度为0.1、1、10 mmol·L-1的含1 mg·L-1四环素溶液。试验前将pH值都调节到6, 其他操作同1.2.1。
(3) 不同浓度富里酸对微塑料吸附四环素的影响:试验参照真实土壤中可溶性有机物的含量[18-19], 设置了6个不同浓度的富里酸溶液(0、0.1、1、10、50、100 mg·L-1)。试验前将pH值都调节到6, 其他操作同1.2.1。
1.3 分析方法采用扫描电子显微镜(SEM, Hitachi S-4800, Ja- pan)对微塑料的形貌进行观测; 使用全自动气体吸附分析仪Autosorb-iQ(Quantachrome Instruments, USA)对微塑料的比表面积进行测定(氮气吸附-脱附法); 微塑料的ζ电位(pH=6)通过纳米粒度电位仪(Zeta- sizer Nano ZS90, Malvern Instruments Ltd., UK)来进行测定。溶液中抗生素的浓度使用高效液相色谱(Agi- lent HPLC 1260, USA)测定, 分析条件为流动相A (20%乙腈), 流动相B(80% 10 mmol·L-1草酸), 进样量20 μL, 柱温20℃, 流速为0.8 mL·min-1, 检测波长365 nm。
数据的整理分析和作图使用Excel 2010(Micro- soft, USA)和Origin 2017(OriginLab, USA)。
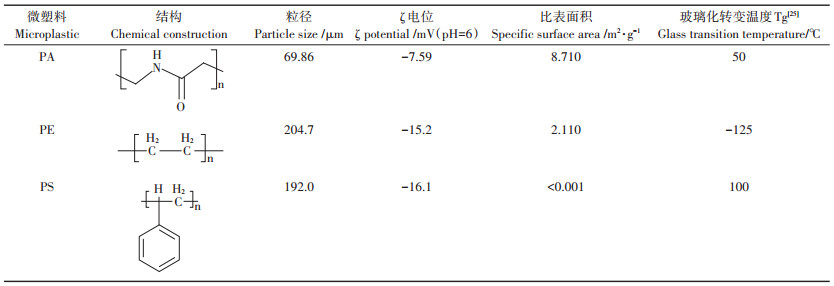
2 结果与讨论 2.1 微塑料形貌及表征微塑料的微观形貌和基本性质如图 1和表 1所示。选用的微塑料粒径均小于250 μm的塑料微粒。从微塑料的形貌来看, PA与其他塑料颗粒相比具有更多的微孔, 而PE表面有很多褶皱, PS表面仅有少量裂纹和凹陷。化学结构式显示出PA含有酰胺基, PS具有苯环结构。

|
图 1 三种微塑料的扫描电镜图(a、b:PA; c、d:PE; e、f:PS) Figure 1 Scanning electron microscopy(SEM)of three types of microplastics(a, b:PA; c, d:PE; e, f:PS) |
|
|
表 1 不同种类微塑料的基本性质 Table 1 Basic properties of different types of microplastics |
比表面积数据表明, PA的比表面积(8.71 m2·g-1)远大于另外两种微塑料, 这可能与其粒径较小、表面有很多的微孔有关; PE比表面积为2.11 m2·g-1, PS的比表面积最小(< 0.001 m2·g-1)。尽管PE和PS的粒径差异不大, 但PE的比表面积明显大于PS, 这可能与PE表面存在明显的褶皱和孔洞有关。Wang等[23]研究了PE、PS和PVC这三种微塑料对芘的吸附, 所使用的塑料微粒的比表面积分别是6.91、2.35、1.87 m2·g-1。Xu等[16]在研究三种不同微塑料对四环素吸附时选择了PE、PS和PP, 它们的比表面积分别是0.234、0.059、0.036 m2·g-1。不同文献使用的塑料颗粒比表面积差别很大, 这可能与塑料的生产过程及用途有密切关系。这些微塑料的理化性质会影响其吸附行为[24]。不同微塑料在pH为6时的ζ电位也存在明显差异, 其中PA的ζ电位绝对值要小于PE和PS, 仅为7.59 mV。Xu等[16]在研究3种不同微塑料对四环素吸附时选择了PE、PS和PP, ζ电位随着pH的升高不断降低, 且在pH为6时, 三种塑料微粒的ζ电位均低于-30 mV。
玻璃化转变温度(Tg)反映的是聚合物分子从冻结到运动的一个转变温度, 在该温度以下聚合物属于玻璃态, 而在该温度以上分子链开始运动, 表现出像橡胶一样的高弹性。表 1数据表明PE的Tg值为-125℃, 而PA和PS分别为50℃和100℃[25]。PE属于橡胶态聚合物, 而PS、PA都属于玻璃态聚合物。
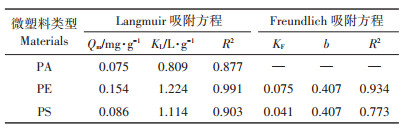
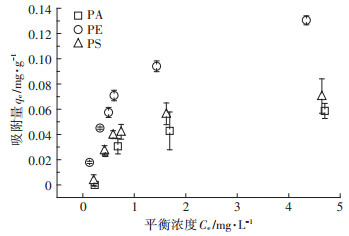
2.2 不同微塑料对四环素的吸附三种微塑料对四环素的吸附等温线如图 2所示。从图中可以看出, 随着浓度的增加, 吸附逐渐达到饱和, 使用Langmuir和Freundlich吸附等温方程进行拟合(表 2), 在这三种微塑料中, PE的吸附能力最强, 由Langmuir方程拟合出的最大吸附量达到了0.154 mg· g-1。PA和PS的最大吸附量相近, 分别为0.075、0.086 mg·g-1。三种微塑料对TC的吸附更符合Langmuir吸附等温线, 表明这三种微塑料对极性有机分子四环素的吸附以单层饱和吸附为主。这也与Xu等[16]关于PE、PS、PP对四环素吸附的研究相一致。
|
图 2 四环素在三种微塑料上的吸附等温线(pH=6, 温度298 K) Figure 2 The adsorption isotherms of tetracycline on three types of microplastics(pH=6, temperature 298 K) |
|
|
表 2 Langmuir和Freundlich吸附拟合参数 Table 2 Langmuir and Freundlich adsorption fitting parameters |
微塑料的吸附行为与很多因素有关, 微塑料本身的性质和吸附质的性质等都会影响其吸附行为。PE的玻璃化转变温度较低, 在常温下呈橡胶态。而PA、PS的玻璃化转变温度较高, 常温下呈玻璃态, 有机物容易以分配作用吸附在PE上[26]。吸附质的亲疏水性和极性会影响微塑料的吸附[27]。四环素含有多个极性官能团, 包括氨基、羧基、苯环等, 有三个水解常数, 分别为pKa1=3.3、pKa2=7.7、pKa3=9.3, 通过pKa值可以模拟出其在不同pH溶液中的存在状态。Xu等[16]研究了在pH为6.8条件下, 微塑料对四环素的吸附能力由强到弱依次是PS、PP和PE。这与本研究发现的规律不同, 可能的原因是在pH为6.8时, 有部分四环素为阴离子, 此时微塑料的ζ电位也比pH为6的时候低, 两者间的静电斥力会影响PE的吸附, PE的表面会存在范德华力, 而PS不仅有范德华力还有π-π键的相互作用。微塑料的极性也会影响其吸附, Wang等[28]在之前的研究中发现, 对于非极性有机污染物全氟辛基磺酰胺(FOSA)的吸附, 微塑料吸附能力强弱的顺序为PE>PVC>PS。这和微塑料的固有结构有关, PE为非极性塑料, PVC和PS因含有氯离子和苯环而造成极性的改变。由此可见, 微塑料在环境中对有机污染物的吸附是复杂的过程, 受到很多因素的影响。
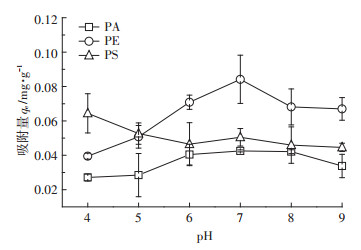
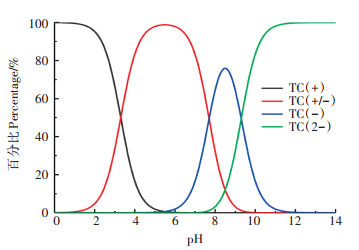
2.3 不同pH条件下微塑料对四环素的吸附pH对微塑料吸附四环素的影响如图 3所示。随着pH增加, PE的吸附量也在增加, 在pH为7时吸附量最大, 达到0.084±0.014 mg·g-1; PS的吸附量随着pH的增加而降低, 在pH为4时最大, 达到0.064± 0.011 mg·g-1。pH的变化对PA吸附TC影响不大, 中性条件更有利于其吸附。在不同pH值条件下, 四环素的存在状态也不相同(如图 4), pH为3.3时, 溶液中四环素中性离子和阳离子各占一半, 随着pH值的升高, 以阳离子存在的四环素所占比例渐渐减少, 在pH为6附近完全转变为中性离子并开始出现阴离子; 当pH在4~7时, 四环素以中性离子为主; 当pH>7.7时, 四环素主要以阴离子形式存在。
|
图 3 不同pH条件下微塑料对TC的吸附 Figure 3 Adsorption of TC on microplastics at different pH values |
|
图 4 不同pH条件下TC的存在状态 Figure 4 The existence of TC under different pH conditions |
pH同时会对四环素和微塑料的表面电荷产生影响。前人的研究发现, 微塑料的PZC(零电荷点)在pH 4~5, 在pH为4时微塑料表面带正电荷, 而当pH为5时, 表面带负电荷, 且会随着pH的增加而带有更多的负电荷[16, 29]。静电吸附和橡胶态聚合物的特征可能是PE吸附四环素的主要原因。在酸性条件下, 部分四环素是阳离子形态, 会与溶液中的H+竞争PE表面的吸附位点; 在pH为7时, 没有H+对吸附产生影响而使PE吸附量达到最大; 而当pH在7~9的时候, 四环素中性离子变少, 随着pH值的增大, 阴离子状态的四环素逐渐增多, 此时PE也是表面带负电荷, 相互之间产生静电斥力而减小吸附。而PS微塑料对四环素的吸附可能是疏水性作用力、分子间作用力和静电力共同作用的结果, 在pH为4时, H+和部分四环素带有的正电荷会产生排斥力而阻止四环素在微塑料上的吸附, 微塑料对四环素的吸附以疏水性作用力和分子间作用力为主(如范德华力和氢键等)。此时由于PS具有苯环结构, π-π键的相互作用会使PS与其他微塑料相比吸附更多的四环素。当pH为5~6时微塑料表面带负电荷并且会随着pH值的增大负电荷越多, 此时的四环素绝大部分是中性离子, 表面的基团随着pH的增加接受质子的能力减弱, 使吸附量降低[30]。当pH在7~9时, 此时的溶液中只有中性和阴离子型四环素, 静电斥力会影响PS吸附四环素。Xu等[16]研究发现PS对四环素的吸附在pH为6时吸附量最大, 说明在其研究的微塑料吸附过程中疏水性作用占主导, 这可能与材料本身的性质有关系, 比表面积较小, ζ电位较大。PA由于含有酰胺基键, pH值变化时, 分子链端基上的酰胺基会中和掉一部分的H+或者OH-, 从而减小pH对其吸附的影响, 也可能是因为PA的ζ电位较小, 分子间作用力和疏水性作用力大于静电作用力。此外, 微塑料表面极性官能团浓度也会影响其吸附作用。Zhang等[31]在研究微塑料对土霉素的吸附时发现, 对于原始EPS微塑料, pH对其吸附的影响不大, 氢键的作用可能在吸附中占主导, 而表面风化后的塑料表面含有更多的极性官能团, 而导致在pH为5~6时吸附量最大。
2.4 不同浓度钙镁离子对微塑料吸附四环素的影响由于pH在6时四环素主要以两性离子形式存在, 因此环境中的阳离子也会影响到微塑料对四环素的吸附行为。Ca2+和Mg2+是土壤环境中最常见的两种阳离子, 它们对微塑料吸附四环素的影响如图 5所示。Ca2+和Mg2+的浓度越高, 三种微塑料对四环素的吸附量则越低, 且Ca2+和Mg2+两者之间的差异不明显。这结果和以往的研究类似, Zhang等[31]在研究Ca2+和Na+对发泡聚苯乙烯(EPS)吸附土霉素的影响时, 发现随着Ca2+浓度的增加, EPS对土霉素的吸附逐渐减少。通常情况下, 金属阳离子会直接竞争微塑料表面的吸附位点从而减弱四环素在微塑料表面的吸附。此外二价金属阳离子会通过阳离子架桥作用, 形成四环素-金属离子-微塑料的复合物, 间接将四环素和微塑料连接[32]。但由于Ca2+和Mg2+水化离子半径较大, 阳离子架桥作用较弱[33], 并不会增加微塑料对四环素的吸附, 因此主要以钙镁离子和四环素在微塑料表面的竞争吸附为主。二价金属阳离子和一价金属阳离子的竞争吸附也存在明显差异。Shen等[34]和Xu等[16]在研究不同浓度NaCl溶液对微塑料吸附四环素影响时发现, 随着浓度增大, 微塑料的吸附能力基本没有改变, 这可能是因为Na+是一价阳离子, 静电力较弱而对吸附影响较小。

|
图 5 不同钙镁离子对微塑料吸附四环素的影响 Figure 5 Effects of different concentrations of calcium and magnesium ions on microplastics adsorption of tetracycline |
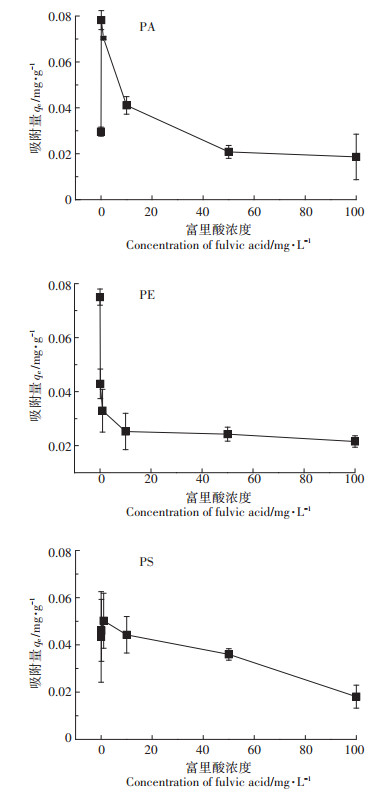
富里酸是一种既可溶于酸又可溶于碱的复合有机物质, 属于可溶性有机物一种, 是土壤腐殖质的核心成分, 其结构中含有大量酚羟基、羰基等基团, 研究其微塑料吸附四环素的影响将有助于了解土壤环境中存在的复杂可溶性有机物质对微塑料吸附污染物的影响。如图 6所示, 随着富里酸浓度的增加, PE对四环素的吸附量在逐渐减少, 而PA和PS对四环素的吸附先增加后减少。在pH为6时, 四环素都是中性离子, 少量的富里酸(< 1 mg·L-1)可能会先通过PA和PS所产生的分子间作用力(氢键和π-π键的作用)吸附在微塑料表面, 同时富里酸也会吸附四环素, 起到桥梁的作用[35]。随着富里酸的不断增多, 四环素和溶液中的富里酸通过羧基络合以及氢键作用与微塑料竞争, 从而减少四环素吸附在微塑料上[36]。Xu等[16]的研究也表明PE对四环素的吸附量会随着富里酸浓度(0~20 mg·L-1)的增大而减小。而土壤环境中存在更高浓度的富里酸, 这将会进一步减少吸附于微塑料表面的抗生素。Zhao等[33]研究发现随着胡敏酸浓度的增加, 微塑料对四环素的吸附不断降低, 这可能是因为胡敏酸含有大量的官能团, 这些官能团覆盖在微塑料表面改变其亲疏水性和比表面积, 从而影响吸附。
|
图 6 不同浓度富里酸对微塑料吸附四环素的影响 Figure 6 Effects of fulvic acid at different concentrations on adsorption of tetracycline on microplastics |
(1) 在pH为6时, 对四环素的吸附量最大的微塑料是PE, 其次是PS和PA。PA、PE和PS都可以用Langmuir吸附方程拟合, 拟合出的最大吸附量分别为0.075、0.154、0.086 mg·g-1, 表明这三种微塑料对四环素的吸附都是以单层饱和吸附为主。同时微塑料本身的性质也会造成吸附作用力(疏水作用力、分子间作用力、静电作用力等)的不同, 从而影响其吸附四环素。
(2) pH值对微塑料吸附四环素的影响较为复杂, PE在pH为7时吸附量最大, 达到0.084±0.014 mg· g-1, 酸碱条件下都会减少其对四环素的吸附; PS在pH为4时吸附量最大, 随着pH值的增大吸附量降低; pH的变化对PA吸附四环素影响较小。
(3) Ca2+和Mg2+的存在会减少这三种微塑料对四环素的吸附, 并随着离子浓度增大而使吸附量降低。
(4) 富里酸的存在会阻碍PE吸附四环素, 且富里酸浓度与四环素的吸附量呈反比。随着富里酸浓度的增加, PA和PS对四环素的吸附先增加后减少。当富里酸浓度为0~1 mg·L-1时会促进微塑料对四环素的吸附。
| [1] |
赵方凯, 杨磊, 李守娟, 等. 长三角典型城郊土壤抗生素空间分布的影响因素研究[J]. 环境科学学报, 2018, 38(3): 1163-1171. ZHAO Fang-kai, YANG Lei, LI Shou-juan, et al. Affecting factors of the spatial distribution of antibiotics in soils in typical peri-urban area of Yangtze River Delta[J]. Acta Scientiae Circumstantiae, 2018, 38(3): 1163-1171. |
| [2] |
赵方凯, 陈利顶, 杨磊, 等. 长三角典型城郊不同土地利用土壤抗生素组成及分布特征[J]. 环境科学, 2017, 38(12): 5237-5246. ZHAO Fang-kai, CHEN Li-ding, YANG Lei, et al. Composition and distribution of antibiotics in soils with different land use types in a typical peri-urban area of the Yangtze River Delta[J]. Environmental Science, 2017, 38(12): 5237-5246. |
| [3] |
Ji X L, Shen Q H, Liu F, et al. Antibiotic resistance gene abundances associated with antibiotics and heavy metals in animal manures and agricultural soils adjacent to feedlots in Shanghai, China[J]. Journal of Hazardous Materials, 2012, 235/236: 178-185. DOI:10.1016/j.jhazmat.2012.07.040 |
| [4] |
曾巧云, 丁丹, 檀笑. 中国农业土壤中四环素类抗生素污染现状及来源研究进展[J]. 生态环境学报, 2018, 27(9): 1774-1782. ZENG Qiao-yun, DING Dan, TAN Xiao. Pollution status and sources of tetracycline antibiotics in agricultural soil in China:A review[J]. Ecology and Environmental Sciences, 2018, 27(9): 1774-1782. |
| [5] |
Plastics Europe. Plastics-the Facts 2018, an analysis of European plastics production: Demand and waste data for 2017[R]. Brussels: Association of Plastic Manufacturers, 2018.
|
| [6] |
Gasperi J, Wright S L, Dris R, et al. Microplastics in air:Are we breathing it in?[J]. Current Opinion in Environmental Science & Health, 2018, 1: 1-5. |
| [7] |
Zhou Q, Zhang H, Fu C, et al. The distribution and morphology of microplastics in coastal soils adjacent to the Bohai Sea and the Yellow Sea[J]. Geoderma, 2018, 322: 201-208. DOI:10.1016/j.geoderma.2018.02.015 |
| [8] |
Mishra S, Rath C C, Das A P. Marine microfiber pollution:A review on present status and future challenges[J]. Marine Pollution Bulletin, 2019, 140: 188-197. DOI:10.1016/j.marpolbul.2019.01.039 |
| [9] |
Mintenig S M, Loder M G J, Primpke S, et al. Low numbers of microplastics detected in drinking water from ground water sources[J]. Science of the Total Environment, 2019, 648: 631-635. DOI:10.1016/j.scitotenv.2018.08.178 |
| [10] |
骆永明, 周倩, 章海波, 等. 重视土壤中微塑料污染研究防范生态与食物链风险[J]. 中国科学院院刊, 2018, 33(10): 1021-1030. LUO Yong-ming, ZHOU Qian, ZHANG Hai-bo, et al. Pay attention to research on microplastic pollution in soil for prevention of ecological and food chain risks[J]. Bulletin of Chinese Academy of Sciences, 2018, 33(10): 1021-1030. |
| [11] |
Nizzetto L, Futter M, Langaas S. Are agricultural soils dumps for microplastics of urban origin?[J]. Environmental Science & Technology, 2016, 50: 10777-10779. |
| [12] |
Van Sebille E, Wilcox C, Lebreton L, et al. A global inventory of small floating plastic debris[J]. Environmental Research Letters, 2015, 10(12): 124006. DOI:10.1088/1748-9326/10/12/124006 |
| [13] |
Antunes J C, Frias J G L, Micaelo A C, et al. Resin pellets from beaches of the Portuguese coast and adsorbed persistent organic pollutants[J]. Estuarine Coastal & Shelf Science, 2013, 130(4): 62-69. |
| [14] |
杨婧婧, 徐笠, 陆安祥, 等. 环境中微(纳米)塑料的来源及毒理学研究进展[J]. 环境化学, 2018, 37(3): 383-396. YANG Jing-jing, XU Li, LU An-xiang, et al. Research progress on the sources and toxicology of micro(nano)plastics in environment[J]. Environmental Chemistry, 2018, 37(3): 383-396. |
| [15] |
Laganà P, Caruso G, Corsi I, et al. Do plastics serve as a possible vector for the spread of antibiotic resistance? First insights from bacteria associated to a polystyrene piece from King George Island(Antarctica)[J]. International Journal of Hygiene and Environmental Health, 2019, 222: 89-100. DOI:10.1016/j.ijheh.2018.08.009 |
| [16] |
Xu B, Liu F, Brookes P C, et al. Microplastics play a minor role in tetracycline sorption in the presence of dissolved organic matter[J]. Environmental Pollution, 2018, 240: 87-94. DOI:10.1016/j.envpol.2018.04.113 |
| [17] |
张凯娜, 李嘉, 李晓强, 等. 微塑料表面土霉素的吸附-解吸机制与动力学过程[J]. 环境化学, 2017, 36(12): 2531-2540. ZHANG Kai-na, LI Jia, LI Xiao-qiang, et al. Mechanisms and kinetics of oxytetracycline adsorption-desorption onto microplastics[J]. Environmental Chemistry, 2017, 36(12): 2531-2540. DOI:10.7524/j.issn.0254-6108.2017032703 |
| [18] |
陈同斌, 陈志军. 土壤中溶解性有机质及其对污染物吸附和解吸行为的影响[J]. 植物营养与肥料学报, 1998, 4(3): 201-210. CHEN Tong-bin, CHEN Zhi-jun. Dissolved organic matter and its effects on adsorption and desorption of pollutants in soils[J]. Plant Nutrition and Fertilizer Science, 1998, 4(3): 201-210. DOI:10.3321/j.issn:1008-505X.1998.03.001 |
| [19] |
Matsuguma Y, Takada H, Kumata H, et al. Microplastics in sediment cores from Asia and Africa as indicators of temporal trends in plastic pollution[J]. Archives Environmental Contamination Toxicology, 2017, 73(2): 230-239. DOI:10.1007/s00244-017-0414-9 |
| [20] |
Li J, Zhang K, Zhang H. Adsorption of antibiotics on microplastics[J]. Environmental Pollution, 2018, 237: 460-467. DOI:10.1016/j.envpol.2018.02.050 |
| [21] |
Hüffer T, Hofmann T. Sorption of non-polar organic compounds by micro-sized plastic particles in aqueous solution[J]. Environmental Pollution, 2016, 214: 194-201. DOI:10.1016/j.envpol.2016.04.018 |
| [22] |
黄昌勇, 徐建明. 土壤学[M]. 三版. 北京: 中国农业出版社, 2010: 170. Huang Chang-yong, Xu Jian-ming. Soil science[M]. 3rd Edition. Beijing: China Agriculture Press, 2010: 170. |
| [23] |
Wang W F, Wang J. Comparative evaluation of sorption kinetics and isotherms of pyrene onto microplastics[J]. Chemosphere, 2018, 193: 567-573. DOI:10.1016/j.chemosphere.2017.11.078 |
| [24] |
Alimi O S, Budarz J F, Hernandez L M, et al. Microplastics and nanoplastics in aquatic environments:Aggregation, deposition, and enhanced contaminant transport[J]. Environmental Science & Technology, 2018, 52(4): 1704-1724. |
| [25] |
Misumi. Glass transition temperature Tg of plastics[R/OL]. 2011. http://www.misumi-techcentral.com/tt/en/mold/2011/12/106-glasstransition-temperature-tg-of-plastics.html.
|
| [26] |
Hüffer T, Hofmann T. Sorption of non-polar organic compounds by micro-sized plastic particles in aqueous solution[J]. Environmental Pollution, 2016, 214: 194-201. DOI:10.1016/j.envpol.2016.04.018 |
| [27] |
Wu P, Cai Z, Jin H, et al. Adsorption mechanisms of five bisphenol analogues on PVC microplastics[J]. Science of the Total Environment, 2019, 650: 671-678. DOI:10.1016/j.scitotenv.2018.09.049 |
| [28] |
Wang F, Shih K M, Li X Y. The partition behavior of perfluorooctane sulfonate(PFOS)and perfluorooctane sulfonamide(FOSA)on microplastics[J]. Chemosphere, 2015, 119: 841-847. DOI:10.1016/j.chemosphere.2014.08.047 |
| [29] |
周阳.海岸环境中微塑料对土霉素的吸附分配特征研究[D].烟台: 中国科学院烟台海岸带研究所, 2018. ZHOU Yang. Adsorption and partition characteristics of oxytetracycline by the microplastics in coastal environments[D]. Yantai: Yantai Insititute of Coastal Zone Research, Chinese Academy of Sciences, 2018. |
| [30] |
Gao Y, Li Y, Zhang L, et al. Adsorption and removal of tetracycline antibiotics from aqueous solution by graphene oxide[J]. Journal of Colloid & Interface Science, 2012, 368(1): 540-546. |
| [31] |
Zhang H, Wang J, Zhou B, et al. Enhanced adsorption of oxytetracycline to weathered microplastic polystyrene:Kinetics, isotherms and influencing factors[J]. Environmental Pollution, 2018, 243: 1550-1557. DOI:10.1016/j.envpol.2018.09.122 |
| [32] |
黄翔峰, 熊永娇, 彭开铭, 等. 金属离子络合对抗生素去除特性的影响研究进展[J]. 环境化学, 2016, 35(1): 133-140. HUANG Xiang-feng, XIONG Yong-jiao, PENG Kai-ming, et al. The progress of antibiotics removal performance under the complexation effect of metal ions[J]. Environmental Chemistry, 2016, 35(1): 133-140. |
| [33] |
Zhao Y, Geng J, Wang X, et al. Adsorption of tetracycline onto goethite in the presence of metal cations and humic substances[J]. Journal of Colloid and Interface Science, 2011, 361(1): 247-251. DOI:10.1016/j.jcis.2011.05.051 |
| [34] |
Shen X C, Li D C, Sima X F, et al. The effects of environmental conditions on the enrichment of antibiotics on microplastics in simulated natural water column[J]. Environmental Research, 2018, 166: 377-383. DOI:10.1016/j.envres.2018.06.034 |
| [35] |
Chen W, Ouyang Z Y, Qian C, et al. Induced structural changes of humic acid by exposure of polystyrene microplastics:A spectroscopic insight[J]. Environmental Pollution, 2018, 233: 1-7. DOI:10.1016/j.envpol.2017.10.027 |
| [36] |
Gu C, Karthikeyan K G, Sibley S D, et al. Complexation of the antibiotic tetracycline with humic acid[J]. Chemosphere, 2007, 66: 1494-1501. DOI:10.1016/j.chemosphere.2006.08.028 |
 2019, Vol. 38
2019, Vol. 38