2. 南开大学环境科学与工程学院, 天津 300350;
3. 山东理工大学资源与环境工程学院, 山东 淄博 255000
2. College of Environmental Science and Engineering, Nankai University, Tianjin 300350, China;
3. School of Resources and Environmental Engineering, Shandong University of Technology, Zibo 255000, China
生物炭是无氧或限氧条件下经高温热解制备的一类碳质材料,含有高度芳香化的碳结构,具有多孔结构和高比表面积。作为一种多功能的土壤改良剂,生物炭可以减少温室气体排放、改善土壤肥力、提高农业生产可持续性[1]。同时,生物炭对多种有机污染物都有着极强的吸附能力[2-4];还可对有机污染物的水解与氧化还原过程起催化作用[5]。生物炭可从多种途径影响农药在土壤中的归宿。首先,生物炭对农药具有很强的吸附能力,主要通过疏水性分配作用、孔填充作用、氢键作用、p(n)-π与π-π电子供体-受体作用和离子架桥作用等进行吸附[2-4];其次,生物炭还可以通过改变土壤理化环境进而影响农药的化学降解和微生物降解,有研究表明,猪粪生物炭能够通过提高pH、释放金属离子和表面的活性催化位点来促进阿特拉津、西维因的降解[5];油菜秆生物炭也可通过促进有机物的化学降解作用和微生物降解作用而提高五氯酚的脱氯反应[6]。因此,利用生物炭修复土壤农药污染具有重要的应用价值。
生物炭施入土壤后会与土壤中的可溶性有机质(Dissolved organic matter,DOM)、矿物等组分发生相互作用,堵塞表面孔道,减少农药吸附位点,从而影响农药在生物炭上的吸附[7-8]。Jin等[7]研究发现添加生物炭能够提高土壤体系对吡虫啉、阿特拉津和异丙隆的吸附,但由于生物炭与土壤混合体系的比表面积和有机碳(Organic carbon,OC)含量的实际值低于理论值,造成其实际吸附量比理论吸附量要低,因此生物炭对农药在土壤中的吸附能力可能被过高地估计,这一结论有待更多研究数据的验证。生物炭修复对土壤中农药的微生物降解也有利有弊。已有研究表明,生物炭能够改善土壤微环境,提高土壤微生物丰度,进而提高农药微生物降解的降解率[9-11]。首先,由于生物炭对农药强烈的吸附作用,减少了微生物和植物对农药的利用,进而抑制了农药的微生物降解,且随着生物炭用量的增加而抑制作用增强[10, 12-13]。其次,来自生物炭表面的可降解有机质能够促进微生物的增长,但生物炭强烈的吸附作用反而减少了微生物对此类物质的利用[14]。以上关于不同生物炭对农药微生物降解的影响差异,可能与生物炭的热解温度、原材料、用量和土壤类型有关[15-16],这需要进一步研究。
噻虫胺(Clothianidin),化学名(E)-1-[(2-氯-1,3-噻唑-5-基)甲基]-3-甲基-2-硝基胍,CAS号:210880-92-5,是当前广泛应用的一种新烟碱类杀虫剂,其含有多个极性基团,水溶性高(340 mg·L-1),土壤半衰期长。加拿大和美国等化学品管理机构已将噻虫胺划为具有中高级别淋溶风险的化学品[17]。自2012年以来,Science等杂志多次报道了噻虫胺等新烟碱类杀虫剂对蜜蜂等传粉昆虫和食虫鸟类具有毒性,导致这些生物数量下降[18],引发了对噻虫胺环境归趋与危害调控措施研究的新一轮热潮。与此同时,在生物炭被广泛推广应用的今天,由于制备条件和原材料等因素的影响,生物炭对极性农药噻虫胺吸附和降解的影响尚无明确的结论,其机制也尚需进一步研究。本实验拟通过研究添加由不同热解温度和原材料制备的生物炭对土壤理化性质的影响,以及噻虫胺在生物炭-土壤混合体系中吸附和降解的行为,探讨生物炭制备温度和原材料对噻虫胺吸附和降解行为的影响及其机制,研究结果对深入认识生物炭调控噻虫胺土壤吸附及降解过程的微观机制具有重要意义。
1 材料与方法 1.1 噻虫胺、生物炭与土壤样品制备噻虫胺:称取0.508 g噻虫胺原药(纯度98.5%,河北威远化学品有限公司),用色谱级甲醇溶剂定容至100 mL,即配成5000 mg·L-1噻虫胺储备液。噻虫胺的基本性质如表 1所示。
生物炭的制备:本实验以玉米秸秆和猪粪为生物质原材料制备生物炭,玉米秸秆取自天津市津南区农田,猪粪收集于山东省潍坊市某养殖场。具体步骤如下:原材料经自然风干、粉碎、研磨后过2 mm筛。采用马弗炉限氧灼烧法[5]制备生物炭,马弗炉升温速率为5 ℃·min-1,分别升至300、500 ℃和700 ℃并保持4 h。等炉内温度自然冷却至室温后,取出生物炭,置于广口瓶中,干燥避光保存待用。根据原材料和热解温度,将所得生物炭分别标记为MBn和PBn,MB和PB分别代表原材料玉米秸秆生物炭和猪粪生物炭,n(n= 3、5和7)分别代表热解温度(300、500 ℃和700 ℃)。
供试土壤:本实验以黑土(BS)为供试土壤,采自于东北地区农田土壤。将上述六种生物炭按照2%的质量比分别与黑土混合均匀(吸附和化学降解实验采用风干后的土壤,微生物降解实验采用新鲜土壤),现制现用。将土壤放入高压灭菌锅中121 ℃条件下灭菌30 min(每日一次,连续3 d),获得灭菌土壤[19]。
1.2 样品性质表征土壤样品及其与生物炭混合样品进行以下表征分析:
整体元素C、N和H,通过全自动元素分析仪(EA3000,利曼,意大利)测定。利用多站扩展式全自动快速比表面仪(ASAP2460,麦克仪器,美国)测定样品的比表面积[20]。有效态氮采用联合浸提-比色法测定(NY/T 1848—2010),有效态磷采用紫外/可见分光光度计测定(NY/T 1121.7—2014)。
pH的测定:采用1:5的固水质量比,加入10 mmol·L-1 CaCl2溶液。在摇床上振荡2 h后于4000 r· min-1转速下离心10 min,用pH计对上清液进行测定。
可溶性有机碳含量的测定[20]:采用1:5的固水质量比,在摇床上振荡24 h后,于4000 r·min-1转速下离心10 min,取上清液,过0.45 μm水系膜后,利用TOC仪进行测定。
1.3 吸附实验吸附实验采用批量吸附平衡法[5]。具体步骤如下:准确称取土壤样品2.000 0 g于12 mL EPA样品瓶(带有Teflon内垫的盖子)中,再加入10 mL含5 mmol·L-1 CaCl2和200 mg·L-1 NaN3的水溶液。对于生物炭样品,准确称取100 mg于40 mL EPA样品瓶,然后加入40 mL含5 mmol·L-1 CaCl2和200 mg·L-1 NaN3的水溶液。预平衡2 h后,加入一定量的噻虫胺储备液,使每个样品瓶中噻虫胺的浓度达到预设值。盖紧盖子,摇匀后置于25±1 ℃摇床中避光振荡,振荡速度180 r·min-1。振荡48 h后取出样品瓶(动力学实验表明噻虫胺在48 h内均可达到表观吸附平衡),取1.5 mL于离心管中,在15 000 r·min-1高速离心机下离心5 min。取上清液过0.45 μm水系滤膜后,待高效液相色谱仪分析。每处理重复3次。噻虫胺在实验过程中挥发、降解以及对瓶壁吸附等损失小于5%。因此,采用质量平衡法计算噻虫胺在生物炭上的吸附量。
1.4 降解实验本实验中将噻虫胺在土壤中的降解分为化学降解和微生物降解两部分来研究。分别准确称取灭菌和未灭菌的土壤10.000 0 g于棕色EPA瓶中(未灭菌土壤测量含水量后折百计算得来),加入去离子水使土壤保持60%的含水率;其中,灭菌土壤中添加200 mg·L-1 HgCl2溶液以抑制微生物的生长,加入10.0 μL 5000 mg·L-1噻虫胺母液,涡旋30 s充分混匀。EPA瓶加棉塞封口后,置于25±1 ℃恒温培养箱中避光培养。分别于0、2、5、10、20、40 d和60 d定期取样测定土壤中的噻虫胺含量。每处理设置3个平行。土壤样品经冷冻干燥机冻干后,称取1.000 0 g土壤样品于EPA瓶中,加入10 mL乙腈,超声萃取20 min,在3000 r· min-1下离心5 min,移取上清液。重复上述步骤,合并两次萃取液,氮吹近干。加入2 mL乙腈定容,过0.45 μm有机膜后待高效液相色谱仪测定。萃取回收率均为90%以上。以上溶剂均为色谱纯级。
1.5 噻虫胺样品分析方法噻虫胺的浓度采用Aglient 1260液相色谱仪进行分析。测定方法为:色谱柱为Venusil XBP C18反相色谱柱(4.6 mm×250 mm×5 μm,150 Å),流动相为乙腈:水=70:30(V:V),流速为1.0 mL·min-1,检测器为紫外检测器(检测波长254 nm)。使用噻虫胺的标准储备液,配制系列浓度的标样,外标法定量。
1.6 数据分析采用Freundlich模型对吸附等温线数据进行拟合:lg Qe = lg Kf + nlgCe。其中,Ce和Qe分别为目标物在水相和固相中的平衡浓度,单位分别为mg·L-1和mg·kg-1;Kf为吸附常数,单位为(mg·kg-1)·(mg·L-1)-n,n为吸附等温线非线性指数,n值越小,表示吸附等温线非线性程度越强。
对土壤降解动力学曲线进行拟一级动力学方程拟合:Ct = C0e-kt。其中,Ct和C0分别为目标物的瞬时浓度和初始浓度,mg·L-1;t为时间,d;k为降解速率常数,d-1;通过拟合的k可以计算半衰期t1/2=ln2/k,d。
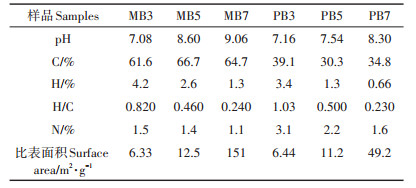
2 结果与讨论 2.1 生物炭对土壤理化性质的影响生物炭的理化性质表征结果见Zhang等[21]已发表的文章。生物炭以2 %的质量比添加到黑土后,生物炭-土壤混合体系的理化性质如表 3所示。相对于原始土壤,土壤与生物炭混合体系的pH、有效态磷和有机碳含量均提高,而H/C呈现下降现象。这与Martin等[22]和Kim等[23]获得的结果一致。土壤及生物炭-土壤混合体系的pH值均呈弱碱性,且pH随着加入生物炭热解温度的升高而提高,这与生物炭的pH值变化是一致的。H/C通常用来表征碳质材料的芳香性。H / C越小,芳香性越大[24]。因此,与低温生物炭(300 ℃和500 ℃)-土壤混合体系相比,高温生物炭(700 ℃)-土壤混合体系的H/C要低,表明高温生物炭严重碳化并显示出高度芳香性[25]。可溶性有机碳浓度在300 ℃制备的生物炭-土壤混合体系中升高,而在700 ℃制备的生物炭-土壤混合体系中降低。这是因为低温生物炭向土壤释放出大量的可溶性有机碳,而高温生物炭自身的强吸附能力对土壤中的可溶性有机碳起到了吸附作用[26]。相比于单一土壤(15.3 m2·g-1),高温生物炭较大的比表面积(49.2 m2·g-1和151 m2·g-1)显著提高生物炭-土壤混合体系的比表面积。王立果等[27]和邓金环等[28]的研究也证实了这一点。此外,除了PB3添加的生物炭-土壤混合体系,有效态氮的浓度均比原始土壤中有所降低。
|
|
表 3 生物炭-土壤混合体系的土壤理化性质 Table 3 Physicochemical properties of the biochar-soil mixtures |
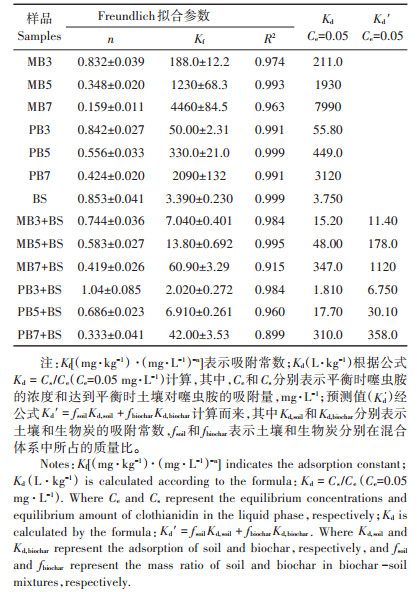
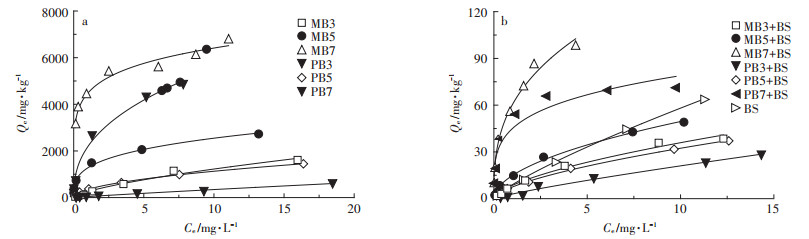
噻虫胺在生物炭、土壤和生物炭-土壤混合体系中的吸附等温线结果见图 1。如图 1所示,噻虫胺的吸附等温线均符合Freundlich方程(R2 > 0.899),表明生物炭、土壤及生物炭-土壤混合体系对噻虫胺的吸附以多分子层吸附为主[28-29]。如表 4所示,噻虫胺在生物炭上的Kf值为50.0~4460,且随着热解温度的升高而增大。添加生物炭后,生物炭-土壤混合体系对噻虫胺的吸附能力均有所提高,Kf值为2.85~60.9。尽管由于与土壤的相互作用,生物炭-土壤混合体系较生物炭对噻虫胺的吸附能力降低,但生物炭的添加增强了噻虫胺的吸附。相对于单一土壤,生物炭-土壤混合体系对噻虫胺的吸附能力均有所增加,其中噻虫胺在玉米秸秆生物炭-土壤混合体系中的Kf值提高了2.08~39.3倍;在猪粪生物炭-土壤混合体系中的Kf值提高了0.60~19.8倍。这表明生物炭添加能够显著提高土壤对噻虫胺的吸附能力且吸附能力的提高程度随着所添加生物炭热解温度的升高而增大。
|
图 1 噻虫胺在生物炭、土壤及生物炭-土壤混合体系上的吸附等温线 Figure 1 Adsorption isotherms of clothianidin on biochar, soil, and biochar-soil mixtures |
|
|
表 4 噻虫胺在生物炭、土壤及生物炭-土壤混合体系上的Freundlich拟合参数和浓度分配系数 Table 4 Freundlich isotherm parameters and concentration-dependent distribution coefficients for the sorption of clothianidin on biochar, soil, and biochar-soil mixtures |
为比较生物炭类型对生物炭-土壤混合体系吸附能力的影响,本研究对噻虫胺的吸附浓度分配系数(Kd)进行了计算(表 4)。与Kf值相似,生物炭添加提高了土壤的Kd值。噻虫胺在高温生物炭-土壤混合体系中的Kd值均高于其在低温生物炭-土壤混合体系中的Kd值,例如,相比于B3+BS和B5+BS的混合体系,高温生物炭(700 ℃)-土壤混合体系的Kd值约高出一个数量级,这说明高温生物炭对噻虫胺在土壤中具有更强的吸附能力。这是因为在玉米秸秆和猪粪高温热解过程中,随着热解温度的升高,生物炭的比表面积增大,芳构化程度加深,表面疏水性增强,这为生物炭吸附农药提供了可能[30-31]。且刘剑楠等[32]的研究也发现随着热解温度的升高,比表面积越大,生物炭表面能提供更多的吸附位点,所以噻虫胺在高温生物炭上的吸附能力较强。除PB3 + BS混合体系,Freundlich拟合参数n值均 < 1,说明噻虫胺在生物炭-土壤混合体系上的吸附呈非线性,表明多种作用机制参与了噻虫胺在生物炭-土壤混合体系上的吸附。此外,本文作者前期研究表明,高温热解使得生物炭含有较多芳香碳和高比表面积,从而使噻虫胺通过疏水性分配作用、孔填充作用、氢键作用、p(n)-π与π-π电子供体-受体作用吸附于生物炭[21]。噻虫胺在生物炭与土壤混合体系中的Kd值(Ce =0.05 mg·L-1)均与混合体系的比表面积具有正相关关系(r=0.855;P < 0.05),这表明生物炭添加后土壤比表面积的增加是提高土壤吸附能力的一个重要因素。
为进一步评价生物炭与土壤的相互作用对噻虫胺吸附的影响,本研究对吸附浓度分配系数的测定值(Kd)和预测值(Kd′)进行了比较(表 4)。结果发现,噻虫胺在300 ℃生物炭-土壤混合体系中的Kd值比其Kd ′值要低,而在700 ℃生物炭-土壤混合体系中的Kd值比其Kd ′值要高。这表明700 ℃生物炭和土壤相互作用对噻虫胺吸附影响的衰减要强于300 ℃生物炭-土壤相互作用对其吸附的影响。这种现象暗示着生物炭与土壤不是各自孤立存在的。高温生物炭-土壤混合体系中的强吸附能力导致有效态氮和可溶性有机碳浓度水平的降低(表 3),同时这种吸附可能会与污染物分子竞争生物炭表面的高能吸附位点或堵塞微孔和介孔[7, 33-34],从而减少噻虫胺的吸附点位。但对于300 ℃生物炭-土壤混合体系,生物炭表面的有效态氮磷和可溶性有机碳的释放改变了其表面的性质,提高了对噻虫胺的吸附[5, 35]。而且,土壤中的细小矿物颗粒也会降低生物炭孔道和吸附位点的可及性[7-8, 33]。尽管生物炭对噻虫胺的吸附能力因生物炭和土壤的相互作用而降低,但生物炭修复仍提高了土壤的吸附能力,且提高程度随着生物炭热解温度的上升而增强。因此,生物炭对噻虫胺的强吸附能力可为减弱其在土壤中的移动性发挥重要的作用。
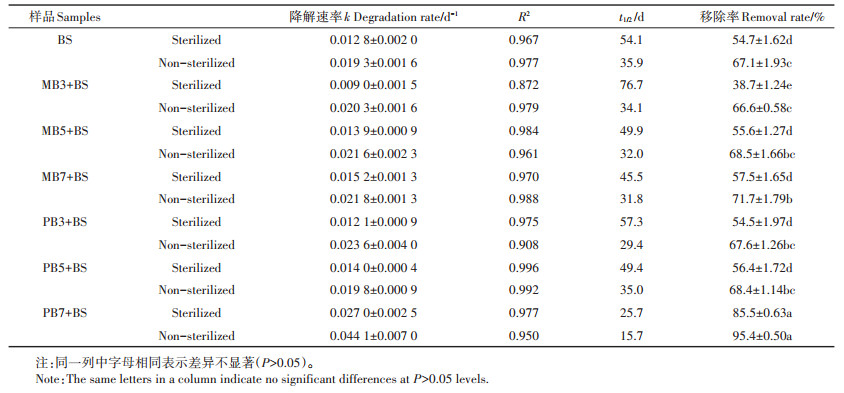
2.3 生物炭对噻虫胺在土壤中降解的影响为探讨生物炭类型对土壤中农药降解的影响,本研究考察了灭菌和未灭菌条件下生物炭添加到黑土中对噻虫胺降解的影响。灭菌土壤反映生物炭对土壤中噻虫胺化学降解的影响,而未灭菌土壤反映生物炭对土壤中噻虫胺微生物降解的影响。单一土壤和生物炭-土壤混合体系中噻虫胺60 d的降解结果见表 5。结果表明,添加不同类型的生物炭对土壤中噻虫胺降解的影响不同。在灭菌条件下,噻虫胺60 d的降解速率和移除率顺序均为:PB7 > MB7≈PB5≈MB5≈ BS≈PB3 > MB3;在未灭菌条件下,噻虫胺60 d的降解速率和移除率顺序均为:PB7 > PB5 > MB7 > MB5 > PB3≈ BS≈MB3。噻虫胺在灭菌和未灭菌处理中的最高移除率均来自PB7-土壤混合体系。已有研究表明,噻虫胺在土壤中的降解与土壤的有机碳含量、pH值和水分含量有关[36-37]。Li等[36]发现噻虫胺在密西西比州3种农业土壤中的半衰期为90~175 d,且降解率随着土壤有机碳和水分含量的增大而提高。而噻虫胺在本研究中的半衰期仅为15.7~76.7 d,这是由于本研究所采用的黑土偏碱性、较高的有机碳和水分含量促进了噻虫胺的降解。此外,Zhang等[5]研究生物炭对阿特拉津化学降解的影响时发现,土壤pH的升高、矿物表面活性组分、可溶性金属离子和·OH及其他自由基的产生,也可促进农药的化学降解。本研究也发现噻虫胺在高温生物炭-土壤混合体系中具有相对较高的化学降解速率(表 5),说明高温生物炭催化噻虫胺化学降解是影响其在土壤中降解的主导因素。然而,噻虫胺在未灭菌土壤中的移除率和降解速率均显著高于灭菌土壤(表 5),这说明其在未灭菌的土壤中既有化学降解又存在微生物降解。这与张怡宁等[38]研究噻虫胺在灭菌和未灭菌的水稻土中的降解结果是一致的。
|
|
表 5 噻虫胺在土壤和生物炭-土壤混合体系中60 d的降解 Table 5 Degradation of clothianidin in soils and biochar-soil mixtures during 60 days |
本研究将灭菌与未灭菌的土壤中噻虫胺降解率的差值近似为微生物降解的贡献,60 d不同处理中微生物对噻虫胺的移除率见图 2。在生物炭与土壤组成的混合体系中,噻虫胺微生物降解的移除率均随所添加生物炭热解温度的升高呈下降趋势,且MB7和PB7添加处理中噻虫胺的微生物降解速率显著低于对照组。这表明低温生物炭能够促进微生物降解而高温生物炭抑制微生物降解。
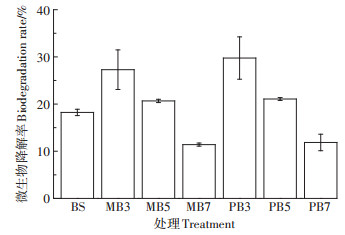
|
图 2 噻虫胺在土壤和生物炭-土壤混合体系中60 d的微生物降解率 Figure 2 Biotic removal rates of clothianidin in soils and biochar-soil mixtures at day 60 |
Ren等发现有机污染物的土壤降解与土壤类型和相关微生物群落变化有关,且红壤因贫瘠的微生物群落而限制了有机污染物的微生物降解[34, 39]。生物炭修复不仅可以改善土壤理化性质如氮磷水平、阳离子交换量和持水能力[40],还能提升微生物群落结构的稳定性及其种群丰度,进而增强微生物代谢能力[41-42]。在本研究中,与高温热解生物炭相比,低温生物炭添加不仅能催化噻虫胺的化学降解,还可显著提升其微生物降解率(图 2)。这是因为低温生物炭比高温生物炭能够释放出更多的可溶性有机碳和有效态氮磷。由此可知,生物炭修复能够改变土壤的营养水平,进而影响土壤中土著微生物的群落结构,从而改变了污染物的微生物降解速率[10, 43]。噻虫胺的微生物降解率与可溶性有机碳具有显著的正相关关系(r= 0.606,P < 0.01),也较好地验证了以上研究结果。
相对于微生物群落结构的变化,污染物的生物可利用性也是影响微生物降解效率的一个重要因素。在本研究中,生物炭修复提高了土壤对噻虫胺的吸附能力,且它们的吸附常数随着生物炭热解温度的升高而增大(表 4)。噻虫胺的微生物降解率与其Kd值具有显著的负相关关系(r=-0.672,P < 0.01),这说明噻虫胺的吸附降低了它们的生物可利用性。生物炭吸附减少了噻虫胺在土壤孔隙水中的浓度,进而降低了噻虫胺的生物可利用性。这也解释了噻虫胺在生物炭-土壤混合体系中的微生物降解率随着生物炭热解温度的升高而下降的现象。
3 结论(1)热解温度和原材料可显著改变生物炭的理化性质。添加生物炭能够提高土壤的pH、有效态磷和有机碳含量,降低土壤的H/C。
(2)噻虫胺在生物炭、土壤及生物炭-土壤混合体系上的吸附符合Freundlich方程。不同热解温度和原材料的生物炭通过影响生物炭-土壤混合体系的理化性质进而影响其对噻虫胺的吸附。
(3)噻虫胺在高温生物炭-土壤混合体系中具有相对较高的化学降解速率,而在低温生物炭-土壤混合体系中具有相对较高的微生物降解速率;生物炭通过增大有机碳含量提高了土壤对噻虫胺的吸附,但抑制了土壤中噻虫胺的微生物降解。
| [1] |
Marris E. Putting the carbon back:Black is the new green[J]. Nature, 2006, 442(7103): 624-626. DOI:10.1038/442624a |
| [2] |
Inyang M, Dickenson E. The potential role of biochar in the removal of organic and microbial contaminants from potable and reuse water:A review[J]. Chemosphere, 2015, 134: 232-240. DOI:10.1016/j.chemosphere.2015.03.072 |
| [3] |
Goulson D. Review:An overview of the environmental risks posed by neonicotinoid insecticides[J]. Journal of Applied Ecology, 2013, 50(4): 977-987. DOI:10.1111/1365-2664.12111 |
| [4] |
Xiao F, Pignatello J J. Interactions of triazine herbicides with biochar:Steric and electronic effects[J]. Water Research, 2015, 80: 179-188. DOI:10.1016/j.watres.2015.04.040 |
| [5] |
Zhang P, Sun H W, Yu L, et al. Adsorption and catalytic hydrolysis of carbaryl and atrazine on pig manure-derived biochars:Impact of structural properties of biochars[J]. Journal of Hazardous Materials, 2013, 244/245: 217-224. DOI:10.1016/j.jhazmat.2012.11.046 |
| [6] |
Tong H, Hu M, Li F B, et al. Biochar enhances the microbial and chemical transformation of pentachlorophenol in paddy soil[J]. Soil Biology & Biochemistry, 2014, 70: 142-150. |
| [7] |
Jin J, Kang M J, Sun K, et al. Properties of biochar-amended soils and their sorption of imidacloprid, isoproturon, and atrazine[J]. Science of the Total Environment, 2016, 550: 504-513. DOI:10.1016/j.scitotenv.2016.01.117 |
| [8] |
Ren X H, Zhang P, Zhao L J, et al. Sorption and degradation of carbaryl in soils amended with biochars:Influence of biochar type and content[J]. Environmental Science and Pollution Research International, 2016, 23(3): 2724-2734. DOI:10.1007/s11356-015-5518-z |
| [9] |
Xu H J, Wang X H, Li H, et al. Biochar impacts soil microbial community composition and nitrogen cycling in an acidic soil planted with rape[J]. Environmental Science & Technology, 2014, 48(16): 9391-9399. |
| [10] |
Nielsen S, Minchin T, Kimber S, et al. Comparative analysis of the microbial communities in agricultural soil amended with enhanced biochars or traditional fertilisers[J]. Agriculture, Ecosystems & Environment, 2014, 191: 73-82. |
| [11] |
Lopez-Pineiro A, Pena D, Albarran A, et al. Behavior of MCPA in four intensive cropping soils amended with fresh, composted, and aged olive mill waste[J]. Journal of Contaminant Hydrology, 2013, 152: 137-146. DOI:10.1016/j.jconhyd.2013.07.003 |
| [12] |
Oleszczuk P, Jośko I, Futa B, et al. Effect of pesticides on microorganisms, enzymatic activity and plant in biochar-amended soil[J]. Geoderma, 2014, 214/215: 10-18. DOI:10.1016/j.geoderma.2013.10.010 |
| [13] |
Chai Y Z, Currie R J, Davis J W, et al. Effectiveness of activated carbon and biochar in reducing the availability of polychlorinated dibenzo-p-dioxins/dibenzofurans in soils[J]. Environmental Science & Technology, 2012, 46(2): 1035-1043. |
| [14] |
Zimmerman A R, Gao B, Ahn M Y. Positive and negative carbon mineralization priming effects among a variety of biochar-amended soils[J]. Soil Biology & Biochemistry, 2011, 43(6): 1169-1179. |
| [15] |
Jiang X Y, Haddix M L, Cotrufo M F. Interactions between biochar and soil organic carbon decomposition:Effects of nitrogen and low molecular weight carbon compound addition[J]. Soil Biology & Biochemistry, 2016, 100: 92-101. |
| [16] |
Imparato V, Hansen V, Santos S S, et al. Gasification biochar has limited effects on functional and structural diversity of soil microbial communities in a temperate agroecosystem[J]. Soil Biology & Biochemistry, 2016, 99: 128-136. |
| [17] |
Morrissey C A, Mineau P, Devries J H, et al. Neonicotinoid contamination of global surface waters and associated risk to aquatic invertebrates:A review[J]. Environment International, 2015, 74: 291-303. DOI:10.1016/j.envint.2014.10.024 |
| [18] |
Whitehorn P R, O'Connor S, Wackers F L, et al. Neonicotinoid pesticide reduces bumble bee colony growth and queen production[J]. Science, 2012, 336(6079): 351-352. DOI:10.1126/science.1215025 |
| [19] |
Zhang P, Ren C, Sun H W, et al. Sorption, desorption and degradation of neonicotinoids in four agricultural soils and their effects on soil microorganisms[J]. Science of the Total Environment, 2018, 615: 59-69. DOI:10.1016/j.scitotenv.2017.09.097 |
| [20] |
Jones D L, Edwards-Jones G, Murphy D V. Biochar mediated alterations in herbicide breakdown and leaching in soil[J]. Soil Biology & Biochemistry, 2011, 43(4): 804-813. |
| [21] |
Zhang P, Sun H W, Ren C, et al. Sorption mechanisms of neonicotinoids on biochars and the impact of deashing treatments on biochar structure and neonicotinoids sorption[J]. Environmental Pollution, 2018, 234: 812-820. DOI:10.1016/j.envpol.2017.12.013 |
| [22] |
Martin S M, Kookana R S, Zwieten L V, et al. Marked changes in herbicide sorption-desorption upon ageing of biochars in soil[J]. Journal of Hazardous Materials, 2012, 231-232: 70-78. DOI:10.1016/j.jhazmat.2012.06.040 |
| [23] |
Kim K H, Kim J Y, Cho T S, et al. Influence of pyrolysis temperature on physicochemical properties of biochar obtained from the fast pyrolysis of pitch pine(Pinus rigida)[J]. Bioresource Technology, 2012, 118: 158-162. DOI:10.1016/j.biortech.2012.04.094 |
| [24] |
王菲, 孙红文. 生物炭对极性与非极性有机污染物的吸附机理[J]. 环境化学, 2016, 35(6): 1134-1141. WANG Fei, SUN Hong-wen. Sorption mechanisms of polar and apolar organic contaminants onto biochars[J]. Environmental Chemistry, 2016, 35(6): 1134-1141. |
| [25] |
Ren X H, Wang F, Zhang P, et al. Aging effect of minerals on biochar properties and sorption capacities for atrazine and phenanthrene[J]. Chemosphere, 2018, 206: 51-58. DOI:10.1016/j.chemosphere.2018.04.125 |
| [26] |
Mukherjee A, Zimmerman A R. Organic carbon and nutrient release from a range of laboratory-produced biochars and biochar-soil mixtures[J]. Geoderma, 2013, 193/194: 122-130. DOI:10.1016/j.geoderma.2012.10.002 |
| [27] |
王立果, 钟金魁, 赵保卫, 等. 水中镉和芘在核桃壳生物炭上的吸附行为及其交互作用[J]. 农业环境科学学报, 2017, 36(9): 1868-1876. WANG Li-guo, ZHONG Jin-kui, ZHAO Bao-wei, et al. Adsorption and interaction of Cd(Ⅱ) and pyrene in water on walnut shell biochar[J]. Journal of Agro-Environment Science, 2017, 36(9): 1868-1876. |
| [28] |
邓金环, 郜礼阳, 周皖婉, 等. 不同温度制备香根草生物炭对Cd2+的吸附特性与机制[J]. 农业环境科学学报, 2018, 37(2): 340-349. DENG Jin-huan, GAO Li-yang, ZHOU Wan-wan, et al. Adsorption characteristics and mechanisms of Cd2+ in biochar derived from vetiver grass under different pyrolysis temperatures[J]. Journal of AgroEnvironment Science, 2018, 37(2): 340-349. |
| [29] |
程启明, 黄青, 刘英杰, 等. 花生壳与花生壳生物炭对镉离子吸附性能研究[J]. 农业环境科学学报, 2014, 33(10): 2022-2029. CHENG Qi-ming, HUANG Qing, LIU Ying-jie, et al. Adsorption of cadmium on peanut shell and its biochar[J]. Journal of Agro-Environment Science, 2014, 33(10): 2022-2029. DOI:10.11654/jaes.2014.10.020 |
| [30] |
Keiluweit M, Kleber M. Molecular-level interactions in soils and sediments:The role of aromatic pi-systems[J]. Environmental Science & Technology, 2009, 43(10): 3421-3429. |
| [31] |
Lattao C, Cao X, Mao J, et al. Influence of molecular structure and adsorbent properties on sorption of organic compounds to a temperature series of wood chars[J]. Environmental Science & Technology, 2014, 48(9): 4790-4798. |
| [32] |
刘剑楠, 封吉猛, 李丹, 等. 牛粪和核桃壳生物炭对水溶液中Cd2+和Zn2+的吸附研究[J]. 农业环境科学学报, 2019, 38(5): 1142-1150. LIU Jian-nan, FENG Ji-meng, LI Dan, et al. The adsorption of Cd2+ and Zn2+ in aqueous solutions by dairy manure and walnut shell biochar[J]. Journal of Agro-Environment Science, 2019, 38(5): 1142-1150. |
| [33] |
Cornelissen G, Gustafsson Ö, Bucheli T D, et al. Extensive sorption of organic compounds to black carbon, coal, and kerogen in sediments and soils:mechanisms and consequences for distribution, bioaccumulation, and biodegradation[J]. Environmental Science & Technology, 2005, 39(18): 6881-6895. |
| [34] |
Ren G D, Teng Y, Ren W J, et al. Pyrene dissipation potential varies with soil type and associated bacterial community changes[J]. Soil Biology & Biochemistry, 2016, 103: 71-85. |
| [35] |
Sun K, Kang M J, Zhang Z Y, et al. Impact of deashing treatment on biochar structural properties and potential sorption mechanisms of phenanthrene[J]. Environmental Science & Technology, 2013, 47(20): 11473-11481. |
| [36] |
Li Y, Su P D, Li Y D, et al. Adsorption-desorption and degradation of insecticides clothianidin and thiamethoxam in agricultural soils[J]. Chemosphere, 2018, 207: 708-714. DOI:10.1016/j.chemosphere.2018.05.139 |
| [37] |
Dankyi E, Gordon C, Carboo D, et al. Sorption and degradation of neonicotinoid insecticides in tropical soils[J]. Journal of Environmental Science & Health Part B, 2018, 53(9): 1-8. |
| [38] |
张怡宁, 殷丽. 温度、添加浓度和微生物对噻虫胺在稻田土壤中降解的影响[J]. 绿色科技, 2019, 8: 53-55. ZHANG Yi-ning, YIN-Li. Effects of temperature, added concentration and microorganisms on the degradation of clothianidin in paddy soil[J]. Journal of Green Science and Technology, 2019, 8: 53-55. |
| [39] |
Ren G D, Ren W J, Teng Y, et al. Evident bacterial community changes but only slight degradation when polluted with pyrene in a red soil[J]. Front Microbiology, 2015, 22(6): 1-11. |
| [40] |
Hartley W, Riby P, Waterson J. Effects of three different biochars on aggregate stability, organic carbon mobility and micronutrient bioavailability[J]. Journal of Environmental Management, 2016, 181: 770-778. DOI:10.1016/j.jenvman.2016.07.023 |
| [41] |
Xu N, Tan G C, Wang H Y, et al. Effect of biochar additions to soil on nitrogen leaching, microbial biomass and bacterial community structure[J]. European Journal of Soil Biology, 2016, 74: 1-8. DOI:10.1016/j.ejsobi.2016.02.004 |
| [42] |
Andert J, Mumme J. Impact of pyrolysis and hydrothermal biochar on gas-emitting activity of soil microorganisms and bacterial and archaeal community composition[J]. Applied Soil Ecology, 2015, 96: 225-239. DOI:10.1016/j.apsoil.2015.08.019 |
| [43] |
Chen J, Sun X, Li L, et al. Change in active microbial community structure, abundance and carbon cycling in an acid rice paddy soil with the addition of biochar[J]. European Journal of Soil Science, 2016, 67(6): 857-867. DOI:10.1111/ejss.12388 |
 2019, Vol. 38
2019, Vol. 38