2. 南京林业大学南方现代林业协同创新中心, 南京 210037;
3. 江苏洪泽湖湿地生态系统国家定位观测研究站, 江苏 洪泽 223100
2. Co-Innovation Center for the Sustainable Forestry in Southern China, Nanjing Forestry University, Nanjing 210037, China;
3. National Positioning Observation Station of Hungtse Lake Wetland Ecosystem in Jiangsu Province, Hongze 223100, China
溶解性有机质(Dissolved organic matter,DOM)普遍存在于地表水中,其浓度一般在1~40 mg·L-1之间(以C计)[1]。DOM在光照作用下,能够产生一系列活性物质(RS),如单线态氧(1O2)、羟基自由基(·OH)和三重态有机物(3DOM*)等[2-3],从而对抗生素等有机污染物的化学降解和迁移转化产生重要影响[4-6]。研究表明,不同来源的DOM对抗生素等污染物光降解的影响也不相同[7-8],而这主要是由于不同来源的DOM的活性物质产生能力不同造成的[9-10]。近年来,随着人们生活水平的提高,大量污水处理厂二级出水有机物(Effluent organic matter,EfOM)排入到受纳水体中,逐渐成为地表水DOM的重要组成部分[11]。而EfOM中特有的可溶性微生物代谢产物(SMPs)可能使EfOM具有和天然有机物(NOM)不同的光化学活性[12]。
DOM的活性物质产生能力除受其来源和pH的影响外[13],还可能受到共存离子如Fe(Ⅲ)的影响。Fe是普遍存在于水环境中的金属元素,溶解态Fe的浓度可达到10 μmol·L-1[14]。Fe具有很强的络合能力,水环境中的Fe(Ⅲ)多以络合物[Fe(Ⅲ)-DOM]的形式存在。这种络合物在光照作用下可通过Fe的氧化还原循环产生·OH等活性物质[15-16],对水环境中有机污染物的环境转化产生重要影响[17]。研究发现,不同来源的DOM与Fe络合后可能表现出不同的活性物质产生能力,如富里酸与Fe络合后能够促进活性物质的产生,而柠檬酸与腐植酸则抑制了含铁水体中活性物质的产生[18]。在实际水环境中,DOM的来源和结构特征复杂,而Fe(Ⅲ)对不同来源DOM的光化学活性的影响尚不清楚。
因此,本文以Suwannee河腐植酸(SRHA)和Suwannee河天然有机质(SRNOM)作为典型的外源DOM,以EfOM作为典型的内源DOM[12],通过研究环境pH条件下,Fe(Ⅲ)对不同来源DOM的光化学活性的影响,为DOM及其与Fe共存体系中有机污染物的光化学转化的研究提供理论依据。
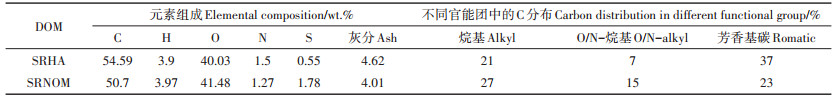
1 材料与方法 1.1 实验材料SRHA(3S101H)和SRNOM(2R101N)购于国际腐殖质协会,其元素组成和官能团信息见表 1。SRHA和SRNOM母液(50 mg·L-1)可通过在磷酸盐缓冲溶液中加入一定量的SRHA或SRNOM配制得到,现配现用;EfOM样品取自南京某污水处理厂二级出水,其水质特征为:总有机碳(TOC)7.03 mg·L-1,pH 7.3,Cl- 70.44 mg·L-1,NO2- 0.37 mg·L-1和NO3- 60.99 mg·L-1;色谱纯甲醇和乙腈购于美国Tedia公司;三氯化铁(FeCl3·6H2O)购于阿拉丁化学试剂公司;磷酸二氢钾(KH2PO4)和磷酸氢二钾(K2HPO4)购于国药集团化学试剂有限公司;糠醇(FFA)、对氯苯甲酸(pCBA)和2,4,6-三甲基苯酚(TMP)购于Sigma-Aldrich试剂公司;所使用的试剂均为分析纯以上;超纯水(> 18.2 MΩ)由Milli-Q Advantage A10超纯水系统(Millipore,德国)制备。
|
|
表 1 不同DOM的元素组成和C在不同官能团中的分布[19] Table 1 Elemental composition and C distribution in different functional groups of different DOM solutions[19] |
模拟日光照射实验在XPA-7型光化学反应仪(南京胥江机电厂)中进行,光源选择500W汞灯和500W氙灯,利用滤光片得到大于290 nm的模拟日光。采用辐照计(UVA,北京师范大学光电仪器厂)测得500 W汞灯和500W氙灯在365 nm处的光强分别为11.7 mW·cm-2和0.484 mW·cm-2。实验在50 mL的石英试管中进行,首先配制5 mmol·L-1的磷酸盐缓冲溶液,使其pH为6和7,加入一定量的SRHA和SRNOM母液,使DOM的浓度达到10 mg·L-1;然后在SRHA、SRNOM和EfOM溶液中加入不同浓度的Fe(Ⅲ)(初始浓度分别为0、10、25 μmol·L-1和50 μmol·L-1),再加入FFA、pCBA和TMP作为1O2、·OH和3DOM*的分子探针化合物(Probe)[20-23],它们的初始浓度分别为30、10 μmol·L-1和10 μmol·L-1;最后将反应溶液置于光化学反应仪中,反应一段时间后,取样测定探针化合物的浓度。同时,在相同光照条件下,考察未添加DOM的磷酸盐缓冲溶液中的相同浓度的FFA、pCBA和TMP的直接光解行为。每个处理组3个平行。
1.3 分析方法 1.3.1 探针化合物浓度的测定采用高效液相色谱仪(Ultimate3000,戴安)测定FFA、pCBA和TMP的浓度,色谱柱为安捷伦Eclipse plus C18柱(150 mm×4.6 mm,5 μm),柱温35 ℃。测定FFA的流动相为乙腈和0.1%甲酸(15:85,V/V),检测波长为219 nm;测定pCBA的流动相为甲醇和0.1%甲酸(65:35,V/V),检测波长为237 nm;测定TMP的流动相为甲醇和0.1%甲酸(70:30,V/V),检测波长为220 nm。流速均为1 mL·min-1,进样量50 μL。
1.3.2 活性物质的检测采用一级反应动力学模型(1)对FFA、pCBA和TMP的降解数据进行拟合:
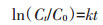
|
(1) |
式中:Ct和C0分别表示在反应时刻t和0时分子探针化合物的浓度,k为一级反应动力学常数。
在DOM及Fe共存的体系中,分子探针化合物光降解的表观反应速率常数(kProbe,总)等于活性物质引发其降解的反应速率常数(kProbe,RS)和其直接光解反应速率常数(kProbe,直接光解)之和(公式2)。DOM及Fe共存体系的活性物种的产生能力可根据活性物质氧化降解分子探针化合物的光降解反应速率常数来表征。
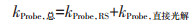
|
(2) |
DOM及Fe共存的体系产生的1O2和·OH的稳态浓度可根据公式(3)和(4)进行计算,其原理为FFA和1O2以及pCBA和·OH的反应符合二级反应动力学,但由于反应体系中1O2和·OH的浓度是稳定的,FFA和1O2、pCBA和·OH的反应可降为一级反应动力学。
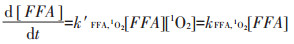
|
(3) |
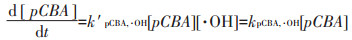
|
(4) |
式中,k′FFA, 1O2是FFA和1O2的二级反应速率常数,为8.3×107 L·mol-1·s-1[22],k′pCBA, ·OH是pCBA与·OH的二级反应速率常数,为5.2×109 L·mol-1·s-1[23]。
1.3.3 紫外可见吸收光谱的测定采用紫外可见吸收光谱仪测定DOM及其与Fe共存时的紫外可见吸收光谱,扫描波长范围为200~600 nm,比色皿光程为1 cm,扫描速度为600 nm · min-1。
1.3.4 数据分析采用SPSS 22和Excel 2016对数据进行统计分析及作图。结果以平均值±标准偏差的形式表示。对不同处理组的实验数据进行LSD多重比较,统计显著性水平为P < 0.05。
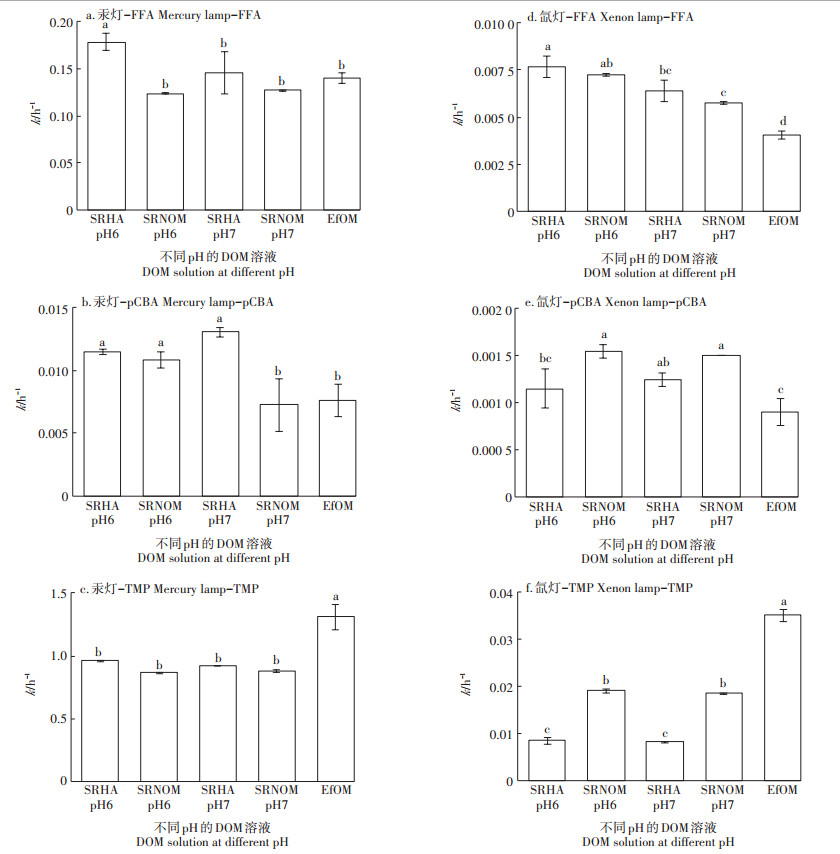
2 结果与讨论 2.1 不同DOM的光化学活性在汞灯和氙灯照射下,不同DOM体系中FFA、pCBA和TMP的光降解均符合一级反应动力学(R2 > 0.95)。FFA、pCBA和TMP的光降解速率反映了DOM体系产生的1O2、·OH和3DOM*的能力的差异,即FFA、pCBA和TMP的光降解速率越大,DOM产生1O2、·OH和3DOM*的能力就越强。图 1列出了不同DOM存在时,FFA、pCBA和TMP的光降解一级反应动力学常数。由图 1可见,不同DOM产生活性物质的能力也不相同。
|
不同小写字母表示组间差异显著(P < 0.05) Different lower-case letters indicate significant differences between groups(P < 0.05) 图 1 不同来源DOM引发FFA、pCBA和TMP的光降解反应动力学常数 Figure 1 Photodegradation kinetic constants of FFA, pCBA, and TMP induced by DOM from different sources |
在汞灯照射下,SRHA共存时FFA、pCBA和TMP的光降解一级反应速率常数均高于SRNOM,说明SRHA产生1O2、·OH和3DOM*的能力均高于SRNOM,特别是pH6条件下SRHA的1O2的产生能力和pH7条件下SRHA的·OH的产生能力显著高于SRNOM(图 1)。EfOM体系中FFA的光降解速率常数(0.140 2 h-1)与pH7条件下SRHA和SRNOM体系的FFA的光降解速率常数并没有显著性差异,说明EfOM产生1O2的能力与SRHA和SRNOM基本一致。EfOM体系中pCBA的光降解反应速率常数仅为pH7条件下SRHA体系的58.2%,说明EfOM产生·OH的能力显著低于SRHA,而EfOM与pH7条件下SRNOM产生·OH的能力并无显著性差异。EfOM引发的TMP的光降解反应速率常数显著高于SRHA和SRNOM,分别为SRHA和SRNOM体系中的1.42倍和1.49倍,说明EfOM产生的3DOM*显著高于SRHA和SRNOM。
在氙灯照射下,DOM体系中FFA、pCBA和TMP的光降解反应速率常数均显著低于汞灯照射条件下,氙灯照射条件下FFA、pCBA和TMP的光降解反应速率常数分别为汞灯照射条件下的2.9%~5.9%、9.6%~20.7%和0.9%~2.7%。另一方面,不同DOM在氙灯和在汞灯照射条件下产生活性物质的强弱趋势可能有所相同。如SRHA产生·OH和3DOM*的能力在氙灯照射条件下小于SRNOM,在汞灯照射条件下则高于SRNOM,这可能是由于氙灯和汞灯发射的光谱和光强不同造成的。但SRHA产生1O2的能力在氙灯和汞灯照射下始终大于SRNOM,这可能是由于SRHA含有更高的芳香碳[24]。
环境pH也会影响不同光源照射条件下DOM的活性物质产生能力。在汞灯照射下,当pH从6增加到7时,SRHA产生1O2的能力显著降低,产生·OH和3DOM*的能力无显著性差异;SRNOM产生·OH的能力显著下降,而产生1O2和3DOM*的能力并未表现出显著差异。这说明pH能够改变DOM的结构特征,从而改变其吸光性能及其活性物质的产生能力[13]。在氙灯照射下,当pH从6增加到7时,SRHA和SRNOM的1O2产生能力显著降低,·OH和3DOM*的产生能力略有降低或无明显差异。这与Dalrymple等[25]研究发现的Suwannee河中的DOM光致生成1O2量子产率随溶液pH增大而减小是一致。
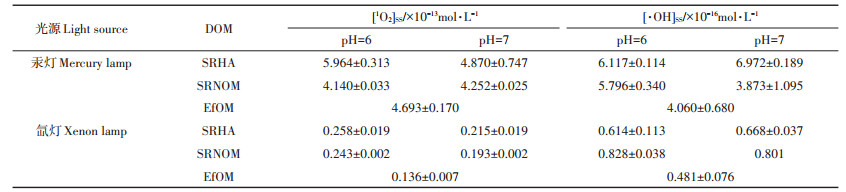
根据公式(3)和(4)计算得到不同来源DOM生成的1O2和·OH的稳态浓度见表 2。由表 2可见,在汞灯照射下,不同来源DOM产生的1O2的稳态浓度在(4.140~5.964)×10-13 mol·L-1范围内,产生的·OH的稳态浓度在(3.873~6.972)×10-16 mol·L-1范围内。在氙灯照射下,DOM产生的1O2和·OH的稳态浓度比汞灯照射条件下低一个数量级,1O2的稳态浓度在(0.136~0.258)× 10-13 mol · L-1范围内,·OH的稳态浓度在(0.481~0.828)×10-16 mol·L-1范围内。Zhang等[26]研究发现,在光源为1700W氙灯和pH为8的条件下,SRHA和EfOM产生的1O2的稳态浓度分别为4.9 × 10-13 mol·L-1和4.1×10-13 mol·L-1;SRHA和EfOM产生的·OH的稳态浓度为3.4×10-17 mol·L-1和2.2×10-17 mol·L-1。Mostafa等[27]研究发现SRHA和SRNOM产生的1O2的稳态浓度为9.4×10-14 mol·L-1和6.2×10-14 mol· L-1,这些报道基本上与本研究中1O2和·OH的稳态浓度在一个数量级上。Dong等[28]研究发现EfOM产生·OH的表观量子产率为(6.1~9.8)× 10-5,高于SRNOM和SRHA产生·OH的表观量子产率(2.99~4.56)×10-5,但是在本研究和Zhang等[26]的研究中都发现,SRHA产生的·OH的稳态浓度高于EfOM,这可能是由于EfOM中的SMPs和·OH具有较高的反应活性,消耗EfOM产生的·OH造成的[26]。此外,光源、水中共存离子和溶解氧等因素也可能会影响EfOM体系中·OH的稳态浓度。值得注意的是,本研究中发现EfOM产生的3DOM*能力显著高于SRHA和SRNOM,而3DOM*也在抗生素等有机物光降解中发挥着非常重要的作用[29-30],因此EfOM具有更高的3DOM*产生能力可能是其更能促进抗生素等有机污染物降解的原因之一。
|
|
表 2 不同来源DOM在pH 6和pH 7时生成的1O2和·OH的稳态浓度 Table 2 Steady state concentrations of 1O2 and ·OH generated by DOM from different sources at pH 6 and pH 7 |
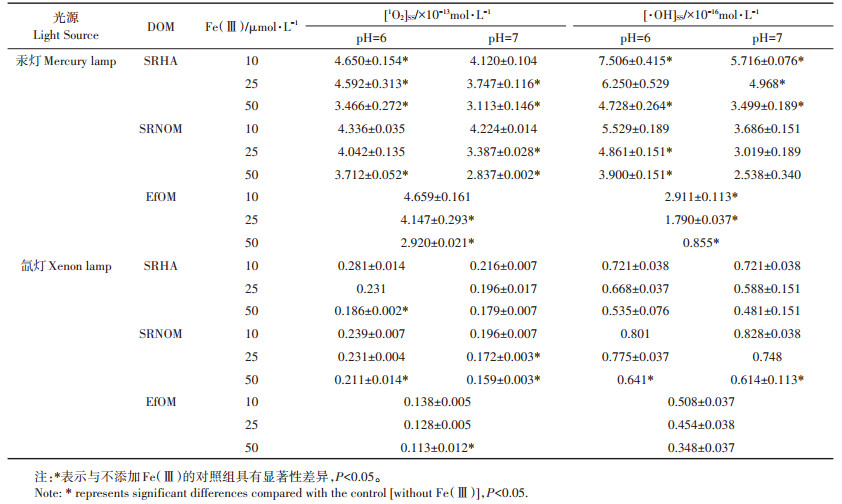
表 3列出了不同浓度Fe(Ⅲ)对DOM光解产生的1O2的稳态浓度的影响。由表 3可见,除汞灯照射条件时,10 μmol·L-1的Fe(Ⅲ)显著降低了pH6 SRHA溶液产生的1O2的稳态浓度外,其他条件下,10 μmol· L-1的Fe(Ⅲ)对SRHA、SRNOM和EfOM产生1O2的稳态浓度均没有显著影响。但是,当Fe(Ⅲ)浓度增加到25 μmol·L-1和50 μmol·L-1时,不同DOM产生的1O2的稳态浓度均随Fe(Ⅲ)浓度的增加而降低,说明较高浓度的Fe(Ⅲ)抑制了DOM产生1O2的能力。另一方面,Fe(Ⅲ)对不同DOM产生1O2的抑制程度并不相同。Fe(Ⅲ)对pH为6的SRNOM溶液产生的1O2稳态浓度的抑制效应相对较弱,在汞灯和氙灯照射条件下,Fe(Ⅲ)浓度为50 μmol·L-1时,pH6的SRNOM溶液产生1O2的稳态浓度分别降低了10.34%和13.17%;Fe(Ⅲ)对pH6的SRHA产生1O2的抑制效应则相对较强,在汞灯和氙灯照射下,Fe(Ⅲ)浓度为50 μmol·L-1时,pH6的SRHA溶液产生1O2的稳态浓度分别降低了41.88%和27.91%。
|
|
表 3 DOM与Fe(Ⅲ)共存时生成1O2和·OH的稳态浓度 Table 3 Steady state concentrations of 1O2 and ·OH when DOM and Fe(Ⅲ) coexist |
不同浓度Fe(Ⅲ)共存时,DOM产生的· OH的稳态浓度如表 3所示。10 μmol·L-1和25 μmol·L-1的Fe(Ⅲ)能够促进pH6的SRHA体系中·OH的产生,在汞灯和氙灯照射下,10 μmol·L-1的Fe(Ⅲ)使pH6的SRHA体系产生的·OH的稳态浓度提高了22.71%和17.43%。另一方面,10 μmol·L-1的Fe(Ⅲ)使汞灯照射下的EfOM体系产生的·OH的稳态浓度降低了28.30%。10 μmol·L-1的Fe(Ⅲ)对其他条件下的DOM体系产生·OH的稳态浓度无显著影响。在其他实验条件下,Fe(Ⅲ)的存在总体上对DOM产生·OH的效应表现为抑制作用,并随Fe(Ⅲ)浓度的增加而增加。与Fe(Ⅲ)对DOM产生1O2的影响一样,Fe(Ⅲ)对不同DOM产生·OH的影响也不相同。Fe(Ⅲ)对pH6的SRHA体系产生的·OH的影响较小,在Fe(Ⅲ)浓度为50 μmol·L-1时,汞灯和氙灯照射条件下,pH6的SRHA体系产生的·OH的稳态浓度分别降低了22.70%和12.87%。汞灯照射条件下,Fe(Ⅲ)对EfOM体系产生·OH的影响最大,在Fe(Ⅲ)浓度为50 μmol·L-1时,EfOM体系产生的·OH的稳态浓度降低了78.94%。在氙灯照射条件下,Fe(Ⅲ)对pH7的SRHA体系和EfOM体系产生·OH的影响较大,50 μmol·L-1的Fe(Ⅲ)使这两个体系产生的·OH的稳态浓度分别降低了27.99%和27.65%。高浓度的Fe(Ⅲ)对DOM产生·OH的抑制作用可能是由于Fe(Ⅲ)与DOM形成了络合物,具有与单一DOM不同的吸光特性(图 3),从而改变其产生活性物质的能力。

|
HA+Fe、NOM+Fe、EfOM+Fe表示HA、NOM、EfOM和Fe的吸光度的加和,Fe的浓度为50 μmol·L-1 HA+Fe, NOM+Fe, and EfOM+Fe represent the sum of absorbance of HA or NOM or EfOM and Fe, the concentration of Fe is 50 μmol·L-1 图 3 DOM-Fe溶液的紫外可见吸收光谱 Figure 3 UV-vis absorption spectra of DOM-Fe solutions |
以TMP为3DOM*的分子探针,通过TMP的光降解的反应速率常数可以反映DOM产生的3DOM*的性能[20]。Fe(Ⅲ)对不同DOM光致TMP降解的一级反应速率常数的影响如图 2所示。10 μmol·L-1的Fe(Ⅲ)除了在汞灯照射下显著抑制了pH7 SRHA体系中TMP的光降解外,其他条件下对TMP的光降解均无显著影响。25~50 μmol·L-1的Fe(Ⅲ)对TMP的光降解均表现为抑制作用,特别是50 μmol·L-1的Fe(Ⅲ),除对氙灯照射下EfOM体系的TMP的光降解无显著影响外,其他条件下对TMP的光降解均表现为显著的抑制作用。汞灯照射下,Fe(Ⅲ)对不同DOM的TMP的抑制效应相差不大,50 μmol·L-1的Fe(Ⅲ)对不同DOM产生3DOM*的抑制率在22.63%(SRNOMpH6)到29.74%(SRHA-pH7)范围内。在氙灯照射下,Fe(Ⅲ)对不同DOM光致TMP降解的影响差异较大,其对pH6条件下的SRNOM的抑制较弱,对SRHA的抑制较强。50 μmol·L-1的Fe(Ⅲ)使pH6条件下的SRNOM、SRHA和pH7的SRHA体系中TMP的光解反应速率常数分别降低了13.87%、40.83%和40.24%。

|
不同小写字母表示同一DOM体系中不同Fe(Ⅲ)浓度间具有显著性差异(P < 0.05) Different lowercase letters indicate significant differences between the different Fe(Ⅲ) concentration groups in the same DOM system(P < 0.05) 图 2 汞灯和氙灯照射下,不同浓度Fe(Ⅲ)对DOM引发TMP光降解反应速率常数的影响 Figure 2 Effect of different concentrations of Fe(Ⅲ) on the rate constant of TMP photodegradation induced by DOM under the irradiation of mercury and xenon lamps |
综上,低浓度的Fe(Ⅲ)(10 μmol· L-1)对不同DOM产生活性物质的性能无显著影响,而高浓度的Fe(Ⅲ)(25~50 μmol·L-1)对不同DOM产生活性物质的影响表现为抑制作用,并随Fe(Ⅲ)浓度的增加而增加。事实上,Fe(Ⅲ)可能对污染物的光降解表现为双重作用:一方面,Fe(Ⅲ)对光的竞争吸附效应可抑制污染物的光降解,另一方面,Fe(Ⅲ)也可能通过氧化还原循环产生·OH促进污染物的光降解[31]。如Ou等[32]研究发现Fe(Ⅲ)能与腐植酸(HA)的-COOH结合形成络合物,在光照作用下,通过配体至金属电子转移还原成Fe(Ⅱ),并与H2O2反应生成·OH,促进了阿特拉津的降解。Ge等[33-34]发现Fe(Ⅲ)可能通过光屏蔽效应抑制了沙拉沙星和氟苯尼考的光降解。在本研究中,高浓度的Fe(Ⅲ)抑制了活性物种的生成,可能也是由于Fe和DOM形成的络合物的吸光特性和/或Fe的光屏蔽效应造成的。图 3为DOM和Fe溶液的紫外可见吸收光谱,由图 3可见,在pH6条件下,SRHA与Fe络合后对 < 340 nm的光的吸收减弱,对 > 340 nm的光的吸收略有增强;EfOM与Fe络合后对 < 320 nm的光的吸收减弱,对 > 320 nm的光的吸收增强,这说明DOM与Fe形成络合物,改变了DOM的吸光特性,使其对低波长的光吸收减弱,而对高波长的光的吸收增强,导致DOM吸收的光子总能量降低,进而导致产生的活性物种的浓度降低。在pH6条件下,SRNOM与Fe并未发生明显的络合(NOM-Fe的吸光度与NOM和Fe的吸光度之和重合),这种情况下,Fe的屏蔽效应可能是其抑制DOM产生活性物质的主要原因。此外,Fe-DOM的络合物在光照作用下可被还原成Fe(Ⅱ),而Fe(Ⅱ)本身也会消耗·OH等活性物质[35],这可能也是导致DOM和Fe共存体系活性物质的稳态浓度较低的原因之一。
2.3 DOM/Fe的光化学活性与其光学特征的关系DOM的结构组成复杂,其光学特征,如254 nm的吸光度(A254)、250 nm与365 nm处的吸光度比值(E2/E3)等可以在一定程度上反映DOM的结构特征[36-37]。研究发现,E2/E3可以反映DOM的分子量大小和芳香化合物的含量,并与DOM产生活性物质的量子产率呈正相关的关系[36-37]。图 4展示了不同DOM及其与Fe共存体系的E2/E3值与其产生的活性物质能力的相关关系。由图 4可见,单一DOM及其与Fe共存体系的E2/E3值与其产生活性物质的能力具有较好的正相关关系,但是E2/E3与不同DOM体系的活性物质产生能力则没有明显的相关关系,这可能是由不同DOM的化学结构差异造成的。另一方面,不同DOM溶液随着Fe(Ⅲ)浓度的增加,其E2/E3值也随之减小,这与Poulin等[38]研究发现添加铁离子会引起DOM溶液的E2/E3减小是一致的。同时,E2/E3值减小也说明DOM与Fe形成了络合物,导致其分子量增加,在光降解过程中释放出更少的活性物质,这与Fe(Ⅲ)对DOM产生活性物质的抑制随Fe(Ⅲ)浓度增加而增加是一致的。
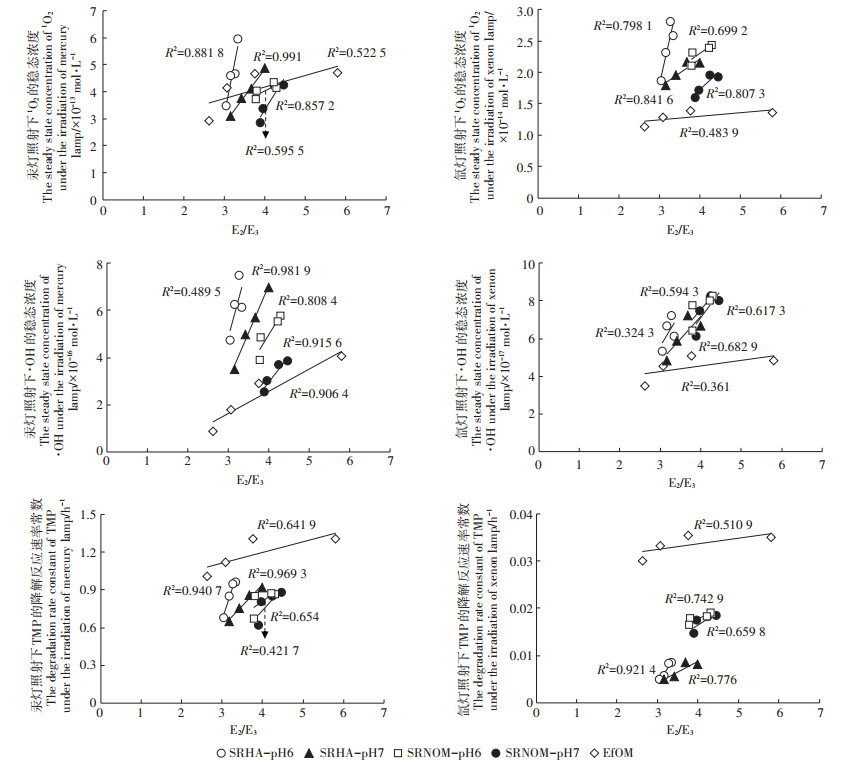
|
图 4 DOM/Fe溶液的E2/E3值与其产生的1O2、·OH稳态浓度和TMP的光降解速率常数的关系 Figure 4 Correlation between the E2/E3 value of DOM/Fe and the steady state concentration of 1O2 and ·OH and the degradation kinetic rate constant of TMP generated by DOM/Fe |
(1)不同来源的DOM生成活性物质1O2、·OH和3DOM*的能力不同,且受到光源和pH的影响;汞灯照射下DOM产生活性物质的能力显著高于氙灯照射条件下;总体上,SRHA和SRNOM具有更高的1O2和· OH生成效能,而EfOM具有更高的3DOM*生成效能。
(2)低浓度的Fe(Ⅲ)(10 μmol·L-1)对DOM产生活性物种的能力无显著影响,高浓度的Fe(Ⅲ)(25~50 μmol·L-1)对DOM产生活性物质的能力表现为抑制作用,且随Fe(Ⅲ)浓度的增加,抑制效应增强。
(3)单一DOM/Fe体系的E2/E3与其产生1O2、·OH的稳态浓度以及TMP的光降解反应速率常数具有正相关关系,因此可以采用E2/E3预测DOM/Fe体系的活性物质产生能力。
| [1] |
吴丰昌, 王立英, 黎文, 等. 天然有机质及其在地表环境中的重要性[J]. 湖泊科学, 2008, 20(1): 1-12. WU Feng-chang, WANG Li-ying, LI Wen, et al. Natural organic matter and its significance in terrestrial surface environment[J]. Journal of Lake Sciences, 2008, 20(1): 1-12. DOI:10.3321/j.issn:1003-5427.2008.01.001 |
| [2] |
陈蕾, 沈超峰, 王郑, 等. 天然有机质对环境污染物的转化过程的介导作用[J]. 生态环境学报, 2013, 22(7): 1244-1249. CHEN Lei, SHEN Chao-feng, WANG Zheng, et al. Transformation of environmental pollutants mediated by natural organic matter[J]. Ecology and Environmental Sciences, 2013, 22(7): 1244-1249. DOI:10.3969/j.issn.1674-5906.2013.07.026 |
| [3] |
Yang S, Song W. Photo-transformation of pharmaceutically active compounds in the aqueous environment:A review[J]. Environmental Science:Processes and Impacts, 2014, 16(4): 697-720. DOI:10.1039/C3EM00502J |
| [4] |
Wang H, Wang M, Wang H, et al. Aqueous photochemical degradation of BDE-153 in solutions with natural dissolved organic matter[J]. Chemosphere, 2016, 155: 367-374. DOI:10.1016/j.chemosphere.2016.04.071 |
| [5] |
Yang W L, Sihem B A, Zheng Z, et al. Photochemical transformation of terbutaline(pharmaceutical) in simulated natural waters:Degradation kinetics and mechanisms[J]. Water Research, 2013, 47(17): 6558-6565. DOI:10.1016/j.watres.2013.08.029 |
| [6] |
Luciano C, Daniel Q M, Monica C G, et al. Photochemical fate of a mixture of emerging pollutants in the presence of humic substances[J]. Water Research, 2012, 46(15): 4732-4740. DOI:10.1016/j.watres.2012.06.022 |
| [7] |
Ryan C C, Tan D T, Arnold W A. Direct and indirect photolysis of sulfamethoxazole and trimethoprim in wastewater treatment plant effluent[J]. Water Research, 2011, 45(3): 1280-1286. DOI:10.1016/j.watres.2010.10.005 |
| [8] |
吕宝玲, 李威, 于筱莉, 等. 溶解性有机质对罗红霉素光降解的影响研究[J]. 环境科学学报, 2019, 39(3): 747-754. LÜ Bao-ling, LI Wei, YU Xiao-li, et al. Effect of dissolved organic matter on the photodegradation of roxithromycin[J]. Acta Scientiae Circumstantiae, 2019, 39(3): 747-754. |
| [9] |
Cawley K M, Korak J A, Rosario-Ortiz F L. Quantum yields for the formation of reactive intermediates fromdissolved organic matter samples from the Suwannee River[J]. Environmental Engineering Science, 2015, 32(1): 31-37. |
| [10] |
Zhou H, Lian L, Yan S, et al. Insights into the photo-induced formation of reactive intermediates from effluent organic matter:The role of chemical constituents[J]. Water Research, 2017, 112: 120-128. DOI:10.1016/j.watres.2017.01.048 |
| [11] |
Bodhipaksha L C, Sharpless C M, Chin Y P, et al. Triplet photochemistry of effluent and natural organic matter in whole water and isolates from effluent-receiving rivers[J]. Environmental Science & Technology, 2015, 49(6): 3453-3463. |
| [12] |
O'Connor M, Helal S R, Latch D E, et al. Quantifying photo-production of triplet excited states and singlet oxygen from effluent organic matter[J]. Water Research, 2019, 156: 23-33. DOI:10.1016/j.watres.2019.03.002 |
| [13] |
马哲, 王杰琼, 陈景文, 等. pH对不同来源溶解性有机质光致生成活性物种量子产率的影响[J]. 环境化学, 2017, 36(9): 1889-1895. MA Zhe, WANG Jie-qiong, CHEN Jing-wen, et al. Effect of pH on the quantum yield of reactive photo-induced species generated in different sources of DOM[J]. Environmental Chemistry, 2017, 36(9): 1889-1895. |
| [14] |
Jones M E, Beckler J S, Tailefert M. The flux of soluble organic-iron (Ⅲ) complexes from sediments represents a source of stable iron(Ⅲ) to estuarine waters and the contimental shelf[J]. Limnology and Oceanography, 2011, 56(5): 1811-1823. DOI:10.4319/lo.2011.56.5.1811 |
| [15] |
王兆慧, 宋文静, 马万红, 等. 铁配合物的环境光化学及其参与的环境化学过程[J]. 化学进展, 2012, 24(2/3): 423-432. WANG Zhao-hui, SONG Wen-jing, MA Wan-hong, et al. Environmental photochemistry of iron complexes and their involvement in environmental chemical processes[J]. Progress in Chemistry, 2012, 24(2/3): 423-432. |
| [16] |
Miller P, Chin Y P. Indirect photolysis promoted by natural and engineered wetland water constituents:Processes leading to alachlor degradation[J]. Environmental Science and Technology, 2005, 39(12): 4454-4462. DOI:10.1021/es049111e |
| [17] |
Batista A P S, Cottrell B A, Nogueira R F P. Photochemical transformation of antibiotics by excitation of Fe(Ⅲ)-complexes in aqueous medium[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2014, 274: 50-56. DOI:10.1016/j.jphotochem.2013.09.017 |
| [18] |
Ng T W, Chow A T, Wong P K. Dual roles of dissolved organic matter in photo-irradiated Fe(Ⅲ)-contained waters[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2014, 290: 116-124. DOI:10.1016/j.jphotochem.2014.06.011 |
| [19] |
Fu H, Liu K, Alvarez P J J, et al. Quantifying hydrophobicity of natural organic matter using partition coefficients in aqueous two-phase systems[J]. Chemosphere, 2019, 218: 922-929. DOI:10.1016/j.chemosphere.2018.11.183 |
| [20] |
Cawley K M, Korak J A, Rosario-Ortiz F L. Quantum yields for the formation of reactive intermediates from dissolved organic matter samples from the Suwannee River[J]. Environmental Engineering Science, 2015, 32(1): 31-37. |
| [21] |
Chen C Y, Jafvert C T. Photoreactivity of carboxylated single-walled carbon nanotubes in sunlight:Reactive oxygen species production in water[J]. Environmental Science & Technology, 2010, 44(17): 6674-6679. |
| [22] |
Zhang Y, Zhou L, Zeng C, et al. Photoreactivity of hydroxylated multiwalled carbon nanotubes and its effects on the photodegradation of atenolol in water[J]. Chemosphere, 2013, 93(9): 1747-1754. DOI:10.1016/j.chemosphere.2013.06.001 |
| [23] |
Xu H, Cooper W J, Jung J, et al. Photosensitized degradation of amoxicillin in natural organic matter isolate solutions[J]. Water Research, 2001, 45(2): 632-638. |
| [24] |
Rosado-Lausell S L, Wang H, Gutiérrez L, et al. Roles of singlet oxygen and triplet excited state of dissolved organic matter formed by different organic matters in bacteriophage MS2 inactivation[J]. Water Research, 2013, 47(14): 4869-4879. DOI:10.1016/j.watres.2013.05.018 |
| [25] |
Dalrymple R M, Carfagno A K, Sharpless C M. Correlations between dissolved organic matter optical properties and auantum yields of singlet oxygen and hydrogen peroxide[J]. Environmental Science & Technology, 2010, 44(15): 5824-5829. |
| [26] |
Zhang D, Yan S, Song W. Photochemically induced formation of reactive oxygen species(ROS) from effluent organic matter[J]. Environmental Science & Technology, 2014, 48(21): 12645-12653. |
| [27] |
Mostafa S, Rosario-Ortiz F L. Singlet oxygen formation from wastewater organic matter[J]. Environmental Science & Technology, 2013, 47(15): 8179-8186. |
| [28] |
Dong M M, Rosario-Ortiz F L. Photochemical formation of hydroxyl radical from effluent organic matter[J]. Environmental Science & Technology, 2012, 46(7): 3788-3794. |
| [29] |
Ryan C C, Tan D T, Arnold W A. Direct and indirect photolysis of sulfamethoxazole and trimethoprim in wastewater treatment plant effluent[J]. Water Research, 2011, 45(3): 1280-1286. DOI:10.1016/j.watres.2010.10.005 |
| [30] |
Wenk J, Gunten U, Canonica S, et al. Effect of dissolved organic matter on the transformation of contaminants induced by excited triplet states and the hydroxyl radical[J]. Environmental Science & Technology, 2011, 45(4): 1334-1340. |
| [31] |
Ge L K, Na G S, Chen C E, et al. Aqueous photochemical degradation of hydroxylated PAHs:Kinetics, pathways, and multivariate effects of main water constituents[J]. Science of the Total Environment, 2016, 547: 166-172. DOI:10.1016/j.scitotenv.2015.12.143 |
| [32] |
Ou X, Chen S, Quan X, et al. Photochemical activity and characterization of the complex of humic acids with iron(Ⅲ)[J]. Journal of Geochemical Exploration, 2009, 102(2): 49-55. DOI:10.1016/j.gexplo.2009.02.003 |
| [33] |
Ge L K, Chen J W, Wei X X, et al. Aquatic photochemistry of fluoroquinolone antibiotics:Kinetics, pathways, and multivariate effects of main water constituents[J]. Environmental Science & Technology, 2010, 44(7): 2400-2405. |
| [34] |
Ge L K, Chen J W, Qiao X L, et al. Light-source-dependent effects of main water constituents on photodegradation of phenicol antibiotics:Mechanism and kinetics[J]. Environmental Science & Technology, 2009, 43(9): 3101-3107. |
| [35] |
Wang Z H, Liu J S. New insight into photochemical oxidation of Fe(Ⅱ):The roles of Fe(Ⅲ) and reactive oxygen species[J]. Catalysis Today, 2014, 224: 244-250. DOI:10.1016/j.cattod.2013.09.063 |
| [36] |
Mckay G, Huang W, Romera-Castillo C, et al. Predicting reactive intermediate quantum yields from dissolved organic matter photolysis using optical properties and antioxidant capacity[J]. Environmental Science & Technology, 2017, 51(10): 5404-5413. |
| [37] |
刘雪石, 乔显亮, 刘远. DOM的光化学活性及其对污染物光解的影响[J]. 环境科学与技术, 2017, 40(1): 85-94. LIU Xue-shi, QIAO Xian-liang, LIU Yuan. Photoreactivity of DOM and its effect on the photo-transformation of pollutants[J]. Environmental Science & Technology, 2017, 40(1): 85-94. |
| [38] |
Poulin B A, Ryan J N, Aiken G R. Effects of iron on optical properties of dissolved organic matter[J]. Environmental Science & Technology, 2014, 48(17): 10098-10106. |
 2019, Vol. 38
2019, Vol. 38