2. 金华职业技术学院农业与生物工程学院, 浙江 金华 321007
2. College of Agricultural and Biological Engineering, Jinhua Polytechnic, Jinhua 321007, China
铝毒是酸性土壤中限制作物生长最普遍的非生物因素之一[1]。作物在长期的进化过程中,逐渐形成了如分泌螯合物(有机酸、酚类和黏液)[2]或磷酸根[3]、细胞壁固定[4]、根系pH提高[5]、根尖边缘细胞[6]以及根表铁膜[7]等耐铝能力以适应铝毒环境。根尖细胞壁作为植物响应铝毒的第一道屏障,既是铝毒害的最初位点,也是铝(Al)积累的主要部位,其在植物耐铝毒中的作用倍受关注[8-9]。细胞壁主要由多糖(果胶、半纤维素)组成,其中果胶的基本结构是聚半乳糖醛酸,其上大量带负电荷的羧基是Al结合的主要位点[10]。现有的研究中已经发现,豌豆(Pisumsativum)[11]、紫花苜蓿(Medicago sativa)[12]和水稻(Oryza sativa L.)[13]根尖的细胞壁果胶含量与根尖Al积累显著正相关。Yang等[5]指出拟南芥(Arabidopsis thaliana)细胞壁结合的Al有75%分布在半纤维素,20%分布在果胶。可见,植物细胞壁的多糖组分对根系上Al的积累起到了至关重要的作用。
淹水环境中水生植物根系具有特殊的通气组织能将地上部的氧气运输至根系,释放的氧气把根系周围的Fe2+氧化形成铁氧化物胶膜(铁膜,IP)附着在植物根表[14-15]。铁膜属于两性胶体,与自然界中的铁氧化物具有相似的特征,它可以通过吸附、共沉淀等作用,改变Cd、Pb、As等重金属[16-17]及氧化铜纳米颗粒[18]的存在形态,影响其生物有效性。研究已经证明,铁膜能将Al固定在水稻根表,阻止根系对Al的吸收以及向地上部的运输[19]。磷(P)作为植物生长发育的必需元素之一,在植物Al的吸收和运输中也起到了一定的作用,如于姣妲等[20]发现磷能够改变杉木(Cunninghamia lanceolata)幼苗细胞内抗氧化酶的活性以及离子转运,增加Al向液泡的转移,降低Al在细胞壁中的积累。此外,细胞壁组分也参与了和磷相关的抗铝毒过程。例如,在缺磷状态下,水稻根系的磷脂和果胶的含量降低或者酸性磷酸酶(APA)活性提高以提供更多的磷与Al结合钝化,由此提高耐铝性[21]。磷充足时,磷通过与Al在荞麦根细胞壁中形成不溶性沉淀[22]或通过降低耐铝性水稻细胞壁多糖含量以减少Al结合位点[23],表明铝毒胁迫下磷能通过改变根系细胞壁组分提高耐铝性。
以往的研究主要侧重于铁膜或磷单一因素对水稻耐铝性的影响,而铁膜以及吸附于铁膜上的磷对水稻根尖细胞壁组分和耐铝性的影响及其相互作用需要进一步探索。因此,本研究以耐铝能力有显著差异的两个水稻基因型为材料,研究铝毒作用下铁膜和覆铁膜供磷对水稻生长以及细胞壁多糖含量的影响,从而进一步探究铁膜和磷对水稻铝耐性的交互作用。
1 材料与方法 1.1 试验材料水稻(Oryza sativa L.)品种选用菲优多系1号(耐铝毒基因型)和红良优166(铝毒敏感基因型),种子由三才种业公司提供[19]。
1.2 植株培养及试验处理种子经0.1%的H2O2消毒30 min后用蒸馏水漂洗并浸种24 h,转移到28 ℃、湿度为80%的培养箱中进行催芽,露白后将长势良好的幼苗转移到含有4 L的全营养液[24]中进行水培育苗,待水稻长至两叶时转移到16孔的塑料板上,将塑料板放入含10 L全营养液的塑料桶中培养,每孔种2株,每3 d更换一次营养液。15 d后取长势一致的水稻,先用去离子水浸泡水稻根系3次,再用0.05 mmol·L-1 CaCl2浸泡30 min,然后用去离子水清洗3次去除根表的CaCl2溶液后进行铁膜、磷和铝毒诱导,过程分为如下5组:(1)CK,全营养液(pH5.0)培养;(2)Al,50 μmol·L-1 Al3+溶液(含0.05 mmol·L-1 CaCl2,pH5.0)处理48 h;(3)IP+Al,40 mg·L-1 Fe(Ⅱ)的全营养液(pH5.0)处理24 h后,用去离子水清洗根部3次,再用0.05 mmol·L-1 CaCl2浸泡30 min,接着用去离子水清洗3次去除根表的CaCl2溶液,再全部转移到50 μmol · L-1 Al3+溶液(含0.05 mmol·L-1 CaCl2)中,处理48 h;(4)IP+Al+P15,40 mg· L-1 Fe(Ⅱ)的全营养液处理24 h诱导铁膜形成,经去离子水和0.05 mmol·L-1CaCl2溶液清洗完全后转移至15 mg·L-1磷水平的NaH2PO4溶液(pH5.0)中处理24 h,之后继续用去离子水和CaCl2溶液洗净根部,再进行50 μmol·L-1 Al3+溶液(含0.05 mmol·L-1 CaCl2)处理48 h;(5)IP+Al+P30,40 mg·L-1 Fe(Ⅱ)的全营养液处理24 h诱导铁膜形成,经去离子水和CaCl2溶液清洗,再转移至30 mg·L-1磷的NaH2PO4溶液(pH5.0)中处理24 h,之后继续用去离子水和0.05 mmol·L-1CaCl2溶液洗净根部,再进行50 μmol · L-1 Al3+溶液(含0.05 mmol·L-1 CaCl2)处理48 h。Al3+均以AlCl3·6H2O形态供应,Fe(Ⅱ)均以Fe(Ⅱ)-EDTA形态供应,磷均以NaH2PO4·2H2O形态供应,各处理溶液pH每日均用1 mol·L-1 NaOH和1 mol·L-1 HCl调节至pH5.0,各处理组水稻总生长天数一致。
1.3 测定方法 1.3.1 水稻生物量测定水稻收获后,用去离子水冲洗干净,分离地上部和根系两部分,地上部于105 ℃杀青30 min后,放在70 ℃烘干至恒质量,称量即为地上部干质量。根系先用连二亚硫酸钠-柠檬酸钠-碳酸氢钠(DCB)浸提除去铁膜后用去离子水洗净,杀青烘干至恒质量,称量即为根系干质量,每个处理重复3次。
1.3.2 水稻根尖Al测定每个处理选取30个1 cm长的根尖经去离子水和0.05 mmol·L-1 CaCl2清洗后置于1.5 mL的离心管中,加入1 mL 2 mol·L-1 HCl溶液振荡浸提24 h。浸提液经ICP-AES测定Al含量。每个处理重复3次。
1.3.3 根表铁膜的Fe含量测定水稻先用去离子水和0.05 mmol·L-1 CaCl2去除根表残留的营养液后,选取每组中长势相同的3株水稻根系,经DCB处理提取铁膜,将去除铁膜后的3株水稻根用去离子水反复冲洗干净后烘干,称量其干质量。采用ICP-AES测定DCB提取液中的Fe含量。用铁膜中的Fe含量表示铁膜含量,单位为g·kg-1 DW。
1.3.4 根尖细胞壁多糖组分的测定水稻先用去离子水和0.05 mmol·L-1 CaCl2去除根表残留的营养液后,参照Zhong等[25]的细胞壁组分的提取方法。取各组提取所得的上清液150 μL进行细胞壁多糖组分测定,加入250 μL冰乙酸中和后加入硫酸-硼砂2.4 mL,100 ℃下水浴5 min,在冰中立即冷却后加入40 μL 0.15%间羟基联苯,放置20 min后在520 nm下比色,标准空白以0.5% NaOH代替间羟基联苯。果胶、半纤维素含量用糖醛酸含量表示。每个处理重复3次。
1.3.5 根尖酸性磷酸酶(APA)活性测定水稻先用去离子水和0.05 mmol·L-1 CaCl2去除根表残留的营养液后,参照秦丽凤APA活性的测定方法,酶活性以单位时间内每克蛋白水解对硝基苯磷酸二钠(ρ-NPP)生成对硝基苯酚(NP)的量(gNP·g-1Pr· h-1)表示[26]。每个处理重复3次。
1.4 数据处理根据1.3中各指标测定所得数据计算平均值和标准误差,采用Excel 2013软件制图,并用SPSS 21.0进行统计分析。
2 结果与分析 2.1 铁膜和磷对铝毒下水稻生物量的影响Al处理下菲优多系1号和红良优166地上部和根系生长受到显著抑制,根系干质量分别比对照下降了32.4%和35.8%,地上部干质量分别比对照下降了26.5%和37.9%,其中铝敏感基因型红良优166降幅较大(图 1)。IP+Al处理的红良优166根系和地上部干质量显著高于Al处理组水稻。较IP+Al处理,15 mg·L-1磷处理后的两基因型水稻的地上部和根系干质量变化差异不明显,而当30 mg·L-1磷处理时根系干质量达显著差异,分别增加了20.4%和22.6%,表明水稻根表铁膜形成后能有效缓解铝毒,较高浓度的外源磷处理覆铁膜水稻,能进一步降低Al对水稻根系的损伤。
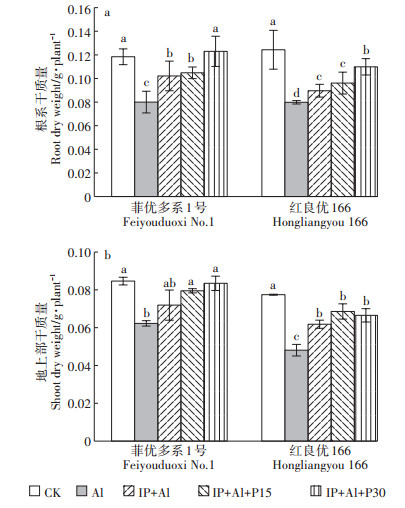
|
不同小写字母表示处理间差异显著(P < 0.05)。下同 Different lowercase letters indicate significant differences among treatments (P < 0.05). The same below 图 1 铁膜和磷对铝毒下水稻根系和地上部干质量的影响 Figure 1 Effects of iron plaque and P on dry weight of rice roots and shoots under aluminum toxicity |
单Al处理下菲优多系1号和红良优166根尖Al含量明显增多,均比对照增加433.3%(图 2)。IP+Al处理下菲优多系1号和红良优166的根尖Al含量分别比单Al处理降低了15.6%和33.3%,说明铁膜有效降低了水稻根尖Al含量,这种改善的效果在敏感型水稻红良优166中更明显。同时,随着外源磷处理浓度增加,菲优多系1号的根尖Al含量也逐渐降低,IP+ Al+P30处理时菲优多系1号根尖Al含量比IP+Al处理降低55.6%,表明铁膜与外源磷的联合处理能有效降低根尖Al含量,该种作用对菲优多系1号更有效。
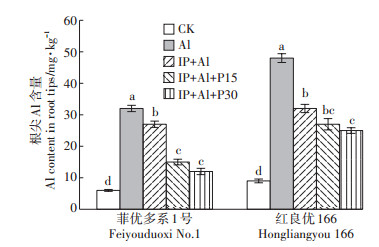
|
图 2 铁膜和磷对铝毒下两个基因型水稻根尖Al含量的影响 Figure 2 Effects of iron plaque and P on Al content in root tips of rice under aluminum toxicity |
外源Fe(Ⅱ)处理下,IP+Al、IP+Al+P15、IP+Al+ P30的水稻根表铁膜中的Fe含量显著高于无Fe(Ⅱ)处理的CK和Al处理,与Al处理相比菲优多系1号和红良优166各组的增幅达434.5%和488.8%、621.3%和265.5%、295.3%和344.3%,红良优166根表的铁膜2683农业环境科学学报第38卷第12期厚度高于菲优多系1号(图 3)。表明Fe(Ⅱ)处理诱导根表形成大量铁膜。
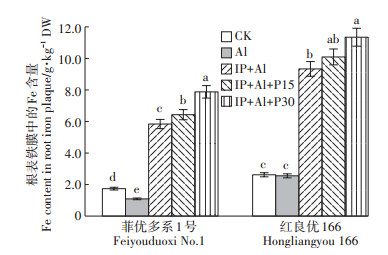
|
图 3 铁膜和磷对铝毒下两个基因型水稻根表铁膜中Fe含量的影响 Figure 3 Effect of Fe (Ⅱ) and P treatment on iron plaque formation on root surface of rice under aluminum toxicity |
Al处理下菲优多系1号和红良优166根尖细胞壁果胶含量分别比对照增加18.6%和27.8%(图 4)。IP+Al处理时两基因型水稻根尖细胞壁果胶含量分别比Al处理减少了22.6%和29.9%。随着外源磷的加入,两基因型水稻根尖细胞壁果胶含量均显著降低,与Al处理组相比,菲优多系1号和红良优166在IP+ Al+P15处理下根尖果胶含量分别下降了33.7%和45.7%,在IP+Al+P30处理下根尖果胶含量降幅达43.3%和57.8%,表明根表有铁膜存在时,水稻根尖的细胞壁果胶含量随着磷处理浓度增加而降低,水稻根尖果胶含量的变化同时说明了磷能够有效降低覆铁膜水稻根尖细胞壁果胶含量。

|
图 4 铁膜和磷对铝毒下水稻根尖细胞壁果胶含量的影响 Figure 4 Effects of iron plaque and P on pectin content in cell wall of root tips under aluminum toxicity |
与对照相比,单Al处理下菲优多系1号和红良优166的半纤维素1含量分别增加了66.1%和182.7%,红良优166增幅远大于菲优多系1号(图 5)。IP+Al处理的根尖细胞壁半纤维素1含量较Al处理下降22.6%和29.9%,铁膜和磷共同处理下根尖细胞壁半纤维素1含量比铁膜单独处理时降幅更大,其中IP+ Al+P15处理组降幅分别为21.0%和41.5%,IP+Al+ P30处理组降幅分别为20.5%和40.2%,表明铁膜能够降低Al处理下根尖细胞壁半纤维素1的产生,外源磷能进一步降低覆铁膜水稻半纤维素1的含量。
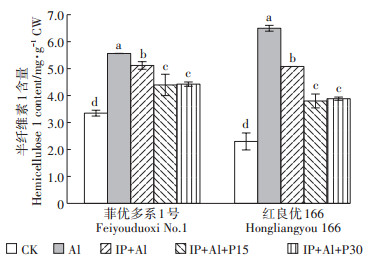
|
图 5 铁膜和磷对铝毒下水稻根尖细胞壁半纤维素1含量的影响 Figure 5 Effects of iron plaque and P on hemicellulose 1 content in cell wall of root tips under aluminum toxicity |
根尖细胞壁半纤维素2含量变化与半纤维素1含量变化基本一致(图 6)。单Al处理下,根尖细胞壁半纤维素2含量与对照相比显著上升,但与单Al处理相比,菲优多系1号和红良优166根尖细胞壁半纤维素2含量在IP+Al处理下分别下降了28.4%和28.1%,IP+Al+P15处理降低42.7%和43.0%,IP+Al+P30处理降低了44.8%和45.3%。表明根表铁膜和外源磷处理能有效降低Al诱导的细胞壁半纤维素2含量的增加。
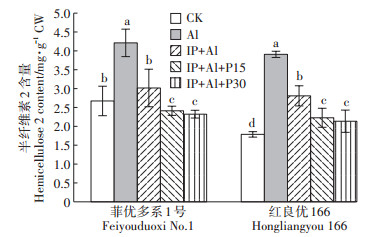
|
图 6 铁膜和磷对铝毒下水稻根尖细胞壁半纤维素2含量的影响 Figure 6 Effects of iron plaque and P on hemicellulose 2 content in cell wall of root tips under aluminum toxicity |
Al处理48 h后菲优多系1号的APA活性在各处理组均无显著性差异,IP+Al处理96 h APA的活性显著增加(图 7),而红良优166的IP+Al处理组的APA活性在Al处理48 h和96 h下均显示出明显的增强,表明低磷状态是水稻根系APA活性急剧增加的主要原因,较短时间内覆铁膜的菲优多系1号能更有效地吸收可溶性磷来对抗低磷环境,同时耐受型水稻显示出更强的抗低磷能力。
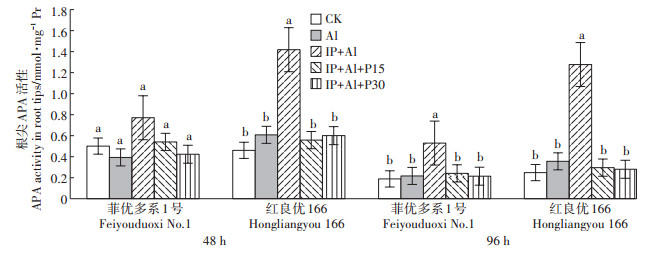
|
图 7 铁膜和磷对铝毒下水稻根尖APA含量的影响 Figure 7 Effects of iron plaque and P on APA content in rice root tips under aluminum toxicity |
铁膜能吸附Cd、As等有害金属[27],有效缓解其对植物生长的损伤[28-29]。Chen等[30]发现水稻根表铁膜可以将Al吸附在根表,同时铁离子能预饱和水稻根尖Al的结合位点,减轻根系对Al的吸收。本实验中经Fe(Ⅱ)处理后水稻根表铁膜大量形成(图 3),显著减少了根尖Al含量(图 2),缓解了铝毒导致的水稻根系以及地上部生物量的降低(图 1),说明铁膜的存在能有效阻止Al进入水稻根尖,减缓铝毒对水稻生长的抑制作用。Dai等[31]在对红树林的研究中发现施加外源磷增强了铁膜对Cd的吸附能力。因此,本实验采用覆铁膜水稻经不同浓度外源磷处理来分析铁膜对水稻耐铝的作用。结果表明外源磷处理明显降低铝耐受型水稻菲优多系1号的根尖Al含量,磷浓度达30 mg·L-1时,两基因型水稻根系干质量显著增加,菲优多系1号的根尖Al含量进一步降低(见图 1~图 3),由此表明,外源磷降低了Al在耐受型覆铁膜水稻根尖的积累,较高浓度的磷能缓解Al对覆铁膜水稻根系生长的抑制,增强了水稻的耐铝效应。
水稻根表铁膜是一个磷储藏库,能从贫营养环境吸附磷从而满足植物生长的需要[32]。Batty等[33]提出Al能与磷酸盐共沉淀形成难溶的磷酸铝,Al胁迫下铁膜的形成和磷处理后铁膜上吸附磷的增加为磷和Al在铁膜表面的反应与沉积提供了条件,因此在菲优多系中观察到磷处理后根尖Al含量的降低可能是由于铁膜上的磷酸盐和Al反应形成稳定的铝磷酸盐络合物[34],而降低了根尖Al的积累。
细胞壁在植物应对铝毒时起着至关重要的作用。Yang等[35-36]发现在Al处理后,铝敏感水稻细胞壁中的果胶以及Al含量显著高于耐铝水稻,在五加科植物三七[Panaxnotoginseng(Burk.)F.H.Chen]的根中,83%的Al结合在根细胞壁的果胶上,Zhu等[37]分析了CO2对铝毒作用下水稻细胞壁组分的影响,发现水稻培养环境中较高的CO2浓度诱导细胞壁中半纤维素含量降低从而缓解铝毒对水稻根系的损伤,表明细胞壁多糖含量与植物铝耐受性相关,通过外源介质调控细胞壁多糖组分含量能够缓解铝毒。磷处理显著降低了覆铁膜水稻菲优多系1号的根系细胞壁多糖含量,与IP+Al相比,IP+Al+P15处理组的根尖细胞壁果胶含量降幅为33.7%(图 3),半纤维素1、半纤维素2含量的降幅分别为21.0%和41.5%(图 4~图 5),IP+Al+P30处理使菲优多系的根尖细胞壁果胶含量进一步减少,降幅达到43.3%,根系细胞壁多糖的含量变化直接影响了根系细胞的伸展[38],细胞壁多糖的增加引起细胞壁的硬化[39],从而抑制了根系的伸长。本试验中细胞壁多糖含量降低后根细胞的伸展性得到提高,因此磷缓解了铝毒对根系生长的抑制作用,增强覆铁膜水稻尤其是铝耐受型水稻的耐铝作用。细胞壁多糖是重金属离子的主要结合位点[5, 10, 35]。从细胞壁多糖的成分来看,果胶含量随着磷处理浓度的增加而降低。果胶富含同聚半乳糖醛酸,在其C6位上的游离羧基能够与金属阳离子结合[10, 40],其含量降低后Al在根尖的结合位点减少,从而缓解了铝毒对水稻根系的损伤。
此外,植物能引发一系列适应性反应来抵御低磷环境,其中包括APA的诱导和分泌,APA能将环境中植物无法吸收的有机磷转化为利于植物吸收的无机磷形态[41]。试验中发现菲优多系1号在48 h时各个处理组根系的APA含量无显著差异,在96 h时IP+Al+P0组的APA含量显著增加,而对于红良优166,处理48 h时IP+Al+P0组的APA含量已经呈现出显著的差异(图 7),表明磷在铝敏感型水稻抗铝过程中具有重要作用,在低磷环境中水稻通过分泌大量APA来增加可用的磷,从而提高覆铁膜水稻的铝耐受性。
4 结论(1)50 μmol·L-1 Al处理显著降低水稻根系和地上部干质量,增加根尖Al含量和细胞壁果胶、半纤维素1以及半纤维素2含量。
(2)根表覆铁膜处理下,菲优多系1号和红良优166通过降低根尖细胞壁的果胶、半纤维素1和半纤维素2含量,减轻Al对水稻生长的抑制,增加水稻根系和地上部干质量。
(3)覆铁膜水稻经磷处理,根尖细胞壁的果胶、半纤维素1和半纤维素2的含量显著降低,从而减少Al在根尖的沉积,减轻根生长受抑程度。
| [1] |
沈仁芳, 赵学强. 酸性土壤可持续利用[J]. 农学学报, 2019, 9(3): 16-20. SHEN Ren-fang, ZHAO Xue-qiang. The sustainable use of acid soils[J]. The Journal of Agriculture, 2019, 9(3): 16-20. |
| [2] |
Riaz M, Yan L, Wu X W, et al. Mechanisms of organic acids and boron induced tolerance of aluminum toxicity:A review[J]. Ecotoxicology and Environment Safety, 2018, 165: 25-35. DOI:10.1016/j.ecoenv.2018.08.087 |
| [3] |
Zhou J Q, Ai Z Z, Wang H, et al. Phosphorus alleviates aluminum toxicity in Camellia oleifera seedlings[J]. International Journal of Agriculture and Biology, 2019, 21(1): 237-243. |
| [4] |
唐剑锋, 林咸永, 章永松, 等. 小麦根系对铝毒的反应及其与根细胞壁组分和细胞壁对铝的吸附-解吸性能的关系[J]. 生态学报, 2005, 25(8): 1890-1897. TANG Jian-feng, LIN Xian-yong, ZHANG Yong-song, et al. Wheat root responses to aluminum toxicity in relation to cell wall composition and adsorption-desorption of aluminum by cell wall in root tips[J]. Acta Ecologica Sinica, 2005, 25(8): 1890-1897. DOI:10.3321/j.issn:1000-0933.2005.08.009 |
| [5] |
Yang J L, Zhu X F, Peng Y X, et al. Cell wall hemicellulose contributes significantly to aluminum adsorption and root growth in Arabidopsis[J]. Plant Physiology, 2011, 155(4): 1885-1892. DOI:10.1104/pp.111.172221 |
| [6] |
蔡妙珍, 王宁, 王志颖, 等. 边缘细胞对荞麦根尖铝毒的防护效应和对细胞壁多糖的影响[J]. 生态学报, 2012, 32(3): 915-922. CAI Miao-zhen, WANG Ning, WANG Zhi-ying, et al. The role of root border cells in protecting buckwheat root apices from aluminum toxicity and their effect on polysaccharide contents of root tip cell walls[J]. Acta Ecologica Sinica, 2012, 32(3): 915-922. |
| [7] |
Yu M, Shen R F, Liu J Y, et al. The role of root border cells in aluminum resistance of pea(Pisum sativum) grown in mist culture[J]. Journal of Plant Nutrition and Soil Science, 2009, 172(4): 528-534. DOI:10.1002/jpln.200800039 |
| [8] |
郑绍建. 细胞壁在植物抗营养逆境中的作用及其分子生理机制[J]. 中国科学:生命科学, 2014, 44(4): 334-341. ZHENG Shao-jian. The role of cell wall in plant resistance to nutritional stresses and the underlying physiological and molecular mechanisms[J]. Scientia Sinica Vitae, 2014, 44(4): 334-341. |
| [9] |
Li Y Y, Yang J L, Zhang Y J, et al. Disorganized distribution of homogalacturonan epitopes in cell walls as one possible mechanism for aluminium-induced root growth inhibition in maize[J]. Annals of Botany, 2009, 104(2): 235-241. |
| [10] |
Tang J F, Luo H X, Lin X Y, et al. Aluminum-induced changes in cell-wall pectin methylesterase activity of wheat seedlings in relation to their aluminum tolerance[J]. Journal of Zhejiang University(Agriculture and Life Sciences), 2006, 32(2): 145-151. |
| [11] |
Li X W, Li Y L, Qu M, et al. Cell wall pectin and its methyl-esterification in transition zone determine Al resistance in cultivars of pea (Pisum sativum)[J]. Frontiers in Plant Science, 2016, 7: 39. |
| [12] |
Wang S Y, Yuan S L, Su L T, et al. Aluminum toxicity in alfalfa(Medicago sativa) is alleviated by exogenous foliar IAA inducing reduction of Al accumulation in cell wall[J]. Environmental and Experimental Botany, 2017, 139: 1-13. DOI:10.1016/j.envexpbot.2017.03.018 |
| [13] |
Zhu C Q, Zhang J H, Sun L M, et al. Hydrogen sulfide alleviates aluminum toxicity via decreasing apoplast and symplast Al contents in rice[J]. Frontiers in Plant Science, 2018, 9: 294. DOI:10.3389/fpls.2018.00294 |
| [14] |
杨旭健, 傅友强, 沈宏, 等. 水稻根表铁膜及其形成的形态、生理及分子机理综述[J]. 生态学杂志, 2014, 33(8): 2235-2244. YANG Xu-jian, FU You-qiang, SHEN Hong, et al. A review on iron plaque on rice(Oryza sativa) root surface and the morphology, physiology and molecular biology of its formation mechanism[J]. Chinese Journal of Ecology, 2014, 33(8): 2235-2244. |
| [15] |
Khan N, Seshadri B, Bolan N, et al. Chaper one-root iron plaque on wetland plants as a dynamic pool of nutrients and contaminants[J]. Advances in Agronomy, 2016, 138: 1-96. DOI:10.1016/bs.agron.2016.04.002 |
| [16] |
沈小雪, 李瑞利, 柴民伟, 等. 深圳湾典型红树植物根表铁膜及其重金属富集特征[J]. 环境科学, 2018, 39(4): 1851-1860. SHEN Xiao-xue, LI Rui-li, CHAI Min-wei, et al. Characteristics of iron plaque and its heavy metal enrichment in typical mangrove plants in Shenzhen Bay, China[J]. Environmental Science, 2018, 39(4): 1851-1860. |
| [17] |
Ji Y, Vollenweider P, Lenz M, et al. Can iron plaque affect Sb(Ⅲ) and Sb (Ⅴ) uptake by plants under hydroponic conditions[J]. Environmental and Experimental Botany, 2018, 148: 168-175. DOI:10.1016/j.envexpbot.2018.01.014 |
| [18] |
Peng C, Chen S, Shen C S, et al. Iron plaque:A barrier layer to the uptake and translocation of copper oxide nanoparticles by rice plants[J]. Environmental Science and Technology, 2018, 52(21): 12244-12254. DOI:10.1021/acs.est.8b02687 |
| [19] |
李方, 邢承华, 蔡妙珍, 等. 根表铁膜、锰膜对水稻铝吸收和运输的影响[J]. 浙江大学学报(农业与生命科学版), 2010, 36(3): 335-340. LI Fang, XING Cheng-hua, CAI Miao-zhen, et al. Effects of iron and manganese plaques on aluminum uptake and translocation by rice seedlings[J]. Journal of Zhejiang University(Agriculture and Life Sciences), 2010, 36(3): 335-340. |
| [20] |
于姣妲, 夏丽丹, 殷丹阳, 等. 磷素对杉木幼苗耐铝性的影响机制[J]. 林业科学, 2018, 54(5): 36-47. YU Jiao-da, XIA Li-dan, YIN Dan-yang, et al. Effects of phosphorus on aluminum tolerance of Chinese fir seedlings[J]. Scientia Silvae Sinicae, 2018, 54(5): 36-47. |
| [21] |
Maejima E, Watanabe T, Osaki M, et al. Phosphorus deficiency enhances aluminum tolerance of rice(Oryza sativa) by changing the physicochemical characteristics of root plasma membranes and cell walls[J]. Journal of Plant Physiology, 2014, 171(2): 9-15. DOI:10.1016/j.jplph.2013.09.012 |
| [22] |
Zheng S J, Yang J L, He Y F, et al. Immobilization of aluminum with phosphorus in roots is associated with high aluminum resistance in buckwheat[J]. Plant Physiology, 2005, 138(1): 297-303. |
| [23] |
黄文方, 陈晓阳, 邢承华, 等. 磷对水稻耐铝性及根尖细胞壁组分的影响[J]. 中国水稻科学, 2013, 27(2): 161-167. HUANG Wen-fang, CHEN Xiao-yang, XING Cheng-hua, et al. Effects of phosphorous on aluminum tolerance and cell wall polysaccharide components in rice root tips[J]. Chinese Journal of Rice Science, 2013, 27(2): 161-167. DOI:10.3969/j.issn.1001-7216.2013.02.008 |
| [24] |
陈晨, 龚海青, 张敬智, 等. 水稻根系形态与氮素吸收累积的相关性分析[J]. 植物营养与肥料学报, 2017, 23(2): 333-341. CHEN Chen, GONG Hai-qing, ZHANG Jing-zhi, et al. Correlation between root morphology and nitrogen uptake of rice[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(2): 333-341. |
| [25] |
Zhong H L, Läuchli A. Changes of cell wall composition and polymer size in primary roots of cotton seedlings under high salinity[J]. Journal of Experimental Botany, 1993, 44(4): 773-778. DOI:10.1093/jxb/44.4.773 |
| [26] |
秦丽凤, 左方华, 段居琪, 等. 低磷与铝毒胁迫对木豆根尖及其分泌的酸性磷酸酶活性的影响[J]. 广西农业科学, 2006, 37(5): 533-536. QIN Li-feng, ZUO Fang-hua, DUAN Ju-qi, et al. Effect of P deficiency and Al stress on root tip of pigeon pea and the activities of acid phosphatase(APA) excreted from root tip[J]. Guangxi Agricultural Sciences, 2006, 37(5): 533-536. |
| [27] |
Jiang F Y, Chen X, Luo A C. Iron plaque formation on wetland plants and its influence on phosphorus, calcium and metal uptake[J]. Aquatic Ecology, 2009, 43(4): 879-890. DOI:10.1007/s10452-009-9241-z |
| [28] |
吴明胤, 陶祥运, 李磊明, 等. 硫酸亚铁诱导根表铁膜形成对水稻吸收和转运铜锌的影响[J]. 安徽农业大学学报, 2018, 45(4): 650-656. WU Ming-yin, TAO Xiang-yun, LI Lei-ming, et al. Effects of ferrous sulfate induced iron plaque formation on root uptake and transport of copper and zinc in rice[J]. Journal of Anhui Agricultural University, 2018, 45(4): 650-656. |
| [29] |
Fu Y Q, Yang X J, Shen H. Root iron plaque alleviates cadmium toxicity to rice(Oryza sativa) seedlings[J]. Ecotoxicology and Environment Safety, 2018, 161: 534-541. DOI:10.1016/j.ecoenv.2018.06.015 |
| [30] |
Chen R F, Shen R F, Gu P, et al. Response of rice(Oryza sativa) with root surface iron plaque under aluminium stress[J]. Annals of Botany, 2006, 98(2): 389-395. |
| [31] |
Dai M Y, Liu J C, Liu W W, et al. Phosphorus effects on radial oxygen loss, root porosity and iron plaque in two mangrove seedlings under cadmium stress[J]. Marine Pollution Bulletin, 2017, 119(1): 262-269. DOI:10.1016/j.marpolbul.2017.04.013 |
| [32] |
Zhang X K, Zhang F S, Mao D R. Effect of iron plaque outside roots on nutrient uptake by rice(Oryza sativa L.):Phosphorus uptake[J]. Plant and Soil, 1999, 209(2): 187-192. DOI:10.1023/A:1004505431879 |
| [33] |
Batty L C, Baker A J M, Wheeler B D. Aluminium and phosphate uptake by Phragmites australis:The role of Fe, Mn and Al root plaques[J]. Annals of Botany, 2002, 89(4): 443-449. DOI:10.1093/aob/mcf067 |
| [34] |
David T C, John S. Inhibition of the uptake and long-distance transport of calcium by aluminium and other polyvalent cations[J]. Journal of Experimental Botany, 1971, 22(4): 837-851. DOI:10.1093/jxb/22.4.837 |
| [35] |
Yang J L, Li Y Y, Zhang Y J, et al. Cell wall polysaccharides are specifically involved in the exclusion of aluminum from the rice root apex[J]. Plant Physiology, 2008, 146(2): 602-611. |
| [36] |
Yang Y, Dai C Y, Guo L P, et al. Distribution pattern of aluminum in Panax notoginseng, a native medicinal plant adapted to acidic red soils[J]. Plant and Soil, 2018, 423(1/2): 375-384. |
| [37] |
Zhu X F, Zhao X S, Wang B, et al. Elevated carbon dioxide alleviates aluminum toxicity by decreasing cell wall hemicellulose in rice(Oryza sativa)[J]. Frontiers in Physiology, 2017, 8: 512. DOI:10.3389/fphys.2017.00512 |
| [38] |
Taiz L. Plant cell expansion:Regulation of cell wall mechanical properties[J]. Annual Review of Plant Physiology, 1984, 35: 585-657. DOI:10.1146/annurev.pp.35.060184.003101 |
| [39] |
Van L H, Kuraishi S, Sakurai N. Aluminum-induced rapid root inhibition and changes in cell wall components of squash seedling[J]. Journal of Plant Physiology, 1994, 106(3): 971-976. |
| [40] |
赵旭升, 朱晓芳, 吴启, 等. 水稻根系果胶去甲酯化促进细胞壁磷再利用的机制探究[J]. 土壤学报, 2018, 55(5): 1190-1198. ZHAO Xu-sheng, ZHU Xiao-fang, WU Qi, et al. Study on mechanism of demethylation of pectin promoting reutilization of cell wall phosphorus in rice(Oryza sativa) root[J]. Acta Pedologica Sinica, 2018, 55(5): 1190-1198. |
| [41] |
Wang L S, Liu D. Functions and regulation of phosphate starvationinduced secreted acid phosphatases in higher plants[J]. Plant Science, 2018, 271: 108-116. DOI:10.1016/j.plantsci.2018.03.013 |
 2019, Vol. 38
2019, Vol. 38


