随着工业的发展,“三废”排放量增加,历史上污灌、污泥的肥料化施用使农田土壤中的Cd浓度逐年增加。Cd是生物非必需元素,高浓度的Cd会对植物产生严重的毒害作用,干扰植物光合和呼吸作用,影响植物对营养元素的吸收与代谢,引起膜脂过氧化并损坏抗氧化系统[1]。Cd易被作物根系吸收,并转移到地上部甚至积累到作物果实中,通过食物链对人类的健康构成威胁。番茄是一种重要的果蔬食物,在我国种植面积约为133.3万hm2 [2],随着土壤重金属污染风险加剧,菜地土壤污染修复与蔬菜安全生产引起全社会的高度重视。水杨酸(SA)是一种小分子酚类物质,也是一种调节植物响应外界胁迫的重要激素[3]。最新研究表明,SA能够缓解重金属对植物的毒害作用,增强植物的抗性。Lu等[4]研究表明外源喷施50 μmol·L-1的SA可减轻10 μmol·L-1 CdCl2胁迫下浮萍的膜脂过氧化。杨建霞等[5]研究表明水杨酸可以缓解重金属胁迫对紫花苜蓿造成的氧化损伤,提高紫花苜蓿叶片中POD、SOD和CAT的活性。然而,水杨酸缓解番茄重金属Cd毒害,调控番茄Cd吸收与累积机制尚不明确。因此本研究通过开展相关试验,研究不同Cd污染程度下外源水杨酸对番茄生长和抗氧化系统酶活性影响,及不同浓度水杨酸对番茄重金属Cd吸收与累积的调控。研究不同污染浓度下,水杨酸施用量对作物生长,重金属毒害缓解和重金属吸收、累积调控,为重金属超标菜地蔬菜安全生产提供新的思路。
1 材料与方法 1.1 供试材料本试验采用的番茄(Solanum lycopersicum L.)品种为石红三号,购于新疆石河子蔬菜研究所番茄研究开发中心。水杨酸(SA)购买于国药集团化学试剂有限公司。
1.2 试验设计挑选饱满的番茄种子若干,用15%的次氯酸钠溶液浸泡15 min,去离子水冲洗3次后播种于蛭石盘中,置于人工植物培养室。人工植物培养室的温度控制在昼26 ℃/夜20 ℃,昼夜时间为16 h/8 h,相对湿度为60%。待幼苗长至“两叶一心”时,将其移栽到水培箱中,先用1/2浓度的霍格兰营养液(pH=6.5)培养2周,再用霍格兰全培养液(pH=6.5)培养2周[6],然后选取长势良好且一致的幼苗进行试验处理。共设置20个处理组,分别为:CK、C1、C1+SA25、C1+SA50、C1+SA100、C1 + SA200、C3、C3 + SA25、C3 + SA50、C3 + SA100、C3 + SA200、C5、C5 + SA25、C5 + SA50、C5 + SA100、C5+SA200、SA25、SA50、SA100、SA200。CK代表空白对照;C1、C3、C5分别代表 1、3、5 mg·L-1 Cd处理;数字25、50、100、200分别代表用浓度为25、50、100、200 μmol·L-1的SA预处理。其中SA(25、50、100、200 μmol·L-1)在Cd处理3 d前于暗处喷洒于番茄叶片,Cd以3CdSO4·8H2O形式加入营养液中,最终培养液中Cd浓度为1、3、5 mg·L-1,每组处理设置6个平行。
1.3 番茄生物量、株高及根长的测定在加Cd处理7 d后收样,收样前量取各个番茄苗的株高和根长,并分开收集番茄的地上、地下部分。番茄根部在5.0 mmol · L-1的乙二胺四乙酸二钠(EDTA-2Na)溶液中浸泡15 min,去除根表面附着的Cd,然后用去离子水冲洗数次[7],地上部分也用去离子水冲洗数次,用吸水纸将表面水分吸干,然后置于烘箱中于105 ℃杀青、烘干。待植物样品烘干至恒质量后,记录下地上、地下部干质量,然后保存于干燥处用于Cd含量测定。
1.4 番茄中Cd积累量的测定准确称取0.2 g烘干后的植物样品于消解管内,加入10 mL HNO3浸泡12 h,然后用电热消解仪(DigiBlock ED54,LabTech)加热消解。消解步骤为:80 ℃加热1.5 h,120 ℃加热1.5 h,150 ℃加热3 h[8]。然后在175 ℃下蒸发硝酸剩余至1 mL左右停止加热,冷却后将其转移至25 mL容量瓶并定容。定容后用0.45 μm的滤膜过滤,然后用火焰炉原子吸收光谱仪(AAS;ZEEnit700P/650P,Analytik-Jena,Germany)测定Cd浓度,每个样品重复3次。
1.5 番茄根系活性氧的荧光标记由于100 μmol·L-1 SA预处理下对番茄生长的促进作用以及Cd积累减少作用最显著,所以选取SA处理浓度为100 μmol·L-1番茄根系活性氧的荧光标记方法,参考Jia等[9]的研究,室温下剪取番茄幼苗主根距根尖1 cm切段,在黑暗中用20 μmol·L-1的活性氧荧光探针H2DCF-DA浸泡60 min[荧光探针加在10 mmol·L-1的Tris-HCl缓冲液(pH=7.4)中],然后用10 mmol·L-1的Tris-HCl缓冲液漂洗2次,每次15 min,漂洗后立即在激光共聚焦显微镜上进行整根观察(激发光495 nm,发射光515 nm)。每个处理3个平行。
1.6 番茄丙二醛含量和抗氧化酶活性的测定酶液提取方法参考郭军康的研究[10],收样时用去离子水将根和叶冲洗3遍去掉表面附着物,吸干水分快速称量鲜质量。然后用液氮速冻,保存于-80 ℃冰箱。测定时,将-80 ℃保存的番茄叶片或根系组织放入预冷研钵中,加入1:10(g:mL)的提取缓冲液[50 mmol · L-1磷酸钾缓冲液(pH=7.0)包含1 mmol · L-1 EDTA,1% PVP-30]研磨提取。匀浆后离心20 min(4 ℃,10 000 r·min-1),收集上清液用于测定酶活性。
过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)和抗坏血酸过氧化物酶(APX)的酶活性采用试剂盒检测(索莱宝);超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(Nitro Blue Tetrazolium chloride,NBT)比色法[11];过氧化物酶(POD)活性测定采用愈创木酚法[12]。丙二醛含量的测定采用硫代巴比妥酸法[13]。
1.7 数据分析利用Excel 2003分析数据,Origin 8.5作图,使用软件SPSS 17.0(One-way ANOVA)进行统计分析,P < 0.05为差异显著。
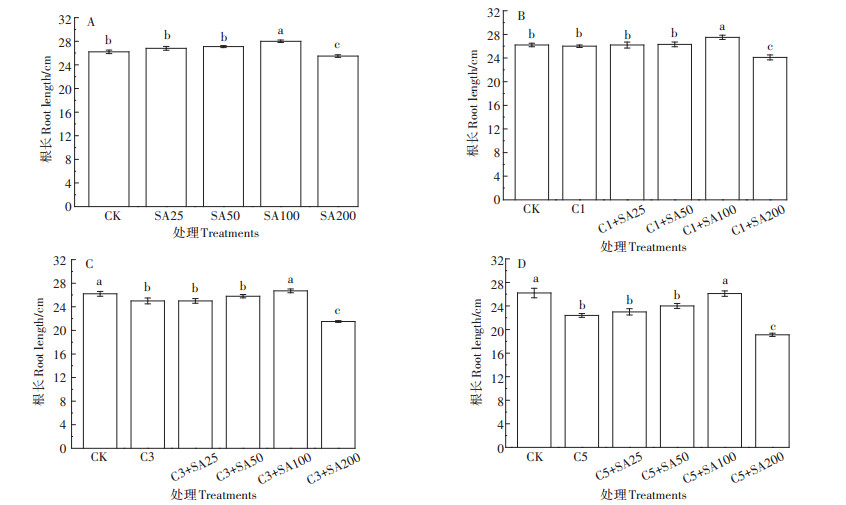
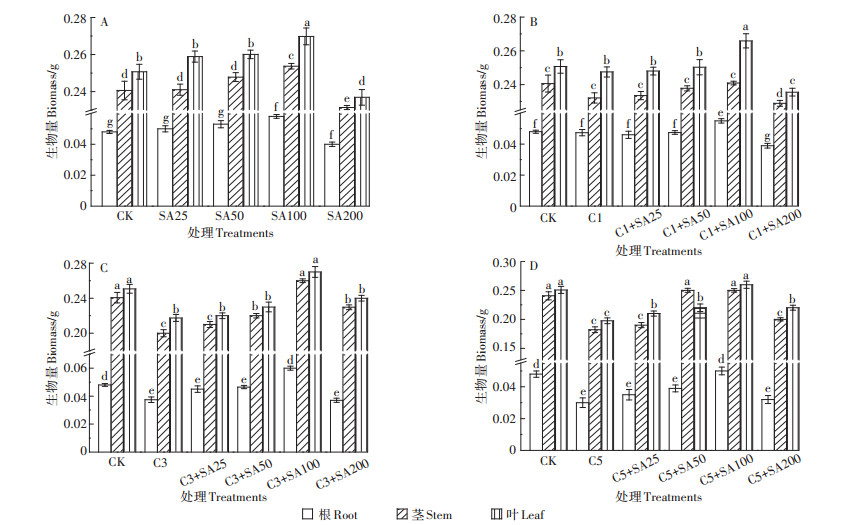
2 结果与分析 2.1 SA对Cd胁迫下番茄株高、根长和生物量的影响由图 1~图 3可知,Cd浓度为1 mg·L-1时,番茄的生长几乎没有受到影响,株高、根长、生物量和CK几乎没有区别。Cd浓度为3 mg·L-1时,番茄的生长已经受到了抑制作用,相比于CK,株高下降了8.3%,根长减少了4.6%,根、茎和叶的干质量分别减少了22.1%、16.9%和13.2%(P < 0.05)。Cd浓度为5 mg·L-1时,对番茄的生长产生了显著的抑制作用,相比于CK,株高下降了11.7%,根长减少了14.5%,根、茎和叶的干质量分别减少了37.5%、24.3%和21.2%。单独SA处理,浓度在25、50 μmol·L-1时对番茄生长的促进作用不明显,而浓度在100 μmol·L-1时对番茄生长有显著的促进作用,相比于CK,株高增长了10%,根长增加了6.4%,根、茎和叶的干质量分别增加了17.2%、5.4%和7.6%。当SA浓度为200 μmol·L-1时却对番茄生长产生了抑制,株高、根长和生物量都有不同程度的下降。另外,100 μmol·L-1的SA预处理缓解番茄Cd胁迫的作用也最为显著,在高浓度Cd胁迫(5 mg·L-1)下,相比于单独Cd处理,C5+SA100处理组的株高增加了10.2%,根长增加了14.2%,根、茎和叶的干质量分别增加了40%、27.2%和24%。
|
不同小写字母表示处理间差异显著(P < 0.05)。下同 Different lowercase letters indicate significant differences among treatments(P < 0.05). The same below 图 1 不同处理下番茄幼苗的根长 Figure 1 Root length of tomato seedlings under different treatments |

|
图 2 不同处理下番茄幼苗的株高 Figure 2 Plant height of tomato seedlings under different treatments |
|
图 3 不同处理下番茄幼苗的生物量 Figure 3 Biomass of tomato seedlings under different treatments |
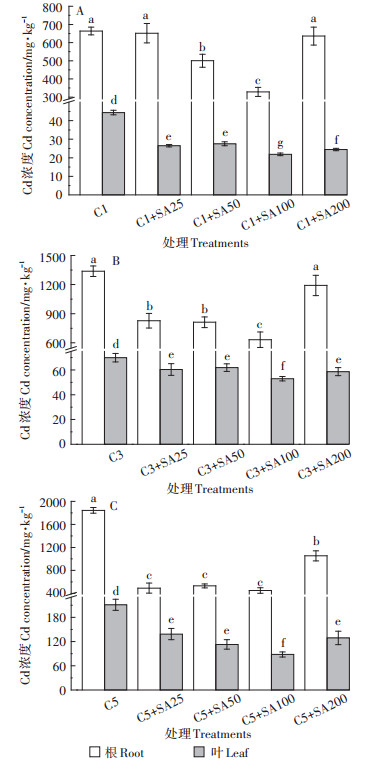
由图 4可知,Cd处理浓度为1 mg·L-1时,番茄根和叶中分别积累了663.5 mg·kg-1和44.4 mg·kg-1的Cd,SA预处理浓度为25、50、100 μmol · L-1和200 μmol·L-1时,番茄根中Cd积累量分别下降了1.8%、24.6%、50.5%和4.1%,叶中Cd积累量分别下降了40.2%、37.9%、50.8%和44.9%;Cd处理浓度为3 mg· L-1时,番茄根和叶中分别积累了1 337.9 mg·kg-1和69.9 mg · kg-1的Cd,SA预处理浓度为25、50、100 μmol·L-1和200 μmol·L-1时,番茄根中Cd积累量分别下降了38.1%、39.2%、52.8%和11%,叶中Cd积累量分别下降了13.7%、11.5%、24.4%和16.1%;Cd处理浓度为5 mg·L-1时,番茄根和叶中分别积累了1 843.3 mg·kg-1和211.3 mg·kg-1的Cd,SA预处理浓度为25、50、100 μmol·L-1和200 μmol·L-1时,番茄根中Cd积累量分别下降了73.3%、71.2%、75.5%和42.9%,叶中Cd积累量分别下降了34.4%、46.5%、58.3%和38.9%。
|
图 4 不同处理下番茄中的Cd积累量 Figure 4 Cd accumulation in tomato under different treatments |
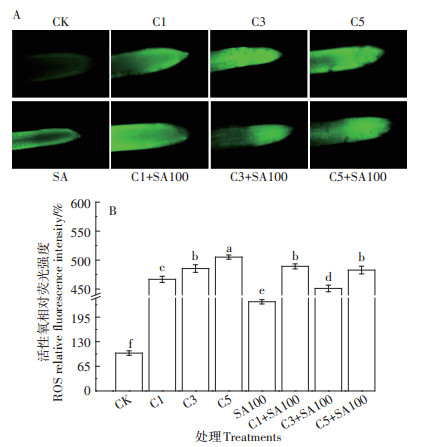
图 5A为不同处理下番茄根尖的活性氧荧光照片,图 5B是通过ImageJ软件对荧光强度的相对定量分析图。可以看出,Cd处理浓度为1、3、5 mg·L-1时,番茄根尖的活性氧荧光亮度都强于CK,3 mg·L-1和5 mg·L-1的Cd处理下,荧光亮度强于1 mg·L-1的Cd处理。SA100单独处理后,番茄根尖活性氧的荧光强度高于CK。C1+SA100处理组的荧光亮度强于C1处理组,C3+SA100和C5+SA100的荧光强度分别弱于C3和C5。
|
A:番茄根系活性氧荧光标记(bar=50 μmol·L-1);B:活性氧荧光强度相对定量分析 A: ROS H2DCF-DA fluorescence in tomato roots(bar=50 μmol·L-1); B: Relative quantification of ROS H2DCF-DA fluorescence intensity 图 5 不同处理下番茄根系活性氧的荧光标记 Figure 5 Fluorescent labeling of active oxygen in tomato roots under different treatments |
由图 6和图 7可知,在1 mg·L-1Cd处理下,番茄根和叶中的5种抗氧化酶(CAT、SOD、POD、APX、GR)活性都显著升高。在3 mg·L-1 Cd处理下,根和叶中POD、APX的活性都显著降低,根中CAT活性仍然显著升高。在5 mg·L-1 Cd处理下,番茄根和叶中的CAT、SOD、POD、APX、GR活性都显著降低,远小于CK对照组。总的来说,这5种抗氧化酶的变化趋势为:低浓度Cd胁迫显著诱导了其活性升高,随着Cd处理浓度的增加,5种酶的活性呈现下降趋势。
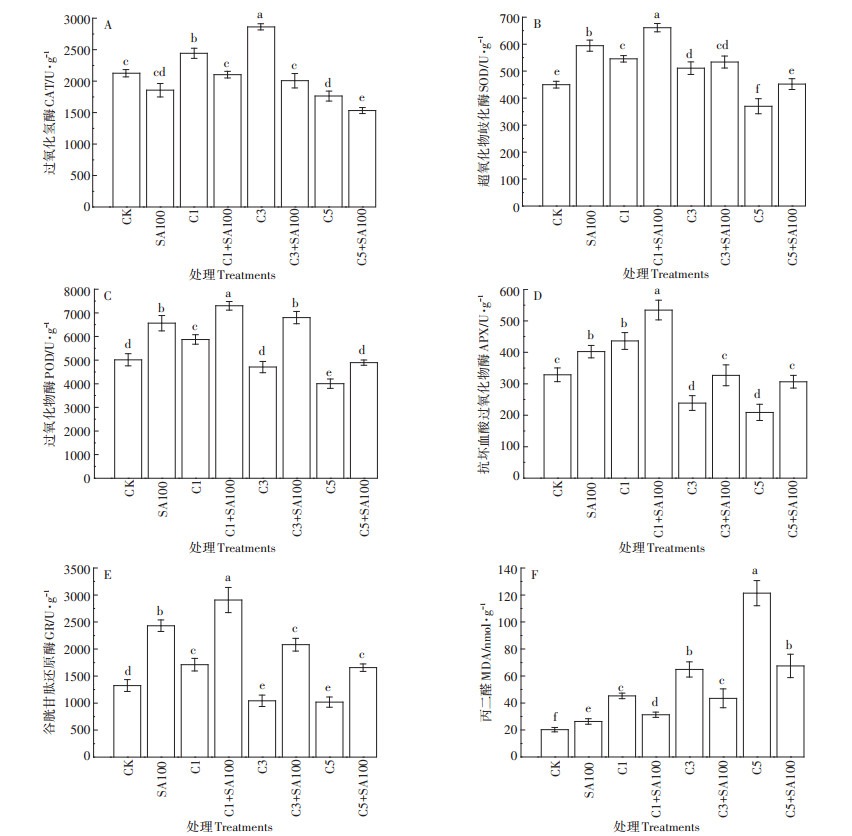
|
图 6 不同处理下番茄根中抗氧化酶活性和丙二醛含量 Figure 6 Antioxidant enzyme activity and malondialdehyde content in tomato root under different treatments |
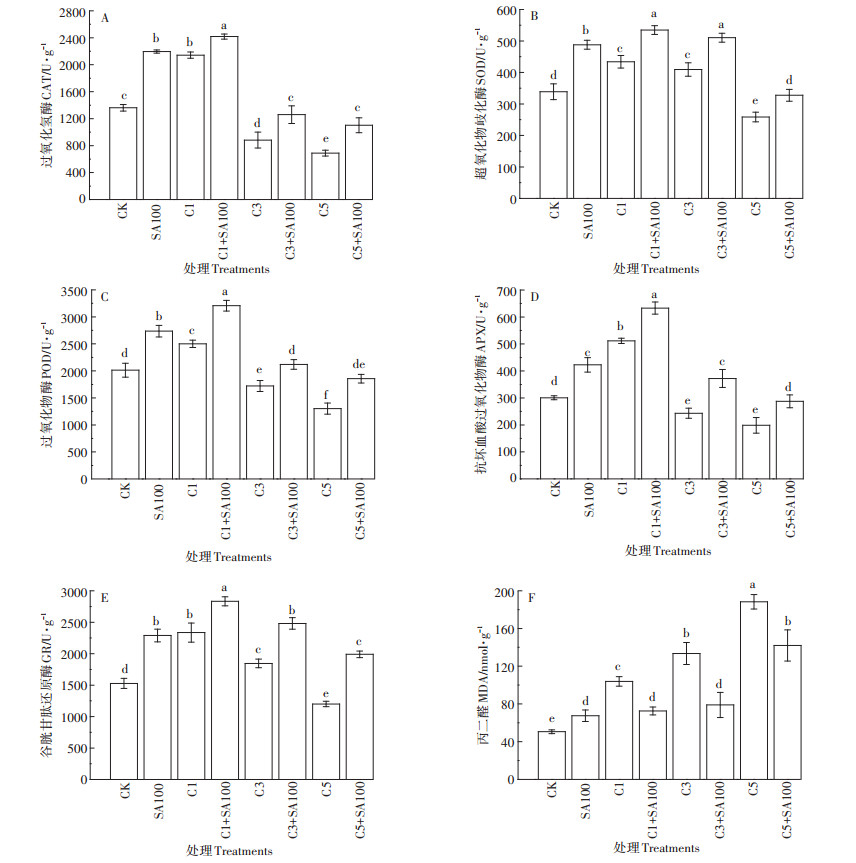
|
图 7 不同处理下番茄叶中抗氧化酶活性和丙二醛含量 Figure 7 Antioxidant enzyme activity and malondialdehyde content in tomato leaf under different treatments |
单独100 μmol·L-1 SA预处理后,番茄根和叶中SOD、POD、APX、GR的活性都显著升高,叶中CAT活性也升高,但根中CAT的活性却显著降低。SA预处理可以显著提高不同浓度Cd胁迫下抗氧化酶的活性,SA+Cd处理组的SOD、POD、APX和GR活性都显著高于单独Cd处理组。
另外,在1、3、5 mg·L-1Cd处理下,番茄叶中的MDA含量分别增加了51.3%、62.2%、73.1%,根中分别增加了55.4%、68.8%、83.3%。SA预处理后,Cd胁迫下,番茄叶中的MDA含量减少了24.6%~40.8%,根中减少了30.9%~44.4%。
3 讨论 3.1 SA对Cd胁迫下番茄株高、根长和生物量的影响SA作为一种植物激素,适量使用可以促进植物的生长发育,但过量后反而会对植物造成伤害。Kováčik等[14]认为不同植物适应SA的量是不同的,适量浓度的SA可以诱导植物产生系统获得性抗性,增强植物抵御外界胁迫的能力,从而促进植物的生长,但过量的SA会使植物发生超敏反应,引起细胞程序性死亡,进而抑制植物生长。Poór等[15]认为高浓度SA(≥200 μmol·L-1)处理会使H2O2过量积累,产生重度氧化胁迫,从而抑制植物生长。本研究结果得出,100 μmol·L-1 SA对番茄的生长促进作用最为明显,而200 μmol·L-1 SA会抑制其生长,这说明100 μmol·L-1的SA处理可以激活番茄的系统抗性,促进番茄的生长。Zhao[16]研究发现,低浓度的Cd对番茄幼苗生长几乎没有抑制作用,然而高浓度Cd胁迫下,细胞内积累的较多的Cd扰乱了细胞的代谢生理平衡,使番茄幼苗的生长受到了抑制。本研究也得到了相似的结果,这说明Cd对番茄的毒害作用是呈剂量效应的。Drazic等[17]用10 μmol·L-1的SA预处理紫花苜蓿种子,显著降低了MDA含量,缓解了Cd对根和茎生长的抑制作用。Ahmad等[18]研究表明用1.0 mmol·L-1 SA预处理可以显著提高芥菜中抗氧化酶的活性,从而缓解Cd对芥菜生长的抑制。本研究得出,100 μmol·L-1 SA预处理可显著缓解高浓度Cd(5 mg·L-1)胁迫对番茄生长的抑制,这可能是因为SA提高了Cd胁迫下抗氧化酶的活性,减少了MDA的积累,从而减弱了Cd对番茄的毒害作用。
3.2 SA对Cd胁迫下番茄中Cd积累量的影响已有研究证明大部分植物地上部分对Cd较为敏感,因此它们主要将Cd积累在根中,向地上部转移的较少[19]。在本试验中,番茄根部积累了89.7%~93.7%的Cd,只有较少的Cd运输到地上部,说明番茄本身对Cd胁迫有一定的抗性。Liu等[20]研究指出SA可以调节离子的跨膜运输,限制重金属的吸收与运输。Gu等[21]证明SA预处理显著降低了睡莲根、茎、叶中的Cd积累。Raza等[22]表明SA处理促进了Ca离子内流,占用了离子通道,从而抑制了Cd离子的吸收。本试验结果证明了外源SA预处理可以显著降低番茄地上、地下组织中的Cd积累,并且在高浓度Cd胁迫下作用更加显著,这可能是SA通过调控Cd离子的吸收与排出机制,使进入到细胞内的Cd减少。
3.3 SA和Cd胁迫对番茄根尖活性氧含量的影响植物在遇到外界环境胁迫时,细胞内会产生大量的活性氧,从而引起细胞氧化,对植物细胞造成危害,但适量的活性氧能够诱导植物产生系统抗性,对植物的生长具有积极作用[23]。Lee等[24]表明SA处理可以诱导拟南芥根中活性氧的积累,从而提高抗氧化酶的活性来缓解盐胁迫。Singh等[25]表明SA可以快速诱导植物组织中活性氧的积累,使植物获得系统抗性,在抵御外界胁迫方面起到重要作用。在本研究的结果中,外源喷施SA后,番茄根尖的活性氧含量增加,活性氧作为第二信使分子可以激活植物抗氧化系统,进而提高抗氧化酶活性。本研究也得出SA预处理可以显著提高SOD、POD、APX、GR这4种抗氧化酶的活性,因此可以证明SA诱导的活性氧对植物抵御外界胁迫起到了积极作用。已有研究指出,重金属Cd、Cu、Pb等都会导致植物根系活性氧的过多积累,从而使植物细胞膜脂过氧化,对植物根系产生严重毒害作用[26]。在本试验结果中,活性氧的积累随着Cd处理浓度的增加而增加,同时番茄的根长、生物量也受到严重抑制,番茄中几种抗氧化酶活性也显著降低,说明高浓度Cd胁迫下诱导的活性氧对番茄产生了严重的毒害作用。
3.4 SA对Cd胁迫下番茄中MDA和抗氧化系统的影响MDA是膜脂过氧化产物,它的增加表明植物细胞受到了氧化伤害,本研究结果显示,单独Cd处理后,番茄根和叶中MDA含量显著上升,并且Cd处理浓度越高,番茄中MDA含量越多,说明Cd胁迫对番茄根和叶细胞产生了严重的氧化损伤。而在SA预处理后,不同浓度Cd胁迫下,MDA含量均显著低于单独Cd处理。Dong等[27]研究指出SA预处理诱导的活性氧作为第二信使启动了抗氧化系统,从而降低了盐胁迫下棉花中的MDA含量;Ali等[28]指出外源使用SA提高了Cd胁迫下油菜中抗氧化酶的活性从而清除了过量的MDA。这些结果表明,SA可以通过诱导活性氧产生来激活植物体内抗氧化酶系统,进而降低Cd胁迫对植物细胞膜的氧化伤害。
过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)是植物活性氧代谢中重要的抗氧化酶,它们使植物细胞免于遭受H2O2的毒害。超氧化物歧化酶(SOD)和过氧化物酶(POD)是机体内O2-的天然消除剂,在生物体的自我保护系统中起着极为重要的作用[29]。本研究结果得出,100 μmol· L-1 SA单独处理后,SOD、POD、APX、GR这4种抗氧化酶活性都显著提高,而CAT的活性却降低。Chen等[30]指出SA可以与CAT结合,抑制CAT的活性,从而导致H2O2的积累,然后H2O2作为信使分子,激活植物的抗氧化系统,提高抗氧化酶SOD、POD、APX、GR等的活性,进而形成自我防御反应。Sihag等[31]研究表明,用外源SA处理高粱幼苗,可显著提高幼苗内SOD、POD、APX、GR等的活性,从而提高了高粱幼苗对铬胁迫的抗性。这些结果表明SA可以通过激活植物抗氧化系统来抵御外界胁迫造成的氧化伤害。
Cd胁迫会使植物中活性氧含量增加,这可能会激活植物的抗氧化防御系统,有研究表明Cd胁迫诱导的大量活性氧可以诱导抗氧化酶SOD、CAT、POD的活性升高,且活性随着Cd浓度的增加而增加[32]。章秀福等[33]研究表明,抗氧化酶对植物的保护具有一定限度,低浓度Cd胁迫可以提高抗氧化酶的活性,但在高浓度Cd胁迫下,抗氧化酶的活性显著降低。覃勇荣等[34]表明,在低浓度的Cd胁迫下,任豆幼苗的SOD、POD和CAT活性均有不同程度的升高,然而在高浓度的Cd胁迫下,SOD、POD和CAT活性则逐渐降低。本研究结果与此相似,低浓度的Cd胁迫可以诱导番茄组织中5种抗氧化酶(SOD、CAT、POD、APX、GR)活性的提高,但是随着Cd浓度的增加,5种抗氧化酶的活性呈下降趋势,在高浓度Cd(5 mg·L-1)胁迫下,这5种抗氧化酶的活性显著低于CK对照组。这些结果说明低浓度的Cd可以诱导植株产生氧化抗性,但在高浓度Cd胁迫下,植物的抗氧化系统可能被破坏,无法抵御氧化胁迫,这也就是为什么高浓度Cd胁迫下,番茄组织中的MDA含量显著高于低浓度Cd胁迫。
已有研究指出外源SA可以缓解重金属对植物的氧化胁迫,Zhang等[35]研究认为SA通过提高水稻幼苗的SOD、POD和GR活性来缓解Cd造成的氧化胁迫。Bai等[36]研究表明SA处理能够提高Cu胁迫下SOD、CAT、GR的活性,缓解Cu对小麦根系的氧化伤害。本试验结果得出,SA预处理可以显著提高Cd胁迫下SOD、POD、APX和GR的活性,并减少MDA的积累。结合前人研究以及本研究结果都证明了SA可以增强植物抵御重金属毒害的能力,SA可能通过提前刺激植株产生系统抗性,激活植物体内的抗氧化保护酶,从而缓解重金属的毒害作用。
4 结论(1)低浓度Cd(1 mg·L-1)胁迫对番茄的生长抑制作用不明显,高浓度Cd(5 mg·L-1)胁迫对番茄的生长产生了明显的抑制作用;100 μmol·L-1的SA可以显著缓解高浓度Cd胁迫对番茄的毒害作用,提高番茄幼苗的生物量。
(2)Cd胁迫诱导番茄根系活性氧的积累,并且随Cd浓度增加而增加;SA预处理也会诱导番茄根系活性氧的积累,从而提高番茄对氧化胁迫的抵抗能力。
(3)低浓度Cd胁迫诱导番茄植株中5种抗氧化酶(SOD、POD、CAT、APX、GR)活性的提高,高浓度Cd胁迫显著抑制了这5种酶的活性;而SA预处理可以显著提高SOD、POD、APX、GR的活性,并显著减轻了高浓度Cd胁迫对抗氧化酶活性的抑制作用。
(4)100 μmol·L-1的SA预处理可以显著降低不同浓度Cd处理下番茄植株(根和叶)中的Cd累积量。
| [1] |
Ali B, Deng X, Hu X, et al. Deteriorative effects of cadmium stress on antioxidant system and cellular structure in germinating seeds of Brassica napus L.[J]. Journal of Agricultural Science & Technology, 2018, 17(1): 63-74. |
| [2] |
但忠, 麻继仙, 木万福, 等. 云南热区番茄栽培现状及主栽品种推荐[J]. 长江蔬菜, 2018(3): 16-18. DAN Zhong, MA Ji-xian, MU Wan-fu, et al. Present situation of tomato cultivation in Yunnan Hot Area and recommended main varieties[J]. Journal of Changjiang Vegetables, 2018(3): 16-18. |
| [3] |
Zanganeh R, Jamei R, Rahmani F. Impacts of seed priming with salicylic acid and sodium hydrosulfide on possible metabolic pathway of two amino acids in maize plant under lead stress[J]. Molecular Biology Research Communications, 2018, 7(2): 83-88. |
| [4] |
Lu Q, Zhang T, Zhang W, et al. Alleviation of cadmium toxicity in Lemna minor by exogenous salicylic acid[J]. Ecotoxicology and Environmental Safety, 2018, 147: 500-508. DOI:10.1016/j.ecoenv.2017.09.015 |
| [5] |
杨建霞, 刘肖, 赵贵霞. 水杨酸对铬胁迫下紫花苜蓿幼苗生理特性的影响[J]. 林业科技通讯, 2018(9): 26-29. YANG Jian-xia, LIU Xiao, ZHAO Gui-xia. Effects of salicylic acid on physiological characteristics of Medicago sativa L. under chromium stress[J]. Forest Science and Technology, 2018(9): 26-29. |
| [6] |
郭军康, 周冉, 任心豪, 等. 不同年限设施菜地番茄细胞壁果胶Cd累积的研究[J]. 农业环境科学学报, 2018, 37(1): 45-51. GUO Jun-kang, ZHOU Ran, REN Xin-hao, et al. Accumulation of Cd in cell wall of tomato plants grown in greenhouse soil of different planting years[J]. Journal of Agro-Environment Science, 2018, 37(1): 45-51. |
| [7] |
董明芳, 郭军康, 冯人伟, 等. Fe2+和Mn2+对水稻根表铁膜及镉吸收转运的影响[J]. 环境污染与防治, 2017, 39(3): 249-253. DONG Ming-fang, GUO Jun-kang, FENG Ren-wei, et al. Effects of Fe2+ and Mn2+ on rice root iron plaque formation and Cd uptake and transportation[J]. Environmental Pollution and Control, 2017, 39(3): 249-253. |
| [8] |
郭军康, 赵瑾, 魏婷, 等. 西安市郊不同年限设施菜地土壤Cd和Pb形态分析与污染评价[J]. 农业环境科学学报, 2018, 37(11): 2570-2577. GUO Jun-kang, ZHAO Jin, WEI Ting, et al. Speciation and pollution assessment of cadmium and lead in vegetable greenhouse soil from a Xi' an suburb with different cultivating years[J]. Journal of Agro-Environment Science, 2018, 37(11): 2570-2577. DOI:10.11654/jaes.2018-0892 |
| [9] |
Jia H, Wang X, Dou Y, et al. Hydrogen sulfide-cysteine cycle system enhances cadmium tolerance through alleviating cadmium-induced oxidative stress and ion toxicity in Arabidopsis roots[J]. Scientific Reports, 2016, 6(1): 39702. DOI:10.1038/srep39702 |
| [10] |
郭军康.耐Cd植物促生菌对番茄幼苗生长及Cd吸收转运的影响机制[D].天津: 天津大学, 2014: 49-50. GUO Jun-kang. Effects of Cd-tolerant plant growth promoting rhizobacteria on mechanisms of tomato seedlings growth Cd uptake and transport[D]. Tianjin: Tianjin University, 2014: 49-50. http://cdmd.cnki.com.cn/Article/CDMD-10056-1015020092.htm |
| [11] |
Leonowicz G, Trzebuniak K F, Zimak-Piekarczyk P, et al. The activity of superoxide dismutases(SODs) at the early stages of wheat deetiolation[J]. PLoS One, 2018, 13(3): e0194678. DOI:10.1371/journal.pone.0194678 |
| [12] |
Xu Z, Ge Y, Zhang W, et al. The walnut JrVHAG1 gene is involved in cadmium stress response through ABA-signal pathway and MYB transcription regulation[J]. Bmc Plant Biology, 2018, 18(1): 19. |
| [13] |
Han Y, Wu M, Hao L, et al. Sulfur dioxide derivatives alleviate cadmium toxicity by enhancing antioxidant defence and reducing Cd2+ uptake and translocation in Foxtail millet seedlings[J]. Ecotoxicology & Environmental Safety, 2018, 157: 207-215. |
| [14] |
Kováčik J, Grúz J, Bačkor M, et al. Salicylic acid-induced changes to growth and phenolic metabolism in Matricaria chamomilla plants[J]. Plant Cell Rep, 2009, 28(1): 135-143. DOI:10.1007/s00299-008-0627-5 |
| [15] |
Poór P, Patyi G, Takács Z, et al. Salicylic acid-induced ROS production by mitochondrial electron transport chain depends on the activity of mitochondrial hexokinases in tomato(Solanum lycopersicum L.)[J]. Journal of Plant Research, 2019, 132(2): 273-283. DOI:10.1007/s10265-019-01085-y |
| [16] |
Zhao Y C. Effects of Cu2+ and Cd2+ stress on growth and POD activity of tomato seedling[J]. Agric Sci Technol, 2008, 9(2): 106-108. |
| [17] |
Drazic G, Mihailovic N, Lojic M. Cadmium accumulation in Medicago sativa seedlings treated with salicylic acid[J]. Biologia Plantarum (Prague), 2006, 50(2): 239-244. DOI:10.1007/s10535-006-0013-5 |
| [18] |
Ahmad P, Nabi G, Ashraf M. Cadmium-induced oxidative damage in mustard[Brassica juncea(L.) Czern. & Coss.] plants can be alleviated by salicylic acid[J]. South African Journal of Botany, 2011, 77(1): 36-44. DOI:10.1016/j.sajb.2010.05.003 |
| [19] |
Rosa G, Montes M, Parsons J. Cadmium uptake and translocation in tumbleweed(Salsola kaki), a potential Cd-hyperaccumulator desert plant species:ICP-OES and XAS studies[J]. Chemosphere, 2004, 55: 117-123. |
| [20] |
Liu Z, Ding Y, Wang F, et al. Role of salicylic acid in resistance to cadmium stress in plants[J]. Plant Cell Reports, 2016, 35(4): 719-731. DOI:10.1007/s00299-015-1925-3 |
| [21] |
Gu C S, Yang Y H, Shao Y F, et al. The effects of exogenous salicylic acid on alleviating cadmium toxicity in Nymphaea tetragona Georgi[J]. South African Journal of Botany, 2018, 114: 267-271. DOI:10.1016/j.sajb.2017.11.012 |
| [22] |
Raza S H, Shafiq F. Exploring the role of salicylic acid to attenuate cadmium accumulation in radish(Raphanus sativus)[J]. International Journal of Agriculture and Biology, 2013, 15(3): 547-552. |
| [23] |
Kanojia A, Dijkwel P P. Abiotic stress responses are governed by reactive oxygen species and age[M]//Kanojia A, Dijkwel P P. Annual Plant Reviews Online, New Zealand: Jeremy Roberts, 2018: 1-32.
|
| [24] |
Lee S, Park C M. Modulation of reactive oxygen species by salicylic acid in Arabidopsis seed germination under high salinity[J]. Plant Signaling & Behavior, 2010, 5(12): 1534-1536. |
| [25] |
Singh S K, Sung T Y, Chung T Y, et al. ACR11 modulates levels of reactive oxygen species and salicylic acid-associated defense response in Arabidopsis[J]. Scientific Reports, 2018, 8(1): 11851. DOI:10.1038/s41598-018-30304-0 |
| [26] |
Tamás L, Mistrík I, Zelinová V. Heavy metal-induced reactive oxygen species and cell death in barley root tip[J]. Environmental & Experimental Botany, 2017, 140: S0098847217301302. |
| [27] |
Dong Y J, Wang Z L, Zhang J W, et al. Interaction effects of nitric oxide and salicylic acid in alleviating salt stress of Gossypium hirsutum L.[J]. Journal of Soil Science and Plant Nutrition, 2005, 15(3): 561-573. |
| [28] |
Ali E, Maodzeka A, Nazim B, et al. The alleviation of cadmium toxicity in oilseed rape(Brassica napus) by the application of salicylic acid[J]. Plant Growth Regulation, 2014, 75(3): 641-655. |
| [29] |
Manquián-Cerda K, Cruces E, Escudey M, et al. Interactive effects of aluminum and cadmium on phenolic compounds, antioxidant enzyme activity and oxidative stress in blueberry(Vaccinium corymbosum L.) plantlets cultivated in vitro[J]. Ecotoxicology & Environmental Safety, 2018, 150: 320-326. |
| [30] |
Chen Z, Silva H, Klessig D. Active oxygen species in the induction of plant systemic acquired resistance by salicylic acid[J]. Science, 1993, 262(5141): 1883-1886. DOI:10.1126/science.8266079 |
| [31] |
Sihag S, Brar B, Joshi U N. Salicylic acid induces amelioration of chromium toxicity and affects antioxidant enzyme activity in Sorghum bicolor L.[J]. International Journal of Phytoremediation, 2019, 21(4): 293-304. DOI:10.1080/15226514.2018.1524827 |
| [32] |
杨颖丽, 王文瑞, 尤佳, 等. Cd2+胁迫对小麦种子萌发、幼苗生长及生理生化特性的影响[J]. 西北师范大学学报, 2012, 48(3): 88-94, 115. YANG Ying-li, WANG Wen-rui, YOU Jia, et al. Effects of cadmium stress on the germination, growth of seedling and physiological and biochemical characters of wheat[J]. Journal of Northwest Normal University (Natural Science), 2012, 48(3): 88-94, 115. DOI:10.3969/j.issn.1001-988X.2012.03.018 |
| [33] |
章秀福, 王丹英, 储开富, 等. 镉胁迫下水稻SOD活性和MDA含量的变化及其基因型差异[J]. 中国水稻科学, 2006, 20(2): 194-198. ZHANG Xiu-fu, WANG Dan-ying, CHU Kai-fu, et al. Changes of SOD activity and MDA content in rice under cadmium stress and their genotypic differences[J]. Chinese Rice Science, 2006, 20(2): 194-198. DOI:10.3321/j.issn:1001-7216.2006.02.014 |
| [34] |
覃勇荣, 汤丰瑜, 严海杰, 等. 重金属胁迫对任豆种子萌发及幼苗抗氧化酶活性的影响[J]. 种子, 2017, 36(10): 31-36. QIN Yong-rong, TANG Fen-yu, YAN Hai-jie, et al. Effects of heavy metal stress on seed germination and seedlings antioxidant enzyme activity of Zenia insigni[J]. Seed, 2017, 36(10): 31-36. |
| [35] |
Zhang Y, Xu S, Yang S, et al. Salicylic acid alleviates cadmium-induced inhibition of growth and photosynthesis through upregulating antioxidant defense system in two melon cultivars(Cucumis melo L.)[J]. Protoplasma, 2015, 252(3): 911-924. DOI:10.1007/s00709-014-0732-y |
| [36] |
Bai X, Dong Y, Kong J, et al. Effects of application of salicylic acid alleviates cadmium toxicity in Perennial ryegrass[J]. Plant Growth Regulation, 2015, 75(3): 695-706. DOI:10.1007/s10725-014-9971-3 |
 2019, Vol. 38
2019, Vol. 38


