土壤重金属污染作为全球性环境热点问题,多年来一直备受社会各界的广泛关注[1]。围绕重金属污染土壤治理修复和风险管控技术研发,众多学者开展了大量研究工作。其中,植物修复因具有经济高效、环境友好和适用于大面积污染修复等优点,成为近年来关注的热点[2]。重金属污染的植物修复技术主要包括植物萃取(Phytoextraction)和植物固定(Phytostabilization)[3]。植物萃取是利用富集植物将土壤中的重金属吸收和富集,并从植物根部转运到茎、叶等地上部分,通过收割地上部分从而达到去除土壤中重金属的效果[4];植物固定是通过植物和根际分泌物对土壤中重金属的吸收积累、螯合及沉淀作用,降低其生物有效性和移动能力,控制其在环境中迁移和扩散能力[5]。前者一般应用于低、中度重金属污染的农田土壤,而后者主要应用于重金属严重污染的矿区和工业污染场地[6-7]。
香根草(Vetiveria zizanioides)属于禾本科岩兰草属多年生大型草本植物,因其具有生物量大、根系发达、适应性强、生长周期短及经济价值高等优点,而被广泛应用于水土保持、退化生态系统恢复和污染物生物修复等领域[8]。现有研究表明,香根草对多种高浓度重金属(如Pb和Cu等)具有较强的耐受性和较高的富集能力,能把大部分重金属积累在根部,对重金属污染土壤,尤其是矿区和工业场地等污染较严重的土壤修复效果显著,具有植物固定修复的潜力[9-13]。目前,国内外学者对香根草修复重金属污染土壤的研究主要集中在单一时间点、不同浓度的重金属处理对香根草生理生态效应及其体内的重金属累积规律等方面,且研究对象多为成年植株,而重金属对香根草种子萌发和幼苗生长阶段在时间尺度上的胁迫效应鲜见报道[3, 14-16]。鉴于种子萌发和幼苗生长是植物生命周期的重要阶段,对外界环境变化最为敏感,开展此阶段植物对重金属胁迫响应的研究对深入探讨植物对重金属胁迫的适应性机制具有重大意义[17-18]。
一般而言,土壤重金属的生物毒性随其总量增加而增加[19]。但大量研究揭示,土壤重金属的生物有效性和生物毒性更大程度上取决于土壤重金属的化学形态[20-21]。其中,土壤重金属水溶态主要以离子态和溶解性有机络合态存在,最容易被植物吸收和积累,是引起植物毒害效应的主要形态[22-24],在重金属污染土壤植物修复工作中,其对植物的胁迫作用不容忽视。在自然环境中,土壤重金属的形态分布受各种环境的综合影响,且通常呈现出复合污染[25],因此,从环境中采集重金属复合污染土壤,模拟重金属水溶态组分对香根草胁迫的研究具有现实意义。
本文以Pb和Cu复合污染土壤为研究对象,模拟土壤中水溶态重金属组分对香根草种子萌发、幼苗生长的影响和植株各部分重金属积累的动态变化,探讨重金属复合污染土壤重金属水溶态组分对香根草种子萌发和幼苗早期的胁迫作用,以期为利用香根草对重金属污染土壤进行植物修复提供科学依据。
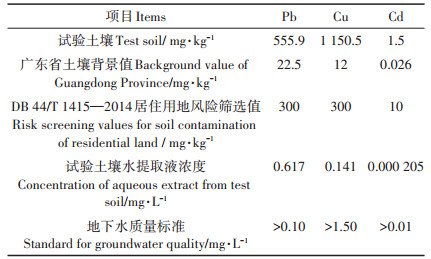
1 材料与方法 1.1 试验材料供试植物材料香根草种子和培养土均购自广州市花卉园艺市场,其中培养土主要成分为天然泥炭土。供试土壤采自广东省清远市龙塘镇电子废物拆解场地,该场地土壤呈现较强酸性(pH为4.3),且受重金属复合污染(表 1),Pb、Cu和Cd含量远高于广东省土壤背景值,其中Pb和Cu含量远高于《土壤重金属风险评价筛选值珠江三角洲》(DB 44/T 1415— 2014)居住用地标准,水提取液Pb含量属于《地下水质量标准》(GB/T 14848—2017)Ⅴ类水质,可能对生态环境存在较大的威胁。
|
|
表 1 土壤及其水提取液重金属含量 Table 1 The concentration of heavy metals in soils and their aqueous extracts |
参考《土壤质量有效态铅和镉的测定原子吸收法》(GB/T 23739—2009)中提取方法的固液比,称取100 g风干的重金属污染土壤于1 L玻璃锥形瓶中,加入500 mL蒸馏水,恒温振荡4 h(150 r·min-1),取出静置,过滤后获得土壤水提取液(水溶态重金属组分)。测定的重金属含量见表 1。
挑选颗粒饱满、大小一致的香根草种子,用5%次氯酸钠溶液消毒5 min后,依次经自来水和蒸馏水漂洗干净,挑选25粒均匀播种于经高压灭菌的培养皿(D=12 cm)中,皿底部预先铺放两层无菌滤纸作为发芽床并添加5 mL污染土壤水提取液润湿,设置3个重复。空白对照组以无菌蒸馏水代替污染土壤水提取液。然后迅速将培养皿加盖,置于温度为25 ℃、湿度为70%的人工气候培养箱中,采用12 h光照、12 h黑暗交替培养,每2 d定量补充污染土壤水提取液或无菌蒸馏水。将胚根出现认定为种子萌发,每2 d定时观察并记录发芽情况,10 d后测定总发芽率。
采用修改后的Timson指数表示种子发芽速率[26]:
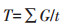
|
式中:G表示每隔2 d的种子发芽率;t表示相应的发芽天数。T数值越大,说明种子萌发得越快。
1.2.2 幼苗水培试验在培养土上对香根草种子进行萌发,幼苗培养2周后,挑选大小、高度一致的香根草幼苗(株高约10 cm),使用蒸馏水清洗干净。将幼苗移栽到1/2 Hoagland营养液中预培养3 d后,按照污染土壤水溶态Pb、Cu和Cd的浓度进行重金属胁迫处理,共设置12个重复,每个重复5株幼苗。将水培盆栽置于温室中培养,营养液连续温和通气,每2 d更换一次。对照组除不进行重金属处理外,其他与处理组一致。分别在第15、30、45、60 d随机收获对照组和处理组各3盆整株植物样本,用自来水和去离子水多次小心冲洗干净,用吸水纸吸干表面水分并晾置20 min后,分成根部和地上部,记录根长、株高及鲜质量,然后置于烘箱中105 ℃杀青30 min,60 ℃干燥至恒质量,测定干质量。根据所采集的样品量情况,第45 d和第60 d收获的香根草根部和地上部分别进行Pb、Cu和Cd含量测定。
重金属耐性指数(MTI)是指处理组植株干质量和对照组植株干质量的百分比,用于衡量香根草幼苗在重金属胁迫下的生长能力[27]。转移系数(TF)是指植物地上部与地下部重金属含量的比值,用来衡量香根草对重金属的转运能力[16]。计算香根草的重金属耐性指数和对各重金属的转运系数。
1.3 分析方法植物样品干燥后经液氮处理进行研磨粉碎,采用硝酸-高氯酸法消解;土壤采用王水-高氯酸法消解;消解定容后的样品与污染土壤提取液一致,均采用原子吸收分光光度计(PinAAcle 900T,美国PerkinElmer公司)测定Pb、Cu和Cd含量。分析中所使用的试剂均为优级纯以上,采样和实验用器皿用2%硝酸浸泡超过24 h,然后用超纯水冲洗干净备用。每批样品均做两个以上的空白试验和20%的平行样品,土壤和植物样品分别采用土壤成分分析标准物质——砖红壤GBW 07407(GSS-7)和生物成分分析标准物质——芹菜GBW 10048(GSB-26)进行质控,各金属回收率在90%~110%之间。
1.4 数据分析采用Microsoft Excel 2010和SPSS 16.0对所有数据进行统计分析,数据采用平均值±标准误差表示,使用单因素方差分析(One-way ANOVA)对变量进行差异性检验;图形绘制采用OriginPro 8.5软件(OriginLab corporation,USA)完成。
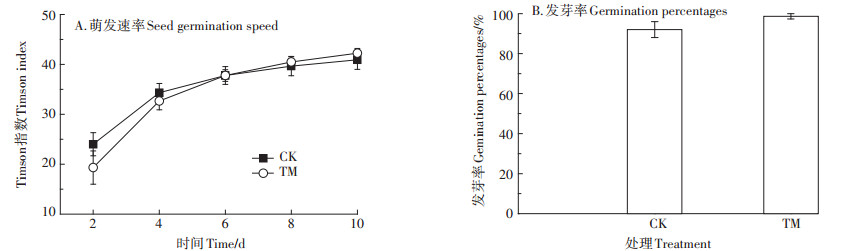
2 结果与分析 2.1 水溶态重金属组分对种子萌发的影响Pb和Cu复合污染土壤水溶态重金属组分对香根草种子萌发速率和最终发芽率的影响均不显著(图 1)。第2、4 d,处理组香根草种子的发芽速率低于对照组,第6~10 d,处理组的发芽速率逐渐高于对照组,但均未达到显著差异(P > 0.05)。香根草的种子萌发速率很快,处理组在第2 d的Timson指数为19.3,此后一直维持较高的萌发速率,至第10 d,指数已高达42.3。污染土壤水溶态重金属组分对香根草种子的最终发芽率产生了轻微促进作用,但未达到显著差异水平(P > 0.05)。因此,香根草的种子萌发受污染土壤水溶态重金属组分的影响较小,且萌发速度较快、发芽率较高,具有在重金属复合污染土壤中定植的潜力。
|
CK——对照组,TM——处理组。下同 CK-control, TM-treatment. The same below 图 1 水溶态重金属组分对香根草种子萌发速率和最终发芽率的影响 Figure 1 Effects of water-soluble components of heavy metals in contaminated soil on the seed germination speed and germination percentages of vetiver |
植物的根长和株高是反映植物在污染环境中抗性和生长能力的重要指标。水溶态Pb和Cu对香根草幼苗的根长、株高产生较大的抑制作用(图 2A和图 2B),且对根长的抑制作用比株高更显著。第15 d,处理组香根草幼苗根长受到显著抑制(P < 0.05),但株高并未受到影响(P > 0.05)。第30 d,香根草幼苗的根长、株高分别比对照组低38.9%、39.7%,达到极显著差异(P < 0.01)。此后,根长一直受到明显抑制(P < 0.01),至第60 d,根长较对照组低43.6%。株高在第45 d受到抑制作用的程度有所减弱(P < 0.05),但在第60 d,受到的抑制同样达到极显著水平(P < 0.01),较对照组低18.9%。

|
*P < 0.05,**P < 0.01:表示与同期对照组相比,处理组达到显著或极显著差异。下同 Asterisk and double asterisk indicate the treatment is significantly different with the control at P < 0.05 and P < 0.01 levels, respectively. The same below 图 2 水溶态重金属组分对香根草幼苗根长、株高和生物量的影响 Figure 2 Effects of water-soluble components of heavy metals on root length, shoot height and biomass of vetiver seedlings |
水溶态Pb和Cu对香根草幼苗鲜质量和干质量的影响见图 2C和图 2D。与对照组相比,除第15 d,香根草幼苗生物量均受到了显著或极显著抑制(P < 0.05或P < 0.01),抑制作用强度随时间呈现先升后降的规律。第15 d,处理组香根草幼苗的鲜质量和干质量相较对照组均无显著差异(P > 0.05)。随着生长时间的增加,处理组生物量受到的抑制作用开始显现,在第30~45 d,处理组幼苗鲜质量和干质量均受到极显著抑制(P < 0.01)。但在第60 d,处理组幼苗生物量受到的抑制作用有所减弱,此时仍达到显著差异(P < 0.05),鲜质量、干质量分别较对照低43.8%、30.7%。与干质量相比,处理组幼苗鲜质量的减少更加显著,即植株含水率下降。
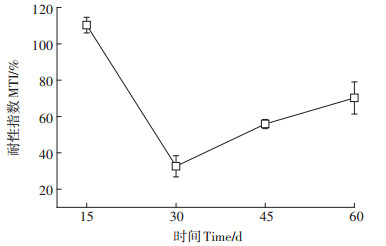
2.2.3 耐性指数由图 3可知,香根草幼苗的MTI值随生长时间的增加呈现先降后升的趋势。在第15 d,香根草幼苗的MTI值为110.3%,可能因为处理的时间较短,幼苗体内积累的重金属含量较低,对植株生长抑制作用不明显。幼苗MTI值在第30 d达到最低值,为32.7%,说明随着培养时间的增加,香根草幼苗体内逐渐累积的重金属对幼苗的生长产生了较强烈的抑制。但自第30 d起,幼苗MTI值为上升趋势,至第60 d时,MTI值达到了70.2%。
|
图 3 水溶态重金属组分胁迫下香根草幼苗的耐性指数 Figure 3 The MTI of vetiver seedlings under the stress of water-soluble components of heavy metals |
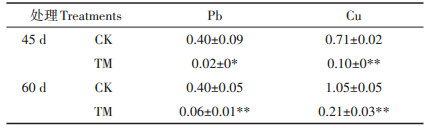
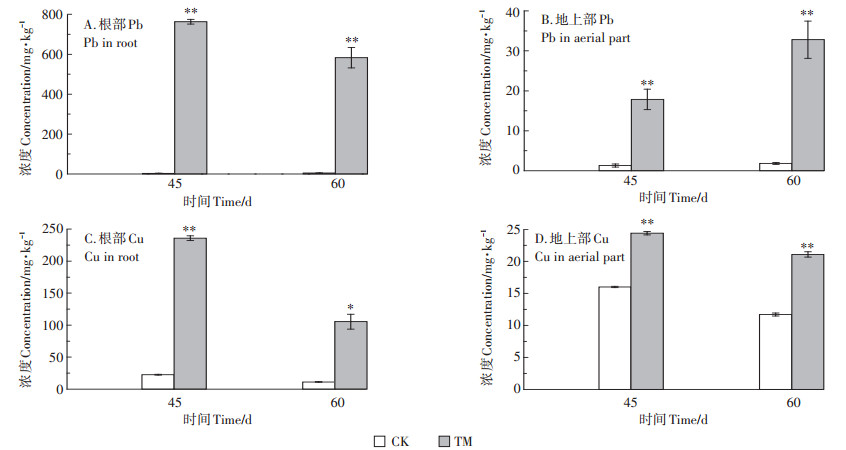
随着生长时间的增加,处理组香根草幼苗根部的Pb和Cu含量和地上部Cu含量均呈下降趋势(图 4A,图 4C和图 4D),地上部Pb含量呈上升的趋势(图 4B)。在第45 d,处理组幼苗根部和地上部的Pb和Cu含量均极显著高于对照组(P < 0.01)。第60 d,处理组幼苗根部和地上部的Pb和Cu含量均显著或极显著高于对照组(P < 0.05或P < 0.01)。
|
图 4 香根草幼苗根部和地上部Pb和Cu的含量 Figure 4 Pb and Cu concentration in root and aerial part of vetiver seedlings |
香根草幼苗对Pb、Cu的吸收和积累均主要发生在根部,根部最大积累量分别达到763 mg·kg-1和235 mg·kg-1,而地上部的Pb和Cu最大积累量仅为32.8 mg·kg-1和24.4 mg·kg-1。第60 d,处理组根部和地上部Pb含量分别是对照组的124.3、17.9倍,Cu含量分别是对照组的9.41、1.80倍。香根草幼苗对不同的重金属富集能力不同,其对Pb的积累量较Cu大。
2.4 香根草幼苗对重金属的转运能力香根草幼苗对Pb和Cu的TF值随生长时间的增加而增大(表 2),但TF值均小于1,说明香根草幼苗对这两种重金属元素从根部转运到地上部的能力较弱。尽管处理组香根草幼苗根部富集的Pb和Cu含量较高,但其在香根草体内的迁移受到很大的限制,其TF值均远小于对照组,达到显著或极显著差异(P < 0.05或P < 0.01),说明香根草幼苗根系对重金属有较强的滞留效果。香根草幼苗对不同重金属的转运能力存在差异,相较而言,对Cu的转运能力强于Pb。
|
|
表 2 香根草对Pb和Cu的转运系数 Table 2 Translocation factor of Pb and Cu in vetiver seedling |
种子萌发作为植物生命活动的开始,对植物的繁殖、生长和适应环境均有重大影响[18]。现有研究证明,Pb和Cu对植物种子的萌发具有浓度效应,一般表现为低促高抑[28-29],一定浓度的重金属可通过打破种子的休眠而提高发芽率[30]。本研究中,Pb和Cu复合污染土壤的水溶态重金属组分对香根草种子萌发速率的影响表现为前期抑制后期促进,对最终发芽率的影响表现为轻微促进,但与对照组并无显著差异(P > 0.05)。这可能是由于污染土壤中水溶态重金属组分比重较小,相对浓度较低,且香根草种子自身有较强的重金属耐受性[31],因而对其表现出低浓度促进的效应。因此,虽然土壤中重金属水溶态组分被认为是造成植物危害的主要形态[24],但由于其比重较小,即使在重金属污染较严重的土壤中,其相应的重金属水溶态组分也不一定会限制植物的种子萌发。
在污染物胁迫下能发芽并存活是修复植物的基本特征[32]。植物幼苗期生长是经受重金属胁迫的关键时期,已有报道表明,Pb和Cu对香根草幼苗的生长存在低浓度促进高浓度抑制的影响,具体表现因重金属、植物种类及外部条件的不同而有所差异[14, 16]。重金属污染土壤对植物幼苗生长的抑制作用主要表现为抑制根伸长、降低株高、减少生物量,且土壤中重金属浓度越高,其抑制作用越强[33-34]。本研究结果表明,香根草幼苗生长比种子萌发更容易受到水溶态Pb和Cu的胁迫,处理组香根草幼苗的根长、株高和生物量均受到了显著或极显著的抑制作用(P < 0.05或P < 0.01),这种抑制作用可能来自于植株内富集重金属毒性的直接作用或来自于对微量元素、水分获取能力抑制的间接作用[14]。香根草幼苗根部对水溶态Pb和Cu的胁迫比地上部更为敏感。根系是重金属胁迫最直接的受害部位,当土壤受到重金属污染时,根系受到的影响相对最为严重[35-36],因此,幼苗根系受胁迫程度可反映重金属对植物的生物毒性及植物对重金属的忍耐能力[37]。本研究中,与对照相比,水溶态Pb和Cu处理的香根草幼苗鲜质量减少幅度大于干质量,即植株含水率出现下降现象,这与前人报道的高浓度Cu、Cd胁迫引起香根草植株含水率和生物量下降的结果一致[14, 16]。重金属胁迫可能阻碍了香根草植株对于水分的输送,从而影响了细胞对水分的吸收[38]。
MTI是用于筛选修复植物的最常用指标之一,可以用来衡量植物对某一浓度重金属胁迫下的生长能力[39],MTI值越高,表明植物对重金属的耐受性越强,在重金属污染区域存活和生长的可能性越大[40]。本研究结果表明,第30~60 d香根草幼苗的MTI值均小于100%,为敏感-中度耐受级别[3],但随着生长时间的增加,MTI值呈上升趋势,说明其耐受性逐渐增强。Gautam等[3]的研究发现,香根草在Pb、Cu、Zn和Ni等重金属污染的土壤中培养180 d后的MTI值均大于100%,属于重金属高耐受性植物。因此,可推断香根草幼苗对重金属的胁迫较成年植株敏感,在研究重金属污染土壤修复植物耐受性时应重点关注植物幼苗期的胁迫响应。
植物的重金属含量和转移系数是衡量植物对重金属耐受性的重要指标[14]。本研究结果表明,与对照组相比,处理组较高浓度的Pb和Cu使香根草幼苗的根部和地上部重金属含量显著增加,这也是处理组幼苗生长受到显著抑制的主要原因[14]。随着生长时间的推移,处理组香根草根部的Pb和Cu含量均呈下降趋势,而地上部Pb含量呈上升的趋势。相应地,TF值也随生长时间的增加而增大,说明香根草幼苗对重金属从根部转移到地上部的能力随生长时间逐渐增强,从而提高对重金属胁迫的抗性[41]。在不同生长阶段,香根草幼苗根系的Pb和Cu含量均远大于地上部,根部重金属含量所占总量比例高达97.7%和90.6%,只有少量重金属转移到地上部。因此,香根草属于根部重金属积累型植物,这与前人研究的结论一致[16, 42-43]。
TF可用于评估植物对单一重金属的转运能力,当TF大于1时,说明植物将重金属从地下部转运到地上部的能力较强,可达到地下部重金属的大量吸收,主要表现为耐性生长[16]。在本研究中,所有处理Pb和Cu的TF值均小于1。因此,香根草幼苗对两种重金属的转运能力较弱,根系对重金属有较强的滞留效果,这可能是由于大部分Pb和Cu被根际区域的分泌物固定,只有少部分重金属能有效地向上转移所致[14]。植物将大部分重金属滞留或固定在根部,阻止或减少其向地上部分运输,被认为是植物减轻对地上部敏感器官的毒害作用,增强植物耐性的重要机制之一[40, 44-45]。大量研究表明,香根草对高浓度的重金属具有较强的耐受能力[8, 11, 14, 43]。本研究结果表明,香根草幼苗根系对两种重金属较强的滞留能力可能对提高其重金属耐性产生了重要作用。本研究中,尽管处理组香根草幼苗根部富集的Pb和Cu含量较高,但其在香根草体内的迁移受到很大的限制,处理组香根草幼苗的TF值均显著小于对照组,说明香根草地上部可能存在较低重金属浓度阈值以减轻重金属对地上部植株的毒害作用从而增加耐受性[41]。这与Aibibu等[14]的研究中香根草转运系数随着水溶液Cd浓度升高而降低的结论一致。
4 结论(1)香根草幼苗生长受污染土壤水溶态Pb和Cu组分的胁迫比种子萌发阶段敏感,表现为幼苗根长、株高、湿质量和干质量的显著减少;但其耐性随生长时间的增加而逐渐增强,在研究重金属污染土壤的修复植物时应特别关注植物幼苗早期的表现。
(2)在水溶态Pb和Cu组分的处理下,香根草幼苗根部和地上部的Pb和Cu含量均显著增加,但主要富集在根部,其转运系数均小于1,表明香根草属于根部积累性植物,通过限制重金属向上部转移以减轻对地上部的伤害,提高其耐受性。
| [1] |
Rahman M A, Rahman M M, Reichman S M, et al. Heavy metals in Australian grown and imported rice and vegetables on sale in Australia:Health hazard[J]. Ecotoxicology and Environmental Safety, 2014, 100: 53-60. DOI:10.1016/j.ecoenv.2013.11.024 |
| [2] |
Mahar A, Wang P, Ali A. Challenges and opportunities in the phytoremediation of heavy metals contaminated soils:A review[J]. Ecotoxicology and Environmental Safety, 2016, 126: 111-121. DOI:10.1016/j.ecoenv.2015.12.023 |
| [3] |
Gautam M, Agrawal M. Phytoremediation of metals using vetiver (Chrysopogon zizanioides L. Roberty) grown under different levels of red mud in sludge amended soil[J]. Journal of Geochemical Exploration, 2017, 182: 218-227. DOI:10.1016/j.gexplo.2017.03.003 |
| [4] |
McGrath S P, Zhao F J. Phytoextraction of metals and metalloids from contaminated soils[J]. Current Opinion in Biotechnology, 2003, 14: 277-282. DOI:10.1016/S0958-1669(03)00060-0 |
| [5] |
Pignattelli S, Colzi I, Buccianti A, et al. Exploring element accumulation patterns of a metal excluder plant naturally colonizing a highly contaminated soil[J]. Journal of Hazardous Materials, 2012, 227/228: 362-369. DOI:10.1016/j.jhazmat.2012.05.075 |
| [6] |
Padmavathiamma P K, Li L Y. Phytoremediation technology:Hyperaccumulation metals in plants[J]. Water, Air, and Soil Pollution, 2007, 184(1/2/3/4): 105-126. |
| [7] |
Sheoran V, Sheoran A S, Poonia P. Phytomining:A review[J]. Minerals Engineering, 2009, 22: 1007-1019. DOI:10.1016/j.mineng.2009.04.001 |
| [8] |
曹红梅, 林曼芬. 香根草和香茅草对铜、锌的耐性研究[J]. 安徽农学通报, 2014, 20(9): 18-19, 30. CAO Hong-mei, LIN Man-fen. Study on tolerance of Vetiveria zizanioides and lemon grass on copper and zinc[J]. Anhui Agricultural Science Bulletin, 2014, 20(9): 18-19, 30. |
| [9] |
Xia H P. Ecological rehabilitation and phytoremediation with four grasses in oil shale mined land[J]. Chemosphere, 2004, 54(3): 345-353. DOI:10.1016/S0045-6535(03)00763-X |
| [10] |
Chiu K K, Ye Z H, Wong M H. Growth of Vetiveria zizanioides and Phragmities australis on Pb/Zn and Cu mine tailings amended with manure compost and sewage sludge:A greenhouse study[J]. Bioresource Technology, 2006, 97(1): 158-170. DOI:10.1016/j.biortech.2005.01.038 |
| [11] |
Ghosh M, Paul J, Jana A, et al. Use of the grass, Vetiveria zizanioides (L.) Nash for detoxification and phytoremediation of soils contaminated with fly ash from thermal power plants[J]. Ecological Engineering, 2015, 74: 258-265. DOI:10.1016/j.ecoleng.2014.10.011 |
| [12] |
Attinti R, Barrett K R, Datta R, et al. Ethylenediaminedisuccinic acid (EDDS) enhances phytoextraction of lead by vetiver grass from contaminated residential soils in a panel study in the field[J]. Environmental Pollution, 2017, 225: 524-533. DOI:10.1016/j.envpol.2017.01.088 |
| [13] |
Mu J, Hu Z Y, Huang L J, et al. Influence of alkaline silicon-based amendment and incorporated with biochar on the growth and heavy metal translocation and accumulation of vetiver grass(Vetiveria zizanioides) grown in multi-metal-contaminated soils[J]. Journal of Soils and Sediments, 2019, 19(15): 2277-2289. |
| [14] |
Aibibu N, Liu Y G, Zeng G M, et al. Cadmium accumulation in Vetiveria zizanioides and its effects on growth, physiological and biochemical characters[J]. Bioresource Technology, 2010, 101(16): 6297-6303. DOI:10.1016/j.biortech.2010.03.028 |
| [15] |
Abaga N O Z, Dousset S, Mbengue S, et al. Is vetiver grass of interest for the remediation of Cu and Cd to protect marketing gardens in Burkina-Faso?[J]. Chemosphere, 2014, 113: 42-47. DOI:10.1016/j.chemosphere.2014.04.010 |
| [16] |
Dhananjay K, Sushil K B, Sangeeta A. Bioaccumulation and biochemical responses of Vetiveria zizanioides grown under cadmium and copper stresses[J]. Environmental Sustainability, 2018, 1(2): 133-139. DOI:10.1007/s42398-018-0009-z |
| [17] |
Wang W, Keturi P H. Comparative seed germination tests using ten plant species for toxicity assessment of metals engraving effluent sample[J]. Water, Air, and Soil Pollution, 1990, 52(3/4): 369-376. |
| [18] |
Chen Y X, He Y F, Luo Y M. Physiological mechanism of plant roots exposed to cadmium[J]. Chemosphere, 2003, 50(6): 789-793. DOI:10.1016/S0045-6535(02)00220-5 |
| [19] |
Filgurira A V, Lavilla I, Bendicho C. Chemical sequential extraction for metal partitioning in environmental solid samples[J]. Journal of Environmental Monitoring, 2002, 4(6): 823-857. DOI:10.1039/b207574c |
| [20] |
曹勤英, 黄志宏. 污染土壤重金属形态分析及其影响因素研究进展[J]. 生态科学, 2017, 36(6): 222-232. CAO Qin-ying, HUANG Zhi-hong. Review on speciation analysis of heavy metals in polluted soils and its influencing factors[J]. Ecological Science, 2017, 36(6): 222-232. |
| [21] |
邓迎璇, 李永涛, 李晓晶, 等. 土壤样品中重金属化学形态模型的发展与应用[J]. 农业环境科学学报, 2018, 37(7): 1350-1361. DENG Ying-xuan, LI Yong-tao, LI Xiao-jing, et al. Development and application of chemical speciation models for heavy metals in environmental soil samples[J]. Journal of Agro-Environment Science, 2018, 37(7): 1350-1361. |
| [22] |
Tessier A, Campbell P G C, Bisson M. Sequential extraction procedure for the speciation of particulate trace metals[J]. Analytical Chemistry, 1979, 51(7): 844-851. DOI:10.1021/ac50043a017 |
| [23] |
刘恩玲, 王亮. 土壤中重金属污染元素的形态分布及其生物有效性[J]. 安徽农业科学, 2006, 34(3): 547-548, 557. LIU En-ling, WANG Liang. Distribution of different heavy metal forms in soil and their bio-availability[J]. Journal of Anhui Agricultural Sciences, 2006, 34(3): 547-548, 557. DOI:10.3969/j.issn.0517-6611.2006.03.077 |
| [24] |
黄先飞, 秦樊鑫, 胡继伟. 重金属污染与化学形态研究进展[J]. 微量元素与健康研究, 2008, 25(1): 48-51. HUANG Xian-fei, QIN Fan-xin, HU Ji-wei. Review on studies of heavy metal pollution and chemical speciation[J]. Studies of Trace Elements and Health, 2008, 25(1): 48-51. DOI:10.3969/j.issn.1005-5320.2008.01.023 |
| [25] |
吴志能, 谢苗苗, 王莹莹. 我国复合污染土壤修复研究进展[J]. 农业环境科学学报, 2016, 35(12): 2250-2259. WU Zhi-neng, XIE Miao-miao, WANG Ying-ying. Remediation of soils with combined pollution in China:A review[J]. Journal of AgroEnvironment Science, 2016, 35(12): 2250-2259. DOI:10.11654/jaes.2016-0863 |
| [26] |
Khan M A, Ungar I A. The effect of salinity and temperature on the germination of polymorphic seeds and growth of Atriplex triangular is Wild[J]. American Journal of Botany, 1984, 71(4): 481-489. DOI:10.1002/j.1537-2197.1984.tb12533.x |
| [27] |
Wang S, Shi X, Sun H, et al. Variations in metal tolerance and accumulation in three hydroponically cultivated varieties of Salix integra treated with lead[J]. PLoS One, 2014, 9(9): e108568. DOI:10.1371/journal.pone.0108568 |
| [28] |
陶玲, 任珺, 祝广华, 等. 重金属对植物种子萌发的影响研究进展[J]. 农业环境科学学报, 2007, 26(增刊1): 52-57. TAO Ling, REN Jun, ZHU Guang-hua, et al. Advance on the effects of heavy metals on seed germination[J]. Journal of Agro-Environment Science, 2007, 26(Suppl1): 52-57. |
| [29] |
高柱, 王小玲, 刘腾云, 等. 重金属Cu污染对苏丹草种子发芽及幼苗生长的影响[J]. 中国农学通报, 2013, 29(25): 199-204. GAO Zhu, WANG Xiao-ling, LIU Teng-yun, et al. Effects of heavy metals copper pollution on seed germination and seedlings growth of Sorghum sudanense(Piper) stapf[J]. Chinese Agricultural Science Bulletin, 2013, 29(25): 199-204. |
| [30] |
傅强, 杨期和, 叶万辉. 种子休眠的解除方法[J]. 广西农业生物科学, 2003, 22(3): 230-234. FU Qing, YANG Qi-he, YE Wan-hui. Summarization on methods to relieve seed dormancy[J]. Journal of Guangxi Afric and Biol Science, 2003, 22(3): 230-234. |
| [31] |
赵述华, 陈志良, 张太平, 等. 稳定化处理对矿渣中重金属迁移转化的影响研究[J]. 环境科学, 2014, 35(4): 1548-1554. ZHAO Shu-hua, CHEN Zhi-liang, ZHANG Tai-ping, et al. Effects of stabilization treatment on migration and transformation of heavy metals in mineral waste residues[J]. Environmental Science, 2014, 35(4): 1548-1554. |
| [32] |
Kidd P, Barceló J, Bernal M, et al. Trace element behavior at the root-soil interface:Implications in phytoremediation[J]. Environmental and Experimental Botany, 2009, 67(1): 243-259. DOI:10.1016/j.envexpbot.2009.06.013 |
| [33] |
Li S F, Zhang G J, Gao W J, et al. Development and change in GSH level in safflower (Carthamus tinctorius L.) exposed to copper and lead[J]. Archives of Biological Sciences, 2015, 67(2): 385-396. DOI:10.2298/ABS140910006L |
| [34] |
Wang S F, Zhao Y, Guo J H, et al. Effects of Cd, Cu and Zn on Ricinus communis L. growth in single element or co-contaminated soils:Pot experiments[J]. Ecological Engineering, 2016, 90: 347-351. DOI:10.1016/j.ecoleng.2015.11.044 |
| [35] |
唐东民, 伍钧, 唐勇, 等. 重金属胁迫对植物的毒害及抗性机理研究进展[J]. 四川环境, 2008, 27(5): 79-83. TANG Dong-min, WU Jun, TANG Yong, et al. The research advance in toxic hazard of heavy metal stress on plant and its resistance mechanism[J]. Sichuan Environment, 2008, 27(5): 79-83. DOI:10.3969/j.issn.1001-3644.2008.05.018 |
| [36] |
武文飞, 南忠仁, 王胜利, 等. 绿洲土Cd、Pb、Zn、Ni复合污染下重金属的形态特征和生物有效性[J]. 生态学报, 2013, 33(2): 619-630. WU Wen-fei, NAN Zhong-ren, WANG Sheng-li, et al. Fractionation character and bioavailability of Cd, Pb, Zn and Ni combined pollution in oasis soil[J]. Acta Ecologica Sinica, 2013, 33(2): 619-630. |
| [37] |
田胜尼, 刘登义, 彭少麟, 等. 香根草和鹅观草对Cu、Pb、Zn及其复合重金属的耐性研究[J]. 生物学杂志, 2004, 21(3): 15-19, 26. TIAN Sheng-ni, LIU Deng-yi, PENG Shao-lin, et al. The study on tolerance of Vetiveria zizanioides and Roegneria kamoji to heavy metal Cu, Pb, Zn and their mixed soluble[J]. Journal of Biology, 2004, 21(3): 15-19, 26. |
| [38] |
史春琼, 黄光团. 利用香根草吸收水体底泥中重金属Cu的效能分析[J]. 净水技术, 2013, 32(3): 82-84. SHI Chun-qiong, HUANG Guang-tuan. Performance analysis for absorption of heavy metal(Cu) in sediment of water body by making use of Vetiveria zizanioides[J]. Water Purification Technology, 2013, 32(3): 82-84. DOI:10.3969/j.issn.1009-0177.2013.03.019 |
| [39] |
Zacchini M, Pietrini F, Mugnozza G S, et al. Metal tolerance, accumulation and translocation in poplar and willow clones treated with cadmium in hydroponics[J]. Water, Air, and Soil Pollution, 2009, 197(1): 23-34. |
| [40] |
Preeti P P, Tripathi A K. Effect of lead and cadmium on morphological parameters of Syzygium cumini Linn seedling[J]. Indian Journal of Science, 2012, 1: 29-31. |
| [41] |
Verkleij J A C, Schat H, Shaw A J. Mechanisms of metal tolerance in higher plants[M]//Shaw, A J. Ed. Heavy meta tolerance in plants: Evolutionary aspects. Boca Raton: CRC Press, 1990: 179–193.
|
| [42] |
何东, 邱波, 彭尽晖, 等. 湖南下水湾铅锌尾矿库优势植物重金属含量及富集特征[J]. 环境科学, 2013, 34(9): 3595-3600. |
| [43] |
Yang B, Shu W S, Ye Z H, et al. Growth and metal accumulation in vetiver and two Sesbania species on lead/zinc mine tailings[J]. Chemosphere, 2003, 52(9): 1593-1600. DOI:10.1016/S0045-6535(03)00499-5 |
| [44] |
雷梅, 岳庆玲, 陈同斌, 等. 湖南柿竹园矿区土壤重金属含量及植物吸收特征[J]. 生态学报, 2005, 25(5): 1146-1151. LEI Mei, YUE Qing-ling, CHEN Tong-bin, et al. Heavy metal concentrations in soils and plants around Shizhuyuan of Hunan Province[J]. Acta Ecologica Sinica, 2005, 25(5): 1146-1151. DOI:10.3321/j.issn:1000-0933.2005.05.029 |
| [45] |
陈柳燕, 张黎明, 李福燕, 等. 剑麻对重金属铅的吸收特性与累积规律初探[J]. 农业环境科学学报, 2007, 26(5): 1879-1883. CHEN Liu-yan, ZHANG Li-ming, LI Fu-yan, et al. A primary research on sisal's uptake property and the accumulation rule to Pb ions[J]. Journal of Agro-Environment Science, 2007, 26(5): 1879-1883. DOI:10.3321/j.issn:1672-2043.2007.05.056 |
 2019, Vol. 38
2019, Vol. 38