2. 沈阳农业大学植物保护学院, 沈阳 110866;
3. 中国农业科学院农业环境与可持续发展研究所, 北京 100081
2. College of Plant Protection, Shenyang Agricultural University, Shenyang 110866, China;
3. Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Science, Beijing 100081, China
生物炭是生物质材料在低氧环境下高温热解产生的一类多功能材料[1],具有高含碳量、多孔性、吸附能力强等特点[2]。大量研究指出,向农田施用生物炭不仅可以提高土壤碳氮含量,还可以提高土壤持水力[3],增加土壤养分固持[4],因此添加生物炭在一定程度上有利于改善土壤理化性质,提高土壤生物活性[5]。近年来,一些研究也认为生物炭与传统改良剂相比,具有成本低、技术原理简单、环境友好等特点,不仅可解决土壤污染问题,还可以为秸秆等过剩农业废弃物提供解决途径[6],因此在土壤、水体污染修复,新型肥料制备等领域,生物炭具有广阔应用前景[7]。
尽管与传统改良剂相比,生物炭具有诸多优势,但也有大量研究显示,由于制备原料、方法和投入剂量的不同,不同材料生物炭本身的理化性状[8]、吸附特征[9]、有害物质释放量[10]等均存在显著差异。虽然一些研究认为添加生物炭有利于降低受污染土壤多环芳烃化合物(PAHs)的生物有效性[11],但另一些研究也显示,在生物炭制备过程中,由于不完全燃烧和热解,会产生多种多环芳烃化合物[12]。多环芳烃化合物是重要的环境污染物,抑制土壤微生物的活性和种子萌发,对土壤生物区系组成、根系养分可利用性和作物生长产生不利影响[13-15],因此,其农田施用生物质炭的安全性仍存在争议[16-17]。Rogovska等[18]的研究结果显示,在6种不同材料制备的生物炭中均测出萘、二苯并呋喃、蒽等多环芳烃化合物,而其总PAHs含量范围为0.8~255.3 μg·g-1,不同材料制得生物炭PAHs含量差异显著。Buss等[19]也指出,土壤淋溶液中总PAHs含量随生物炭施用量的增加而升高,并对作物早期生长产生显著抑制作用。李阳等[20]的研究进一步显示,所用玉米秸秆生物炭测出8种多环芳烃化合物,其浸提液中PAHs总量接近3750 ng·g-1,对作物早期生长有显著抑制作用。虽然上述研究提到生物炭本身具有多环芳烃,且含量存在一定差异,但常规施用是否达到安全阈值,作物生长是否受生物炭含有的PAHs影响,仍缺乏相应报道。因此,探讨各原料生物炭在不同用量下对土壤环境和作物早期生长的影响,对生物炭的农田安全使用具有重要意义[21-22]。
本研究以小麦种子和黄瓜种子为供试对象,采用培养试验,以不施用生物炭处理作为对照(CK),分别按不同的比例施用花生壳生物炭(PBC)、玉米秸秆生物炭(MBC)、杨木屑生物炭(ABC)以及竹屑生物炭(BBC),测定不同种类生物炭组分及理化性质和水溶性PAHs的含量,及不同施用量对小麦和黄瓜种子发芽率及早期生长特征的影响,为生物炭的安全施用提供理论依据。
1 材料和方法 1.1 原料性质及生物炭制备本研究以花生壳(P)、玉米秸秆(M)、杨木屑(A)、竹屑(B)4种生物质为原料,原料化学组分如表 1所示。原料经自然风干、粉碎、研磨后过20目筛,在500 ℃下充N2制备生物炭。具体的操作过程为:启动温度为60 ℃,以8 ℃·min-1幅度升温至500 ℃,保持120 min,然后保持通N2状态冷却至室温。冷却后,将生物炭研磨过100目筛,干燥保存备用。
|
|
表 1 花生壳(P)、玉米秸秆(M)、杨木屑(A)、竹屑(B)原料化学组分 Table 1 The proximate analysis of the peanut shell(P), corn stalks biochar (M), aspen chips (A) and the bamboo chips (B) |
生物炭组分特性各指标的测试分析方法在前期研究均有报道。pH测定参考GB/T 12496.7—1999;灰分含量测定采用缓慢灰化法,参照GB/T 17664—1999;挥发分的测定参照GB/T 2001—2013;固定碳的计算方法为固定碳(%)=100-灰分(%)-挥发分(%);采用X射线光电子能谱(XPS)测定生物炭相对原子含量(%)[23-24]。
生物炭水溶性PAHs提取方法如下:按10 g生物炭加入100 mL去离子水(固液比1:10 m/m),混合后,150 r·min-1振荡24 h,振荡结束后经whatman no.1定性滤纸过滤(滤纸厚度0.18 mm,滞留粒径11 μm)。将烧杯中提取物用高纯氮气吹扫提取液至干,随后用正己烷定容至2 mL,过0.22 μm滤膜,转入进样小瓶[19]。土壤样品、土壤生物炭混合后样品中PAHs测定采用超声萃取-层析柱净化-质谱联用的方法。提取方法如下:称取2.0 g土样于25 mL玻璃离心管中,加入10 mL二氯甲烷(分析纯),盖紧后置于超声水浴中连续提取1 h。随后在4000 r·min-1条件下离心5 min。将上清液通过装有少量无水Na2SO4的漏斗转移至干燥烧杯中,重复两次。通风橱内用高纯氮气吹扫提取液至有机相蒸干,随后正己烷定容至2 mL。取1 mL过2 g硅胶柱净化后用体积比为1:1的二氯甲烷和正己烷混合溶液洗脱,将洗脱液收集至旋转蒸发瓶中,在40 ℃下恒温浓缩干燥,再用正己烷定容至2 mL,过0.22 μm滤膜后,转入进样小瓶[25]。本研究主要测定美国环保局和欧洲环保组织优先考虑的16种多环芳烃的含量[26]。PAH16测定仪器为气相色谱串联三重四极杆质谱仪(安捷伦7890GC-7000C triplequadrupole MS),检测限(MDL)为1 μg·kg-1。
扫描电镜图(SEM):采用TM-1000型扫描电镜(HIECH Corp),冷场发射式,观察生物炭样品的大小、形状和表面特征。
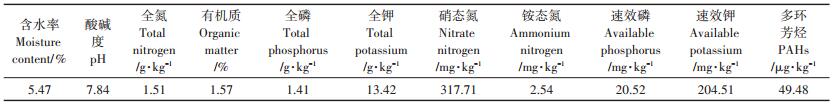
1.3 土壤理化性质测定供试土壤采自天津西青区益利来生态农场,常年种植黄瓜、番茄等蔬菜作物。土壤取样后经充分混合,风干过20目筛后待用。土壤全氮含量采用凯氏定氮法测定,土壤硝态氮、铵态氮浓度采用全自动连续流动分析仪(AA3,Bran+Luebbe Corp)测定。有机质、全磷等基本理化性质测定方法参照《土壤农化分析》 [27]。测定结果见表 2。
|
|
表 2 供试土壤基本理化性质 Table 2 Basic physical and chemical properties of soil |
将4种生物炭(竹炭、木屑炭、花生壳炭、玉米秸秆炭)按0、20.0、40.0、80.0、160.0 g·kg-1施用比例与100 g土壤混合均匀后装于培养皿中。底部平铺滤纸,选取黄瓜、小麦各25粒。种子用10%H2O2浸泡10 min,随即用自来水和去离子水各冲洗3次。将种子于去离子水中浸泡2 h后,滤纸拭干表面水分待用。将25粒处理过的种子均匀铺于各培养皿中,调节水分至田间持水量的40%~50%,置于培养箱中(25±0.5 ℃)避光培养,每个处理5个重复,记录种子的发芽情况。测量指标及方法如下:
当对照组种子发芽率超过65%且对照根长超过3 cm时结束发芽实验,并以初生根长>5 mm作为发芽标准统计发芽数,用直尺测定各处理已萌发种子根长、茎长。生物炭施用对作物生态安全性可用种子发芽试验来评价,主要指标有发芽率、根伸长抑制率、茎长抑制率等,按以下公式计算[28]。

|
(1) |
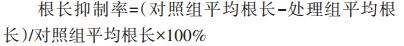
|
(2) |

|
(3) |
采用Microsoft Excel 2010、Origin 9.1和OMNIC对数据进行处理以及图表的绘制,SPSS 20.0统计软件对试验数据进行方差分析,Duncan多重比较判断处理间的差异显著性(P < 0.05)。
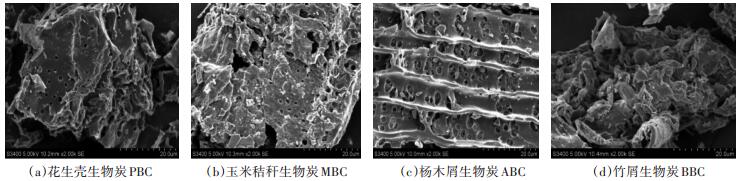
2 结果与分析 2.1 不同材料生物炭的组分特征由图 1可知,4种生物炭表面均存在明显的孔隙结构,且表面粗糙、凹凸不平,其中,杨木屑生物炭(图 1c)表面的孔隙大且密集,花生壳生物炭(图 1a)和玉米秸秆生物炭(图 1b)次之,而竹屑生物炭(图 1d)表面看不到明显的孔隙结构。由生物炭的FT-IR图(图 2)可见,4种生物炭在3781、3434、2363、1628、1383、1087 cm-1处存在6个主要的吸收峰,主要由-OH、-C≡C-和-C≡N-、=C=C=C=和=C=C=O-C=O、-C-O、-O-引起。不同材料生物炭组分差异显著(表 3)。灰分、挥发分和固定态碳变化范围分别为0.7%~5.8%、0.57%~0.77%和93.40%~98.50%。4种生物炭C、O质量分数在80.70%~86.80%和11.70%~15.40%之间。N、P、S、K等无机养分含量较低或部分未检测出。4种生物炭均呈碱性,pH变化范围为9.92~8.76,其中花生壳生物炭pH最高达9.92,较杨木屑生物炭高出11.69%。
|
图 1 不同原料生物炭电镜扫描图(×2000倍) Figure 1 SEM (×2000 times) of different raw materials |

|
a: ABC; b: PBC; c: BBC; d: MBC 图 2 不同原料生物炭傅里叶红外光谱图(FT-IR) Figure 2 FT-IR spectra o of biochar on different raw materials |
|
|
表 3 不同原料生物炭特性分析 Table 3 Analysis of characteristics of biochar on different raw materials |
结果显示,4种生物炭浸提液中均含多环芳烃类化合物,16种EPA优控PAHs(PAH16)总量变化范围为62.48~95.83 μg·kg-1,无显著差异。4种生物炭浸出PAH16均为萘(Nap)、芴(Fl)、菲(Phe)、荧蒽(Flt)和芘(Pyr),其中,芘(Pyr)含量最高,分别为48.58、46.95、43.96 μg·kg-1和37.28 μg·kg-1,分别占PAH16总量的51.91%、48.99%、50.41%和59.67%(表 4)。
|
|
表 4 不同原料生物炭的PAH16含量(μg·kg-1) Table 4 Concentrations of PAH16 of the biochars (μg·kg-1) |
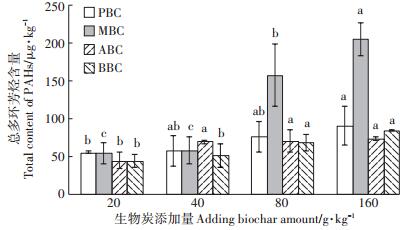
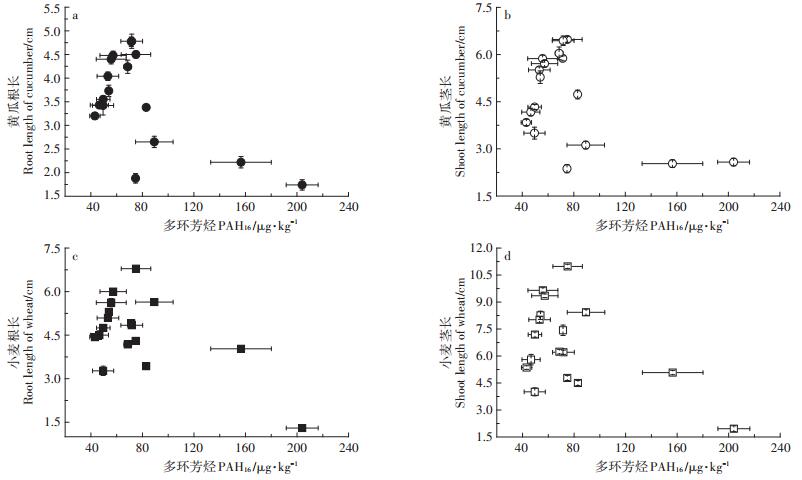
如图 3所示,随生物炭添加量的增加,土壤PAH16含量显著增加,变化范围为42.37~204.04 μg·kg-1。其中PBC与MBC增幅最大,当二者添加量为160.0 g·kg-1时,PAH16含量分别为89.69 μg·kg-1和204.04 μg·kg-1,较CK相比增幅达44.83%和75.75%。土壤中添加生物炭,土壤PAH16含量会随着生物炭添加量的增加而增加(图 3)。土壤中PHA16含量在小于80 μg·kg-1时,对两种作物的根长和茎长没有明显的抑制,当土壤PHA16含量超过80 μg·kg-1后,两种作物根、茎生长受到明显的抑制(图 4)。
|
图 3 添加生物炭处理土壤PAH16含量 Figure 3 Soil PAH16 content after adding biochar |
|
图 4 土壤PAH16含量对小麦、黄瓜根长和茎长的影响 Figure 4 Effect of soil PAH16 content on root length and shoot length of wheat and cucumber |
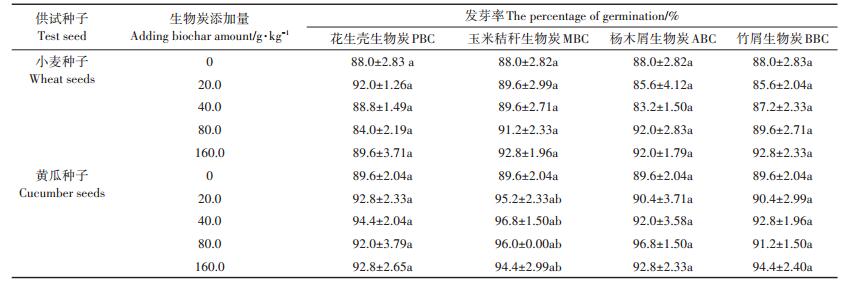
由表 5所示,各处理种子发芽率均在85%以上,且生物炭种类和用量对两种根系类型作物(小麦、黄瓜)种子发芽率均无显著影响。虽然与无生物炭添加的空白对照相比,随生物炭用量的增加,小麦和黄瓜种子发芽率整体上呈升高趋势,但促进作用不显著。
|
|
表 5 不同原料生物炭对种子发芽率的影响 Table 5 Effects of different biochars on the percentage of germination of wheat and cucumber seeds |
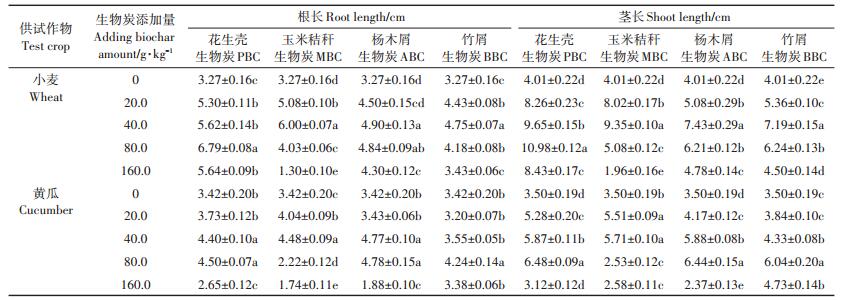
由表 6可知,随生物炭用量的增加,各处理均呈低添加量促进小麦和黄瓜种子根系生长,高添加量抑制根系生长的趋势。其中,与其他3种生物炭相比,PBC对小麦根长的促进效果最好,当PBC添加量为80.0 g·kg-1时,根长达最大值6.79 cm,显著高于CK;MBC、ABC与BBC均在施用量40.0 g·kg-1时对小麦根长的促进效果最好,分别较CK高出83.49%、49.85%和45.26%,之后随着生物炭添加量的增加,对根长的促进作用逐渐减小。而当生物炭添加量为160.0 g·kg-1时,各处理小麦根长显著降低。MBC添加量为160.0 g·kg-1时,小麦根长仅为1.30 cm,显著抑制根系生长。与小麦种子相比,高添加量对黄瓜种子根长的抑制作用更为显著。各处理中,黄瓜种子最大根长分别为4.50、4.48、4.78 cm和4.24 cm,较CK相比增幅为23.98%~39.77%,显著低于小麦种子的45.26%~107.65%。而当4种生物炭施用量为160.0 g·kg-1时,黄瓜根长仅为2.65、1.74、1.88 cm和3.38 cm,抑制率分别为22.51%、49.12%、45.03%和4.17%,也说明黄瓜根系对高剂量生物炭施用更为敏感。
|
|
表 6 不同原料生物炭对小麦和黄瓜根长和茎长的影响 Table 6 Effects of different biochars on the root and shoot length of wheat and cucumber |
不同生物炭对小麦和黄瓜茎长的影响,也随其施用量的增加,表现出先促进、后抑制的趋势(表 6)。其中,PBC对小麦和黄瓜茎长的促进效果最好,当其添加量达到80.0 g·kg-1时,小麦和黄瓜茎长分别为10.98 cm和6.48 cm,较CK相比分别增加173.82%和85.14%。当MBC、ABC和BBC添加量为40.0 g·kg-1时,对小麦茎长的促进达到最大值,分别为9.35、7.43 cm和7.19 cm,后随生物炭添加量的增加,对茎长的促进逐渐减小。在4种不同添加量下,PBC、ABC、BBC对小麦种子的茎长均表现出促进作用。而MBC在160.0 g·kg-1剂量下,与CK相比,茎长表现出显著的抑制作用。
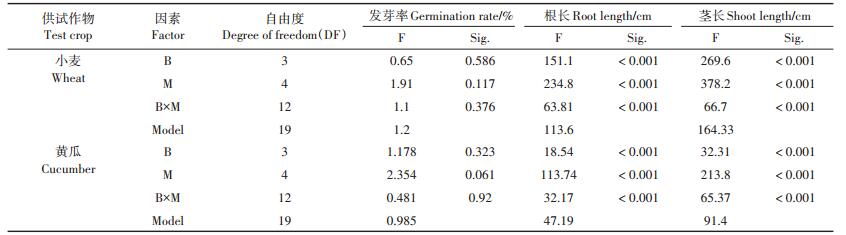
2.6 生物炭用量与种子发芽率、根长和茎长的相关性分析由表 7可知,由于小麦和黄瓜根长和茎长在一定程度上与各生物炭添加量呈显著正相关关系,二者根长和茎长随各生物炭添加量的增加而增加,生物炭种类和添加量均极显著影响小麦和黄瓜的根长和茎长,且交互作用显著;而生物炭种类和添加量对小麦和黄瓜种子发芽率的影响不显著,交互作用影响亦不显著。
|
|
表 7 生物炭种类(B)与添加量(M)对小麦和黄瓜种子发芽率、根长和茎长影响的双因素方差分析 Table 7 Two-factor variance analysis of effects by biochar of different materials and inputs on germination, root length, shoot length of wheat and cucumber |
供试花生壳、玉米秸秆、杨木屑以及竹屑生物炭均为快速热解条件下制备,由生物炭的基本理化性质可得知,4种生物炭均呈碱性,主要与生物炭本身矿质灰分,以及生物炭表面官能团有关[29]。本研究结果也显示,4种生物炭表面孔隙结构明显(图 1),表面附有-O-、-OH、-C=O等含氧官能团(图 2)。生物炭无机养分组成也显示,4种生物炭固定碳含量在90%以上,N、K、P、S等含量极低或部分缺失,该结果与Yu等[30]和Macdonald等[31]相似,其认为,与粪便废弃物制备的生物炭相比,秸秆类生物炭含碳量明显较高,且N、P、S等非金属元素会在生物炭热解制备过程中挥发损失。
此外,4种生物炭本身除含有对植物生长有利的Mg、K等营养元素外,也含有多种PAHs有机化合物,且不同材料生物炭PAHs含量存在显著差异(表 4)。多环芳烃(PAHs)是一类具有致癌、致突变的持久性有机污染物,有研究指出,该有机污染物在热解制备生物炭的过程中产生,会对环境健康和作物生长发育构成威胁[32]。生物炭对土壤PAHs总量及有效性的影响主要集中在污染土壤化学污染物去除方面[33],但也有研究显示,施用生物炭,可能引入多环芳烃或重金属等有害物质到土壤环境中,产生毒害,从而对作物生长发育产生负面影响,造成作物减产[34]。生物炭浸提液中PAHs含量的高低与制备温度有关,735~850 ℃制备的生物炭提取液PAHs浓度最高,而500 ℃以下温度制备生物炭PAHs浓度较低[35],且农用秸秆制备生物炭中多环芳烃等有机污染物浓度要显著低于畜禽粪便等有机废弃物制备生物炭[36-37]。本研究中,16种优控PAHs总量变化范围为43.16~204.04 μg·kg-1,显著低于欧盟和美国对用于土地处理的生物性固体废弃物所规定的安全限值(3 mg·kg-1[38];6 mg · kg-1[39]),且测出PAHs为萘(Nap)、芴(Fl)、菲(Phe)、荧蒽(Flt)和芘(Pyr),均为毒性较低的非致癌性PAH16。但本研究显示,当土壤PHA16含量超过80 μg·kg-1后,两种作物根、茎生长仍受到明显抑制(图 4),该阈值与苏君梅等[40]对小麦的研究结果相似,但低于丁克强等[41]和曹启民等[42]的研究结果,与前期研究均为添加单体PAHs化合物有关,也和土壤类型与供试植物种类有关。
3.2 不同材料生物炭对种子萌发和根茎早期生长的影响不同剂量下种子发芽抑制试验是被广泛采用的高等植物毒理试验方法,通过对小麦和黄瓜两种根系类型植物在污染条件下的发芽和早期根、茎生长状况进行分析是评价环境毒性的优选方法。本研究中,生物炭对小麦和黄瓜种子发芽率的影响不显著,对根、茎生长的影响总体呈生物炭低添加量促进、高添加量抑制趋势(表 6、表 7)。一方面,种子胚内养分供应会影响种子萌发过程对污染物的敏感性,种子发芽率对有害物质反应最迟缓,而与污染物直接接触的根部伸长与发育对污染物的响应最为敏感[41]。另一方面,前期报道指出,生物炭具疏松多孔的特性,添加到土壤后会提高土壤孔隙度,降低土壤容重,从而使土壤的抗张强度降低,改变土壤团聚体特性,提高土壤持水、透气性,从而促进作物的生长[43-44]。同时,生物炭的输入还可通过为土壤微生物提供碳源和栖息场所,影响微生物群落分布,激发微生物生长,提高土壤微生物的种类和数量[45]。因此,生物炭对土壤养分含量、土壤酸碱度及质地等影响,也会对污染物产生干扰,进而影响其诊断指标的敏感性。只有当土壤中污染物的剂量达到一定水平时才表现其抑制作用。因此,本研究结果显示,当4种生物炭超过80 g·kg-1添加量时,两种作物的根茎长度均显著降低(表 4、表 5),该结果与Buss等[19]研究相似。李阳等[20]研究结果显示,随生物炭剂量增加,西红柿种子发芽率、根长、芽长呈现先增后降的变化趋势,主要是因为供试生物炭除含有植物生长所需的营养物质外,也存在重金属[46]、PAHs[47]、挥发物[48]等潜在污染物,影响作物早期生长。黄超等[49]研究指出,在肥力水平较高的土壤中,高量施用生物质炭(200 g·kg-1)可导致土壤微生物生物量下降,从而对作物的生长产生抑制作用。Zwieten等[50]研究提出,由于生物炭本身灰分物质中含有Na、Ca和Mg等碱金属元素,及表面负载有吡喃酮等碱性官能团,对温带碱性农业土壤施用过量生物炭,可能会导致土壤pH值过高。此外,高量施用生物炭也可带入过多有机碳组分,从而引起土壤微生物及植物生长竞争氮素等问题,降低土壤氮素养分可利用性,影响作物养分吸收,抑制作物生长[51-52]。
本研究中,不同作物对生物炭响应不同,生物炭对小麦种子根长和茎长的促进效果优于黄瓜种子,该结果与Marks等[53]的研究结果相近,其指出不同作物对生物炭产生的挥发物耐受性不同,对磷、钙等养分需求和利用效率也存在差异。李瑞霞等[54]对冬小麦根系结构的研究认为,适量施用生物炭可显著增加初生根直径和长度,但抑制侧根生长,说明适量施用生物炭处理可减少小麦根部冗余,优化根区结构,增强其主根吸收水分养分的能力。周劲松等[55]对须根系作物水稻的解剖结构进一步分析发现,添加生物炭改变根表皮细胞体积和皮层厚度,高施炭量处理的水稻根表皮细胞几乎完全脱落、皮层发育受到抑制。因此,生物炭在农业生产上的应用,需根据不同土壤、作物种类以及不同生物炭材料,确定安全用量,为生物炭田间安全施用提供理论依据,降低其还田生态风险。
4 结论(1)4种生物炭均呈碱性,官能团组成主要有-OH、=C=C=O、-C=O、-C-O和-O-等含氧官能团,C含量最高在80.74%~86.82%之间,O含量次之在11.69%~15.43%之间。
(2)生物炭浸提物中16种优控PAHs总量均值变化范围为62.48~95.83 μg·kg-1。随生物炭添加量的增加,土壤PAH16含量显著增加,变化范围为42.37~204.04 μg·kg-1,增幅上MBC>PBC>BBC>ABC。
(3)在培养条件下,生物炭添加量对小麦和黄瓜种子发芽率的影响不显著,但显著影响其根、茎生长。总体表现为生物炭低添加量促进、高添加量抑制的趋势,当土壤生物炭施用量超过80 g·kg-1后,供试小麦和黄瓜发芽后的根、茎生长受到显著抑制。
| [1] |
Mahtab A, Anushka U R, Jung E L, et al. Biochar as a sorbent for contaminant management in soil and water:A review[J]. Chemosphere, 2014, 99: 19-33. DOI:10.1016/j.chemosphere.2013.10.071 |
| [2] |
Nguyen T T N, Xu C Y, Tahmasbian I, et al. Effects of biochar on soil available inorganic nitrogen: A review and meta-analysis[J]. Geoderma, 2017, 288: 79-96. DOI:10.1016/j.geoderma.2016.11.004 |
| [3] |
Sparrevik M, Lindhjem H, Andria V, et al. Environmental and socioeconomic impacts of utilizing waste for biochar in rural areas in Indonesiae: A syshoots perspective[J]. Environmental Science & Technology, 2014, 48: 4664-4671. |
| [4] |
Jeffery S, Martijn B T, Cornelissen G, et al. The way forward in biochar research:Targeting trade-offs between the potential wins[J]. Global Change Biology Bioenergy, 2015, 7: 1-13. DOI:10.1111/gcbb.2014.7.issue-1 |
| [5] |
Zhang A F, Zhou X, Li M, et al. Impacts of biochar addition on soil dissolved organic matter characteristics in a wheat-maize rotation syshoot in Loess Plateau of China[J]. Chemosphere, 2017, 186: 986-993. DOI:10.1016/j.chemosphere.2017.08.074 |
| [6] |
崔红标, 范玉超, 周静, 等. 改良剂对土壤铜镉有效性和微生物群落结构的影响[J]. 中国环境科学, 2016, 36(1): 197-205. CUI Hong-biao, FAN Yu-chao, ZHOU Jing, et al. Availability of soil Cu and Cd and microbial community structure as affected by applications of amendments[J]. China Environmental Science, 2016, 36(1): 197-205. DOI:10.3969/j.issn.1000-6923.2016.01.033 |
| [7] |
Suzette P G, Jonathan K Y, David G. The economic value of biochar in crop production and carbon sequestration[J]. Energy Policy, 2011, 39: 6344-6350. DOI:10.1016/j.enpol.2011.07.035 |
| [8] |
Uzoma K C, Inonu M, Andry H, et al. Effect of cow manure biochar on maixe productivity under sandy soil condition[J]. Soil Use and Management, 2011, 27(2): 205-212. DOI:10.1111/j.1475-2743.2011.00340.x |
| [9] |
Taghizaden-Toosi A, Clough T J, Sherlock R R, et al. A wood based low-temperature biochar capture NH3-N generated from ruminant urine-N, retaining its bioavailability[J]. Plant and Soil, 2012, 353(1/2): 73-84. |
| [10] |
Shanmugam S, Abbott L K. Potential for recycling nutrients from biosolids amended with clay and lime in coarse-textured water repellence, acidic soils of Western Australia[J]. Applied and Environmental Soil Science, 2015. DOI:10.1155/2015/541818 |
| [11] |
Ni N, Shi R, Liu Z, et al. Effects of biochars on the bioaccessibility of phenanthrene/pyrene/zinc/lead and microbial community structure in a soil under aerobic and anaerobic conditions[J]. Journal of Environmental Sciences, 2018, 63(1): 296-306. |
| [12] |
罗飞, 宋静, 陈梦舫. 油菜饼粕生物炭制备过程中多环芳烃的生成、分配及毒性特征[J]. 农业环境科学学报, 2016, 35(11): 2210-2215. LUO Fei, SONG Jing, CHEN Meng-fang. Generation, distribution and toxicity characteristics of polycyclic aromatic hydrocarbons during the preparation of biochar from rapeseed cake[J]. Journal of AgroEnvironment Science, 2016, 35(11): 2210-2215. DOI:10.11654/jaes.2016-0529 |
| [13] |
李昌见, 屈忠义, 勾芒芒, 等. 生物炭对土壤水肥利用效率与番茄生长影响研究[J]. 农业环境科学学报, 2014, 33(11): 2187-2193. LI Chang-jian, QU Zhong-yi, GOU Mang-mang, et al. Effects of biochar amendment on soil water and nutrient utilization efficiencies and tomato growth[J]. Journal of Agro-Environment Science, 2014, 33(11): 2187-2193. DOI:10.11654/jaes.2014.11.017 |
| [14] |
Amanda M L, Sharon L W, Julia W G, et al. Impact of two different biochars on earthworm growth and survival[J]. Annals of Environmental Science, 2010, 4: 1-9. |
| [15] |
Deenik J K, Mcclellan T, Uehara G, et al. Charcoal volatile matter content influences plant growth and soil nitrogen transformations[J]. Soil Science Society of America Journal, 2010, 74(4): 1259-1270. DOI:10.2136/sssaj2009.0115 |
| [16] |
Marcin K, Patryk O. Biochar production increases the polycyclic aromatic hydrocarbon content in surrounding soils and potential cancer risk[J]. Environmental Science and Pollution Research, 2014, 21(5): 3646-3652. DOI:10.1007/s11356-013-2334-1 |
| [17] |
王欣, 尹带霞, 张凤, 等. 生物炭对土壤肥力与环境质量的影响机制与风险解析[J]. 农业工程学报, 2015, 31(4): 248-257. WANG Xin, YIN Dai-xia, ZHANG Feng, et al. Analysis of effect mechanism and risk of biochar on soil fertility and environmental quality[J]. Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(4): 248-257. DOI:10.3969/j.issn.1002-6819.2015.04.035 |
| [18] |
Rogovska N, Laird D A, Rathke S J, et al. Biochar impact on midwestern mollisols and maize nutrient availability[J]. Geoderma, 2014, 230-231(7): 340-347. |
| [19] |
Buss W, Mašek O. Mobile organic compounds in biochar a potential source of contamination-phytotoxic effects on cress seed(Lepidium sativum)germination[J]. Journal of Environmental Management, 2014, 137(4): 111. |
| [20] |
李阳, 黄梅, 沈飞, 等. 生物炭早期植物毒性评估培养方法研究[J]. 生态毒理学报, 2016, 11(4): 168-175. LI Yang, HUANG Mei, SHEN Fei, et al. Investigations on cultivation methods for assessing the early phytotoxicity of biochar[J]. Asian Journal of Ecotoxicology, 2016, 11(4): 168-175. |
| [21] |
Qadeer S, Anjum M, Khalid A, et al. A dialogue on perspectives of biochar applications and its environmental risks[J]. Water Air and Soil Pollution, 2017, 228(8): 281. DOI:10.1007/s11270-017-3428-z |
| [22] |
Abujabhah I S, Bound S A, Doyle R, et al. Effects of biochar and compost amendments on soil physico-chemical properties and the total community within a temperate agricultural soil[J]. Applied Soil Ecology, 2016, 98: 243-253. DOI:10.1016/j.apsoil.2015.10.021 |
| [23] |
宋婷婷, 赖欣, 王知文, 等. 不同原料生物炭对铵态氮的吸附性能研究[J]. 农业环境科学学报, 2018, 37(3): 576-584. SONG Ting-ting, LAI Xin, WANG Zhi-wen, et al. Adsorption of ammonium nitrogen by biochars produced from different biomasses[J]. Journal of Agro-Environment Science, 2018, 37(3): 576-584. |
| [24] |
宋婷婷, 李洁, 张贵龙, 等. 不同原料生物炭对水体硝态氮的吸附性能研究[J]. 生态环境学报, 2018, 27(2): 330-340. SONG Ting-ting, LI Jie, ZHANG Gui-long, et al. Adsorption of nitrate nitrogen by different raw materials of bio char[J]. Ecology and Environmental Sciences, 2018, 27(2): 330-340. |
| [25] |
李玉龙.土壤中多环芳烃的迁移转化规律及其对植物生长的影响[D].西安: 西安建筑科技大学, 2015. LI Yu-long. Migration regularity of PAHs in soil and its effect on plant growth[D]. Xi′an: Xi′an University of Architecture and Technology, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10703-1015995084.htm |
| [26] |
Berset J D, Holzer R, Häni H. Solving coelution problems on a smectic-liquid crystalline polysiloxane capillary column for the determination of priority polycyclic aromatic hydrocarbons in environmental samples[J]. Journal of Chromatography A, 1998, 823(1/2): 179-187. |
| [27] |
鲍士旦. 土壤农化分析[M]. 三版. 北京: 中国农业出版社, 2000. BAO Shi-dan. Soil agrochemical analysis[M]. Third edition. Beijing: China Agricultural Publisher, 2000. |
| [28] |
Liao S. Detecting free radicals in biochars and determining their ability to inhibit the germination and growth of corn, wheat and rice seedlings[J]. Environmental Science and Technology, 2014, 48(15): 8581-8587. DOI:10.1021/es404250a |
| [29] |
Yuan J H, Xu R K. The amelioration effects of low temperature biochar generated from nine crop residues on an acidic ultisol[J]. Soil Use and Management, 2011, 27(1): 110-115. DOI:10.1111/sum.2011.27.issue-1 |
| [30] |
Yu X Y, Ying G G, Kookana R S. Reduced plant uptake of pesticides with biochar additions to soil[J]. Chemosphere, 2009, 76(5): 665-671. DOI:10.1016/j.chemosphere.2009.04.001 |
| [31] |
Macdonald L M, Farrell M, Zwieten L V, et al. Plant growth responses to biochar addition: An Australian soils perspective[J]. Biology and Fertility of Soils, 2014, 50(7): 1035-1045. DOI:10.1007/s00374-014-0921-z |
| [32] |
Hilber I, Blum F, Leifeld J, et al. Quantitative determination of PAHs in biochar: A prerequisite to ensure its quality and safe application[J]. Journal of Agricultural and Food Chemistry, 2012, 60(12): 3042. DOI:10.1021/jf205278v |
| [33] |
张原原, 王聪颖, 李增波, 等. 生物质炭对土壤中PAHs总量及有效性的影响研究[J]. 农业环境科学学报, 2017, 36(2): 286-292. ZHANG Yuan-yuan, WANG Cong-ying, LI Zeng-bo, et al. Effects of biochar on the total and bioavailable polycyclic aromatic hydrocarbons (PAHs)in soil[J]. Journal of Agro-Environment Science, 2017, 36(2): 286-292. |
| [34] |
Kloss S, Zehetner F, Wimmer B, et al. Biochar application to temperate soils: Effects on soil fertility and crop growth under greenhouse conditions[J]. Journal of Plant Nutrition and Soil Science, 2014, 177(1): 3-15. DOI:10.1002/jpln.v177.1 |
| [35] |
Wolska L, Mechlińska A, Rogowska J, et al. Sources and fate of PAHs and PCBs in the marine environment[J]. Critical Reviews in Environmental Science and Technology, 2012, 42(11): 1172-1189. DOI:10.1080/10643389.2011.556546 |
| [36] |
Zhao X, Wang J W, Wang S Q, et al. Successive straw biochar application as a strategy to sequester carbon and improve fertility: A pot experiment with two rice /wheat rotations in paddy soil[J]. Plant and Soil, 2014, 378: 279-294. DOI:10.1007/s11104-014-2025-9 |
| [37] |
刘园, Jamal Khan M, 靳海洋, 等. 秸秆生物炭对潮土作物产量和土壤性状的影响[J]. 土壤学报, 2015(4): 849-858. LIU Yuan, KHAN M J, JIN Hai-yang, et al. Effects of successive application of crop-straw biochar on crop yield and soil properties in cambosols[J]. Acta Pedologica Sinica, 2015(4): 849-858. |
| [38] |
Communities S O O. Sustainable development in the European Union: Monitoring report of the EU sustainable development strategy[M]. Publications Office of the European Union, 2011.
|
| [39] |
Khair M, Lemaire J, Fischer S. Achieving heavy-duty diesel NOx/PM levels below the EPA 2002 standards an integrated solution[C]. SAE 2000 World Congress, 2000.
|
| [40] |
苏君梅, 王丹丹, 张琦. 土壤中蒽、菲、芘对小麦种子的生态毒性效应[J]. 山西化工, 2008, 28(1): 13-15. SU Jun-mei, WANG Dan-dan, ZHANG Qi. Eco-toxicological effects of anthracene, phenanthrene, pyrene in soils on the inhibition of seed germination and elongation of wheat[J]. Shanxi Chemical Industry, 2008, 28(1): 13-15. DOI:10.3969/j.issn.1004-7050.2008.01.004 |
| [41] |
丁克强, 骆永明, 刘世亮. 多环芳烃对土壤中小麦发育的生态毒性效应[J]. 南京工程学院学报(自然科学版), 2008, 6(2): 52-56. DING Ke-qiang, LUO Yong-ming, LIU Shi-liang. Ecotoxicity effect of polycyclic aromatic hydrocarbons on wheat growth[J]. Journal of Nanjing Institute of Technology(Natural Science Edition), 2008, 6(2): 52-56. DOI:10.3969/j.issn.1672-2558.2008.02.011 |
| [42] |
曹启民, 王华, 张永北, 等. 热带砖红壤生长的小白菜吸收和累积PAHs的特征[J]. 生态环境学报, 2014, 23(9): 1478-1481. CAO Qi-min, WANG Hua, ZHANG Yong-bei, et al. Characters of uptake and accumulation of polycyclic aromatic hydrocarbons(PAHs) in pakchoi cabbage in tropical latosol[J]. Ecology and Environmental Sciences, 2014, 23(9): 1478-1481. DOI:10.3969/j.issn.1674-5906.2014.09.011 |
| [43] |
Lehmann J, Rillig M C, Thies J, et al. Biochar effects on soil biota: A review[J]. Soil Biology and Biochemistry, 2011, 43(9): 1812-1836. DOI:10.1016/j.soilbio.2011.04.022 |
| [44] |
Solaiman Z M, Murphy D V, Abbott L K. Biochars influence seed germination and early growth of seedlings[J]. Plant and Soil, 2012, 353(1/2): 273-287. |
| [45] |
Paz-Ferreiro J, Fu S. Biological indices for soil quality evaluation: Perspectives and limitations[J]. Land Degradation and Development, 2016, 27(1): 14-25. DOI:10.1002/ldr.v27.1 |
| [46] |
Cao X D, Ma L N, Gao B, et al. Dairy-manure derived biochar effectively sorbs lead and atrazine[J]. Environmental Science Technology, 2009, 43: 3285-3291. DOI:10.1021/es803092k |
| [47] |
Thies J E, Rillig M C. Characteristics of biochars: Biological properties[J]. Earthscan, 2009, 9: 85-105. |
| [48] |
Deenik J L, Mcclellan T, Uehara G, et al. Charcoal volatile matter content influences plant growth and soil nitrogen transformations[J]. Soil Science Society of America Journal, 2010, 74(4): 1259-1270. DOI:10.2136/sssaj2009.0115 |
| [49] |
黄超, 刘丽君, 章明奎. 生物质炭对红壤性质和黑麦草生长的影响[J]. 浙江大学学报(农业与生命科学版), 2011(4): 439-445. HUANG Chao, LIU Li-ju, ZHANG Ming-kui. Effects of biochar on properties of red soil and ryegrass growth[J]. Journal of Zhejiang University, 2011(4): 439-445. |
| [50] |
Zwieten V L, Kimber S, Morris S, et al. Effects of biochar from slow pyrolysis of papermill waste on agronomic performance and soil fertility[J]. Plant and Soil, 2010, 327: 235-246. DOI:10.1007/s11104-009-0050-x |
| [51] |
Butnan S, Deenik J L, Toomsan B, et al. Biochar characteristics and application rates affecting corn growth and properties of soils contrasting in texture and mineralogy[J]. Geoderma, 2015, 237-238: 105-116. DOI:10.1016/j.geoderma.2014.08.010 |
| [52] |
Solaiman Z M, Murphy D V, Abbott L K. Biochars influence seed germination and early growth of seedlings[J]. Plant and Soil, 2012, 353(1/2): 273-287. |
| [53] |
Marks EAN, Alcañiz JM, Domene X. Unintended effects of biochars on short-term plant growth in a calcareous soil[J]. Plant and Soil, 2014, 385(1/2): 87-105. |
| [54] |
李瑞霞, 李洪杰, 霍艳丽, 等. 生物炭对华北冬小麦根系形态和内生真菌多样性的影响[J]. 农业机械学报, 2018, 49(3): 235-242. LI Rui-xia, LI Hong-jie, HUO Yan-li, et al. Effect of biochar on root morphology and endophytic fungal diversity of winter wheat in north China[J]. Transactions of the Chinese Society for Agricultural Machinery, 2018, 49(3): 235-242. |
| [55] |
周劲松, 闫平, 张伟明, 等. 生物炭对东北冷凉区水稻秧苗根系形态建成与解剖结构的影响[J]. 作物学报, 2017, 43(1): 72-81. ZHOU Jin-song, YAN Ping, ZHANG Wei-ming, et al. Effect of biochar on root morphogenesis and anatomical structure of rice cultivated in cold region of northeast China[J]. Acta Agronomica Sinica, 2017, 43(1): 72-81. |
 2019, Vol. 38
2019, Vol. 38