2. 广东省环境修复产业技术创新联盟, 广州 510006
2. Technical Innovation Alliance of Guangdong Environmental Restoration Industry, Guangzhou 510006, China
镉、铅是毒性大的重金属,土壤中重金属总量超标现象对生态系统和人类来说是一种潜在的风险[1]。根据国家原环境保护部和原国土资源部2014年4月公布的《全国土壤污染状况调查公报》,全国镉污染物点位超标率为7%,位居重金属污染物榜首,铅超标的问题也不容忽视。因此,土壤镉、铅超标的环境问题亟待解决。
研究表明,黏土矿物具有很强的吸附重金属的能力[2]。Glatstein等[3]通过吸附实验,发现50 mg·L-1投加量的膨润土具有较强的吸附镉、铅、铜的能力。Sun等[4]通过盆栽实验,发现投加膨润土后植物根系对镉和铅的吸收分别降低了31.3%和26.7%,茎部对镉和铅的吸收分别降低了44.3%和7.8%。Merrikhpour等[5]在修复材料的筛选中,使用天然沸石吸附铜、镍、铅、镉四种重金属,发现重金属之间存在竞争吸附,天然沸石对四种重金属都有吸附效果。Edwards等[6]按0.5%、1.0%和5.0%投加合成沸石进行土壤修复,发现投加合成沸石能有效降低土壤重金属的迁移性。另外,海泡石[7]、硅藻土[8]、羟基磷灰石[9]等修复材料也具有修复重金属土壤的前景。
生物炭是由农业有机废弃物在高温缺氧的环境下制得,是一种低成本、孔隙率高、比表面积大、物理化学性质稳定的吸附材料[10],具有很强的吸附重金属和有机污染物的能力,有利于修复重金属污染土壤和减少植物对土壤中重金属的积累[11]。
农田原位修复既要考虑重金属的固定效果,修复后要保证农产品的质量安全,又要考虑钝化材料是否会破坏农田土壤的理化性质,保证钝化材料不会影响农田土壤的肥力以及生产能力。目前,普遍研究单一修复材料对农田重金属的钝化效果,不同修复材料之间的修复效果缺乏比较,同时修复材料的投加量都比较高,不利于节约成本和保持土壤原来的理化性质。因此,本文以黏土矿物和生物炭作为修复材料,以降低投加量的处理方式来比较分析不同修复材料单独施加和复合施加对农田土壤镉、铅的钝化效果,探究修复材料处理后土壤中镉、铅的形态以及土壤理化性质的变化,为我国铅镉污染农田土壤的修复提供科学依据与方法参考。
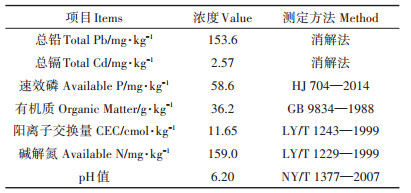
1 材料与方法 1.1 供试土壤与供试材料供试土壤取自佛山顺德某农田,破碎过筛后往该镉污染土壤中添加硝酸铅溶液,搅拌均匀,静置至自然风干。放置一个月后作为模拟污染土壤进行实验,为保证镉、铅在模拟污染土壤中均匀分布,我们选取其中4个土壤样品进行分析,结果表明,误差小于5%。土壤的基本理化性质如表 1所示。
|
|
表 1 土壤理化性质 Table 1 Basic physical and chemical properties of the test soil |
供试的修复材料有黏土矿物和生物炭,其中黏土矿物为硅藻土(CP,广州亿峰化工科技有限公司)、膨润土(CP,广州亿峰化工科技有限公司)、海泡石粉(CP,行唐县鑫磊矿物粉体厂)、人造沸石粉(AR,国药集团化学试剂有限公司)、羟基磷灰石(CP,广州亿峰化工科技有限公司)。供试的生物炭原料为中药渣,在惰性的氮气氛围中以550±50 ℃的热解条件下制备成中药渣生物炭,选取4个样品进行测定。经测定,生物炭含碳量为766 g·kg-1、pH值为10.05、灰分含量为27.4%、比表面积为233.3 m2·kg-1。
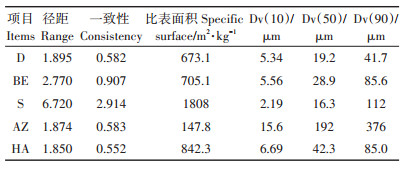
1.2 修复材料的表征修复材料由硅藻土(Diatomite,D)、膨润土(Bentonite,BE)、海泡石(Sepiolite,S)、人造沸石(Artificial zeolite,AZ)、羟基磷灰石(Hydroxyapatite,HA)、硅藻土+生物炭(Diatomite/Biochar,DB)、膨润土+生物炭(Bentonite/Biochar,BEB)、海泡石+生物炭(Sepiolite/Biochar,SB)、人造沸石+生物炭(Artificial zeolite/Biochar,AZB)、羟基磷灰石+生物炭(Hydroxyapatite/Biochar,HAB)、生物炭(Biochar,B)组成。用激光粒度仪检测修复材料的粒径分布,设备型号为Mastersizer 3000。
1.3 铅镉污染土壤修复实验为比较D、BE、S、AZ、HA、DB、BEB、SB、AZB、HAB、B对土壤中镉、铅的钝化效果,将修复材料D、BE、S、AZ、HA、DB(黏土矿物:生物炭质量比为1:1,下同)、BEB、SB、AZB、HAB、B分别按0.1%(m/m)、0.2%(m/m)和0.3%(m/m)的投加量投加修复材料,每个样品含污染土壤60 g,每种处理做2个平行样品,分别加入100 mL离心管中,将100 mL离心管放入翻转式振荡机,翻转速度为30±2 r·min-1,常温,21 d后取出,参考二乙烯三胺五乙酸(Diethylenetriaminepentaacetic acid,DTPA)浸提——八种有效元素的测定,将配制好的浸提剂按土液比1:2的比例加入,在180±20 r·min-1摇床中反应2 h后提取浸提液,检测重金属的生物有效性、通过连续提取法(Sequential Extraction Prodcedures,SEP)分步提取铅镉的可交换态、碳酸盐结合态、铁锰氧化物结合态、有机结合态、残渣态[12],检测铅镉的形态变化,分析修复后土壤的理化性质。
1.4 铅镉形态分析经21 d修复后的土壤,用SEP连续提取法进行提取,提取后各形态的重金属溶液经0.45 μm微孔滤膜过滤,滤液用火焰原子吸收光谱法检测,设备型号为TAS-986。每种处理做3个平行样品。
1.5 土壤理化性质参照《土壤pH值的测定》(NY /T 1377—2007)、《土壤有效磷的测定碳酸氢钠浸提-钼锑抗分光光度法》(HJ 704—2014)、《土壤有机质的测定》(GB 9834—1988)、《森林土壤阳离子交换量的测定》(LY / T 1243—1999)和《森林土壤水解性氮的测定》(LY / T1299—1999)等国家标准对经21 d修复后的土壤进行理化性质的测定,每种处理做3个平行样品。
1.6 数据处理DTPA法中铅(镉)修复率的计算公式为:

|
式中:Q为修复率,%;C0为空白实验中浸提液的铅镉)浓度,mg·L-1;C1为修复材料处理后浸提液的铅(镉)浓度,mg·L-1。
2 结果与讨论 2.1 修复材料的表征表 2为5种黏土矿物激光粒度仪检测结果。由表 2可知,各修复材料的粒径都在微米级,硅藻土的中值粒径为19.2 μm,比表面积为673.1 m2·kg-1,膨润土的中值粒径为28.9 μm,比表面积为705.1 m2·kg-1,羟基磷灰石的中值粒径为42.3 μm,比表面积为842.3 m2 ·kg-1,海泡石的中值粒径为16.3 μm,比表面积为1808 m2·kg-1,人造沸石的中值粒径为192 μm,比表面积为147.8 m2·kg-1。本次实验中,选用的人造沸石的粒径比其他黏土矿物的粒径大一个数量级,其余五种矿物材料的粒径相似,在同一个数量级。
|
|
表 2 黏土矿物粒度分布参数 Table 2 Particle size distribution of clay mineral |
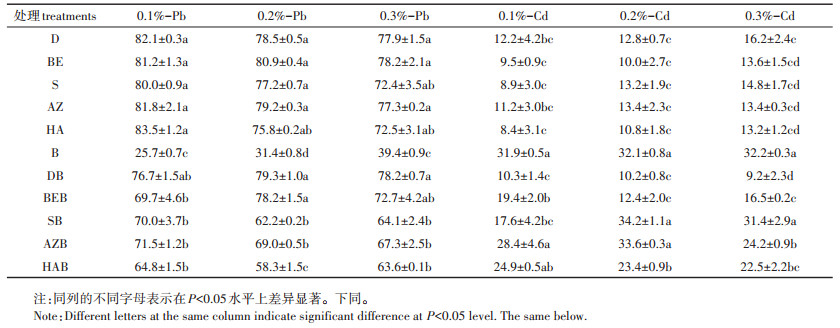
二乙烯三胺五乙酸(DTPA)浸提剂可以模拟植物根系吸收土壤中重金属的过程,具备生物有效性的重金属能被DTPA提取出来[13-14]。未经修复材料处理的空白土壤经DTPA提取的铅浓度为56.6 mg·L-1,各修复材料的铅修复效果如表 3所示。由表 3可知,各修复材料铅修复率大小顺序为:HA>D>AZ>BE>S>DB>BEB>AZB>SB>HAB>B,投加单一黏土矿物的修复率明显高于黏土矿物与生物炭复合投加的修复率(P < 0.05)。黏土矿物单一处理的实验中,HA对铅的修复效果最好,修复率介于72.5%~83.4%,其余单一黏土矿物对铅的修复率介于12.4%~82.1%,与HA对铅的修复率没有显著差异(P < 0.05)。黏土矿物与生物炭复合处理的实验中,DB对铅的修复效果最好,修复率介于76.7%~79.3%,其余复配组合对铅的修复率介于58.3%~79.3%,在0.1%(m / m)的投加量下,其余复配组合对铅的修复率与DB没有显著差异,在0.2%(m/m)和0.3%(m/m)的投加量下,DB和BEB对铅的修复率与SB、AZB和HAB存在显著差异(P < 0.05),投加单一生物炭对铅的修复效果最差。
|
|
表 3 铅和镉的修复率(%) Table 3 Pb and Cd repair rate in tested soils (%) |
未经修复材料处理的空白土壤经DTPA提取的镉浓度为0.182 mg·L-1,各修复材料的镉修复效果如表 3所示。由表 3可知,各修复材料镉修复率大小顺序为:SB>AZB>B>HAB>BEB>D>S>BE>AZ>HA>DB,黏土矿物与生物炭复合处理的修复率明显高于投加单一黏土矿物的修复率(P < 0.05)。黏土矿物与生物炭复合处理的实验中,SB对镉的修复效果最好,平均修复率最高,修复率介于26.2%~34.2%,其余的复配组合对铅的修复率介于9.2%~33.6%,在0.1%(m/m)的投加量下,AZB和HAB对镉的修复效果最好,BEB和SB次之,但SB与AZB、HAB对镉的修复率没有显著差异,在0.2%(m/m)和0.3%(m/m)的投加量下,SB对镉的修复效果最好,与DB、BEB、HAB对镉的修复率存在显著差异(P < 0.05);黏土矿物单一处理的实验中,D对镉的修复效果最好,修复率介于12.2%~16.2%,其余黏土矿物对铅的修复率为8.4%~ 14.8%不等,不同黏土矿物在不同投加量下对镉的修复效果均没有显著性差异;单独投加生物炭对镉的修复率介于31.9%~32.2%。
铅的修复主要以沉淀的形式为主,镉的修复主要以离子交换的形式为主[9],两种重金属的钝化机制存在差异,因此修复材料对铅、镉的修复效果也存在差异。上述实验结果表明,黏土矿物对铅有良好的修复效果,生物炭对镉有良好的修复效果。修复材料投加量对铅的修复影响较小,对镉的修复影响较大。HA对铅修复率高的原因可能是羟基磷灰石能抑制土壤中铅离子的解吸[15],从而降低铅的浸出,而B对铅修复率低的原因可能是铅依靠生物炭中的磷元素钝化[16],但土壤速效磷背景值较高,具备一定的钝化能力,从而弱化了生物炭的钝化能力;SB对镉修复率高的原因可能是海泡石和生物炭能显著提高农田土壤的pH值,使农田土壤的Zeta电位变为负值,从而能固定镉离子[17-18],而DB对镉修复率低的原因可能是该组合降低了农田土壤中的速效磷含量,从而影响农田土壤自身的钝化能力。
2.3 SEP连续提取法通过SEP连续提取法可以合理地估算土壤中真实的重金属形态分布[19]。在SEP连续提取法中,土壤中的重金属可以根据其在土壤中的稳定性划分为五种形态,分别为可交换态(EX)、碳酸盐结合态(CB)、铁锰氧化物结合态(OX)、有机结合态(OM)和残渣态(RS),各种形态的稳定性顺序为EX<CB<OX<OM<RS。图 1a、图 1c和图 1e给出了铅在土壤中的形态分布,土壤修复前后均未检出EX-Pb,可能是因为近中性土壤的铅溶解性极低[20],加上土壤中EX-Pb含量本身较低[21]。在空白土壤(CK)中(CB:29.3%,OX:28.0%,OM:21.2%,RS:21.4%),铅比较均匀地分布在CB、OX、OM和RS四种形态中。经修复材料处理后,大量的CB朝RS转化,少量OX和OM也朝RS转化,HA处理后的这种变化趋势更为明显。CB占比由29.3%降至5.8%~8.8%,相应的RS占比由21.4%升至67.0%~72.0%,均高于其他修复材料处理后的RS值,由此说明HA适合用于铅污染农田土壤的修复。
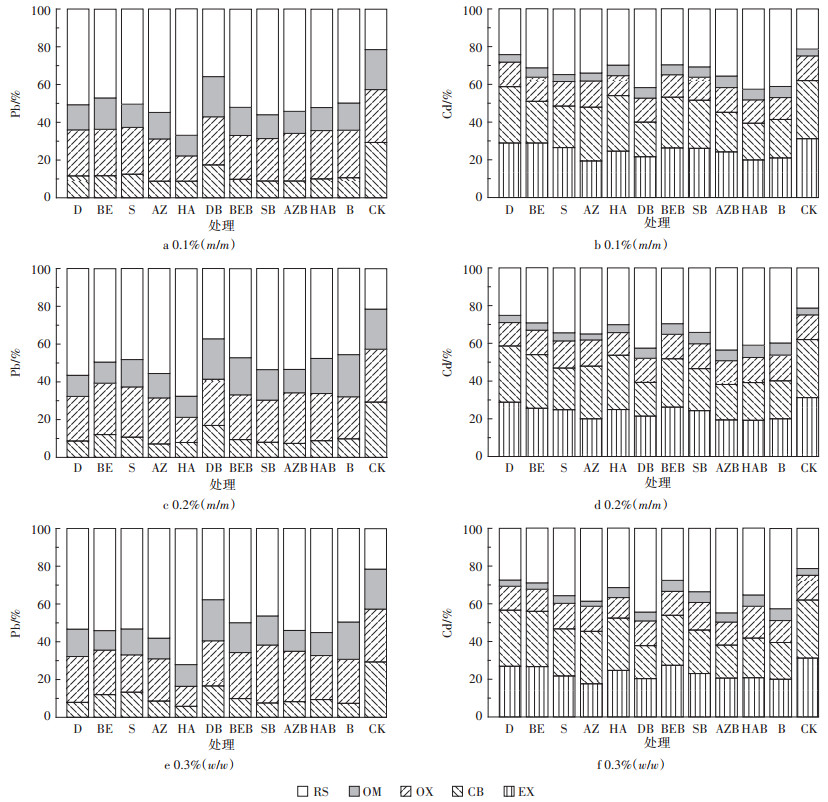
|
图 1 不同修复材料对铅和镉形态分布的影响 Figure 1 Changes of Pb and Cd speciation in soils treated with amendments |
图 1b、图 1d、图 1f为镉在土壤中的形态分布,在空白土壤(CK)中(EX:31.2%,CB:30.8%,OX:13.1%,OM:3.6%,RS:21.3%),由于镉在土壤中比较活跃[22],因此镉主要分布在EX和CB中。经修复材料处理后,部分的EX和CB朝OM和RS转化,DB、AZB、HAB、B处理后的这种变化趋势更为明显。生物炭作为修复材料处理后镉的RS占比高于单一黏土矿物处理,经B处理后镉的RS占比由21.3%升至41.7%~44.4%,因此,生物炭适合用于修复镉污染农田,也适合作为复配材料用于修复含镉的复合重金属污染农田。
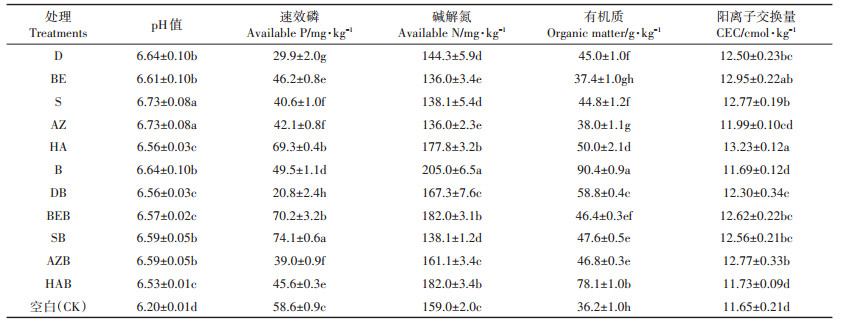
2.4 修复过程前后土壤理化性质的变化 2.4.1 pH值修复剂处理后土壤pH值上升0.33~0.53个单位(表 4)。其中,S和AZ处理后对pH值影响最大,D、BE、HA、DB、BEB、SB、AZB、HAB、B处理后农田土壤pH值则分别增加了0.44、0.41、0.36、0.36、0.37、0.39、0.39、0.33、0.44,S和AZ处理后土壤pH值的提升幅度最大,D、BE、SB、AZB、B的提升幅度次之(P < 0.05)。由此可得,单独投加黏土矿物(D、BE、S、AZ、HA)处理后pH值上升幅度高于黏土矿物和生物炭(DB、BEB、SB、AZB、HAB)混合处理后pH值上升幅度。土壤pH的升高可能是由于BE、S、AZ、HA均属于碱性矿物材料。而D虽然本身呈酸性,却使土壤pH值上升,其原因可能在于D表面携带的可代换性H+较少,而携带的Na+、K+等交换性阳离子较多,进入土壤后,交换性阳离子的水解作用强于H+的交换作用,在土壤溶液中产生较多的NaOH,致使土壤pH值升高[23]。而B则是由于本身的碱度,还有B形成过程中形成的碳酸盐(MgCO3、CaCO3)和有机酸根(-COO-)有关[24]。总的来说,修复材料处理后农田土壤pH值会显著增大(P < 0.05),由于修复材料投加量比较低,修复材料处理后土壤pH值仍保持在6~7的范围内,符合农田土壤的pH值范围。
|
|
表 4 修复后土壤的理化性质 Table 4 Changes of basic physical and chemical properties of the test soil with amendments |
土壤溶液中的氮磷是植物的主要氮源和磷源,也是衡量土壤肥力的重要指标[25]。修复剂处理后土壤中速效磷的含量变化如表 4所示,对照组(CK)的速效磷含量为58.6 mg·kg-1,单独黏土矿物处理后,除了HA使土壤的速效磷增加10.7 mg·kg-1外,D、BE、S、AZ分别使速效磷减少了28.7、12.4、18.0、16.5 mg·kg-1。黏土矿物和生物炭混合处理后,除了BEB和SB分别使速效磷增加11.6 mg · kg-1和15.5 mg · kg-1外,DB、AZB、HAB分别使速效磷减少了37.8、19.6、13.0 mg· kg-1。B的施入使得土壤速效磷含量降低9.1 mg·kg-1,可能是因为生物炭处理后提高了土壤pH值,进而影响磷的吸附和解吸[26]。此外,HA之所以能够增加速效磷则可能是因为HA具有低淋出率和缓慢磷释放的特性,是一种具有较大潜力的磷肥[27-28]。修复剂处理后土壤中碱解氮的含量变化如表 4所示,对照组(CK)的碱解氮含量为158.96 mg·kg-1。黏土矿物单独处理后,除了HA分别使土壤的碱解氮增加18.83 mg·kg-1外,D、BE、S、AZ分别使碱解氮减少了14.64、23.01、20.91、23.01 mg·kg-1。黏土矿物和生物炭混合处理后,除了SB使碱解氮减少20.91 mg·kg-1外,DB、BEB、AZB、HAB分别使碱解氮增加了8.37、23.01、2.09、23.01 mg·kg-1。B处理后土壤碱解氮提高46.02 mg·kg-1。由此看出,黏土矿物会降低土壤中的碱解氮,但生物炭可以弥补这一不足,可以提高土壤的碱解氮。生物炭提高土壤碱解氮可能是因其具有多孔特性和巨大的比表面积可以吸附氮素物质,与此同时也改变了土壤理化性质,使得土壤环境中微生物多样性、丰度及活性受到了影响,继而影响土壤氮的循环[29]。
2.4.3 有机质土壤有机质是土壤肥力的物质基础,它对土壤肥力起着多方面的作用[30]。从表 4可以看出,对照组CK的有机质含量为36.2 g·kg-1,修复剂处理后土壤有机质上升了1.2~54.2 g·kg-1,其中,HAB和B处理对有机质的影响尤为显著(P < 0.05),分别增加了41.9 g·kg-1和54.2 g·kg-1,D、BE、S、AZ、HA、DB、BEB、SB、AZB处理后有机质分别增加8.8、1.2、8.6、1.8、13.8、22.6、10.2、11.4、10.6 g·kg-1。因此,黏土矿物和生物炭混合处理对土壤有机质的提升幅度均要高于黏土矿物单独处理。生物炭本身碳含量非常高,因此B可以大量地增加土壤有机质的含量[24]。D由于其本身含有一定量的有机质,以及可以通过提高土壤pH值来固定土壤原有的有机质,因此D处理后能够提高土壤的有机质含量[23]。BE、S、AZ、HA等处理增加有机质则可能是通过改变土壤的质地、水分等土壤外部环境条件而对土壤有机质起作用的[30]。
2.4.4 阳离子交换量阳离子交换量(CEC)可以用来估算土壤吸收、保留和交换阳离子的能力[24]。从表 4可以看出,对照组CK的CEC含量为11.65 cmol·kg-1。修复材料处理后土壤CEC含量提高了0.04~1.58 cmol·kg-1,D、BE、S、AZ、HA、DB、BEB、SB、AZB、HAB、B处理后分别使CEC增加0.85、1.30、1.12、0.34、1.58、0.65、0.97、0.91、1.15、0.08、0.04 cmol·kg-1。黏土矿物单独处理对土壤CEC的提升幅度要高于黏土矿物和生物炭混合处理,黏土矿物能明显提高土壤的阳离子交换量(P < 0.05)。B的施入未对土壤CEC产生显著的影响(P < 0.05),可能是因为B表面氧化程度较低,结构稳定性强,不易发生化学氧化和微生物降解,因而不能增加土壤CEC含量[31]。D、BE可能由于其本身含有一定量的CEC,同时提高土壤pH值,促进土壤胶体表面阳离子的解离,从而增加土壤的CEC含量[23]。S、AZ、HA则可能是通过提高土壤pH值来增加土壤中的CEC含量。
2.5 不同处理的影响通过研究对比发现,不同修复材料D、BE、S、AZ、HA、DB、BEB、SB、AZB、HAB和B,均能显著降低铅和镉的有效形态。D、BE、S、AZ、HA和DB处理对铅的修复率与其他组合存在显著性差异(P < 0.05),这几种处理均能显著提高农田土壤的pH值,同时可以显著提高农田土壤的阳离子交换量和有机质含量,有利于重金属的钝化和农田安全生产,HA能显著提高农田土壤速效磷和碱解氮,原因可能是修复材料本身的磷和氮含量比较高,除HA外,其他组合会显著降低农田土壤速效磷和碱解氮,会对农田生产造成不利影响。B、SB和AZB处理对镉的修复率与其他组合存在显著性差异(P < 0.05),这几种处理均能显著提高农田土壤的pH值和有机质含量,SB和AZB可以显著提高农田土壤的阳离子交换量,B和AZB能显著提高农田土壤碱解氮的含量,有利于农田生产,B和AZB处理会降低农田土壤速效磷的含量,SB处理可以显著提高农田土壤速效磷的含量。
2.6 成本核算1 m2土壤耕作层的质量按2.25 t计算,农田土壤含水率按60%计算,则1 m2实际需要修复的土壤为0.90 t,修复材料按0.1%(m/m)~0.3%(m/m)的投加量计算,即修复1 m2农田土壤需要修复材料0.90~2.7 kg·m-2。
硅藻土、膨润土、海泡石、人造沸石、羟基磷灰石大致的价格分别为3.00、0.80、2.00、3.50、2.00元· kg-1,因此修复1 m2土壤耕作层的修复材料费用分别为2.70~8.10、0.72~2.16、1.80~5.40、3.15~9.45、1.80~5.40元。
3 结论本研究旨在比较原位修复中不同修复材料D、BE、S、AZ、HA、DB、BEB、SB、AZB、HAB和B在低投加量下对重金属污染农田土壤中铅、镉的修复效果。结果表明,以HA为代表的黏土矿物在原位修复铅污染农田土壤方面有明显优势,含生物炭的修复材料在原位修复镉污染农田土壤方面有明显优势,SB和AZB适合用于铅镉复合污染农田,各种修复材料的组合均能提高铅、镉残渣态(RS)的比例,处理后农田土壤理化性质未发生较大变化。低投加量下的黏土矿物和生物炭结合具有应用在重金属污染土壤原位修复领域的前景。
| [1] |
Violante A, Huang P M, Gadd G M. Biophysico-chemical processes of heavy metals and metalloids in soil environments[M]. Hoboken, NJ: John Wiley & Sons Inc, 2008: 15-22.
|
| [2] |
Tahervand S, Jalali M. Sorption and desorption of potentially toxic metals(Cd, Cu, Ni and Zn)by soil amended with bentonite, calcite and zeolite as a function of pH[J]. Journal of Geochemical Exploration, 2017, 181: 148-159. DOI:10.1016/j.gexplo.2017.07.005 |
| [3] |
Glatstein D A, Francisca F M. Influence of pH and ionic strength on Cd, Cu and Pb removal from water by adsorption in Na-bentonite[J]. Applied Clay Science, 2015, 118: 61-67. DOI:10.1016/j.clay.2015.09.003 |
| [4] |
Sun Y B, Li Y, Xu Y M, et al. In situ stabilization remediation of cadmium (Cd) and lead (Pb) co-contaminated paddy soil using bentonite[J]. Applied Clay Science, 2015, 105: 200-206. |
| [5] |
Merrikhpour H, Jalali M. Comparative and competitive adsorption of cadmium, copper, nickel, and lead ions by Iranian natural zeolite[J]. Clean Technol Environ Policy, 2013, 15(2): 303-316. |
| [6] |
Edwards R, Rebedea I, Lepp N W. An investigation into the mechanism by which synthetic zeolites reduce labile metal concentrations in soils[J]. Environmental Geochemistry and Health, 1999, 21(2): 157-173. DOI:10.1023/A:1006677115486 |
| [7] |
Liang X F, Xu Y, Xu Y M, et al. Two-year stability of immobilization effect of sepiolite on Cd contaminants in paddy soil[J]. Environmental Science and Pollution Research, 2016, 23(13): 12922-12931. DOI:10.1007/s11356-016-6466-y |
| [8] |
Ye X X, Kang S H, Wang H M, et al. Modified natural diatomite and its enhanced immobilization of lead, copper and cadmium in simulated contaminated soils[J]. Journal of Hazardous Materials, 2015, 289: 210-218. DOI:10.1016/j.jhazmat.2015.02.052 |
| [9] |
Sun Y B, Li Y, Xu Y M, et al. Reliability and stability of immobilization remediation of Cd polluted soils using sepiolite under pot and field trials[J]. Environmental Pollution, 2016, 208. |
| [10] |
Reddy H K, Lee S M. Magnetic biochar composite:Facile synthesis, characterization, and application for heavy metal removal[J]. Colloids and Surfaces A-physicoshemical and Engineering Aspects, 2014, 454: 96-103. |
| [11] |
Beeley L, Moreno J E, Gomez E J L, et al. A review of biochars' potential role in the remediation, revegetation and restoration of contaminated soils[J]. Environmental Pollution, 2011, 159(12): 3269-3282. DOI:10.1016/j.envpol.2011.07.023 |
| [12] |
Tessier A, Campbell P G, Bisson M. Sequential extraction procedure for the speciation of particulate trace metals[J]. Analytical Chemistry, 1979, 51(7): 844-851. DOI:10.1021/ac50043a017 |
| [13] |
Dai J, Becquer T, Rouiller J H, et al. Influence of heavy metals on C and N mineralization and microbial biomass in Zn, Pb, Cu, and Cd contaminated soils[J]. Applied Soil Ecology, 2004, 25(2): 99-109. DOI:10.1016/j.apsoil.2003.09.003 |
| [14] |
Lindsay W L, Norvell W A. Equilibrium relationships of Zn2+, Fe2+, Ca2+ and H+ with EDTA and DTPA in soils[J]. Proceedings of the Soil Science Society of America, 1969, 33(1): 62-68. |
| [15] |
Chen J H, Wang Y J, Zhou D M, et al. Adsorption and desorption of Cu(Ⅱ), Zn(Ⅱ), Pb(Ⅱ), and Cd(Ⅱ) on the soils amended with nanoscale hydroxyapatite[J]. Environmental Progress & Sustainable Energy, 2010, 29(2): 233-241. |
| [16] |
Xu C, Chen H X, Xiang Q, et al. Effect of peanut shell and wheat straw biochar on the availability of Cd and Pb in a soil-rice(Oryza sativa, L.) system[J]. Environmental Science & Pollution Research, 2017, 25(5): 1-10. |
| [17] |
Yin X, Xu Y, Huang R, et al. Remediation mechanisms for Cd-contaminated soil using natural sepiolite at the field scale[J]. Environmental Science Processes & Impacts, 2017, 19(12): 1563-1570. |
| [18] |
Liang X, Han J, Xu Y, et al. In situ field-scale remediation of Cd polluted paddy soil using sepiolite and palygorskite[J]. Geoderma, 2014, 235(4): 9-18. |
| [19] |
Filip M G T, Marc G V. Single extractions versus sequential extraction for the estimation of heavy metal fractions in reduced and oxidized dredged sediments[J]. Chemical Speciation & Bioavailability, 1999, 11(2): 43-50. |
| [20] |
罗泽娇, 刘沛, 贾娜. 土壤中重金属铅浸出毒性的方法研究[J]. 环境科学与技术, 2014, 37(11): 86-89. LUO Ze-jiao, LIU Pei, JIA Na. Study on leaching toxicity of heavy metal lead in soil[J]. Environmental Science & Technology, 2014, 37(11): 86-89. |
| [21] |
钟晓兰, 周生路, 黄明丽, 等. 土壤重金属的形态分布特征及其影响因素[J]. 生态环境学报, 2009, 18(4): 1266-1273. ZHONG Xiao-lan, ZHOU Sheng-lu, HUANG Ming-li, et al. Speciation and distribution of heavy metals in soil and its influencing factors[J]. Ecology and Environmental Science, 2009, 18(4): 1266-1273. DOI:10.3969/j.issn.1674-5906.2009.04.013 |
| [22] |
Mench M J, Fargues S. Metal uptake by iron-efficient and inefficient oats[J]. Plant & Soil, 1994, 165(2): 227-233. |
| [23] |
朱健, 王平, 林艳, 等. 不同产地硅藻土原位控制土壤镉污染差异效应与机制[J]. 环境科学, 2016, 37(2): 717-725. ZHU Jian, WANG Ping, LIN Yan, et al. Different effects of diatomite in situ on controlling cadmium pollution in soil and its mechanism[J]. Environmental Science, 2016, 37(2): 717-725. |
| [24] |
武玉, 徐刚, 吕迎春, 等. 生物炭对土壤理化性质影响的研究进展[J]. 地球科学进展, 2014, 29(1): 68-79. WU Yu, XU Gang, LÜ Ying-chun, et al. Research progress on effects of biochar on soil physical and chemical properties[J]. Advances in Earth Science, 2014, 29(1): 68-79. |
| [25] |
韩君, 梁学峰, 徐应明, 等. 黏土矿物原位修复镉污染稻田及其对土壤氮磷和酶活性的影响[J]. 环境科学学报, 2014, 34(11): 2853-2860. HAN Jun, LIANG Xue-feng, XU Ying-ming, et al. In situ remediation of cadmium contaminated paddy soils with clay minerals and their effects on soil nitrogen, phosphorus and enzyme activities[J]. Acta Scientiae Circumstantiae, 2014, 34(11): 2853-2860. |
| [26] |
Parvage M M, Ulen B, Eriksson J, et al. Phosphorus availability in soils amended with wheat residue char[J]. Biology and Fertility of Soils, 2013, 49(2): 245-250. DOI:10.1007/s00374-012-0746-6 |
| [27] |
Montalvo D, Mclaughlin M J, Degryse F. Efficacy of hydroxyapatite nanoparticles as phosphorus fertilizer in Andisols and Oxisols[J]. Soil Science Society of America Journal, 2015, 79(2): 551-558. DOI:10.2136/sssaj2014.09.0373 |
| [28] |
Liu R Q, Rattan L. Potentials of engineered nanoparticles as fertilizers for increasing agronomic productions[J]. Science of the Total Environment, 2015, 514: 131-139. DOI:10.1016/j.scitotenv.2015.01.104 |
| [29] |
Spokas K A, Novak J M, Venterea R T, et al. Biochar's role as an alternative N-fertilizer:Ammonia capture[J]. Plant and Soil, 2012, 350(1/2): 35-42. |
| [30] |
李吉进, 徐秋明, 倪小会, 等. 施用膨润土对土壤含水量和有机质含量的影响[J]. 华北农学报, 2002(2): 88-91. LI Ji-jin, XU Qiu-ming, NI Xiao-hui, et al. Effect of bentonite on soil water content and organic matter content[J]. Acta Agriculturae Boreali-Sinica, 2002(2): 88-91. DOI:10.3321/j.issn:1000-7091.2002.02.019 |
| [31] |
李金文, 顾凯, 唐朝生, 等. 生物炭对土体物理化学性质影响的研究进展[J]. 浙江大学学报(工学版), 2018, 52(1): 192-206. LI Jin-wen, GU Kai, TANG Chao-sheng, et al. Research progress in the influence of biochar on physical and chemical properties of soil[J]. Journal of Zhejiang University(Engineering Science), 2018, 52(1): 192-206. |
 2019, Vol. 38
2019, Vol. 38