2. 四川省土壤环境保护重点实验室, 成都 611130
2. Key Laboratory of Soil Environment Protection of Sichuan Province, Chengdu 611130, China
随着我国工农业的快速发展,土壤镉(Cd)污染问题日趋严峻[1-2]。Cd易通过食物链进入人体,影响多种酶活性和细胞的正常功能,对人类健康构成极大威胁[3]。因此寻找安全、实用、高效的土壤Cd污染修复方法是当前研究的热点。植物修复属于土壤重金属污染的原位修复技术,因其具有修复成本低、二次污染风险小以及不破坏土壤结构的优点受到广泛关注[4-6]。然而植物对Cd的提取效率受到土壤中Cd的赋存形态、迁移转化能力以及生物有效性的影响[7]。一般而言,土壤中能被植物有效利用的Cd形态含量不高,限制了植物对其的吸收,Cd修复的效率低[8]。这些因素限制了该技术的工程化应用,需要进一步探索提高植物修复效率的方法。
研究表明,螯合剂可与土壤中的重金属形成水溶性的金属-螯合剂络合物,从而改变其赋存形态,提高生物有效性,增加植物对重金属的吸收能力[9]。目前广泛使用的螯合剂主要包括氨基多羧酸类螯合剂(Amino polycarboxylate chelating agents,简称APCAs)和小分子有机酸类螯合剂(Low molecular organic acids,简称LMWOAs)。APCAs主要通过与目标金属形成络合物,从而增加其生物有效性,而LMWOAs则通过酸溶、吸附解吸等作用活化土壤中的重金属[10]。乙二醇双(2-氨基乙基醚)四乙酸(EGTA)作为一种人工合成的螯合剂,与Cd能形成较稳定的络合物,是修复Cd污染土壤较理想的选择[11-13]。但高浓度的EGTA对植株会产生毒害作用,限制植物修复的效率[9]。EGTA对植株产生毒害作用的机制可能是由于高浓度的EGTA大幅增加了土壤溶液中的Cd浓度,造成植株对Cd的大量积累,导致植株的氧化胁迫和叶绿体结构的改变,抑制植株生长[9, 14]。而有机酸对Cd具有解毒作用,酒石酸(TA)和柠檬酸(CA)可增大植株的生物量,提高叶绿素含量和抗氧化酶活性[15-16]。因此,EGTA与TA、CA联合施用能否在保证植物正常生长的同时提高植物Cd积累能力,是一个值得研究的问题。
黄麻(Corchorus capsularis L.)是椴树科黄麻属,一年生草本植物,在我国南方有广泛种植,具有生物量大、生长速度快等特点,其主要产品是纤维,不进入食物链,且有一定经济效益。前期研究发现,黄麻对Cd具有较强的富集能力,当Cd浓度为50 mg·kg-1时,地上部Cd含量可达181.60 mg·kg-1,是一种良好的Cd污染修复材料[17-18]。然而,是否可利用螯合剂的添加来增强黄麻对Cd的提取效率,目前尚无相关研究报道。因此本研究拟通过盆栽试验,分析EGTA分别与TA和CA混合施用对黄麻富集Cd能力及其生理特征的影响,揭示人工合成的螯合剂与有机酸配施对植株解毒的生理机制,从而为提高黄麻对Cd的修复效率提供理论依据。
1 材料与方法 1.1 试验材料选取黄麻为试验材料,种子购买于四川省种子市场。
1.2 试验设计 1.2.1 幼苗培养将饱满成熟的黄麻种子浸泡在0.05%NaClO中消毒30 min,再用蒸馏水洗净,于28 ℃恒温培养箱内催芽,5 d后播种于未受重金属污染的营养土中,培养30 d后选择长势一致的幼苗(株高15 cm左右,8叶)备用。
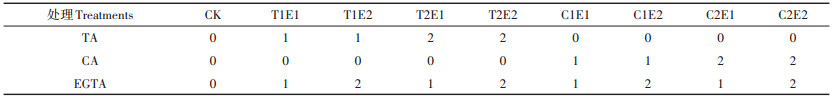
1.2.2 盆栽试验供试土壤为水稻土,取自受工业污染的严重污染农田,其基本理化性质为pH值7.63,有机质20.26 g·kg-1,碱解氮73.42 mg·kg-1,速效磷15.35 mg·kg-1,速效钾148.4 mg·kg-1。其Cd全量为37.21 mg·kg-1。复合肥以NH4NO3和KH2PO4的形式添加(N:P2O5:K2O=17:17:17),每盆添加量4.0 g,以基肥形式加入,试验期间不再添加任何肥料。将该土壤分装进塑料花盆(直径30 cm,高度20 cm),每盆装土5.0 kg,将准备好的黄麻幼苗移栽到塑料花盆中,每盆3株。盆栽30 d后以溶液滴灌形式向黄麻根系土壤加入螯合剂,培养80 d后收获植株,并取适当根系土,自然风干留样备用。盆栽试验设计共9个处理,每个处理3次重复。试验设计如表 1。
|
|
表 1 盆栽试验设计(mmol·kg-1) Table 1 Experiment design (mmol·kg-1) |
植株收获后,先反复用自来水把根冲洗干净,然后用去离子水反复清洗3~5次。测量并记录植物的株高和根长,再将植物分为根、茎和叶3部分,将植物各部分鲜样置于105 ℃下杀青30 min,然后在80 ℃下烘干至恒质量,称量其干物质量。
1.3.2 生理指标(1)光合色素含量
分别选取各处理植株上2片成熟叶片,用丙酮浸提,用紫外可见分光光度计分别测定浸提液在663、645、470 nm波长处的光密度OD值,按熊庆娥[19]的方法计算各光合色素的含量。
(2)抗氧化酶活性酶液的提取:用磷酸缓冲液(pH 7.8)在冰浴上研磨成匀浆,在4 ℃、12 000 g下离心20 min,上清液即为酶液。
采用氮蓝四唑(NBT)法测定SOD活性[19]。样品管中加反应体系(pH 7.8的PBS,甲硫氨酸,NBT,核黄素,EDTA)和酶液。设置1支对照管放置在暗处,其他管于4000 lx日光下反应10 min,计算SOD活性。
采用愈创木酚法测定POD活性[19]。用pH 6.0磷酸缓冲溶液,30%过氧化氢溶液和愈创木酚配制反应混合液。样品管中加入反应液和酶液,加入pH 6.0的磷酸缓冲溶液为对照管,然后在470 nm下测定光密度,40 s后再次测定。计算POD活性。
采用高锰酸钾滴定法测定CAT活性[19]。设置两个测定管,两个对照管,测定瓶中加入酶液,对照瓶加入已煮死酶液,各瓶均加入0.1 mol·L-1H2O2,在30 ℃恒温水浴中保温10 min,立刻加入10%的H2SO4终止反应。用0.1 mol·L-1KMnO4标准溶液滴定,至出现粉红色(0.5 min内不消失)。计算CAT活性。
1.3.3 土壤pH值及各形态的Cd含量土壤pH值测定[20]:称取过100目筛的土样20 g,放入50 mL的烧杯中,加入去离子水20 mL,以玻棒搅拌1 min,使水土充分混合,静置30 min后用pHS-3C复合电极测定pH值。
土壤Cd的全量测定[20]:土壤样品风干后磨细过2 mm网筛备用。称取1.000 g土壤样品于聚四氟乙烯坩埚中,经去离子水润湿后加入15 mL HF和10 mL HCl4-HNO3混合酸(体积比为1:1)加热至干,再加入5 mL HNO3消煮至少量无色无白烟冒出的液体,完全转移至容量瓶后定容并过滤,用原子吸收分光光度计测定Cd含量。
采用改进的BCR连续提取法[21]分别测量土壤中Cd弱酸提取态、可还原态、可氧化态、残渣态的含量。弱酸提取态:用HAc作为提取液提取,用原子吸收分光光度计测定浓度,表示为C1。残余土样供下一步实验使用。可还原态:用NH2OH·HCl作为提取液对上一步残渣进行提取,用原子吸收分光光度计测定浓度,表示为C2。残余土样处理方法同上。可氧化态:向上一步残渣中缓慢加入30%(质量分数)H2O2消解至溶液减少到1 mL以下。用NH4OAc作为提取液提取后,用原子吸收分光光度计测定浓度,表示为C3。残余土样处理方法同上。残渣态:将上一步残渣小心转移到聚四氟乙烯烧杯中,然后加入一定比例的HNO3、HF和HClO4于电热板上消解至内容物呈黏稠状时,以水定容后,用原子吸收分光光度计测定浓度,表示为C4。
土壤有效态Cd用二乙基三胺五乙酸(DTPA)作为提取剂提取,DTPA提取剂(0.005 mol·L-1 DTPA-0.1 mol·L-1 TEA-0.01 mol·L-1 CaCl2)用6 mol·L-1的HCl调节pH至7.30。提取后用原子吸收分光光度计测定浓度[22]。
1.3.4 植物样品Cd含量用硝酸-高氯酸法消煮,取烘至恒质量的黄麻,分为根、叶、茎,粉碎,过1 mm尼龙网筛,混合均匀备用。称取0.300 g于三角瓶中,加入20 mL的HNO3 - HClO4混合酸(体积比为4:1)消煮至少量无色液体后,完全转移至容量瓶定容并过滤,用原子吸收分光光度计测定Cd含量[23]。
1.4 数据处理与统计分析试验数据采用Microsoft Office Excel 2010处理,用Origin制作图表,在IBM SPSS Statistics 20.0中对数据进行单因素方差(ANOVA)检验,采用DUNCAN多重比较进行处理间差异显著性检验。分别计算转移系数(地上部Cd含量/地下部Cd含量),富集系数[地上(下)部Cd含量/污染土壤Cd含量]和土壤净化率(地上部Cd积累量/土壤总Cd量)。
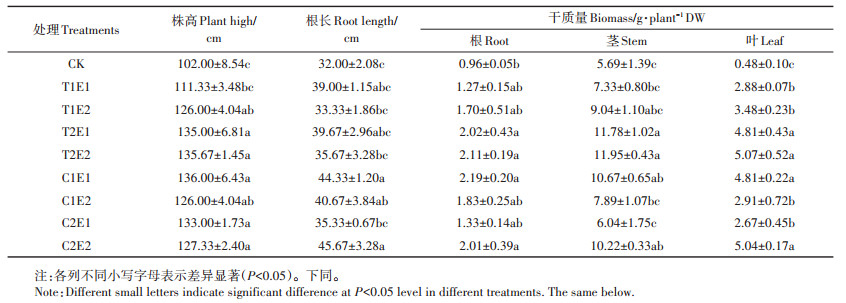
2 结果与分析 2.1 螯合剂对黄麻生长的影响与CK相比,各处理均不同程度地增加了黄麻的株高、根长和各器官的生物量(表 2)。且T2E2和C1E1处理株高增加量最大,达1.33倍。C2E2处理根长增大最多,达1.42倍。各处理对黄麻叶生物量促进最为明显,其次为根和茎。与CK相比,螯合剂添加处理叶生物量增加453.52%~1 051.18%,根部生物量升高25.32%~127.96%,茎部生物量升高6.13%~ 105.12%。
|
|
表 2 不同处理对黄麻生长的影响 Table 2 Effects of different treatments on the growth of C. capsularis |
(1)光合色素
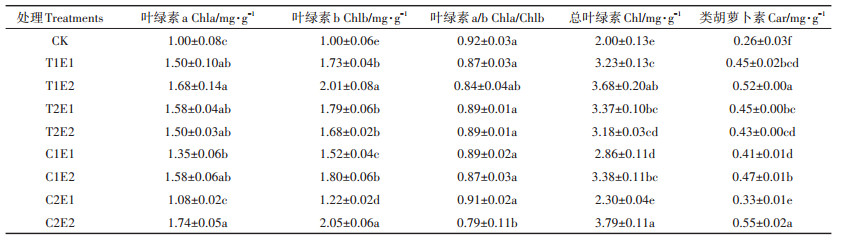
表 3可见,与CK相比,各处理均显著提高了黄麻的叶绿素b、总叶绿素和类胡萝卜素含量(P < 0.05),涨幅分别达22.7%~105.7%、15.1%~89.6%和25.5%~111.6%,除C2E1处理外,其余处理均显著提高黄麻叶绿素a含量(P < 0.05),比CK增加34.1%~73.4%。其中,C2E2处理黄麻的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量最高,分别是CK的1.73~2.11倍。
|
|
表 3 不同处理对黄麻光合色素含量的影响 Table 3 Effects of different treatments on the photosynthetic pigments of C. capsularis |
(2)抗氧化酶
螯合剂处理下,黄麻SOD、POD和CAT酶活性均呈增加趋势,其中SOD和POD酶活性根部增幅大于叶部,而CAT酶活性则相反(图 1)。各处理黄麻叶片SOD酶活性和POD酶活性比CK显著(P < 0.05)增加,增幅分别为29.58%~116.17%,11.71%~84.16%。除T1E2和T2E1处理外,其余处理叶片CAT酶活性均显著(P < 0.05)高于CK,是CK的1.73~2.66倍。各处理黄麻根系SOD酶活性均显著增加(P < 0.05),增幅达37.47%~294.13%,除T1E2外,各处理黄麻根系POD酶活性与CK相比均显著提高(P < 0.05),涨幅达15.03%~347.29%。除T2E2和C2E2处理外,各处理黄麻根系CAT酶活性相对CK均显著(P < 0.05)增加,涨幅达17.62%~179.97%。
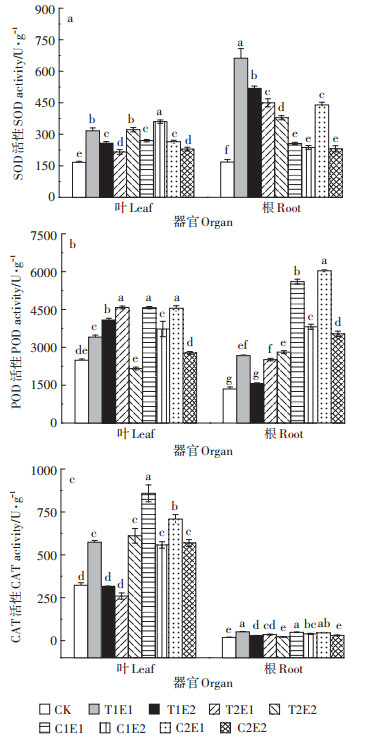
|
图 1 不同处理对黄麻抗氧化酶活性的影响 Figure 1 Effects of different treatments on antioxidative enzyme activities of C. capsularis |
由于EGTA与有机酸都为酸性物质,相对于CK各处理土壤pH值有所降低,但降低幅度较小,最大不超过0.31,各处理间土壤pH无显著差异(图 2)。添加螯合剂后各处理土壤弱酸提取态Cd所占比例有所增加,可还原态和可氧化态占比有所降低,而残渣态无明显变化(图 2)。各处理弱酸提取态Cd占比为CK的1.01~1.12倍。T1E2与T2E1处理弱酸提取态Cd占比最高,分别是CK的1.12倍和1.11倍。
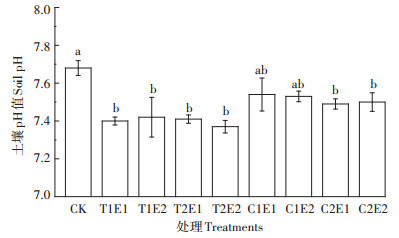
|
图 2 不同处理土壤pH Figure 2 Soil pH after different treatments |

|
图 3 不同处理土壤Cd形态分布特征 Figure 3 Speciation distribution characteristics of Cd in soil after different treatments |
与CK相比,除T1E1、T2E2、C1E1外,各处理DTPA提取态Cd比CK显著(P < 0.05)增加,增幅达36.29%~ 60.36%(P < 0.05),其中,C2E2处理土壤DTPA提取态Cd含量最高,为CK的160.36%。
2.4 螯合剂处理下黄麻对Cd的富集特征由图 4可以看出,不同处理黄麻各器官的Cd含量和Cd积累量均呈增加趋势,且地上部的增加幅度大于地下部,CK中各器官Cd含量表现为根>叶>茎,处理中黄麻各器官Cd含量均呈现为叶>根>茎,Cd积累量也从茎>根>叶变为叶>茎>根,说明Cd的主要积累场所从地下部变为了地上部。除T1E2与C1E2外,各处理根的Cd含量均显著(P < 0.05)高于CK,增加幅度为12.65%~81.07%。其中,C1E1处理黄麻根系Cd含量达最高为62.42 mg·kg-1。与CK相比,各处理黄麻茎、叶的Cd含量较CK均显著(P < 0.05)增加,增加幅度分别达39.23%~82.83%和181.45%~336.19%。茎中Cd含量在C1E1处理达最大为28.59 mg·kg-1,各处理黄麻叶的Cd含量较CK均显著(P < 0.05)增加,增加幅度达181.45%~336.19%,并在C2E1处理达最大为88.57 mg·kg-1。叶部Cd积累量增幅为16.45~39.64倍。C1E1处理时叶部Cd积累量达最大为410.48 μg·株-1。
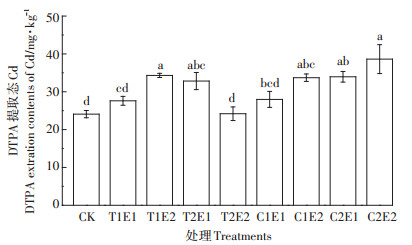
|
图 4 不同处理对土壤有效态Cd含量的影响 Figure 4 Effects of different treatments on the concentration of bioavailable Cd in soil |
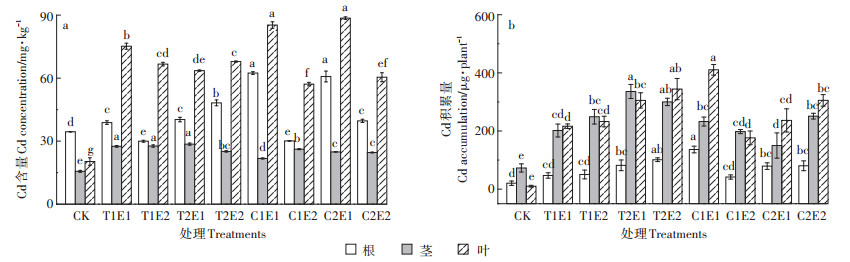
|
图 5 不同处理对黄麻各器官Cd含量与Cd积累量的影响 Figure 5 Effects of different treatments on Cd concentration and accumulation in C. capsularis. organs |
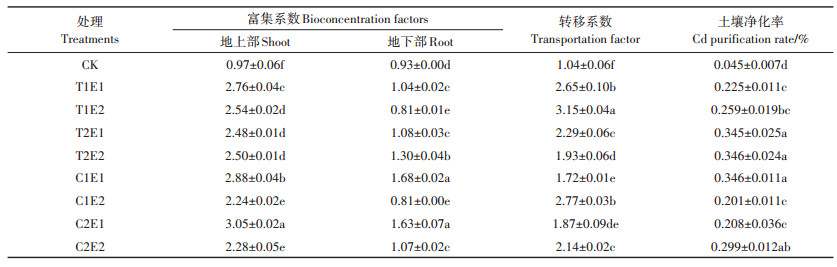
EGTA和TA与CA的配施促进了Cd向黄麻地上部的转移。表 4可见,各处理的转移系数分别比CK增加了64.42%~166.35%,其中,T1E2处理的转移系数最高,达3.15。除T1E2和C1E2处理地下部富集系数下降外,各处理组地上部和地下部富集系数均提高,且增幅分别为1.30~2.14倍、0.11~0.80倍。土壤净化率提高明显,不施加任何螯合剂的对照处理,土壤Cd的净化率仅为0.045%。而施加螯合剂后,土壤净化率提高了2.77~5.53倍。
|
|
表 4 黄麻对Cd的吸收富集特征 Table 4 The characteristics of Cd absorption and accumulation of C. capsularis |
植物生长是影响植物修复效率的重要指标[24]。EGTA对Cd有较强的活化作用,可显著促进植物对土壤中Cd的吸收[25]。但有研究表明EGTA在促进植物吸收重金属的同时会导致植物生长慢、生物量低,限制植物对重金属的去除能力[9]。产生该现象的原因可能是由于高浓度的EGTA大量增加了土壤溶液中的Cd浓度,造成植株对Cd的大量积累,在Cd和螯合剂的双重胁迫下,植株生长受到抑制[9, 14]。李君等[11]研究发现蓖麻(Ricinus communis L.)根系鲜质量和茎干质量在EGTA投加量达到2 mmol·kg-1时比CK显著降低31.82%。研究发现,TA和CA能通过影响Cd在植株中的化学形态来降低Cd对植株的毒害效应[26],也可以通过影响植物代谢过程来调节Cd的毒害作用[27],如改善Cd胁迫下植株的生长、促进植株的生物量提升等[28-29]。本试验中2 mmol·kg-1EGTA与有机酸配施均提高了黄麻的根长、株高与根茎叶干质量,表明EGTA与有机酸配合施用可改善Cd胁迫下黄麻的生长,克服单施螯合剂导致修复植物生物量降低的缺点。但有机酸对黄麻生长的改善机制有待深入研究。
植物光合色素是植物进行光合作用的必需物质,其含量在一定程度上反映了植物受逆境伤害的程度[30]。研究表明,高浓度的APCAs施用会造成植株的叶绿素含量降低,阻碍光合作用的正常进行,最终导致植物生物量的降低[31],本试验中,EGTA与CA和TA配施都提高了Cd胁迫下植株叶绿素a、叶绿素b、叶绿素a+b和类胡萝卜素的含量。这可能是由于有机酸的施用能缓解Cd胁迫下植株的光合色素含量下降[16, 29]。该结果表明有机酸与EGTA复配能缓解单施螯合剂导致的光合色素含量下降,是有机酸与EGTA配施改善黄麻生长的机制之一。
Cd胁迫会导致植物体内活性氧自由基水平急剧上升,氧自由基过量会影响植物生长发育,严重时会导致植物死亡[30]。SOD、POD、CAT等抗氧化酶是植物活性氧清除系统中的重要酶,能抵抗活性氧自由基所造成的氧化伤害[32],抗氧化酶活性的大小在一定程度上反映了植物在逆境中的耐受能力。以往研究发现,单施高浓度APCAs会加剧Cd对植株的氧化胁迫[31, 33]。本试验结果表明,有机酸与EGTA处理下,黄麻叶部和根部抗氧化酶活性相对CK均呈增高趋势,原因在于有机酸可通过参与特异性蛋白或防御相关性酶的表达等方式缓解Cd造成的氧化胁迫,从而提高Cd胁迫下SOD、POD、CAT的活性[16, 34-35]。该结果表明EGTA与TA和CA的配施可在一定程度上减轻单施EGTA时活性氧对黄麻细胞的伤害,提高其抗逆能力,从而改善黄麻的生长。
植物提取是通过富集重金属的植物对重金属的吸收将重金属带出土体,因此植物提取的效率较大程度上取决于重金属在土壤中的生物有效性[36]。BCR连续提取法中,弱酸提取态是重金属在土壤中具生物活性的部分[9]。本试验中,添加EGTA与有机酸后各处理土壤中Cd的土壤弱酸提取态均增加,这与张譞等[37]的研究中所得结论一致。螯合剂作用下,土壤中Cd的弱酸提取态的增加有利于黄麻对Cd吸收的增加。DTPA能浸提出土壤里交换态、吸附态、有机固定态和部分氧化态的水溶性重金属,这部分被认为是重金属生物有效的形态[38]。本试验显示,与CK相比,添加螯合剂的土壤有效态Cd含量显著增高,该结果与张玉芬等[29]的研究结果一致。其原因主要是由于EGTA与Cd形成了稳定的Cd-EGTA络合物,研究表明,有机酸只有在较高浓度和较低pH的情况下才对提高有效态Cd有一定效果,而本试验土壤pH呈微碱性,因此有机酸对于增加土壤有效态Cd的作用十分有限。EGTA在碱性条件下依然可以显著增加有效态Cd含量,则在本试验中发挥主要作用[25, 39]。另外,本试验中各处理pH相比CK均有所降低,这可能是由于EGTA与有机酸都呈酸性的原因,加入土壤后使土壤pH降低。一些研究表明通过降低土壤pH,可以使重金属从植物不可利用态转变为可利用态,从而增加重金属生物有效性[40]。这也与本试验中重金属形态变化趋势匹配。在EGTA与CA和与低浓度TA的处理组中,随螯合剂的浓度增加,有效态Cd浓度随之增加。以上结果说明TA和CA与EGTA配施的活化效应与其剂量有关。因此有机酸与EGTA配施可在避免对黄麻产生毒害的同时,对土壤Cd有较好的活化效果。
植物的Cd修复效率主要取决于其地上部Cd积累量,本试验中,添加螯合剂之前,黄麻对Cd的富集主要集中在黄麻的茎部和根部,地上部对Cd的富集量不高直接限制了黄麻的Cd修复效率。在EGTA与有机酸的配施处理下,黄麻地上部富集系数和迁移系数增幅分别达到1.30~2.14倍和0.64~1.66倍,这与Luo等[41]的研究结果一致,陈亚慧等[9]研究也发现,螯合剂与有机酸配施的处理提高了Cd从植物根系到地上部的转移能力。该结果是由于EGTA能够与土壤中的Cd形成更易被植物吸收的形态而被植物吸收和转运到地上部[11]。Cd积累量受植株生物量与植株Cd含量的共同影响。叶中Cd含量在C1E1处理下虽然未达到最大,仅为85.28 mg·kg-1,但受黄麻生物量影响,其叶部Cd积累量达到最大为410.48 μg·株-1,土壤净化率达0.346%。研究发现,单施5 mmol·kg-1EDTA时,虽蓖麻Cd含量达139.11 mg·kg-1,但地上部生物量相比CK显著降低,其积累量仅为63.07 μg·株-1,土壤净化率0.063%[26]。本试验结果表明,EGTA与有机酸配合施用时,适宜浓度TA和CA可缓解Cd对黄麻的毒害,使黄麻地上部具有较大生物量,而EGTA与Cd形成稳定的Cd-EGTA络合物使得黄麻地上部具有较高的Cd含量,因此,EGTA与TA和CA联合施用能在保证植物正常生长的同时提高植物Cd积累能力。
4 结论(1)EGTA与TA和CA配施增加了黄麻光合色素含量,提高了黄麻SOD、POD、CAT酶活性,表明EGTA与有机酸可通过调节黄麻体内抗氧化酶活性,清除黄麻细胞内因胁迫产生的过量活性氧自由基,保持黄麻体内活性氧代谢平衡,从而保障黄麻的正常生长。
(2)EGTA与TA和CA配施提高了土壤弱酸提取态Cd占比和DTPA提取态Cd含量,从而促进黄麻对土壤Cd的吸收。
(3)施加EGTA和有机酸促进了黄麻的生长,增加了黄麻对Cd的吸收,从而增大了黄麻对土壤Cd的积累。当CA和EGTA施用量均为1 mmol·kg-1时,黄麻具有最大的地上部Cd积累量643.02 μg·株-1,土壤净化率为0.346%,分别为CK的7.75倍和5.53倍。
| [1] |
Chen H, Teng Y, Lu S, et al. Contamination features and health risk of soil heavy metals in China[J]. Science of the Total Environment, 2015, 512-513: 143-153. DOI:10.1016/j.scitotenv.2015.01.025 |
| [2] |
Ran X, Shuang W, Li R, et al. Soil heavy metal contamination and health risks associated with artisanal gold mining in Tongguan, Shaanxi, China[J]. Ecotoxicology & Environmental Safety, 2017, 141: 17-24. |
| [3] |
Jaishankar M, Tseten T, Anbalagan N, et al. Toxicity mechanism and health effects of some heavy metals[J]. Interdisciplinary Toxicology, 2014, 7(2): 60-72. DOI:10.2478/intox-2014-0009 |
| [4] |
孙鑫, 娄燕宏, 王会, 等. 重金属污染土壤的植物强化修复研究进展[J]. 土壤通报, 2017, 48(4): 1008-1013. SUN Xin, LOU Yan-hong, WANG Hui, et al. Review on enhancing phytoremediation of soil contamination by heavy metals[J]. Chinese Journal of Soil Science, 2017, 48(4): 1008-1013. |
| [5] |
Sarwar N, Imran M, Shaheen M R, et al. Phytoremediation strategies for soils contaminated with heavy metals:Modifications and future perspectives[J]. Chemosphere, 2017, 171: 710-721. DOI:10.1016/j.chemosphere.2016.12.116 |
| [6] |
Cristaldi A, Conti G O, Jho E H, et al. Phytoremediation of contaminated soils by heavy metals and PAHs:A brief review[J]. Environmental Technology & Innovation, 2017, 8: 309-326. |
| [7] |
陈良华, 徐睿, 张健, 等. 螯合剂对香樟生理特征和Cd积累效率的影响[J]. 云南大学学报(自然科学版), 2016, 38(1): 150-161. CHEN Liang-hua, XU Rui, ZHANG Jian, et al. The effects of chelator on physiological traits and Cd accumulation efficiency of Cinnamomum camphora[J]. Journal of Yunnan University(Natural Science), 2016, 38(1): 150-161. |
| [8] |
魏树和, 周启星. 重金属污染土壤植物修复基本原理及强化措施探讨[J]. 生态学杂志, 2004, 23(1): 65-72. WEI Shu-he, ZHOU Qi-xing. Discussion on basic principles and strengthening measures for phytoremediation of soils contaminated by heavy metals[J]. Chinese Journal of Ecology, 2004, 23(1): 65-72. DOI:10.3321/j.issn:1000-4890.2004.01.015 |
| [9] |
陈亚慧, 李君, 王明新, 等. EGTA和酒石酸对蓖麻Cd胁迫与积累的调控作用[J]. 西北植物学报, 2014, 35(9): 1025-1031. CHEN Ya-hui, LI Jun, WANG Ming-xin, et al. Regulation of EGTA and tartaric acid on Cd stress and accumunition in Ricinus communis L.[J]. Acta Botanica Boreali-Occidentalia Sinica, 2014, 35(9): 1025-1031. |
| [10] |
胡亚虎, 魏树和, 周启星, 等. 螯合剂在重金属污染土壤植物修复中的应用研究进展[J]. 农业环境科学学报, 2010, 29(11): 2055-2063. HU Ya-hu, WEI Shu-he, ZHOU Qi-xing, et al. Application of chelator in phytoremediation of heavy metals contaminated soils:A review[J]. Journal of Agro-Environment Science, 2010, 29(11): 2055-2063. |
| [11] |
李君, 葛跃, 王明新, 等. EGTA对Cd胁迫下蓖麻Cd积累和营养元素吸收的影响[J]. 西北植物学报, 2015, 35(9): 1855-1860. LI Jun, GE Yue, WANG Ming-xin, et al. Regulation of EGTA on Cd and nutrient elements accumulation in Ricinus Communis under Cd stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(9): 1855-1860. |
| [12] |
Hu Y H, Nan Z R, Su J Q, et al. Chelant-assisted uptake and accumulation of cd by poplar from calcareous arable soils around Baiyin nonferrous metal smelters, Northern China[J]. Arid Soil Research & Rehabilitation, 2014, 28(3): 340-354. |
| [13] |
Wang S, Liu J. The effectiveness and risk comparison of EDTA with EGTA in enhancing Cd phytoextraction by Mirabilis jalapa L.[J]. Environmental Monitoring and Assessment, 2014, 186(2): 751-759. |
| [14] |
Parmar P, Kumari N, Sharma V. Structural and functional alterations in photosynthetic apparatus of plants under cadmium stress[J]. Botanical Studies, 2013, 54(1): 45. DOI:10.1186/1999-3110-54-45 |
| [15] |
Afshan S, Ali S, Bharwana S A, et al. Citric acid enhances the phytoextraction of chromium, plant growth, and photosynthesis by alleviating the oxidative damages in Brassica napus L.[J]. Environmental Science and Pollution Research, 2015, 22(15): 11679-11689. DOI:10.1007/s11356-015-4396-8 |
| [16] |
杨艳, 汪敏, 刘雪云, 等. 三种有机酸对Cd胁迫下油菜生理特性的影响[J]. 安徽师范大学学报(自然科学版), 2007(2): 158-162. YANG Yan, WANG Min, LIU Xue-yun, et al. Effects of organic acids on the growth of rape under Cd stress[J]. Journal of Anhui Normal University (Natural Science), 2007(2): 158-162. DOI:10.3969/j.issn.1001-2443.2007.02.015 |
| [17] |
董袁媛, 孙竹, 杨洋, 等. 镉胁迫对黄麻光合作用及镉积累的影响[J]. 核农学报, 2017, 31(8): 1640-1646. DONG Yuan-yuan, SUN Zhu, YANG Yang, et al. Effects of cadmium of photosynthesis and Cd accumulation of Corchorus capsularis L.[J]. Journal of Nuclear Agricultural Sciences, 2017, 31(8): 1640-1646. |
| [18] |
王玉富. 黄麻、红麻在重金属污染耕地修复中的应用研究进展[J]. 湖南农业科学, 2015(8): 49-52. WANG Yu-fu. Review of jute and kenaf application in remediation of arable lands contaminated by heavy metals[J]. Hunan Agricultural Sciences, 2015(8): 49-52. |
| [19] |
熊庆娥. 植物生理学实验教程[M]. 成都: 四川科学技术出版社, 2003: 52-124. XIONG Qing-e. Plant physiology[M]. Chengdu: Sichuan Science and Technology Press, 2003: 52-124. |
| [20] |
刘凤枝, 李玉浸. 土壤监测分析技术[M]. 北京: 化学工业出版社, 2015: 198-341. LIU Feng-zhi, LI Yu-jin. Soil monitoring and analysis technology[M]. Beijing: Chemical Industry Press, 2015: 198-341. |
| [21] |
张朝阳, 彭平安, 宋建中, 等. 改进BCR法分析国家土壤标准物质中重金属化学形态[J]. 生态环境学报, 2012, 21(11): 1881-1884. ZHANG Chao-yang, PENG Ping-an, SONG Jian-zhong, et al. Utilization of modified BCR procedure for the chemical speciation of heavy metals in Chinese soil reference material[J]. Ecology & Environmental Sciences, 2012, 21(11): 1881-1884. DOI:10.3969/j.issn.1674-5906.2012.11.019 |
| [22] |
刘铭, 刘凤枝, 刘保峰. 土壤中有效态铅和镉的测定[J]. 农业环境科学学报, 2007, 26(S1): 300-302. LIU Ming, LIU Feng-zhi, LIU Bao-feng. Determination of available lead and cadmium in soil[J]. Journal of Agro-Environment Science, 2007, 26(S1): 300-302. |
| [23] |
徐小逊, 董袁媛, 邓玉兰, 等. 镉胁迫对豨莶生长及光合作用相关参数的影响[J]. 农业环境科学学报, 2016, 35(9): 1672-1679. XU Xiao-xun, DONG Yuan-yuan, DENG Yu-lan, et al. Effects of cadmium stress on growth and photosynthetic parameters of Sigesbeckia orientalis L.[J]. Journal of Agro-Environment Science, 2016, 35(9): 1672-1679. |
| [24] |
Cay S, Uyanik A, Engin M S. EDTA supported phytoextraction of Cd from contaminated soil by four different ornamental plant species[J]. Journal of Soil Contamination, 2016, 25(3): 346-355. DOI:10.1080/15320383.2016.1138448 |
| [25] |
张磊. 螯合剂强化棉花对镉污染土壤修复的初步研究[J]. 水土保持学报, 2015, 29(4): 321-326. ZHANG Lei. Preliminary study on chelate-enhanced phytoremediation of cadmium-contami nated soil by cotton plants[J]. Journal of Soil and Water Conservation, 2015, 29(4): 321-326. |
| [26] |
陈英旭, 林琦, 陆芳, 等. 有机酸对铅、镉植株危害的解毒作用研究[J]. 环境科学学报, 2000, 20(4): 467-472. CHEN Ying-xu, LIN Qi, LU Fang, et al. Study on detoxication of organic acid to raddish under the stress of Pb and Cd[J]. Acta Scientiae Circumstantiae, 2000, 20(4): 467-472. DOI:10.3321/j.issn:0253-2468.2000.04.017 |
| [27] |
夏小燕, 杨丽琴, 翟福勤, 等. 有机酸对小麦幼苗镉毒的缓解作用[J]. 农业环境科学学报, 2007, 26(3): 990-995. XIA Xiao-yan, YANG Li-qin, ZHAI Fu-qin, et al. Organic acids alleviating the toxicity of Cd to young wheat plants[J]. Journal of AgroEnvironment Science, 2007, 26(3): 990-995. DOI:10.3321/j.issn:1672-2043.2007.03.036 |
| [28] |
Zaheer I E, Ali S, Rizwan M, et al. Citric acid assisted phytoremediation of copper by Brassica napus L.[J]. Ecotoxicology and Environmental Safety, 2015, 120: 310-317. DOI:10.1016/j.ecoenv.2015.06.020 |
| [29] |
张玉芬, 刘景辉, 杨彦明, 等. 柠檬酸和EDTA对蓖麻生理特性和镉累积的影响[J]. 生态与农村环境学报, 2015, 31(5): 760-766. ZHANG Yu-fen, LIU Jing-hui, YANG Yan-ming, et al. Effects of CA and EDTA on physiological characteristics and Cd accumulation of Ricinus communis[J]. Journal of Ecology and Rural Environment, 2015, 31(5): 760-766. |
| [30] |
胡国涛, 杨兴, 陈小米, 等. 速生树种竹柳对重金属胁迫的生理响应[J]. 环境科学学报, 2016, 36(10): 3870-3875. HU Guo-tao, YANG Xing, CHEN Xiao-mi, et al. Physiological responses of bamboo-willow plants to heavy metal stress[J]. Acta Scientiae Circumstantiae, 2016, 36(10): 3870-3875. |
| [31] |
王思予, 多立安, 赵树兰. 可降解螯合剂对草坪植物高羊茅发育及生理的影响[J]. 园艺学报, 2017, 44(11): 2186-2194. WANG Si-yu, DUO Li-an, ZHAO Shu-lan. Effects of biodegradable chelator on growth and physiology of Festuca arundinacea seedlings[J]. Acta Horticulturae Sinica, 2017, 44(11): 2186-2194. |
| [32] |
Huang C, Lai C, Xu P, et al. Lead-induced oxidative stress and antioxidant response provide insight into the tolerance of Phanerochaete chrysosporium to lead exposure[J]. Chemosphere, 2017, 187: 70-77. DOI:10.1016/j.chemosphere.2017.08.104 |
| [33] |
Zhao Y, Mao G, Hu H, et al. Effects of EDTA and EDDS on heavy metal activation and accumulation of metals by soybean in alkaline soil[J]. Journal of Soil Contamination, 2015, 24(4): 353-367. DOI:10.1080/15320383.2015.962125 |
| [34] |
Gao Y, Miao C, Xia J, et al. Effect of citric acid on phytoextraction and antioxidative defense in Solanum nigrum L. as a hyperaccumulator under Cd and Pb combined pollution[J]. Environmental Earth Sciences, 2015, 65(7): 1923-1932. |
| [35] |
Ehsan S, Ali S, Noureen S, et al. Citric acid assisted phytoremediation of cadmium by Brassica napus L.[J]. Ecotoxicology & Environmental Safety, 2014, 106: 164-172. |
| [36] |
熊国焕, 潘义宏, 何艳明, 等. 螯合剂对大叶井口边草Pb、Cd、As吸收性影响研究[J]. 土壤, 2012, 44(2): 282-289. XIONG Guo-huan, PAN Yi-hong, HE Yan-ming, et al. Chelate assisted uptake of heavy metal of lead, cadmium and arsenic from soil with Pteris cretica var. nervosa[J]. Soils, 2012, 44(2): 282-289. DOI:10.3969/j.issn.0253-9829.2012.02.017 |
| [37] |
张譞, 李晔, 胡进, 等. 三种螯合剂对土壤重金属Cd和Zn形态变化的研究[J]. 科学技术与工程, 2013, 13(21): 6184-6188. ZHANG Xuan, LI Ye, HU Jin, et al. Effects of three chelate on the form distribution of Cd and Zn in soil[J]. Science Technology and Engineering, 2013, 13(21): 6184-6188. DOI:10.3969/j.issn.1671-1815.2013.21.024 |
| [38] |
尹炳奎, 黄满红, 张大磊, 等. 菜籽饼施加对镉-铜污染土壤中重金属形态转化及其植物有效性的影响[J]. 环境工程学报, 2017, 11(6): 3879-3883. YIN Bing-kui, HUANG Man-hong, ZHANG Da-lei, et al. Effects of rapeseed cake on cadmium and copper forms and its phytoavailability in heavy metals contaminated paddy soil[J]. Chinese Journal of Environmental Engineering, 2017, 11(6): 3879-3883. |
| [39] |
郑明霞, 冯流, 刘洁, 等. 螯合剂对土壤中镉赋存形态及其生物有效性的影响[J]. 环境化学, 2007, 26(5): 606-609. ZHENG Ming-xia, FENG Liu, LIU Jie, et al. Effects of chelators on species and bioavailability of cadmium in soil[J]. Environmental Chemistry, 2007, 26(5): 606-609. DOI:10.3321/j.issn:0254-6108.2007.05.010 |
| [40] |
李永涛, 刘科学, 张池, 等. 广东大宝山地区重金属污染水田土壤的Cu Pb Zn Cd全量与DTPA浸提态含量的相互关系研究[J]. 农业环境科学学报, 2004, 23(6): 1110-1114. LI Yong-tao, LIU Ke-xue, ZHANG Chi, et al. Relationships between total and DTPA extractable contents of Cu, Pb, Zn, Cd in trace metalcontaminated paddy soils of Dabaoshan, Guangdong[J]. Journal of Agro-environmental Science, 2004, 23(6): 1110-1114. DOI:10.3321/j.issn:1672-2043.2004.06.018 |
| [41] |
Luo J, Cai L, Qi S, et al. Improvement effects of cytokinin on EDTA assisted phytoremediation and the associated environmental risks[J]. Chemosphere, 2017, 185: 386-393. DOI:10.1016/j.chemosphere.2017.07.036 |
 2019, Vol. 38
2019, Vol. 38