2. 四川农业大学食品学院, 四川 雅安 625014
2. College of Food Science, Sichuan Agricultural University, Ya′an 625014, China
近年来, 在国家一系列惠农政策的支持下, 集约化的畜禽养殖业发展迅速。集约化养殖在提高生产效率、降低死亡率方面起着重要作用[1-2], 但随规模养殖的增加而产生的大量畜禽粪便, 已成为我国最主要的农业面源污染源之一[3]。规模化蛋鸡场被认为是养禽业中的污染大户, 按成年蛋鸡每日产生0.1~0.16 kg的粪便计算, 仅全国蛋鸡每日就可产生14万t左右的粪便。如此大量的粪便为其处理带来了难题, 如果处理不当则可能造成严重的环境污染[4]。
由于一些重金属能够防治疾病, 促进畜禽生长, 如Cu、Mn和Zn在集约化养殖中得到了广泛使用, 然而这些微量元素使用存在超量添加的现象[5]。同时, 由于国内矿产资源多属伴生矿, 也引入了对动物和环境有害的Cd、Pb等重金属。研究表明, 重金属不能被畜禽完全吸收且化学性质稳定, 可随粪便排出体外, 若将粪便直接施用到农田土壤环境中, 可能造成土壤中重金属污染[6-8]。此外, 抗生素在畜禽养殖中的广泛和长期使用导致耐药细菌在肠道中积累, 并伴随粪便排泄出体外, 使粪便成为抗生素耐药菌和耐药基因的重要储存库。Yang等[9]研究发现鸡粪中存在大量耐药细菌, 其中Sphingobacterium, Myroides和Comamonas为主要的多重耐药细菌。由于耐药基因具有水平转移特性, 即便携带耐药基因的细菌死亡或裂解, 耐药基因仍然可以在不同环境中传播[10]。而重金属对抗生素耐药基因有长期选择压力, 加剧了耐药基因的污染[11]。
通过微生物堆肥发酵技术将鸡粪制成优质的生物肥料, 并将其施用到农田中是一种广泛应用的处理方式, 也是实现鸡粪减量化、无害化和资源化的有效方法之一[12]。鸡粪中含有丰富的有机质及大量农作物生长所必需的氮、磷、钾等元素, 堆肥后将其施用到农田中, 可保持土壤肥力, 促进农业可持续发展[3]。堆肥是利用微生物在一定条件下将复杂有机物分解为腐殖质, 并且在分解过程中产生高温杀死病原微生物、寄生虫等, 同时消减抗生素耐药基因, 最终达到无害化和资源化的目的[11, 13]。堆肥过程中的微生物菌系复杂, 由于可培养技术的局限性, 难以完全认识其中微生物群落组成及丰度情况。近年来, 微生物多样性高通量测序技术极大地推动了微生物群落的研究, 因此, 利用高通量测序技术研究鸡粪堆肥发酵中细菌群落结构及多样性变化, 可深入了解不同堆肥发酵阶段细菌菌群的组成及其演替过程。
目前, 国内外开展大量研究主要针对畜禽粪便处理中微生物群落结构组成情况、养分、重金属或抗生素耐药基因等单一因素进行考察, 缺乏对细菌群落结构、养分、重金属及抗生素耐药基因在畜禽粪便-生物处理全过程中的阶段性变化进行考察。此外, 大多数堆肥研究主要通过堆肥试验进行, 而针对实际生产中规模化堆肥处理产业中的样品研究较少。综上, 本研究以某规模化鸡粪处理厂中鲜鸡粪、堆肥发酵鸡粪为研究对象, 一方面研究养分、重金属及抗生素耐药基因在鸡粪堆肥过程中变化规律, 另一方面利用高通量测序技术研究鸡粪堆肥过程中细菌群落的演替规律, 分析细菌菌群与养分、重金属及抗生素耐药基因的相关性, 为实际生产过程中鸡粪的安全高效使用提供依据。
1 材料与方法 1.1 样品采集及前处理新鲜鸡粪及堆肥处理的鸡粪样品取自某规模化蛋鸡养殖场及其堆肥场(养殖规模 < 20万只)。将新鲜鸡粪(不含垫料)与麦麸、蔗渣按质量比5:3:2混匀后进行发酵, 其中麦麸的含水量为11.3%, 粗纤维含量为16.5%, 总灰分为31.8 g·kg-1, 蔗渣的pH值为5, 含水量为23.1%, 粗纤维含量为46.5%, 总碳含量为421 g·kg-1。发酵过程分为一次发酵和二次发酵, 其中一次发酵采用好氧发酵, 发酵14 d, 发酵槽宽度约为6 m, 高度约为1.5 m, 长度为80 m, 每日翻堆一次。经一次发酵后, 样品采用堆储发酵的方式进行二次发酵, 发酵约1个月, 锥形堆体直径和高约2~3 m。分别采集新鲜鸡粪(FM)、一次发酵样品(FC)及二次发酵样品(SC), 每一份样品平行采集3次, 充分混合均匀后得到FM样品3个、FC样品4个、SC样品5个。采集的样品一份室温风干后粉碎过2 mm筛, 用于理化指标检测[14]。一份于105℃烘干后粉碎过0.15 mm筛, 用于测定重金属[15-16]。一份放置于-80℃冰箱, 用于DNA提取。
1.2 养分测定pH值、全量氮磷钾测定方法参照鲁如坤的方法[17]。pH值采用电位法测定(水样比2.5:1)。样品经96% H2SO4和30% H2O2消煮后, 全氮采用凯氏定氮法测定, 全磷采用分光光度计法测定, 全钾采用火焰光度计法测定。有机质依据标准NY525-2012[18], 采用重铬酸钾容量法测定。
1.3 重金属测定全量重金属As、Cd、Cu、Mn、Pb及Zn的测定参照Sastrel等[19]和Hölzel等[16]的方法。取3 g样品放入250 mL消化管中, 加入28 mL 37% HCl与70% HNO3(VHCl: V HNO3=3:1), 摇匀后于室温下静置16 h, 随后将悬浊液于130℃消煮2 h。消煮后的悬浊液通过滤纸(Ash- less Whatman 41, UK)过滤后, 加入100 mL 0.5 mol·L−1 HNO3稀释待测。采用电感耦合等离子体发射光谱法(ICP-OES, Thermo iCAP 6000, UK)测定重金属含量。
1.4 样品总DNA的提取用Mobio Power Fecal DNA Isolation Kit试剂盒提取样品中细菌DNA, 具体步骤参照操作说明书。提取后的DNA置于-80℃保存。
1.5 抗生素耐药基因测定采用实时荧光定量PCR (Bio-rad iQ5 real time PCR dectection system, USA)对抗生素耐药基因进行检测。检测耐药基因包括sul1[20], ermB[21], blaCTXM[22], tetM[23], aac(6′)-Ib-cr(F-5′-CACCGGAAACATC- GCTGCA-3′; R-5′-AAGTTCCGCCGCAAGGCT-3′)。检测主要参照Chen等[24]和Zhu等[22]的方法, 按以下反应体系进行:10 μL SYBR Premix Ex Taq™, 上、下游引物各0.2 μmol·L-1, 1 μL模板, 加ddH2O补至20 μL。反应条件:95℃变性5 min; 95℃ 10 s, 退火温度20 s, 72℃ 30 s, 共40个循环; 荧光采集72℃; 熔点曲线温度设定范围为60~95℃。每个DNA样品重复3次。
1.6 PCR扩增及高通量测序选用16S rRNA V4区引物(520 F-5′-AYT- GGGYDTAAAGNG-3′; 802R-5′-TACNVGGGTATC- TAATCC-3′)对细菌DNA进行扩增。PCR扩增体系: 98℃预变性3 min; 98℃ 15 s, 50℃ 30 s, 72℃ 30 s, 共26个循环; 最后72℃延伸5 min; 12℃结束反应, 最后采用2%琼脂糖凝胶电泳检测。将检测合格的DNA送于上海派森诺生物科技有限公司采用Illumina Miseq测序平台进行高通量测序。
1.7 数据分析高通量测序数据经拼接、过滤、比对处理, 得到最终的有效数据(Effective tags)[25]。利用Uparse软件[26]对有效数据进行OTUs (Operational Taxonomic Units)聚类。用Mothur方法与SILVA的SSUrRNA数据库[27]对OTUs代表序列进行物种注释分析, 获得对应物种信息及在各个分类水平[28]物种丰度情况。对样品使用Qiime软件计算Alpha多样性指数, 进行Alpha多样性指数组间差异分析。使用R软件绘制PCoA图, 对不同样品和分组的群落结构差异进行分析。使用LEfSe软件绘制LEfSe图, 默认设置LDA Score的筛选值为4, 分析不同分组间物种差异[29]。使用R软件进行Spearman分析, 研究细菌菌群组成与环境因子(理化指标、重金属和耐药基因)之间的相关性。采用SPSS软件进行单因素方差分析(ANOVA), 对各环境因子在各分组间进行差异显著性检验(P < 0.05)。
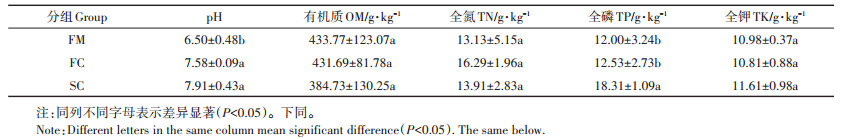
2 结果与分析 2.1 堆肥过程中养分变化情况如表 1所示, 随堆肥进程, pH值、全磷、全钾和全氮含量有不同程度增加, 有机质含量呈下降趋势。其中, pH值在堆肥后(组FC和SC)显著高于在鲜鸡粪中(组FM)(P < 0.05), 全磷含量在二次发酵后(组SC)显著升高(P < 0.05)。全氮含量在组FC中最高(16.29 g·kg-1), 但与其他组全氮含量无显著差异(P > 0.05)。
|
|
表 1 堆肥过程中养分的变化 Table 1 Variation of nutrients during composting |
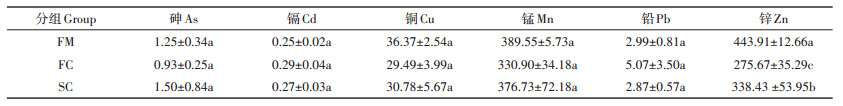
共检测了6种重金属的浓度(表 2), 结果显示不同重金属的浓度差异较大, 其中Zn和Mn浓度最高, 分别为275.67~443.91 mg·kg-1和330.90~389.55 mg·kg-1, Cd浓度最低, 为0.25~0.29 mg·kg-1。同一重金属在不同组中的浓度呈波动变化, 与组FM相比, As、Cd浓度在组SC中升高, Cu、Mn、Pb和Zn在组SC中下降, 但除Zn以外, 其他重金属浓度的组间差异并不显著(P > 0.05)。
|
|
表 2 堆肥过程中重金属浓度变化(mg·kg-1) Table 2 Variation of heavy metals during composting (mg·kg-1) |
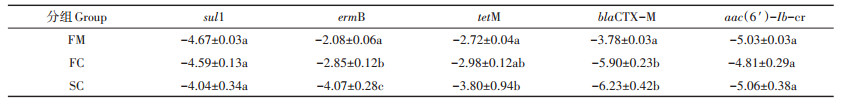
检测了抗生素耐药基因sul1(磺胺类)、ermB (大环内酯类)、tetM (四环素类)、blaCTX-M (β-内酰胺类)和aac(6′)-Ib-cr (氨基糖苷类)的相对表达量(按照以10为底的对数转化后进行分析)。如表 3所示, 在鲜鸡粪中(组FM), 耐药基因的相对丰度值范围为-5.03~ -2.08, 各耐药基因的相对丰度值大小依次为:ermB > tetM > blaCTX-M > sul1 > aac(6′)-Ib-cr。在堆肥过程中, 除基因sul1, 其他基因的相对丰度均呈现不同程度的下降趋势, 其中基因tetM、ermB、blaCTX-M从组FM到SC显著降低了1.08、1.99、2.78个数量级(P < 0.05)。
|
|
表 3 堆肥过程中抗生素耐药基因的变化 Table 3 Variation of antibiotic resistance genes during composting |
对12个混合样品进行高通量测序分析, 共获得552 204条有效序列。将OTU按97%相似度聚类后得到3060个OTUs, 在不同分组中共有OTU数为694, 在组FM、FC和SC中OTU数呈现先减少后增加的趋势, 分别为2365、1974和2373。再通过系统发育分析得2界39门73纲140目236科501属。
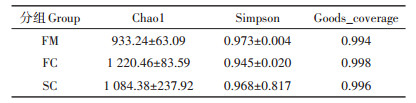
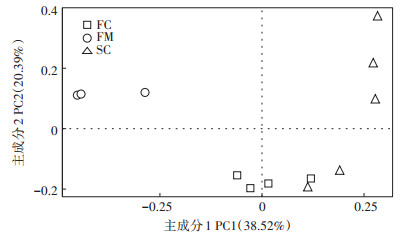
对各组菌群的Chao 1指数和Simpson指数及goods_coverage指数进行计算, 根据表 4可见, Chao1指数在各组中大小为:FC > SC > FM, 表明在发酵后样品中细菌丰富度升高。Simpson指数在各组中大小为:FM > SC > FC。表明发酵后样品中细菌多样性升高。各组中goods_coverage均超过0.99, 说明样品文库的覆盖率较高。对样品进行主坐标分析(PcoA, Unweighted), 以了解堆肥过程中细菌菌群结构的变化。由图 1可得, FM组中样品与FC组和SC组样品距离较远, 而SC组中有2个样品与FC组距离较近。结果表明发酵后的细菌群落结构相较于新鲜鸡粪中发生了明显改变, 而在发酵过程中(组FC和SC)的细菌群落结构有部分相似。
|
|
表 4 堆肥过程中细菌群落多样性指数 Table 4 Diversity index of bacterial community during composting |
|
图 1 堆肥过程中细菌群落多样性的主坐标分析 Figure 1 Principal Co-ordinates Analysis (PCoA) of bacterial community diversity during composting |
|
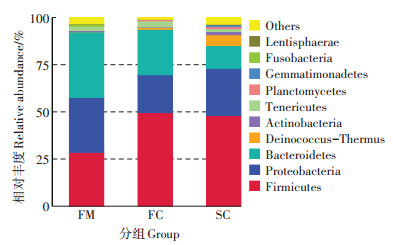
图 2 门水平各组中细菌相对丰度情况 Figure 2 Relative abundance of bacterial at phylum level in each group |
在门分类水平上, 组FM、FC和SC中分别检测到22、26个和32个门。物种相对丰度前10的菌门如图 2所示。在三个组中, 均以厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)3个菌门为主, 厚壁菌门呈现上升趋势、拟杆菌门呈现下降趋势。厚壁菌门的相对丰度在组FC中相对丰度最高(49.63%), 其次为组SC (48.02%)和FM (28.52%), 变形菌门在组FM中相对丰度最高(29.10%), 其次为组SC (25.02%)和FC (20.06%), 拟杆菌门在组FM中相对丰度最高(34.89%), 其次为FC (24.06%)和SC (12.08%)。
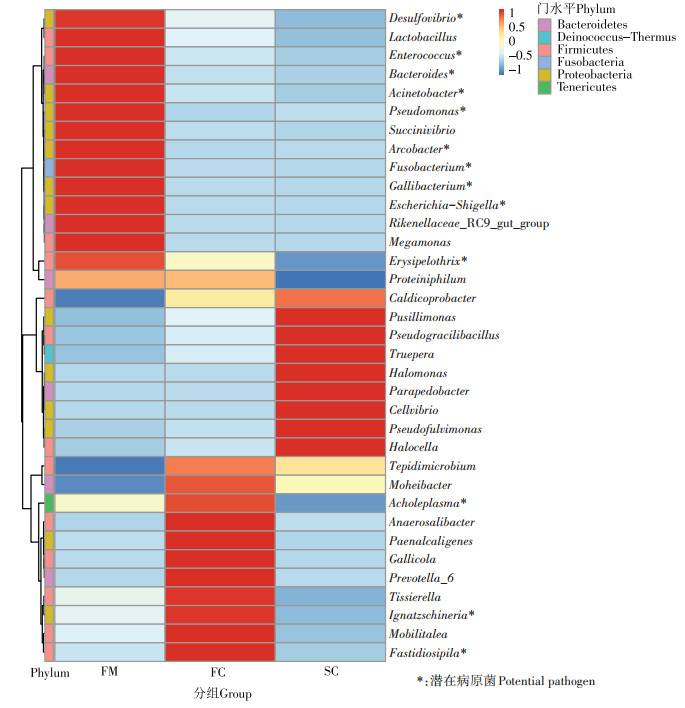
在属分类水平上, 组FM、FC和SC中分别检测到262、338个和380个属, 相对丰度前35的物种如图 3所示, 各组具有不同的优势物种。在组FM、FC和SC中, 分别有15、9种和11种物种的相对丰度高于其他组。其中, 组FM中相对丰度前五的物种为拟杆菌属(Bacteroides)(20.92%)、不动杆菌属(Acinetobacter) (7.50%)、假单胞菌属(Pseudomonas)(4.31%)、理研菌属(Rikenellaceae_RC9_gut_group)(3.35%)和乳杆菌属(Lactobacillus)(3.15%), 组FC中为普氏菌属(Prevotella_6)(12.44%)、依格纳季氏菌属(Ignatzschineria) (10.74%)、Caldicoprobacte(3.72%)、无胆甾原体属(Acholeplasma)(3.06%)和Paenalcaligenes(2.16%), 组SC中为盐胞菌属(Halocella)(8.14%)、假纤细芽孢杆菌属(Pseudogracilibacillus)(5.87%)、特吕珀菌属(Truepera)(5.74%)、Caldicoprobacter(5.44%)和极小单胞菌属(Pusillimonas)(3.12%)。对样品中潜在病原菌菌属进行分析, 结果发现, Bacteroides、Acinetobacter和Pseudomonas等13个菌属在鲜鸡粪中有较高的丰度, 总相对丰度为50.70%。堆肥发酵后, 病原菌丰度逐渐降低, 在组FC和SC中为19.58%和2.97%。
|
图 3 属水平各组中细菌相对丰度情况 Figure 3 Relative abundance of bacterial at genus level in each group |
对各分组样品进行LEfSe (LDA Effect Size)分析(P < 0.05, LDA > 4), 结果显示从门水平到属水平, 共有53个物种具有组间显著差异(图 4), 包括1门6纲11目19科16属。其中, 在组FC中显著富集的物种最少, 共9个, 而在组FM中显著富集的物种最多, 为25个。在门水平上, Deinococcus_Thermus在组SC中的相对丰度显著高于其他组。在属水平上, 共有8个菌属的相对丰度在组FM中显著较高, 除Lactobacillus、Rikenellaceae_RC9_gut_group和Megamonas外, 还包括病原菌属Bacteroides、Acinetobacter、Escherichia_Shigella、Enterococcus和Desulfovibrio。在FC组中菌属Prevotella_6、Mobilitalea及病原菌属Ignatzschineria显著较高。在SC组中具有显著差异的菌属包括Halocella、Truepera、Pseudogracilibacillus、Caldicoprobacter和Pusillimonas。结果表明, 大量病原菌属在组FM中显著高于组SC, 说明堆肥能显著降低病原菌的相对丰度。
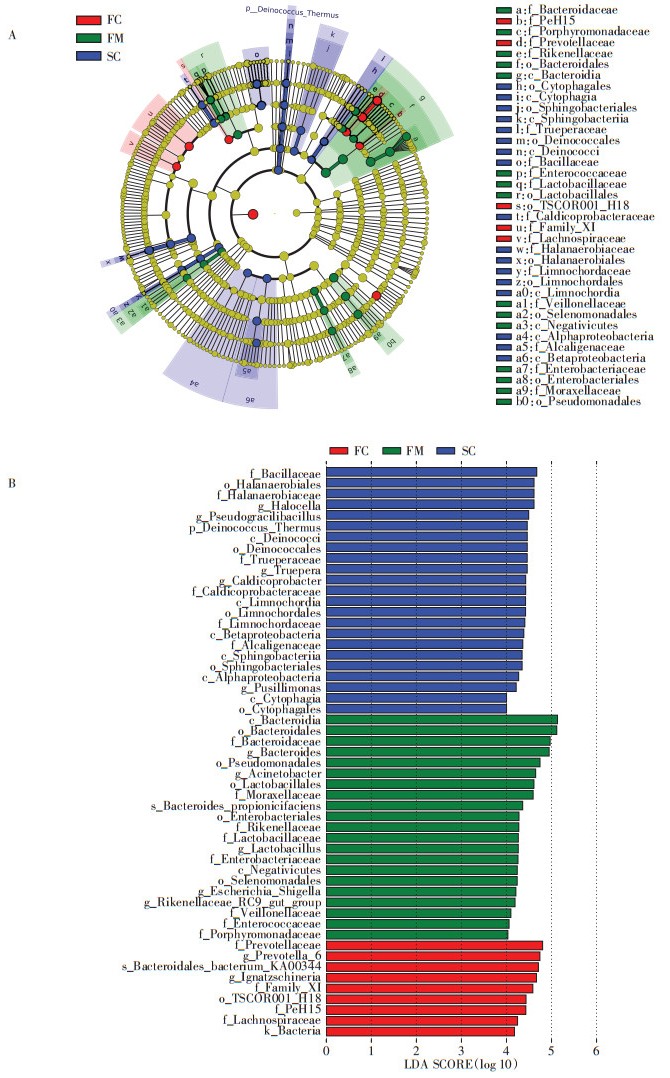
|
图 4 不同分组中差异物种进化分支图(A)和柱状图(B) Figure 4 Cladogram (A) and histogram (B) of taxon with statistical difference in different groups |
通过Spearman相关分析研究细菌丰度(属水平)和环境因子之间的显著相关性(P < 0.05或 < 0.01)。如表 5所示, 不同养分指标、重金属和耐药基因均与部分细菌丰度有显著相关性, 在养分指标中, 与全磷和pH有显著相关性的细菌数量较多, 其中, 全磷和pH与Bacteroides、Escherichia.Shigella、Lactobacillus、Enterococcus、Megamonas和Desulfovibrio呈显著负相关, 与Ureibacillus呈显著正相关。在重金属中, 部分细菌与Cr、Cu和Mn有显著正相关或负相关, 与Cd有显著正相关, 与Pb和Zn有显著负相关。其中, Halocella、Caldicoprobacter和Tepidimicrobium与Cu、Mn和Zn均呈显著负相关, Cellvibrio与Cu和Mn均呈显著正相关。在耐药基因中, 基因sul1、ermB、tetM和blaCTX-M与大部分细菌有显著正相关或负相关。其中, Bacteroides、Rikenellaceae_RC9_gut_group、Lactobacillus、Enterococcus、Megamonas和Desulfovibrio与ermB、tetM和blaCTX-M均呈显著正相关, 而与sul1呈显著正相关。此外, 基因aac(6′)-Ib-cr只与Psychrobacter有显著正相关性。对病原菌属与环境因子之间的显著相关性研究发现, 病原菌属与重金属Cd和Cr、pH和TP、耐药基因sul1呈显著负相关, 与耐药基因ermB、tetM和blaCTX-M呈显著正相关(P < 0.05)。
|
|
表 5 细菌菌属的丰度与环境因子的相关性 Table 5 The correlations between bacterial at genus level and environment factor |
本实验堆肥过程中的pH值为7.58(FC)和7.91 (SC), 处于堆肥微生物有较高的活性时所需的pH值(6.7~9.0)范围内[30]。堆肥后, 有机质含量下降, 这主要是由微生物降解、利用有机物, 如糖类、脂肪和氨基酸等造成的[12, 31]。与鲜鸡粪(组FM)相比, 全磷、全氮和全钾的含量在二次发酵后(组SC)有不同程度的增加, 这与刘微等[3]研究结果相似, 主要是由于堆体总质量下降, 物料的"相对浓缩"作用所导致。从组FM到SC, 全氮含量有所下降, 这与有机氮分解释放出挥发性氨气, 造成氮素损失有关[31]。
由于重金属在堆肥过程中不可降解, 因此将鸡粪作为堆肥原料时, 鸡粪中的重金属含量是影响有机肥中重金属含量的重要因素[8]。各种重金属含量在堆肥过程中有波动变化, 由于堆肥过程中, 有机质降解及挥发性物质损失, 使堆体中干物质总量不断减少, 产生的"浓缩效应"使重金属含量升高。此外, 部分重金属浓度在组FC中低于组FM, 尤其是Zn, 这是由于组FM中堆肥辅料的添加对部分重金属造成的稀释作用。根据2012年原农业部发布的有机肥行业标准(NY 525-2012)对As、Pb和Cd的限量值(15, 50 mg·kg-1和3 mg·kg-1)[18], 本研究中经二次发酵后样品中As、Pb和Cd含量均不超标, 参照德国腐熟堆肥中部分重金属限量标准(Cu ≤100 mg·kg-1, Zn≤400 mg·kg-1, Cd≤1.5 mg·kg-1, Pb≤150 mg·kg-1)[32], 经二次发酵后样品中Cu、Zn、Cd和Pb浓度均不超标。此外, Zn、Mn和Cu在鸡粪中浓度较高, 这与其在饲料中大量添加有关[8], 同时也说明饲料中重金属添加量不同导致鸡粪中重金属浓度有较大差异。
本实验中不同抗生素耐药基因在鲜鸡粪中的相对丰度有差异, 研究表明不同抗生素耐药基因的相对丰度存在很大差异, Cui等[33]发现在鸡粪堆肥发酵时, 磺胺类耐药基因比四环素类耐药基因相对丰度更高, 与本实验结果不一致, 这与不同地区抗生素的使用类型和使用量相关[11]。经过堆肥发酵后, 除基因sul1, 其他基因的相对丰度均呈现不同程度的下降趋势。相似地, Wang等[34]研究发现在猪粪堆肥发酵过程中, 大部分耐药基因的相对丰度有所降低, 而基因tetA的相对丰度呈上升趋势, 对抗生素耐药基因的削减作用与堆肥原料和堆肥方式有关。此外, 研究表明在堆肥发酵过程中, 堆体温度升高可杀灭部分耐药基因宿主细菌, 同时抑制耐药基因在细菌之间的水平转移, 从而降低耐药基因的丰度[35]。
3.2 堆肥过程中细菌群落演替情况本研究采用Illumina Miseq高通量测序技术对新鲜鸡粪及堆肥处理的鸡粪中细菌菌群进行分析, 结果显示在堆肥发酵后细菌多样性增加, 这主要是由于采样时堆体温度已下降, 堆肥发酵的环境、堆肥辅料的添加有利于细菌生长造成的[36-37]。在三个组中, 均以Firmicutes、Proteobacteria和Bacteroidetes为主要菌门, 并随发酵过程的进行各菌门相对丰度发生变化, 这与相关文献的研究结果一致。Cui等[33]通过高通量测序技术研究了三种不同的鸡粪堆肥发酵工艺, 发现在不同的发酵阶段中均以Firmicutes、Proteobacteria和Bacteroidetes 3个菌门为主, 其相对丰度随发酵过程发生变化, 所占比例为72.4%~93.46%。Song等[36]利用DGGE技术, 检测到鸡粪发酵过程中, 以Fir- micutes、Proteobacteria和Bacteroidetes 3个菌门为主。在属水平, 各组中的优势菌属组成不同, 表明随着堆肥发酵的进行, 细菌群落结构发生演替。这与其他方式的鸡粪堆肥发酵中细菌群落演替规律类似[38]。
畜禽粪便是病原微生物的主要载体[39], 本研究发现鸡粪中存在多种病原菌属。其中, Bacteroides可引起人、动物腹泻及动物子宫炎等疾病的发生[40-41]。Acinetobacter属中的A.Baumannii、A.Pittii、A.nosocomialis和A.seifertii为常见的院内感染菌, A.Baumannii可引起医院感染疾病的爆发[42], 尤其易导致脑膜炎等疾病的发生[43-44]。Pseudomonas使人、动物和植物都可能致病, 可引起人尿路、耳道、肺部感染和菌血症等疾病[45], 同时也导致柑橘属果树易患柑桔枯萎病[46]。随堆肥发酵进行, 所有病原菌的相对丰度均有效降低。进一步利用LEfSe分析各组中显著差异的病原菌, 发现Bacteroides、Acinetobacter、Escherichia-Shigella和Enterococcus在组FM中显著较高(P < 0.05), 也说明通过堆肥发酵能显著降低以上病原菌的相对丰度。其他研究结果也表明堆肥发酵过程中产生的高温能有效杀灭病原菌, 降低病原菌随有机肥进入土壤的风险[47-48]。
3.3 环境因子与细菌菌群的关系对属水平细菌相对丰度与养分、重金属和耐药基因间的相关性分析发现, 大部分优势菌属与全磷和pH有显著相关性, 表明全磷和pH可能是影响细菌丰度的重要影响因子。由于大多数微生物细胞内pH值通常接近中性值, 细胞外的pH值的变化会对细菌产生压力[49]。因此, pH值也是细菌多样性和群落结构组成的重要影响因子[50], 进而对堆肥过程产生影响[51]。重金属Cd、Cr、Cu和Mn与部分优势菌属有显著相关性, 其中Truepera、Limnochorda、Simiduia和Cd, Parapedobacter、Galbibacter和Cr, 以及Cellvibrio和Cu、Mn均呈显著正相关, 说明这些菌对重金属具有吸附性、耐受性或减小毒性损伤的特点。目前, 研究表明对重金属具有吸附或耐受性的细菌存在于不同环境中, 可以缓解重金属毒性、修复重金属污染[52-53]。Kamika等[54]发现Pseudomonas putida和Bacillus licheniformis通过生物吸附和富集作用, 可有效治理废水中重金属Co、Ni、Mn、Pb、Ti、Cu、Al和Zn污染。此外, 景炬辉等[55]研究发现在尾矿废弃地中鞘脂单胞菌科相对丰度与重金属浓度显著正相关, 该科细菌对重金属具有一定的耐受性, 可作为重金属污染区域生态恢复的理想菌种。
研究发现部分菌属与检测耐药基因有显著正相关性, 提示这些菌属为耐药基因的宿主菌, 与耐药基因的富集有关, 可导致耐药基因的广泛传播。其中, 潜在病原菌属Bacteroides、Enterococcus和Desulfovibrio与基因ermB、tetM和blaCTX-M均呈显著正相关, Acinetobacter、Escherichia_Shigella和Arcobacter与基因ermB和blaCTX-M均呈显著正相关(P < 0.05)。若这些具有耐药性的病原菌不经有效堆肥处理, 则很有可能随施肥进入食物链, 进而严重威胁人体健康。越来越多研究者发现畜禽粪便中病原菌和耐药基因存在一定的正相关, 并出现多重耐药的趋势。Fang等[56]发现鸡粪中病原菌携带大量耐药基因, 其优势病原菌属Bacillus anthracis、Bordetella pertussis和B.Anthracis与基因sul1呈显著正相关。在猪粪堆肥发酵过程中, Acinetobacter、Escherichia与基因tetX呈显著正相关, 同时, 经过堆肥发酵后, 病原菌相对丰度的降低也是使耐药基因相对丰度降低的原因之一[34]。
4 结论(1) 鸡粪堆肥过程中, 不同重金属的浓度差异较大, 其中Zn和Mn浓度最高, Cd浓度最低。参照相关标准, 堆肥后(组SC)样品中重金属浓度均不超标。
(2) 不同抗生素耐药基因在鲜鸡粪(组FM)中的相对丰度有差异, 范围为-5.03~-2.08。堆肥发酵过程能有效降低耐药基因相对丰度, 堆肥后(组SC), 基因tetM、ermB、blaCTX-M显著降低了1.08、1.99、2.78个数量级(P < 0.05)。
(3) 鸡粪堆肥过程中细菌群落结构变化显著, 在属水平各组具有不同的优势物种。堆肥发酵过程能有效降低病原菌相对丰度, 从50.70%(组FM)降低至2.97%(组SC)。
(4) 环境因子对于细菌菌群丰度具有显著影响(P < 0.05)。其中, 部分细菌与重金属呈显著正相关性, 提示这些细菌对重金属具有吸附性或耐受性。部分潜在病原菌与耐药基因呈显著正相关, 提示这些病原菌属为耐药基因的宿主菌。
| [1] |
Zhang D D, Lin L F, Luo Z X, et al. Occurrence of selected antibiotics in Jiulongjiang River in various seasons, South China[J]. Journal of Environmental Monitoring, 2011, 13(7): 1953-1960. DOI:10.1039/c0em00765j |
| [2] |
黄灿, 李季. 添加剂在减少畜禽粪便污染中的应用与发展前景[J]. 农业环境科学学报, 2006, 25(增刊): 787-791. HUANG Can, LI Ji. Reduction of pollution from livestock manure by application of additives[J]. Journal of Agro-Environment Science, 2006, 25(Suppl): 787-791. |
| [3] |
刘微, 霍荣, 张津, 等. 生物质炭对番茄秸秆和鸡粪好氧堆肥氮磷钾元素变化的影响及其机理[J]. 水土保持学报, 2015, 29(3): 289-294. LIU Wei, HUO Rong, ZHANG Jin, et al. Effects of biochar on N, P and K transformation of tomato straw and chicken manure composting and mechanisms[J]. Journal of Soil and Water Conservation, 2015, 29(3): 289-294. |
| [4] |
Guo X Y, Hao L J, Qiu P Z, et al. Pollution characteristics of 23 veterinary antibiotics in livestock manure and manure-amended soils in Jiangsu Province, China[J]. Journal of Environment Science and Health, B, 2016, 51(6): 383-392. DOI:10.1080/03601234.2016.1142743 |
| [5] |
Vacchina V, Ionescu C, Oguey S, et al. Determination of Zn-, Cu- and Mn-glycinate complexes in feed samples and in-vitro and in vivo assays to assess their bioaccessibility in feed samples[J]. Talanta, 2013, 113: 14-18. DOI:10.1016/j.talanta.2013.03.083 |
| [6] |
Sarmah A K, Meyer M T, Boxall A B. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics (VAs) in the environment[J]. Chemosphere, 2006, 65: 725-759. DOI:10.1016/j.chemosphere.2006.03.026 |
| [7] |
Zhang F, Li Y, Yang M, et al. Content of heavy metals in animal feeds and manures from farms of different scales in northeast China[J]. International Journal of Environment Research and Public Health, 2012, 9(8): 2658-2668. DOI:10.3390/ijerph9082658 |
| [8] |
Yang X P, Li Q, Tang Z, et al. Heavy metal concentrations and arsenic speciation in animal manure composts in China[J]. Waste Management, 2017, 64: 333-339. DOI:10.1016/j.wasman.2017.03.015 |
| [9] |
Yang Q X, Wang R F, Ren S W, et al. Practical survey on antibiotic-resistant bacterial communities in livestock manure and manure-amended soil[J]. Journal of Environmental Science and Health, 2016, 51: 14-23. DOI:10.1080/03601234.2015.1080481 |
| [10] |
田甜甜, 王瑞飞, 杨清香. 抗生素耐药基因在畜禽粪便-土壤系统中的分布、扩散及检测方法[J]. 微生物学通报, 2016, 43(8): 1844-1853. TIAN Tian-tian, WANG Rui-fei, YANG Qing-xiang. Distribution, spread and detection methods of antibiotic resistance genes in livestock manure and soil system[J]. Microbiology China, 2016, 43(8): 1844-1853. |
| [11] |
张俊亚, 魏源送, 陈梅雪, 等. 畜禽粪便生物处理与土地利用全过程中抗生素和重金属抗性基因的赋存与转归特征研究进展[J]. 环境科学学报, 2015, 35(4): 935-946. ZHANG Jun-ya, WEI Yuan-song, CHEN Mei-xue, et al. Occurence and fate of antibiotic and heavy metal resistance genes in the total process of biological treatment and land application of animal manure:A review[J]. Acta Scientiae Circumstantiae, 2015, 35(4): 935-946. |
| [12] |
黄川, 黄珊, 李家祥. 不同堆肥方式对鸡粪与秸秆混合堆肥效果[J]. 环境工程学报, 2013, 7(10): 4090-4096. HUANG Chuan, HUANG Shan, LI Jia-xiang. Effect of different composting models on co-composting chicken manure and maize straw[J]. Chinese Journal of Environment Engineering, 2013, 7(10): 4090-4096. |
| [13] |
张园, 耿春女, 何承文, 等. 堆肥过程中有机质和微生物群落的动态变化[J]. 生态环境学报, 2011, 20(11): 1745-1752. ZHANG Yuan, GENG Chun-nv, HE Cheng-wen, et al. Dynamics of organic matters and microbial population during aerobic composting process[J]. Ecology and Environment, 2011, 20(11): 1745-1752. DOI:10.3969/j.issn.1674-5906.2011.11.028 |
| [14] |
Ye D H, Li T X, Yu H Y, et al. P accumulation of Polygonum hydropiper, soil P fractions and phosphatase activity as affected by swine manure[J]. Applied Soil Ecology, 2015, 86: 10-18. DOI:10.1016/j.apsoil.2014.10.002 |
| [15] |
王飞, 赵立欣, 沈玉君, 等. 华北地区畜禽粪便有机肥中重金属含量及溯源分析[J]. 农业工程学报, 2013, 29(19): 202-208. WANG Fei, ZHAO Li-xin, SHEN Yu-jun, et al. Analysis of heavy metal contents and source tracing in organic fertilizer from livestock manure in North China[J]. Transactions of the CSAE, 2013, 29(19): 202-208. DOI:10.3969/j.issn.1002-6819.2013.19.025 |
| [16] |
Hölzel C S, Müller C, Harms K S, et al. Heavy metals in liquid pig manure in light of bacterial antimicrobial resistance[J]. Environmental Research, 2012, 113: 21-27. DOI:10.1016/j.envres.2012.01.002 |
| [17] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科学出版社, 1999: 296-338. LU Ru-kun. Methods of soil agricultural chemistry analysis[M]. Beijing: Chinese Agricultural Science and Technology Press, 1999: 296-338. |
| [18] |
中华人民共和国农业部.中华人民共和国农业行业标准: 有机肥料NY 525-2012[S].北京: 中国农业出版社, 2012. The Ministry of Agriculture of the people's Republic of China. Standards of agriculture industry of the people's Republic of China: Organic fertilizer NY 525-2012[S]. Beijing: Chinese Agricultural Press, 2012. |
| [19] |
Sastre J, Sahuquillo A, Vidal M. Determination of Cd, Cu, Pb and Zn in environmental samples microwave-assisted total digestion versus aqua regia and nitric acid extraction[J]. Analytica Chimica Acta, 2002, 462: 59-72. DOI:10.1016/S0003-2670(02)00307-0 |
| [20] |
Luo Y, Mao D Q, Rysz M, et al. Trends in antibiotic resistance genes occurrence in the Haihe River, China[J]. Environmental Science & Technology, 2010, 44(19): 7220-7225. |
| [21] |
Knapp C W, Dolfing J, Ehlert P A I, et al. Evidence of increasing antibiotic resistance gene abundances in archived soils since 1940[J]. Environmental Science & Technology, 2010, 44: 580-587. |
| [22] |
Zhu Y G, Johnson T A, Su J Q, et al. Diverse and abundant antibiotic resistance genes in Chinese swine farms[J]. Proceedings of the National Academy of Sciences, USA, 2013, 110: 3435-3440. DOI:10.1073/pnas.1222743110 |
| [23] |
Aminov R, Garrigues-Jeanjean N, Mackie R. Molecular ecology of tetracycline resistance:Development and validation of primers for detection of tetracycline resistance genes encoding ribosomal protection proteins[J]. Applied and Environmental Microbiology, 2001, 67(1): 22-32. |
| [24] |
Chen H, Zhang M M. Occurrence and removal of antibiotic resistance genes in municipal wastewater and rural domestic sewage treatment systems in eastern China[J]. Environment International, 2013, 55: 9-14. DOI:10.1016/j.envint.2013.01.019 |
| [25] |
Bokulich N A, Subramanian S, Faith J J, et al. Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing[J]. Nature Methods, 2013, 10: 57-59. DOI:10.1038/nmeth.2276 |
| [26] |
Edgar R C. UPARSE:Highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10: 996-998. DOI:10.1038/nmeth.2604 |
| [27] |
Quast C, Pruesse E, Yilmaz P, et al. The SILVA ribosomal RNA gene database project:Improved data processing and web-based tools[J]. Nucleic Acids Research, 2013, 41: D590-D596. |
| [28] |
Wang Q, Garrity G M, Tiedje J M, et al. Naive bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267. DOI:10.1128/AEM.00062-07 |
| [29] |
White J R, Niranjan N, Mihai P. Statistical methods for detecting differentially abundant features in clinical metagenomic samples[J]. PLoS Computational Biology, 2009, 5(4): e1000352.. DOI:10.1371/journal.pcbi.1000352 |
| [30] |
宋彩红, 贾璇, 李鸣晓, 等. 沼渣与畜禽粪便混合堆肥发酵效果的综合评价[J]. 农业工程学报, 2013, 29(24): 227-234. SONG Cai-hong, JIA Xuan, LI Ming-xiao, et al. Comprehensive evaluation of co-composting fermentation effect of biogas residue mixed with livestock manure[J]. Transactions of the CSAE, 2013, 29(24): 227-234. DOI:10.3969/j.issn.1002-6819.2013.24.030 |
| [31] |
王亚飞, 李梦婵, 邱慧珍, 等. 不同畜禽粪便堆肥的微生物数量和养分含量的变化[J]. 甘肃农业大学学报, 2017, 3: 37-45. WANG Ya-fei, LI Meng-chan, QIU Hui-zhen, et al. Changes of microbial quantity and nutrient content in different composting livestock manure[J]. Journal of Gansu Agricultural University, 2017, 3: 37-45. |
| [32] |
Verdonck O, Szmidt R A K. Compost specifications[J]. Acta Horticulturae, 1998, 469: 169-177. |
| [33] |
Cui E, Wu Y, Zuo Y, et al. Effect of different biochars on antibiotic resistance genes and bacterial community during chicken manure composting[J]. Bioresource Technology, 2016, 203: 11-17. DOI:10.1016/j.biortech.2015.12.030 |
| [34] |
Wang R, Chen M X, Feng F, et al. Effects of chlortetracycline and copper on tetracyclines and copper resistance genes and microbial community during swine manure anaerobic digestion[J]. Bioresource Technology, 2017, 238: 57-69. DOI:10.1016/j.biortech.2017.03.134 |
| [35] |
Qian X, Gu J, Sun W, et al. Diversity, abundance, and persistence of antibiotic resistance genes in various types of animal manure following industrial composting[J]. Journal of Hazardous Materials, 2018, 344: 716-722. DOI:10.1016/j.jhazmat.2017.11.020 |
| [36] |
Song C, Li M X, Jia X, et al. Comparison of bacterial community structure and dynamics during the thermophilic composting of different types of solid wastes:Anaerobic digestion residue, pig manure and chicken manure[J]. Microbial Biotechnology, 2014, 7: 424-433. DOI:10.1111/1751-7915.12131 |
| [37] |
邓晓, 李勤奋, 侯宪文, 等. 添加甘蔗渣对香蕉杆堆肥化过程中微生物种群的影响[J]. 中国农学通报, 2009, 25(15): 125-130. DENG Xiao, LI Qin-fen, HOU Xian-wen, et al. Effect of adding bagasse on the microbial community during the composting process of banana straw[J]. Chinese Agricultural Science Bulletin, 2009, 25(15): 125-130. |
| [38] |
徐江兵, 王艳玲, 罗小三, 等. 纳米氧化锌对堆肥过程中细菌群落演替的影响[J]. 应用与环境生物学报, 2017, 23(6): 1166-1171. XU Jiang-bing, WANG Yan-ling, LUO Xiao-san, et al. Influence of zinc oxide nanoparticles on the succession of bacterial communities during the composting process[J]. Chinese Journal of Applied and Environmental Biology, 2017, 23(6): 1166-1171. |
| [39] |
国辉, 袁红莉, 耿兵, 等. 牛粪便资源化利用的研究进展[J]. 环境科学与技术, 2013, 36(5): 68-75. GUO Hui, YUAN Hong-li, GENG Bing, et al. Research progress in resource utilization of cattle manure[J]. Environment Science & Technology, 2013, 36(5): 68-75. DOI:10.3969/j.issn.1003-6504.2013.05.014 |
| [40] |
Nakano V, Gomes D A, Arantes R M, et al. Evaluation of the pathogenicity of the Bacteroides fragilis toxin gene subtypes in gnotobiotic mice[J]. Current Microbiology, 2006, 53: 113-117. DOI:10.1007/s00284-005-0321-6 |
| [41] |
Jeon S J, Cunha F, Vieira-Neto A, et al. Blood as a route of transmission of uterine pathogens from the gut to the uterus in cows[J]. Microbiome, 2017, 5: 109-121. DOI:10.1186/s40168-017-0328-9 |
| [42] |
Carvalheira A, Ferreira V, Silva J, et al. Enrichment of Acinetobacter spp. from food samples[J]. Food Microbiology, 2016, 55: 123-127. DOI:10.1016/j.fm.2015.11.002 |
| [43] |
Chang W N, Lu C H, Huang C R, et al. Community-acquired Acinetobacter meningitis in adults[J]. Infection, 2000, 28(6): 395-397. DOI:10.1007/s150100070013 |
| [44] |
Carvalheira A, Casquete R, Silva J, et al. Prevalence and antimicrobial susceptibility of Acinetobacter spp. isolated from meat[J]. International Journal of Food Microbiology, 2017, 243: 58-63. DOI:10.1016/j.ijfoodmicro.2016.12.001 |
| [45] |
Wong M H, Chan E W, Chen S. Isolation of carbapenem-resistant Pseudomonas spp. from food[J]. Journal of Global Antimicrobial Resistance, 2015, 3: 109-114. DOI:10.1016/j.jgar.2015.03.006 |
| [46] |
Beiki F, Busquets A, Gomila M, et al. New Pseudomonas spp. are pathogenic to citrus[J]. PLoS One, 2016, 11: e0148796. DOI:10.1371/journal.pone.0148796 |
| [47] |
Li R, Li L Z, Huang R, et al. Variations of culturable thermophilic microbe numbers and bacterial communities during the thermophilic phase of composting[J]. World Journal of Microbiology and Biotechnology, 2014, 30: 1737-1746. DOI:10.1007/s11274-013-1593-9 |
| [48] |
Marti R, Tien Y C, Murray R, et al. Safely coupling livestock and crop production systems:How rapidly do antibiotic resistance genes dissipate in soil following a commercial application of swine or dairy manure[J]. Applied and Environmental Microbiology, 2014, 80: 3258-3265. DOI:10.1128/AEM.00231-14 |
| [49] |
Fierer N, Jackson R B. The diversity and biogeography of soil bacterial communities[J]. Proceedings of the National Academy of Sciences USA, 2006, 103: 626-631. DOI:10.1073/pnas.0507535103 |
| [50] |
Guo H H, Nasir M, Lv J L, et al. Understanding the variation of microbial community in heavy metals contaminated soil using high throughput sequencing[J]. Ecotoxicology and Environmental Safety, 2017, 144: 300-306. DOI:10.1016/j.ecoenv.2017.06.048 |
| [51] |
Vishan I, Sivaprakasam S, Kalamdhad A. Isolation and identification of bacteria from rotary drum compost of water hyacinth[J]. International Journal of Recycling of Organic Waste in Agriculture, 2017, 6: 245-253. DOI:10.1007/s40093-017-0172-8 |
| [52] |
聂孝红, 尹昊, 郭东矗, 等. 四株耐锑细菌的生物学特性及其对油菜在锑污染土壤中的促生作用[J]. 生态学杂志, 2017, 36(6): 1658-1666. NIE Xiao-hong, YIN Hao, GUO Dong-chu, et al. Biological characteristics of four Sb(Ⅲ)-tolerant bacteria and their growth-promoting effects on the rape in soils contaminated by antimony[J]. Chinese Journal of Ecology, 2017, 36(6): 1658-1666. |
| [53] |
Balakrishnan B, Sahu B K, Ranishree J K, et al. Assessment of heavy metal concentrations and associated resistant bacterial communities in bulk and rhizosphere soil of Avicennia marina of Pichavaram mangrove, India[J]. Environmental Earth Scicences, 2017, 76: 58-67. DOI:10.1007/s12665-016-6378-7 |
| [54] |
Kamika I, Momba M N. Assessing the resistance and bioremediation ability of selected bacterial and protozoan species to heavy metals in metal-rich industrial wastewater[J]. BMC Microbiology, 2013, 13: 28-41. DOI:10.1186/1471-2180-13-28 |
| [55] |
景炬辉, 刘晋仙, 李毳, 等. 中条山铜尾矿坝面土壤细菌群落的结构特征[J]. 应用与环境生物学报, 2017, 23(3): 527-534. JING Ju-hui, LIU Jin-xian, LI Cui, et al. The structural characteristics of a soil bacterial community in a dam of copper mine tailings in Zhongtiaoshan mountains, Shanxi[J]. Chinese Journal of Applied and Environmental Biology, 2017, 23(3): 527-534. |
| [56] |
Fang H, Wang H F, Cai L, et al. Prevalence of antibiotic resistance genes and bacterial pathogens in long-term manured greenhouse soils as revealed by metagenomic survey[J]. Environmental Science & Technology, 2015, 49: 1095-1104. |
 2019, Vol. 38
2019, Vol. 38