铯(Cesium,Cs)为第一主族稀有碱金属元素,其稳定同位素133Cs是制造光电管、光电池的良好材料,也被广泛用于电子器件、催化剂、特种玻璃、生物化学、医药材料及空天领域等。随着核工业发展及核事故偶发,放射性核素不可避免地进入环境,其中137Cs半衰期长、裂变量大,被认为是最危险的放射性核素之一[1],当134Cs、137Cs等放射性核素通过环境进入食物链后,极易经农畜禽产品及其制品进入人体,因其内辐射或取代钾(K)而影响人体健康。
土壤是种植业不可或缺的自然资源,可用于治理土壤放射性核素污染的方法有物理法、化学法和生物修复法。物理或化学方法如土壤清洗、铲土法、离子交换法、可剥离性膜法等,存在成本高、易破坏土壤结构、土壤理化性质恶化、易造成二次污染等缺点。生物修复(植物修复、微生物修复、植物-微生物联合修复)具有经济、环保、可有效处理表层及亚表层甚至更深层污染土壤等优点[2],受到广泛关注。植物修复技术具有周期长、修复效率低等局限性[3],微生物修复难以修复大面积的污染,而植物-微生物联合修复综合了前二者的优势,克服单一修复技术的局限性,能够强化植物对核素的固定、积累、转化作用,明显提高土壤核素污染的修复效率,更大程度地减弱核素污染的生物学效应[4]。
淡紫拟青霉(Paecilomyces lilacinus)是土壤及多种植物根系的习居菌,也是植物寄生线虫的重要天敌,是一种被广泛应用的生防菌和功能菌[5],但利用其与植物互作进行土壤或水体中核素污染修复的研究还鲜见报道。印度芥菜(Brassica juncea L.)是植物修复研究中公认的模式植物,对Cd[6]、Pb[7]、Cs[8]、Sr[9]等多种污染金属具有较强的耐受性和富集能力。
目前,关于联合修复过程中植物-微生物的互作机制尚不够明确。本文以一株Cs+富集真菌淡紫拟青霉A10及其发酵液为试材,测试分析A10的溶磷、解钾、产植物生长素(IAA)类似物及A10发酵液对印度芥菜幼苗蓄积Cs+的影响,研究A10的植物促生特性及其在印度芥菜幼苗蓄积Cs+的过程中可能的作用机制,以期为A10-印度芥菜互作体系修复土壤Cs+污染提供实验依据。
1 材料与方法 1.1 试验材料及处理 1.1.1 高效富集菌的筛选及鉴定供试菌株是本研究室从Cs+污染的盆栽印度芥菜根际土壤中分离获得,经ITS rDNA基因序列分析鉴定,该菌株与Genebank数据库中6株淡紫拟青霉(Paecilomyces lilacinus)的18S ribosomal RNA序列的覆盖度和相似度均为100%,同时结合形态学鉴定结果,确定该菌株为淡紫拟青霉,并命名为淡紫拟青霉A10(Genebank登录号为MH542655)。
1.1.2 溶磷、解钾固体培养基制备用于溶磷研究的无机磷培养基:Ca3(PO4)2 10.0 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·8H2O 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,琼脂18.0 g,蒸馏水1.0 L。
用于解钾研究的硅酸盐培养基:蔗糖5.0 g,Na2HPO4 1.0 g,MgSO4·7H2O 0.2 g,CaCO3 0.1 g,FeCl3· 7H2O 0.005 g,土壤矿物0.1 g,琼脂18.0 g,蒸馏水1.0 L。其中土壤矿物准备方法为:取适量土壤,先去除大块的残渣,再加6 mol·L-1 HCl(土壤与盐酸之比为1:10),煮沸30 min,过滤,用蒸馏水淋洗数次,烘干备用。
参照林先贵[10]的方法配制好上述培养基溶液后,调节pH值为7.0,再配制Cs+终浓度[ρ(Cs+)]为0、25、50、100 mg·L-1的处理培养基溶液;加入琼脂,加热熔化,灭菌,冷却至室温后倒平板,备用。
为方便观察A10的菌落形态,用接种针沾取少量纯化的A10菌丝体点植于培养皿上,培养一定时间后观察菌落形态,用扫描仪(BenQ Scanner 5560)保存扫描图片,用Image J测量菌落直径。
1.1.3 溶磷、解钾液体培养基制备及摇瓶培养用于溶磷研究的摇瓶采用不加琼脂的无机磷培养基,用于解钾研究的摇瓶采用不加琼脂的硅酸盐培养基。培养液灭菌后,配制Cs+终浓度[ρ(Cs+)]为0、25、50、100 mg·L-1的处理液;用打孔器挑取活化的A10菌饼(直径4 mm)置于摇瓶中,以不接菌的为对照,各处理均重复3次。置恒温摇床(150 r·min-1、28 ℃)振荡培养15 d后,制备上清液(即A10发酵液),用于测定速效磷含量和有效钾含量。
1.1.4 A10产IAA类似物培养参照林先贵[10]、沈萍等[11]的方法,以不加孟加拉红溶液作为改良马丁液体培养基(MM)。实验处理分3组:接种A10于MM中(记为A10);接种A10于ρ(Cs+)100 mg·L-1的MM中(记为A10+Cs100);接种A10于ρ(Cs+)100 mg·L-1和色氨酸500 mg·L-1的MM中(记为A10+Cs100+Trp500),以不接种的MM为对照(记为CK)。各处理振荡培养(150 r·min-1、28 ℃)15 d后,制备上清液(即A10发酵液),用于测定IAA类似物。
1.1.5 A10发酵液制备将A10接种于新鲜的MM中,振荡培养(150 r· min-1、28 ℃)8 d,过滤,滤液离心(10 000 r·min-1、4 ℃、10 min)2次,上清液即为A10发酵液,用去离子无菌水调节同一批次或不同批次的发酵液,使其有效活菌数(血球计数板测定孢子数,重复3次,求平均值)为107 cfu·mL-1,备用。
1.1.6 供试植物及其培养上述A10发酵液用1/2 Hoagland营养液(参照汤绍虎等[12]的方法自配)稀释不同倍数:5、35、55倍(设计依据来自以根长为指标的预备实验,可确保印度芥菜幼苗能够生长,分别记作5x、35x、55x)。取适量上述稀释液配制成ρ(Cs+)为0、25、100 mg·L-1的处理液,以1/2 Hoagland营养液作为对照(CK);将上述处理液和对照分装到组培瓶(容量200 mL、口径55 mm、直径64 mm、高90 mm)中,每瓶190 mL。
印度芥菜(Brassica juncea L.)种子购自湖北武汉安谷农业科技有限公司,先用75%的酒精消毒5 min,再用无菌水冲洗数次,播种于以纱布兜底的纸杯中(每杯50粒),将纸杯置于组培瓶上,以兜底的纱布刚好接触到液面不浸泡种子为准。每日上午同一时间补充一定量1/2 Hoagland营养液,光照培养(25 ℃,光强3500 lx,光/暗比为12 h/12 h),每处理重复5次,7 d后取出印度芥菜幼苗依次用20 mmol·L-1的EDTA-Na2、去离子水冲洗后,分为地上部和地下部,编号,烘干至恒质量,用于测定幼苗Cs+蓄积量和K+含量。
1.2 测定方法 1.2.1 A10在溶磷、解钾固体培养基上的生长动态培养期间,观察、记录菌落形态,测量菌落直径,参见1.1.2。
1.2.2 A10发酵液中速效磷、有效钾含量1.1.3中的发酵液离心,吸取无机磷液体培养基上清液2 mL,定容至50 mL,采用钼锑抗比色法测定速效磷含量;采用相同的方法,吸取硅酸盐液体培养基上清液2 mL,定容至50 mL,用火焰原子分光光度计测定有效钾含量;3次独立重复。
1.2.3 A10产IAA类似物1.1.4发酵液离心2次,上清液采用Salkowski比色法[13]测定IAA类似物,3次独立重复。
1.2.4 印度芥菜幼苗Cs+蓄积量和K+含量称取适量幼苗地上和地下部分干样粉末,采用湿法消解法(消解液中HNO3:HClO4=3:1)消解至澄清后,定容至50 mL,用原子吸收分光光度计(TAS-990,北京普析)测定Cs+和K+含量(C:mg·L-1),计算Cs+蓄积量和K+含量(A,mg·g-1 DW):
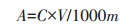
|
式中:V为消解液定容体积,50 mL;m为被消解样品质量,g。均为3次独立重复。
1.3 数据统计与分析采用Excel 2010和SPSS 18.0统计数据,进行单因素方差分析(ANOVA)和Duncan法多重比较,Origin 9.0作图。
2 结果与分析 2.1 A10的促生特性 2.1.1 溶磷、解钾能力将A10接种于不含Cs+的无机磷培养基(图 1A)、硅酸盐培养基(图 1B)上,培养7 d和15 d时,正常情况下,A10菌落呈圆形,外圈为白色,中间部分为粉色,菌落隆起,表明无渗出液,质地呈绒状,无可溶性色素。图 1A中A10生长初期菌落呈白色,生长后期菌落呈淡粉色,表明A10能够正常生长,菌落形态未发生改变,图 1B中也呈现出该趋势,表明A10具有溶磷、解钾的能力。
|
图 1 A10在溶磷培养基(A)和解钾培养基(B)上的菌落形态 Figure 1 The mycelial morphology of A10 in soluble phosphorus medium (A) and potassium medium (B) |
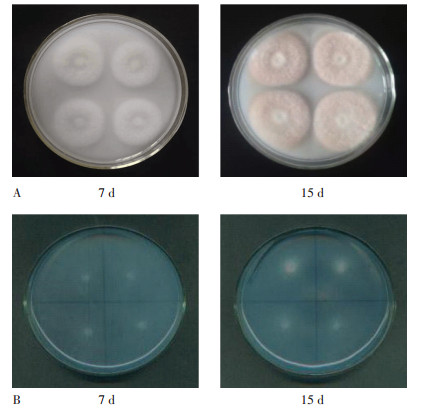
将A10接种于ρ(Cs+)0~100 mg·L-1的溶磷、解钾固体培养基上分别培养8 d和6 d(图 2),相同浓度Cs+处理下,随培养时间延长,菌落直径呈增加的趋势;相同培养时间时,随Cs+处理浓度增加菌落直径呈“先增后降”的趋势,表明A10对Cs+的耐受性强。
|
不同大写字母表示相同Cs+处理和不同培养时间下的差异显著(P < 0.05);不同小写字母表示相同培养时间和不同浓度Cs+处理的差异显著(P < 0.05) Different capital letters and the small letters indicate respectively that the differences are significant (P < 0.05) both in treatments with the same Cs+ concentration and the different incubation time and in treatments with the same incubation time and the different Cs+ concentration 图 2 含不同浓度Cs+的溶磷、解钾培养基上A10菌落直径的变化 Figure 2 Changes of colony diameter of A10 in phosphorus medium and potassium medium with different Cs+ concentrations |
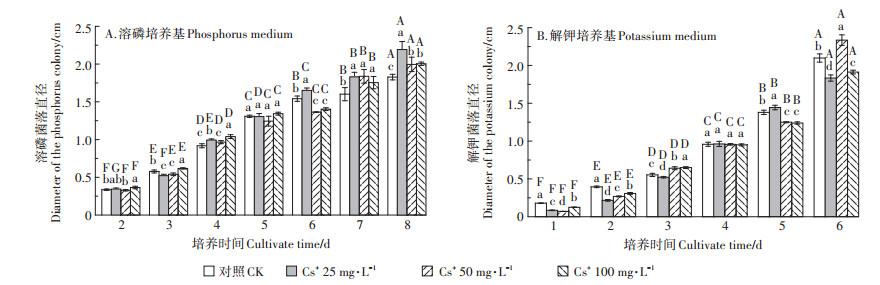
将A10接种于ρ(Cs+)0~100 mg·L-1的溶磷、解钾液体培养基中,振荡培养15 d后(图 3),A10发酵液中速效磷含量为11.99~44.03 mg·L-1,有效钾含量为21.02~25.75 mg·L-1;较高浓度Cs+(50~100 mg·L-1)处理时A10溶磷能力被显著抑制(P < 0.05),但一定程度上激活了A10的解钾潜能。
|
不同小写字母表示不同处理之间的差异显著(P < 0.05),下同 Different small letters indicate that differences are significant between the treatment groups(P < 0.05). The same as below 图 3 含不同浓度Cs+的溶磷、解钾发酵液中速效磷、有效钾含量的变化 Figure 3 The changes of the contents of soluble phosphorus in the soluble phosphorus medium and the effective potassium in potassium medium with different Cs+ concentrations |
Salkowski显色结果如图 4A所示。与CK(不接种的MM)比较,实验组显示深浅不一的红色。随着Cs+浓度增加(图 4B),发酵液中IAA类似物含量显著提高(P < 0.05),ρ(Cs+)100 mg·L-1时IAA类似物含量高达4.04 mg·L-1,为CK的22.57倍。结果表明,A10可分泌IAA类似物,外源Cs+处理和色氨酸诱导均可显著促进A10分泌IAA类似物。
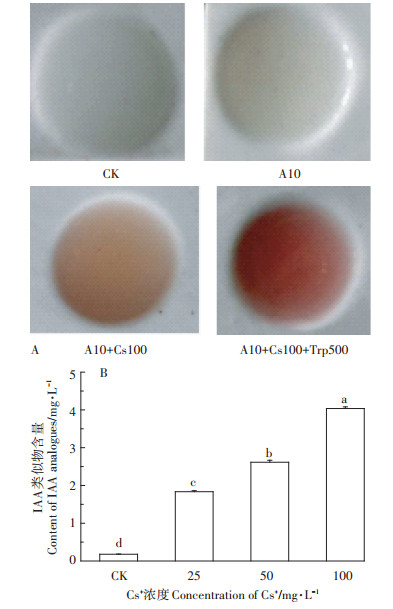
|
图 4 A10发酵液中IAA类似物的定性与定量测试 Figure 4 Qualitative and quantitative tests of IAA analogues in A10 fermentation broth |
图 5可见,随着Cs+浓度增加,CK(营养液处理)和实验组幼苗根的生长均显著被抑制(P < 0.05),表明幼根生长点对外源Cs+具有较强的敏感性。与CK相比,随着发酵液稀释倍数增加,根长呈“先降后增”的变化趋势,稀释5x处理的根长最短,稀释35x处理的根长最长(P=0.026 < 0.05),表明高浓度发酵液(5x)抑制幼根生长(P < 0.05),稀释35x时对根长的促生作用显著(P < 0.05)。
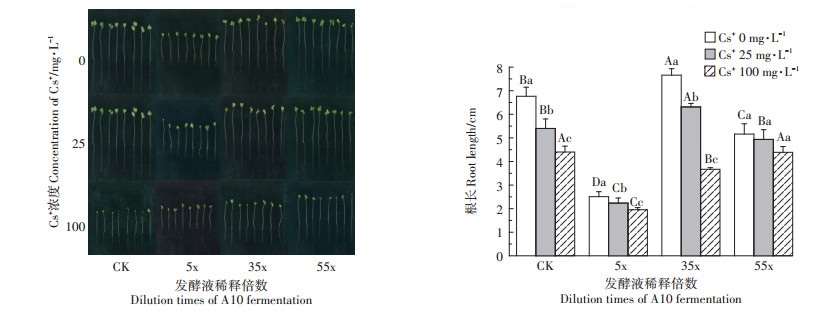
|
不同小写字母表示相同稀释倍数发酵液、不同浓度Cs+处理之间差异显著(P < 0.05);不同大写字母表示相同浓度Cs+、不同稀释倍数的发酵液处理之间差异显著(P < 0.05)。下同 Different small letters and the capital letters indicate respectively that the differences are significant(P < 0.05)both in treatments with the same dilution multiple of A10 fermentation broth and different Cs+ concentrations and in treatments with the same Cs+ concentrations and different dilution multiple of A10 fermentation broth. The same as below 图 5 含不同浓度Cs+的A10发酵液对印度芥菜幼苗根生长的影响 Figure 5 Effects of the A10 fermentation broth with different Cs+ concentration on root growth of Brassica juncea L. seedlings |
CK溶液中随着Cs+浓度增加,幼苗地上、地下部分干质量递降,不同浓度Cs+与不同稀释倍数A10发酵液共同处理时对幼苗干质量的显著降低产生叠加效应(图 6)。
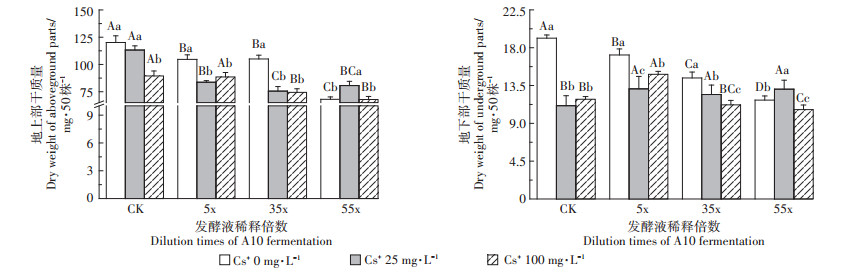
|
图 6 含不同浓度Cs+的A10发酵液对印度芥菜幼苗地上部和地下部干质量的影响 Figure 6 Effects of the A10 fermentation broth with different Cs+ concentration on dry weights of aboveground and underground parts in Brassica juncea L. seedlings |
由图 7可见,随Cs+浓度增加,CK及各处理幼苗的Cs+蓄积量显著升高(P < 0.05);地下部分>地上部分。当ρ(Cs+)25 mg·L-1时,35x处理幼苗地下部分Cs+蓄积量(3.82 mg·g-1 DW)显著高于5x处理(1.69 mg·g-1 DW)。当ρ(Cs+)100 mg·L-1时,35x处理幼苗地上部分Cs+蓄积量高达8.86 mg·g-1 DW,为CK(7.44 mg·g-1 DW)的1.19倍;地下部分Cs+蓄积量高达16.76 mg·g-1 DW,为CK(13.64 mg·g-1 DW)的1.23倍,为5x处理(5.77 mg·g-1 DW)的2.90倍。结果表明,A10发酵液稀释35x时有利于印度芥菜幼苗对培养液中Cs+的蓄积,进入幼苗体内的Cs+主要存在于根部。
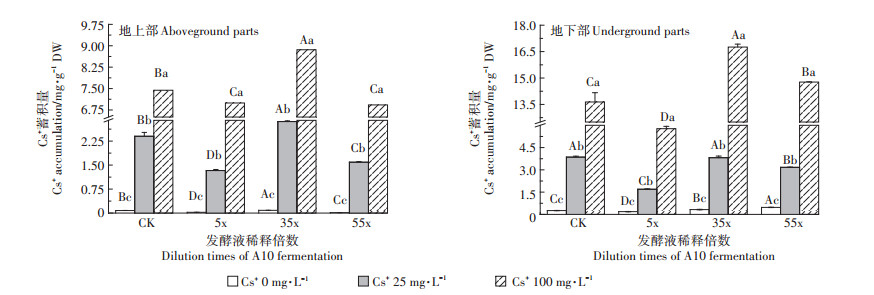
|
图 7 含不同浓度Cs+的A10发酵液对印度芥菜幼苗地上部和地下部Cs+蓄积量的影响 Figure 7 Effects of the A10 fermentation broth with different Cs+ concentration on Cs+ accumulation amount of aboveground and underground parts in Brassica juncea L. seedlings |
图 8可见,幼苗K+含量地上部分>地下部分,但均随Cs+浓度增加而显著降低(P < 0.05),不含Cs+的A10发酵液稀释55x处理有利于K+的吸收和转运。
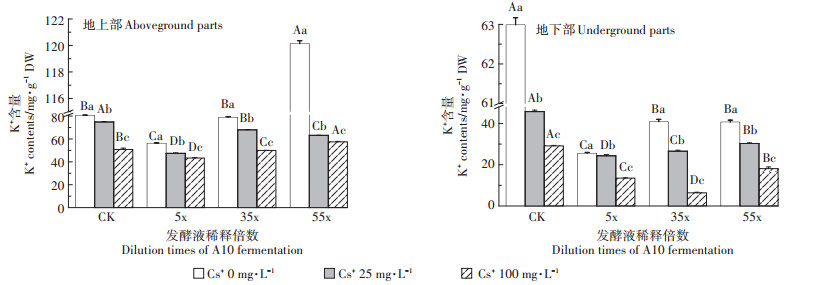
|
图 8 含不同浓度Cs+的A10发酵液对印度芥菜幼苗地上部和地下部K+含量的影响 Figure 8 Effects of the A10 fermentation broth with different Cs+ concentration on K+ contents of aboveground and underground parts in Brassica juncea L. seedlings |
对发酵液稀释5x和35x处理幼苗的地上部分Cs+蓄积量与K+含量进行相关性分析(图 9),可见其呈显著的负相关性(P < 0.05),表明幼苗对Cs+、K+的吸收存在一定的竞争关系,Cs+主要蓄积在根部,K+则大量转移至地上部分。
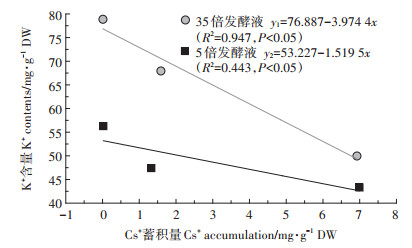
|
图 9 含不同浓度Cs+的A10发酵液对印度芥菜幼苗地上部Cs+蓄积量与K+含量的相关性分析 Figure 9 The correlation analysis between Cs+ accumulation amount and the absorbed K+ contents of aboveground parts in Brassica juncea L. seedlings |
土壤微生物主要通过吸附、转化等方式降低放射性核素对微生物自身和植物的毒性。微生物表面存在种类多样的吸附位点和基团,可在溶液中与金属离子通过离子交换、络合、共价吸附等相互作用,将金属离子吸附在微生物体表[14]。真菌对放射性核素的吸附和吸收机理相对复杂。真菌细胞壁上存在的羟基、羧基和巯基等活性基团或胞外聚合物可通过表面络合作用、螯合作用与重金属离子结合形成络合物或螯合物,将金属离子固定在细胞壁,因此细胞壁是真菌吸附金属离子的主要部位[4],也是缓解金属毒害的天然屏障。真菌也可通过还原反应将重金属离子由高价还原为低价[15],或利用其分泌的有机酸络合并溶解金属离子,从而改变金属的赋存形态及其生物有效性[14]。
一般认为,Cs+对细胞的毒理机制主要在于Cs+可替代K+,导致需K+的关键组分失活而干扰代谢。Cs+是一种较弱的路易斯酸,电荷低、半径小、与配位体相互作用弱。稳定同位素133Cs的毒性小,在非生物和生物系统中有较活跃的迁移性,生物材料对Cs+的亲和力比非生物材料高。与非生物材料不同,微生物对Cs+等金属离子的吸收和转移是活细胞的主动运输过程,需要消耗代谢能,因此,利用微生物修复技术去除环境污染中的Cs+通常需要活的微生物细胞,这些微生物多为可纯培养微生物[16],主要有酿酒酵母菌[17]、丛枝菌根[18]、曲霉F77[19]、耐辐射细菌等[20]。
淡紫拟青霉(Paecilomyces lilacinus)属半知菌纲,丝孢菌科,拟青霉属,是多种植物寄生线虫的寄生真菌,具有分布广、功效多、寄主广泛、易培养等优点。李小龙[21]从淡紫拟青霉518固体发酵物中分离出的脂类化合物白僵菌素,具有细胞毒性、免疫抑制、细胞凋亡等多种生物活性,对革兰氏阳性细菌、分支杆菌有较好的抑菌活性,是极具潜力的生防菌和功能菌[14]。淡紫拟青霉NH-PL-03对有机磷农药具有显著的生物降解活性[22]。本研究结果显示,淡紫拟青霉A10具有较强的溶磷、解钾能力(图 1、图 2),外源较高浓度Cs+显著抑制A10的溶磷能力,但一定程度上激活了A10的解钾潜能(图 3)。A10发酵液能产生和分泌IAA类似物,对印度芥菜幼苗根生长的影响表现为“低促高抑”的双重效应(图 5),这一结果与李小龙[21]、李芳[23]的研究结果一致。人们对淡紫拟青霉胞内、胞外可调控植物生长物质的化学本质开展深入研究,1969年Voinove-Raikova等[24]报道淡紫拟青霉可产生IAA;Leverone等[25]提出该IAA与玉米种子贮藏蛋白结合;杨婷等[26]认为淡紫拟青霉PL-HN-16促进小麦胚芽鞘生长的活性因子为分子量约14 kDa的蛋白质;林茂孙等[27]报道对大豆种子均有明显刺激萌发和生长作用的是淡紫拟青霉滤液中12 kDa和28 kDa蛋白组分,推测某种生理活性物质与蛋白质呈结合态存在于培养滤液中。可见,淡紫拟青霉具有防止线虫和促进植物生长的双重功能,其培养液中促生物质的化学本质虽有待进一步明确,但它们对多种植物生长确有调控作用,推测这种外源激素或激素类似物能诱导特异基因表达和特殊蛋白质合成。
印度芥菜(Brassica juncea L.)对Cs[8]、Sr[9]等多种金属具有较高的耐受性和富集能力,常作为研究重金属胁迫的模式植物。本研究结果显示,用ρ(Cs+)100 mg·L-1的A10发酵液(稀释5x~55x)培养的印度芥菜幼苗生物量呈下降趋势(图 6),Cs+蓄积量显著升高(图 7);发酵液稀释35x时,幼苗地上部Cs+蓄积量与K+含量呈显著的负相关性(图 8、图 9)。胡拥军[28]的研究结果显示,随着重金属砷、铅污染浓度提高,砷超富集植物蜈蚣草、铅超富集植物鬼针草叶片中铅、砷含量能够维持在较高水平或显著增加;若添加一定浓度的IAA,则能减缓砷胁迫造成的细胞膜脂质过氧化损伤。叶和松[29]报道显示,水培条件下菌株发酵液中的生物表面活性剂能明显提高土壤和发酵液中有效态重金属铅、锡的浓度,显著提高植物根部的相对电导率,从而促进植物对铅、锡的吸收。张婷[30]研究结果表明,Cd胁迫下添加植物激素能够促进油菜的生长发育,促进植物根系吸收和富集Cd并向地上部转移。植物激素联合螯合剂的处理能有效地缓解土壤中Cd对油菜植株生长发育的胁迫,促进油菜对Cd的吸收富集,提高油菜对土壤中Cd的提取效率。本文结果显示,随着培养基中Cs+浓度增加,A10分泌的IAA类似物含量显著增加(图 4),A10发酵液稀释35x时印度芥菜幼苗对Cs+的蓄积量显著增加(图 7),因此推测A10发酵液中IAA类似物等活性物质能够缓解Cs+胁迫,有利于幼苗生长及其对Cs+吸收蓄积。研究表明,一些菌根真菌(如丛枝菌根)一方面可通过与宿主植物形成共生体,改变植物根细胞的渗透性,增强植物对土壤养分的吸收,提高植物对环境的适应能力[31];另一方面,丛枝菌根的根毛和菌丝形成网状结构,增加吸收面积,进而提高植物对矿质元素的吸收[32]。本研究中A10具有溶解土壤中难溶性磷盐、钾盐的功能,应有利于增强印度芥菜幼苗对磷、钾等矿质元素的吸收,从而缓解Cs+胁迫。
4 结论(1)淡紫拟青霉A10具有较显著的溶磷、解钾、产IAA类似物等植物促生特性;较高浓度的Cs+处理下A10的解钾能力有所增强,但其溶磷能力显著减弱;外源Cs+和色氨酸可显著诱导A10分泌IAA类似物。
(2)用A10发酵液的稀释液培养印度芥菜幼苗,对幼苗根的生长表现为低浓度促进、高浓度抑制的双重效应,这是由于A10产生和分泌IAA类似物所致;不同稀释倍数(5x~55x)的A10发酵液中Cs+含量为100 mg·L-1时,幼苗生物量显著下降;用稀释35x的A10发酵液(Cs+含量为25~100 mg·L-1)培养幼苗时,幼苗地上部和地下部Cs+蓄积量显著增加,地上部Cs+蓄积量与K+含量呈显著的负相关性。
| [1] |
Noor M J, Ashraf M A. Accumulation and tolerance of radiocesium in plants and its impact on the environment[J]. Environment & Ecosystem Science, 2017(1): 13-16. |
| [2] |
刘红娟, 唐泉, 单健, 等. 环境中放射性铯的迁移进展研究[J]. 环境科学与管理, 2014, 39(12): 50-54. LIU Hong-juan, TANG Quan, SHAN Jian, et al. Migration of radiocesium in environment[J]. Environmental Science and Management, 2014, 39(12): 50-54. DOI:10.3969/j.issn.1673-1212.2014.12.012 |
| [3] |
王丹, 陈晓明, 唐运来, 等. 放射性核素污染土壤的植物提取修复技术研究关键问题探讨[J]. 辐射防护, 2016, 36(2): 94-103. WANG Dan, CHEN Xiao-ming, TANG Yun-lai, et al. Discussion on key issues to research the phytoextraction technology of containmination of radionuclides in soil[J]. Radiation Protection, 2016, 36(2): 94-103. |
| [4] |
邱亮, 丰俊东. 微生物对放射性核素吸附行为的研究进展[J]. 环境工程, 2015, 33(6): 30-34. QIU Liang, FENG Jun-dong. Research progress on biosorption of radionuclides[J]. Environmental Engineering, 2015, 33(6): 30-34. |
| [5] |
李芳, 刘波, 黄素芳. 淡紫拟青霉研究概况与展望[J]. 昆虫天敌, 2004, 26(3): 132-139. LI Fang, LIU Bo, HUANG Su-fang. Research and application of Paecilomyces lilacinus(Thom.)Samson[J]. Natural Enemies of Insects, 2004, 26(3): 132-139. DOI:10.3969/j.issn.1674-0858.2004.03.008 |
| [6] |
苏德纯, 黄焕忠. 印度芥菜对土壤中难溶态Cd的吸收及活化[J]. 中国环境科学, 2002, 22(4): 342-345. SU De-chun, HUANG Huan-zhong. The absorption and activation of insoluble Cd in soil by Indian mustard(Brassica juncea)[J]. China Environmental Science, 2002, 22(4): 342-345. DOI:10.3321/j.issn:1000-6923.2002.04.014 |
| [7] |
Begonia G B, Davis C D, Begonia M F T, et al. Growth responses of Indian mustard[Brassica juncea, (L.)Czern.] and its phytoextraction of lead from a contaminated soil[J]. Bulletin of Environmental Contamination & Toxicology, 1998, 61(1): 38-43. |
| [8] |
付倩, 赖金龙, 尹燚, 等. 铯对印度芥菜幼苗生长的影响及其亚细胞分布和化学形态[J]. 西北植物学报, 2015, 35(11): 2235-2242. FU Qian, LAI Jin-long, YIN Yi, et al. Effect of cesium on seedling growth, its subcellular distribution and chemical forms in Brassica juncea L.[J]. Acta Botanica Boreali-occidentalia Sinica, 2015, 35(11): 2235-2242. DOI:10.7606/j.issn.1000-4025.2015.11.2235 |
| [9] |
赖金龙, 杨垒滟, 付倩, 等. Sr2+在印度芥菜幼苗中的富集、亚细胞分布及贮存形态研究[J]. 农业环境科学学报, 2015, 34(11): 2055-2062. LAI Jin-long, YANG Lei-yan, FU Qian, et al. Bioaccumulation, subcellular distribution and chemical forms of strontium in Brassica juncea L.[J]. Journal of Agro-Environment Science, 2015, 34(11): 2055-2062. DOI:10.11654/jaes.2015.11.003 |
| [10] |
林先贵. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社, 2010. LIN Xian-gui. Principles and methods of soil microbiology research[M]. Beijing: Higher Education Press, 2010. |
| [11] |
沈萍, 陈向东. 微生物学实验[M]. 3版. 北京: 高等教育出版社, 1999. SHEN Ping, CHEN Xiang-dong. Microbiology experiment[M]. 3th. Beijing: Higher Education Press, 1999. |
| [12] |
汤绍虎, 罗充. 植物生理学实验教程[M]. 重庆: 西南师范大学出版社, 2012. TANG Shao-hu, LUO Chong. The experimental guide for plant physiology[M]. Chongqing: Southwestern Normal University Press, 2012. |
| [13] |
Glickmann E, Dessaux Y. A critical examination of the specificity of the Salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology, 1995, 619(2): 793-796. |
| [14] |
班宜辉.铅锌矿区深色有隔内生真菌提高植物耐Pb机制研究[D].杨凌: 西北农林科技大学, 2013. BAN Yi-hui. Mechanisms of dark septate endophyte isolated from Pb-Zn mine improving plant lead tolerance[D]. Yangling: Northwest A & F University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10712-1013347305.htm |
| [15] |
王建龙, 陈灿. 微生物还原放射性核素研究进展[J]. 核技术, 2006, 29(4): 286-290. WANG Jian-long, CHEN Can. Advances in microbial reduction of radionuclides[J]. Nuclear Techniques, 2006, 29(4): 286-290. DOI:10.3321/j.issn:0253-3219.2006.04.012 |
| [16] |
王建龙. 微生物与铯的相互作用及其在放射性核素污染环境修复中的应用潜力[J]. 核技术, 2003, 26(12): 949-955. WANG Jian-long. Interaction of microorganism with caesium and its potential application in bioremediation of radionuclide contamination[J]. Nuclear Techniques, 2003, 26(12): 949-955. DOI:10.3321/j.issn:0253-3219.2003.12.011 |
| [17] |
陈灿, 王建龙. 酿酒酵母对放射性核素铯的生物吸附[J]. 原子能科学技术, 2008, 42(4): 308-313. CHEN Can, WANG Jian-long. Biosorption of cesium by Saccharomyces cerevisia[J]. Atomic Energy Science and Technology, 2008, 42(4): 308-313. |
| [18] |
杨会玲.丛枝菌根真菌对宿根高粱修复铯污染的调节效应[D].绵阳: 西南科技大学, 2015. YANG Hui-ling. Regulation effects of arbuscular mycorrhizal fungi (AMF)on phytoremediation of Sorghum haipense in cesium contamination soils[D]. Mianyang: Southwest University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10619-1015318370.htm |
| [19] |
王卫宪.真菌曲霉F77对水中铯的吸附行为研究[D].兰州: 兰州大学, 2014. WANG Wei-xian. Biosorption of cesium ions in aqueous solution by Aspergillus F77[D]. Lanzhou: Lanzhou University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10730-1014301717.htm |
| [20] |
王建龙. 耐辐射基因工程菌Deinococcus radiodurans及其在环境修复中的应用[J]. 辐射研究与辐射工艺学报, 2004, 22(5): 257-260. WANG Jian-long. Engineered radiation-resistant bacteria and their application in bioremediation of radioactive wastes-contaminated environment[J]. J Radiat Res Radiat Process, 2004, 22(5): 257-260. DOI:10.3969/j.issn.1000-3436.2004.05.001 |
| [21] |
李小龙.淡紫拟青霉518的抗菌活性及其次生代谢产物研究[D].南京: 南京农业大学, 2012. LI Xiao-long. Study on the secondary metabolites from Paecilomyces lilacinus 518[D]. Nanjing: Nanjing Agricultural University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10307-1016024953.htm |
| [22] |
李芳, 黄素芳, 刘波. 淡紫拟青霉对辛硫磷的降解效应[J]. 应用与环境生物学报, 2006, 12(1): 104-107. LI Fang, HUANG Su-fang, LIU Bo. Degradation of phoxmi by Paecilomyces lilaciuns[J]. Chinese Journal of Applied & Environmental Biology, 2006, 12(1): 104-107. DOI:10.3321/j.issn:1006-687X.2006.01.025 |
| [23] |
李芳.淡紫拟青霉菌(Paecilomyces lilacinus(Thom.) Samson Str. NH-PL-03)生物学特性与次生代谢物质生物效应研究[D].福州: 福建农林大学, 2005. LI Fang. Study on biological characteristics of Paecilomyces lilacinus (Thom.)Samson Str. NH-PL-03 and its biological effects of secondary metabolites[D]. Fuzhou: Fujian Agricultural and Forest University, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10389-2005124307.htm |
| [24] |
Voinove-Raikov a Z, Bakaliv anov D, Chanova D, et al. Bet aindoleacetic acid in some soil microorganisms[J]. Pochvozn Agrokhim, 1969, 4: 85-90. |
| [25] |
Leverone L A, Kossenjans W, Jayasimihulu K, et al. Evidence of zeinbound indoleacetic acid using gas chromatography-selected ion monitoring-mass spectrometry analysis and immunogold labeling[J]. Plant Physiology, 1991, 96(4): 1070-1075. DOI:10.1104/pp.96.4.1070 |
| [26] |
杨婷, 廖美德, 贺玉广, 等. 淡紫拟青霉PL-HN-16促进植物生长活性因子的初步研究[J]. 华北农学报, 2015, 30(6): 170-175. YANG Ting, LIAO Mei-de, HE Yu-guang, et al. Preliminary study on the factor of promoting plant growth from Paecilomyces lilacinus PL-HN-16[J]. Agricultural Boreali-Sinica, 2015, 30(6): 170-175. |
| [27] |
林茂松, 沈纪冬, 文玲, 等. 淡紫拟青霉代谢产物生物测定和生理活性物质分析[J]. 江苏农业学报, 1999, 15(4): 226-228. LIN Mao-song, SHEN Ji-dong, WEN Ling, et al. Bioassay of metabolic products of Pacilomyces lilacinus and analysis of its physiologically active substance[J]. Jiangsu Agricultural Sciences, 1999, 15(4): 226-228. |
| [28] |
胡拥军. 3-吲哚乙酸在植物超富集砷中的作用和机理[D].昆明: 昆明理工大学, 2014. HU Yong-jun. The roles and mechanisms of 3-indole acetic acid in arsenic huperaccumulation by plants[D]. Kunming: Kunming University of Science and Technology, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10674-1014353329.htm |
| [29] |
叶和松.生物表面活性剂产生菌株的筛选及提高植物吸收土壤铅镉效应的研究[D].南京: 南京农业大学, 2006. YE He-song. Screening of biosurfactant-producing bacterial strains and their effects on the uptake of lead and cadmium in soils by plants[D]. Nanjing: Nanjing Agricultural University, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10307-2007125909.htm |
| [30] |
张婷.植物激素协同螯合剂强化植物修复土壤重金属污染[D].厦门: 集美大学, 2012. ZHANG Ting. Enhanced phytoremediation of heavy metal polluted soil by phytohormone in combination with chelating agents[D]. Xiamen: Jimei University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10390-1012489054.htm |
| [31] |
Peyronel B. Mycorhizes parl' observation directe[C]//Proceedings of the Seventh, Stockholm: International Botanical Congress, 1950: 436-438.
|
| [32] |
Jefferies P, Gianinazzi S, Perotto S, et al. The contribution of arbuscular mycorrhizal fungi in sustainable maintenance of plant health and soil fertility[J]. Biology and Fertility of Soils, 2003, 37(1): 1-16. |
 2019, Vol. 38
2019, Vol. 38


