序: 滨海湿地土壤承担着化学物质的源大规模围填海等高强度的人类活动已经给滨海湿地带来了一系列的环境问题、汇或转化器的功能,对湿地水体水质的保护发挥着重要的作用,如重金属和有机污染。、富营养化和盐碱化但是快速城市化、等问题日益突出,导致滨海湿地生态系统发生严重的结构和功能退化,成为维持我国滨海区域经济可持续发展的严重障碍。为了明确滨海湿地土壤生境质量演变规律及其退化机制,项目组成员以珠江三角洲和黄河三角洲典型滨海湿地土壤为研究对象开展了大量的室内外试验工作,通过对阶段性成果的梳理组织了滨海湿地土壤环境专栏。研究成果重点评估了珠江三角洲典型湿地土壤PAHs污染风险、以及PAHs污染和重金属污染对城市河流和农村河流湿地土壤氮矿化过程的影响规律,分析了黄河三角洲滨海湿地植物对铯污染的响应和富集规律,辨识了潮间带湿地土壤磷库的动态变化特征以及水盐梯度样带上盐离子的分布规律,以期为大河三角洲湿地土壤环境治理和修复提供科学依据,为滨海湿地生态系统健康维持提供理论
土壤氮素是植物生长发育的重要生源要素,对植物群落多样性和生态系统初级生产力的维持和提升具有重要作用[1]。在天然湿地生态系统中,氮素是最重要的养分之一,其传输过程显著影响湿地生态系统的结构和功能[2-3]。其中,氮矿化过程是生物地球化学循环的重要环节,它不仅可以将植物难以利用的有机氮转化为易吸收的无机氮并调节植物生长,而且土壤氮的硝化作用可以进一步产生温室气体N2O,进而影响全球气候[4]。
多环芳烃(PAHs)是一类含有至少两个苯环且广泛分布在自然界各类生态系统中的有机污染物[5],具有“三致”效应和生物累积效应[6]。多环芳烃可以通过影响微生物或土壤酶活性从而影响氮素循环过程。刘杰[7]通过室内模拟实验发现短期内中浓度(40~80 μg·g-1)多环芳烃芘对土壤微生物群落产生较小影响,而中浓度芘对氨氧化微生物活性则产生显著抑制作用。脲酶是参与有机氮矿化过程的重要水解酶,有研究表明受多环芳烃污染的土壤中脲酶活性会受到不利影响,其中萘对土壤脲酶活性的抑制作用最大,而芘的抑制作用最小[8]。
珠江三角洲湿地是我国重要的河口湿地,但近几年由于珠三角城市群发展迅猛,而暴露出许多环境问题。位于珠江河口的广州市番禺区由于工业发展迅速,给流经该区的城市河流(接收超亿吨废水)和农村河流(主要饮用水源)带来了严重的污染。城市河流湿地受到工业废水、电镀和皮革生产过程中产生的污染,而农村河流受到来自食品、油脂和肉类工厂等农业废水的污染,两者分别受到不同程度的多环芳烃污染[9]。Xiao等[10]研究表明珠江河口湿地土壤中PAHs污染高于亚洲其他一些河口湿地。近年来许多学者都集中在土壤理化性质、温度、湿度、凋落物及氮磷添加对氮矿化的影响[11-13],而对土壤中多环芳烃的研究则集中在来源分布、降解及修复[10, 14-15]方面,面对多环芳烃污染的加剧,氮矿化对多环芳烃的响应机制研究尚不多见。因此,本文采用室内培养法探究不同浓度菲添加对珠江河口工业区农村和城市河流湿地氮矿化的影响机理,可为珠江三角洲受污染胁迫的河流湿地土壤的治理和修复提供理论支撑。
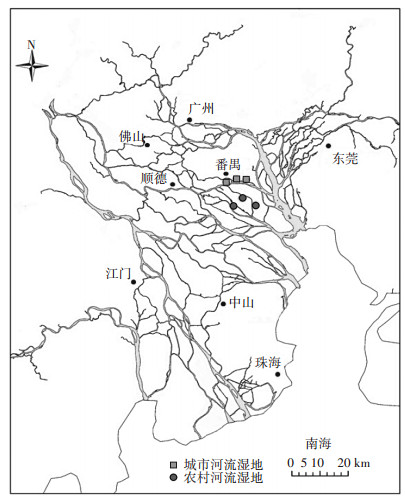
1 材料与方法 1.1 研究区概况珠江三角洲位于我国广东省中南部,珠江下游,濒临南海。大部分属于热带地区,亚热带海洋季风气候。降水量在年内较集中,4—9月的降雨量约占全年83%,年降水量约2100 mm,平均蒸发量为1350 mm。该地区全年日照时数为1900~2200 h,多年平均气温在22 ℃左右。该区土壤主要有赤红壤、潴育型水稻土、盐渍型水稻土和滨海盐渍土等。研究区内植被以莎草科植物为主。研究区位置如图 1所示。
|
图 1 研究区位置图 Figure 1 Location map of the study area |
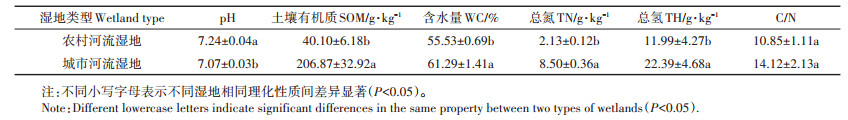
本研究在广东省广州市番禺区选择典型农村河流湿地和城市河流湿地进行样品采集。实验土壤样品采集时间为2015年5月。采样时将地表植被凋落物等杂物去除,用塑料铲采集土壤表层(0~10 cm)土壤,分别在两类湿地内随机设置3个重复样地,每个样地随机采集3个样品进行混合,混合均匀后装入塑封袋编号,带回实验室待用。供试土壤性质如表 1所示。
|
|
表 1 农村和城市河流湿地土壤的基本理化性质 Table 1 Soil physical and chemical properties of rural and urban river wetlands |
本研究选取农村和城市河流湿地鲜土进行室内培养实验。根据珠江三角洲湿地土壤有机污染状况及早期研究结果[10],本实验多环芳烃添加物选择菲,浓度分别设置为无(0,A)、低(15 mg∙kg-1,B)、高(100 mg∙kg-1,C)3个水平。城市河流湿地和农村河流湿地土壤菲的初始平均含量分别为144.4 ng∙g-1和127.2 ng∙g-1。
首先将土壤在25 ℃恒温培养箱中进行预培养,活化3 d后进行添加实验。将不同浓度的菲溶液分别加入相当于100 g干土的鲜土样品中,然后将处理后的样品放入培养容器中,并用塑料膜封口,统一放入25 ℃恒温培养箱中培养,定期向样品中补充水分。多环芳烃对微生物具有慢性毒性,因此将培养时间设置为0、7、14、21、28、35 d和42 d。在各培养时间点随机取出3个样品并测定土壤中铵态氮和硝态氮浓度、脲酶活性、氨氧化古菌(AOA)和氨氧化细菌(AOB)等能够反应有机氮矿化过程的指标。
土壤pH值用pH计(Sartorius PB-10)测定;土壤含水量采用烘干法测定;土壤有机质采用重铬酸钾容量法测定;土壤总氮和总氢采用元素分析仪(CHNOS Elemental Analyzer,Vario EL,German)测定;铵态氮和硝态氮使用流动分析仪(Bran+Luebbe,Germany)测定。脲酶活性用比色法测定[16]。采用荧光定量PCR测定氨氧化细菌和氨氧化古菌的amoA基因拷贝数量。
1.3 计算方法一段培养时间内铵态氮(NH4+-N)的净变化量为氨化量,硝态氮(NO3--N)的净变化量为硝化量,两者之和为无机氮的净变化量(净氮矿化量)。净氮矿化速率则是指培养时间段内无机氮的产生速率,同理可得氨化速率和硝化速率。
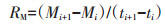
|
(1) |
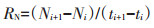
|
(2) |
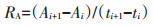
|
(3) |
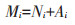
|
(4) |
式中:i为取样批次;t为取样时间,d;M、N、A分别代表净氮矿化量、硝化量和氨化量,mg∙kg-1;RM、RN、RA分别代表净氮矿化速率、硝化速率和氨化速率,mg· kg-1·d-1。
平均矿化、氨化、硝化速率指的是单位时间内培养结束时(t=42)与培养初始时(t=0)氮矿化量、氨化量、硝化量的变化。
1.4 数据处理数据的初步处理通过Excel 2010实现,利用SPSS 20.0软件进行单因素方差分析,判定多环芳烃添加对土壤氮素平均矿化速率、氨化速率、硝化速率的显著性差异以及对脲酶活性的影响。图形绘制通过OriginPro 2017完成。
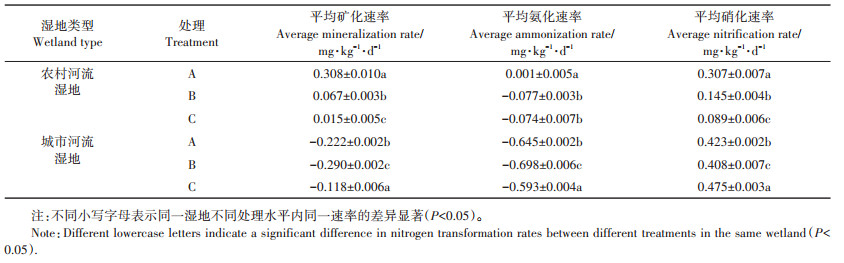
2 结果与讨论 2.1 有机氮矿化过程由图 2和图 3可知,农村河流湿地和城市河流湿地土壤硝化速率和矿化速率大约在21 d达到较高值,而氨化速率约在21 d或35 d出现峰值;硝化速率和矿化速率在35 d出现最低值,而氨化速率较低值则约在14 d和28 d出现,这可能是参与氨化和硝化过程的微生物的适应性和底物不同导致的[17]。两种湿地土壤氨化速率变化范围为-3.823~4.677 mg∙kg-1·d-1,硝化速率的变化范围为-4.990~5.369 mg∙kg-1·d-1,而矿化速率在-4.885~5.877 mg∙kg-1·d-1范围内波动。在培养期内,农村河流湿地和城市河流湿地土壤中固氮和矿化过程同时发生并呈波动性变化。由于硝化速率变动范围较大,所以矿化速率变化趋势主要受硝化速率的影响(图 2和图 3)。在整个培养期内,农村河流湿地土壤氮矿化平均速率为正值,表现为净氮矿化;而城市河流湿地土壤氮矿化平均速率为负值,表现为净氮固定(表 2)。这可能与两种湿地土壤含水量不同有关。城市河流湿地土壤因含水量大导致透气性变差(表 1),使反硝化菌活性变强,反硝化作用明显,导致氮矿化速率为负值[18]。同时,土壤中氮矿化速率与土壤中碳氮比有很大关系。碳氮比可反应基质中氮含量水平,在底物浓度较高情况下,土壤微生物对氮的固定作用可能更强,使矿化速率显示出随碳氮比增加而减小的变化趋势[19],所以城市河流湿地土壤氮的平均矿化速率小于农村河流湿地土壤。
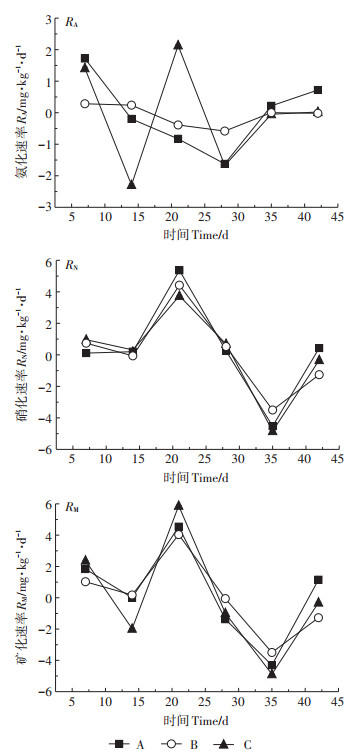
|
图 2 不同菲添加处理下农村河流湿地土壤氨化、硝化、矿化速率动态变化 Figure 2 Dynamic changes in the rates of ammoniation, nitrification and mineralization in rural river wetland soils under different phenanthrene addition treatments |
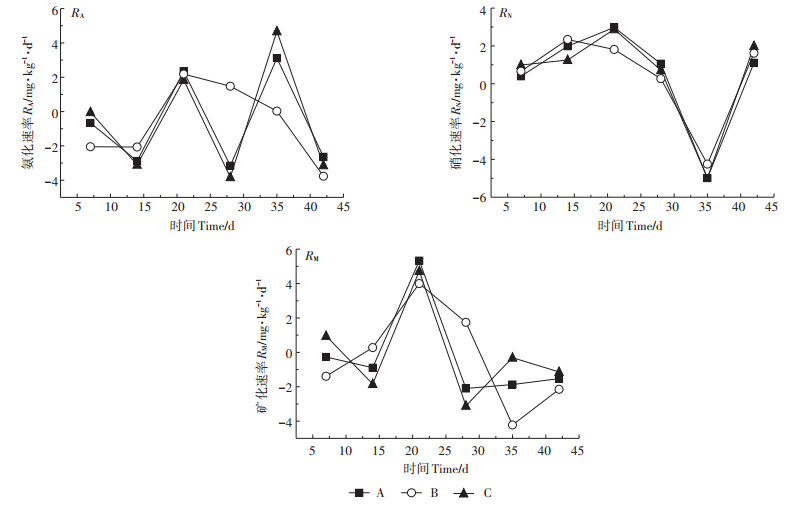
|
图 3 不同菲添加处理下城市河流湿地土壤氨化、硝化、矿化速率动态变化 Figure 3 Dynamic changes in the rates of ammoniation, nitrification and mineralization in urban river wetland soils under different phenanthrene addition treatments |
|
|
表 2 不同菲添加处理下农村和城市河流湿地土壤平均氮转化速率 Table 2 Average nitrogen transformation rates of soils in rural and urban river wetlands under different phenanthrene addition treatments different |
不同剂量多环芳烃菲添加对两种湿地土壤的矿化速率影响不同。由表 2可知,除低浓度和高浓度处理的平均氨化速率无显著性差异外(P > 0.05),农村河流湿地土壤氮的转化速率随多环芳烃浓度升高而降低。所以,农村河流湿地土壤的多环芳烃菲添加不利于土壤氮矿化,表明在培养过程中多环芳烃菲对氮矿化相关微生物产生毒性作用较强,致使活性变低,不利于矿化过程的进行[20]。但在城市河流湿地中,高浓度菲添加处理组的3种氮转化速率最高,其次是无添加处理组,而低浓度菲添加处理组的氮转化速率最低。由于城市河流湿地的各处理显示矿化速率为负值,所以培养期内氮矿化作用较弱,这表明该区域湿地土壤中反硝化菌对氮矿化过程可能起主要作用[18]。已有研究表明[21-22],多环芳烃可以降低反硝化菌活性以及反硝化菌群的丰度和多样性,所以在高浓度处理条件下反硝化过程受到强烈抑制,加之高浓度多环芳烃可以提供更多底物,使矿化量增加。虽然低浓度多环芳烃菲添加也会抑制反硝化过程,但是由于其毒性效应较低,提供的基质较少,所以比高浓度处理下平均矿化速率低。但低浓度处理比无添加处理的平均矿化速率更低,其原因还有待于进一步研究。
在农村河流湿地中,多环芳烃菲对氮矿化的抑制作用影响植物对氮的摄入及其生长发育,增加了该区域生态系统的退化风险。而对于城市河流湿地,高浓度菲添加在一定时间内可能提高植物对氮的利用量。因此,多环芳烃菲的添加会改变氮转化过程,进而影响湿地初级生产力,改变湿地生态系统的结构和功能[2-3]。
2.2 土壤脲酶活性两种湿地土壤脲酶活性随培养时间的延长均呈现出下降的趋势(图 4)。在农村河流湿地中,从14 d开始多环芳烃菲添加处理对脲酶活性表现出明显作用,培养21 d时,低浓度处理对脲酶活性表现出明显的抑制作用(P < 0.01),而高浓度处理则表现出显著的促进作用(P < 0.01)。21 d时,高浓度菲处理下土壤脲酶活性达到最高值(约400 mg NH4+-N·kg-1·2h-1),同时氨化速率也达到峰值(图 2),显著促进了土壤氮的氨化过程。培养结束时,低浓度菲添加处理表现出促进作用,而高浓度菲添加处理的促进作用在后期逐渐消失,与无添加处理组的土壤脲酶活性无显著差异(P > 0.05)。在城市河流湿地中,高浓度菲添加处理在培养前期对土壤脲酶活性呈现出毒性作用,但随培养时间的延长脲酶活性呈现波动式上升,最终与无添加处理的土壤脲酶活性相近。低浓度菲添加处理下土壤脲酶活性在0~7 d时突然升高,随后呈波动式下降,培养结束时则显著低于其他两种处理(P < 0.01)。
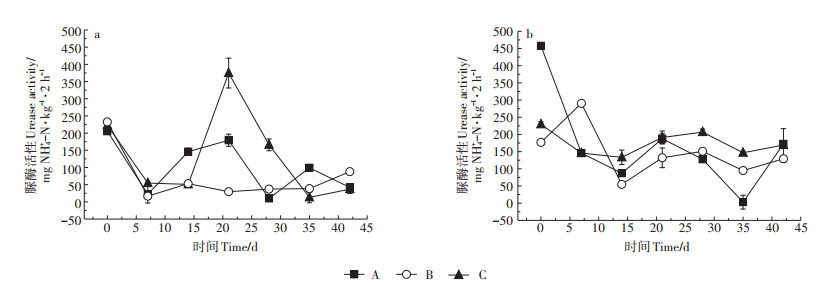
|
图 4 不同菲添加处理下农村河流湿地(a)和城市河流湿地(b)土壤脲酶活性的变化 Figure 4 Changes in urease activities in rural river wetland soils(a)and urban river wetland soils(b)under different phenanthrene addition treatments |
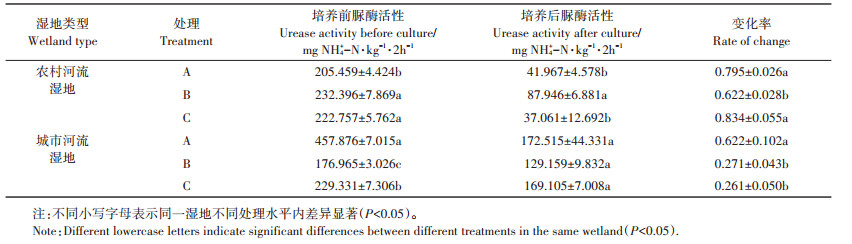
土壤脲酶活性的波动变化主要有以下两个原因[23]:第一,土壤中添加菲等有效底物促进土壤微生物生长和酶诱导作用,导致土壤脲酶活性升高;第二,菲的胁迫作用导致土壤脲酶活性的下降,这主要是可用底物的减少和菲的生物利用度降低引起的。Zhan等[23]将多环芳烃污染对土壤中酶活性的影响划分为两个阶段,第一阶段为8~16 d,第二阶段为16 d后。本研究结果都是从14 d左右开始,多环芳烃菲对脲酶活性显示出明显或波动性促进的作用。在农村河流湿地中,培养21 d时,高含量菲对脲酶活性的刺激作用显现并随时间增加而降低。葛高飞等[24]研究也表明,在高浓度菲处理条件下会产生刺激作用,从而使脲酶活性升高,但随时间增加这种刺激作用会减弱,这与本研究结果一致。但在城市河流湿地中高浓度菲处理中未发现明显刺激作用,这可能是两种湿地土壤微生物的敏感性不同所致[15]。在42 d培养结束时,除高浓度菲添加处理的农村河流湿地土壤外,多环芳烃菲的添加总体上利于土壤脲酶活性的维持(表 3),可见多环芳烃的刺激作用在整个培养期内都存在。而宫璇等[25]则认为2.4 mg∙kg-1以内的菲添加处理在7 d内对土壤脲酶活性呈显著抑制作用,7 d后则与空白处理相同,这可能与多环芳烃添加的浓度和培养时间有关[26]。在不同菲添加处理下城市河流湿地土壤脲酶活性变化率高于农村河流湿地土壤(P < 0.01),且多环芳烃菲的添加更利于城市河流湿地土壤脲酶活性的维持,这可能与有机质含量有关。有机质可能通过两种方式影响土壤脲酶活性,从而导致土壤脲酶活性变化率不同。首先,有机质通过影响微生物活性以及胶体粒子的吸附影响脲酶活性,在高含量有机质土壤中脲酶活性处于较高水平[27-28]。所以无添加处理中城市河流湿地土壤脲酶活性变化率低于农村河流湿地土壤。其次,高有机质含量对PAHs的吸附限制了其降解,降低了其生物毒性,从而使脲酶活性处于较高水平[29]。
|
|
表 3 不同菲添加处理下培养前后农村河流和城市河流湿地土壤脲酶活性及变化率 Table 3 Changes in urease activities and their changing rates in rural and urban river wetland soils before and after incubation under different phenanthrene addition treatments |
图 5表明,在农村河流湿地中,除低浓度菲添加处理下AOA比例呈降低趋势外,其他两种处理在培养后AOA的占比增多,可初步判断AOB在低浓度菲污染条件下适应性更强。在无添加和高浓度菲添加处理下AOA比例随培养时间增加而变大,但高浓度菲添加处理下AOA比例的增幅小于无添加组,所以AOB对多环芳烃的适应性更强,且对低浓度菲的适应性最高。与农村河流湿地相反,AOA与AOB的比例在城市河流湿地中基本没有太大变化,说明多环芳烃可能对该湿地氨氧化反应微生物群落结构无明显作用,这可能与两种湿地受多环芳烃污染的程度不同有关[9]。
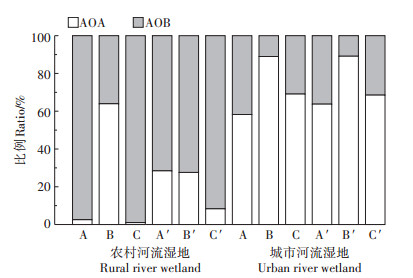
|
A、B、C分别为培养前无添加、低浓度、高浓度处理组;A′、B′、C′分别为培养后无添加、低浓度、高浓度处理组 A, B, C is no phenanthrene addition, low level of phenanthrene addition, high level of phenanthrene addition treatments before incubation, respectively; A′, B′, C′ is no phenanthrene addition, low level of phenanthrene addition, high level of phenanthrene addition treatments after incubation, respectively 图 5 不同菲添加处理下农村河流湿地和城市河流湿地AOA和AOB比例的变化 Figure 5 Changes of AOA and AOB ratios in rural and urban river wetland soils before and after incubation under different phenanthrene addition treatments |
总体上,农村河流湿地土壤中氨氧化反应的主导微生物为AOB,而城市河流湿地土壤中氨氧化反应的主导微生物为AOA。这可能与两类湿地土壤pH和土壤有机质的差异有关(表 1),许多研究也表明氨氧化微生物丰度与pH有关。Nicol等[30]认为随土壤pH升高,AOA丰度降低,所以在pH较低的城市河流湿地,AOA的比重较大。但Li等[31]认为AOB/AOA比值与pH呈显著负相关,这可能是由于土壤类型和氨氧化菌对不同pH的耐受程度不同导致的[32]。同时,Sims等[33]报道了密苏里州湿地土壤有机碳利于AOA存活,这可能是因为AOA积极参与土壤中碳同化过程[34],从而利于其在有机质丰富的城市河流湿地土壤中存活。此外,苏瑜等[35]发现土壤总氮的含量与AOA丰度呈显著正相关,与AOB丰度呈负相关,这与本研究结论一致。
3 结论(1)不同菲添加处理下两类湿地土壤氮矿化速率范围为-4.885~5.877 mg∙kg-1·d-1。总体上,多环芳烃菲添加不利于农村河流湿地土壤氮矿化。高浓度菲添加利于城市河流湿地土壤氮矿化,而低浓度菲添加则利于土壤氮固定。
(2)42 d培养后,不同菲添加处理下土壤脲酶活性均呈下降趋势,但高、低浓度菲添加处理利于土壤脲酶活性的维持,变化幅度均小于无添加处理(高浓度处理的农村河流湿地土壤除外),尤其是城市河流湿地,变幅在27%左右。
(3)多环芳烃菲添加利于农村河流湿地土壤AOB存活,低浓度菲添加使AOB的竞争力增强;但多环芳烃对城市河流湿地土壤氨氧化菌的组成比例基本无影响。
(4)随着多环芳烃污染的加剧,农村河流湿地和城市河流湿地土壤脲酶活性和氨氧化微生物组成(城市河流湿地除外)会受到显著影响,从而改变土壤氮的矿化过程,进而影响湿地生态系统的结构和功能。
| [1] |
Chapin F S, Vitousek P M, Cleve K V. The nature of nutrient limitation in plant communities[J]. The American Naturalist, 1986, 127(1): 48-58. DOI:10.1086/284466 |
| [2] |
Mitsch W J, Gosselink J G. Wetlands[M]. 3rd Edition. New York: Wiley, 2000.
|
| [3] |
白军红, 欧阳华, 邓伟, 等. 湿地氮素传输过程研究进展[J]. 生态学报, 2005, 25(2): 326-333. BAI Jun-hong, OUYANG Hua, DENG Wei, et al. A review on nitrogen transmission processes in natural wetlands[J]. Acta Ecologica Sinica, 2005, 25(2): 326-333. DOI:10.3321/j.issn:1000-0933.2005.02.022 |
| [4] |
牟晓杰, 孙志高, 刘兴土. 黄河口典型潮滩湿地土壤净氮矿化与硝化作用[J]. 中国环境科学, 2015, 35(5): 1466-1473. MOU Xiao-jie, SUN Zhi-gao, LIU Xing-tu. Net nitrogen mineralization and nitrification in the tidal marsh soils of the Yellow River Estuary[J]. China Environmental Science, 2015, 35(5): 1466-1473. DOI:10.3969/j.issn.1000-6923.2015.05.025 |
| [5] |
Haritash A K, Kaushik C P. Biodegradation aspects of polycyclic aromatic hydrocarbons(PAHs):A review[J]. Journal of Hazardous Materials, 2009, 169(1/2/3): 1-15. |
| [6] |
Cornelissen G, Breedveld G D, Naes K, et al. Bioaccumulation of native polycyclic aromatic hydrocarbons from sediment by a polychaete and a gastropod:Freely dissolved concentrations and activated carbon amendment[J]. Environmental Toxicology and Chemistry, 2006, 25(9): 2349-2355. DOI:10.1897/06-026R.1 |
| [7] |
刘杰.土壤多环芳烃(PAHs)污染对氨氧化菌及微生物群落结构的影响研究[D].北京: 北京林业大学, 2011. LIU Jie. The influence on ammonia oxidizing microorganisms and microbial community structure under soil PAHs pollution[D]. Beijing: Beijing Forestry University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10022-1011134993.htm |
| [8] |
Lipinska A, Kucharski J, Wyszkowska J, et al. Urease activity in soil contaminated with polycyclic aromatic hydrocarbons[J]. Polish Journal of Environmental Studies, 2013, 22(5): 1393-1400. |
| [9] |
Xiao R, Bai J H, Huang L B, et al. Distribution and pollution, toxicity and risk assessment of heavy metals in sediments from urban and rural rivers of the Pearl River delta in southern China[J]. Ecotoxicology, 2013, 22(10): 1564-1575. DOI:10.1007/s10646-013-1142-1 |
| [10] |
Xiao R, Bai J H, Wang J J, et al. Polycyclic aromatic hydrocarbons (PAHs)in wetland soils under different land uses in a coastal estuary:Toxic levels, sources and relationships with soil organic matter and water-stable aggregates[J]. Chemosphere, 2014, 110: 8-16. DOI:10.1016/j.chemosphere.2014.03.001 |
| [11] |
聂二旗, 张心昱, 郑国砥, 等. 氮磷添加对杉木林土壤碳氮矿化速率及酶动力学特征的影响[J]. 生态学报, 2018, 38(2): 615-623. NIE Er-qi, ZHANG Xin-yu, ZHENG Guo-di, et al. Effects of nitrogen and phosphorus additions on soil organic carbon and nitrogen mineralization and hydrolase kinetics in Chinese fir plantations[J]. Acta Ecologica Sinica, 2018, 38(2): 615-623. |
| [12] |
刘颖慧, 李悦, 牛磊, 等. 温度和湿度对内蒙古草原土壤氮矿化的影响[J]. 草业科学, 2014, 31(3): 349-354. LIU Ying-hui, LI Yue, NIU Lei, et al. Effects of temperature and moisture on nitrogen mineralization in Inner Mongolia grassland, China[J]. Pratacultural Science, 2014, 31(3): 349-354. |
| [13] |
Xiong Y M, Zeng H, Xia H P, et al. Interactions between leaf litter and soil organic matter on carbon and nitrogen mineralization in six forest litter-soil systems[J]. Plant and Soil, 2014, 379(1/2): 217-229. |
| [14] |
Falciglia P P, Guidi G D, Catalfo A, et al. Remediation of soils contaminated with PAHs and nitro-PAHs using microwave irradiation[J]. The Chemical Engineering Journal, 2016, 296: 162-172. DOI:10.1016/j.cej.2016.03.099 |
| [15] |
Zhang S Y, Wang Q F, Xie S G, et al. Microbial community changes in contaminated soils in response to phenanthrene amendment[J]. International Journal of Environmental Science and Technology, 2011, 8(2): 321-330. DOI:10.1007/BF03326219 |
| [16] |
Schinner F, Oehlinger R, Kandeler E, et al. Methods in soil biology[M]. Berlin: springer-verlag, 1996.
|
| [17] |
Dou Z, Toth J D, Jabro J D, et al. Soil nitrogen mineralization during laboratory incubation:Dynamics and model fitting[J]. Soil Biology and Biochemistry, 1996, 28(4/5): 625-632. |
| [18] |
解成杰, 郭雪莲, 余磊朝, 等. 滇西北高原纳帕海湿地土壤氮矿化特征[J]. 生态学报, 2013, 33(24): 7782-7787. XIE Cheng-jie, GUO Xue-lian, YU Lei-chao, et al. Net nitrogen mineralization in soils of Napahai wetland in northwest Yunnan[J]. Acta Ecologica Sinica, 2013, 33(24): 7782-7787. |
| [19] |
Booth M S, Rastetter E, Stark J. Controls on nitrogen cycling in terrestrial ecosystems:A synthetic analysis of literature data[J]. Ecological Monographs, 2005, 75(2): 139-157. DOI:10.1890/04-0988 |
| [20] |
沈国清, 陆贻通, 洪静波, 等. 菲和镉复合污染对土壤微生物的生态毒理效应[J]. 环境化学, 2005, 24(6): 662-665. SHEN Guo-qing, LU Yi-tong, HONG Jing-bo, et al. Ecotoxicological effect of phenanthrene and Cd combined pollution on soil microbe[J]. Environmental Chemistry, 2005, 24(6): 662-665. DOI:10.3321/j.issn:0254-6108.2005.06.009 |
| [21] |
姚炎红, 王明霞, 左小虎, 等. 典型油田多环芳烃污染对土壤反硝化微生物群落结构的影响[J]. 环境科学, 2016, 37(12): 4750-4759. YAO Yan -hong, WANG Ming-xia, ZUO Xiao-hu, et al. Effects of PAHs pollution on the community structure of denitrifiers in a typical oilfield[J]. Environmental Science, 2016, 37(12): 4750-4759. |
| [22] |
Guo G X, Deng H, Qiao M, et al. Effect of pyrene on denitrification activity and abundance and composition of denitrifying community in an agricultural soil[J]. Environmental Pollution, 2011, 159(7): 1886-1895. DOI:10.1016/j.envpol.2011.03.035 |
| [23] |
Zhan X H, Wu W Z, Zhou L X, et al. Interactive effect of dissolved organic matter and phenanthrene on soil enzymatic activities[J]. Journal of Environmental Sciences, 2010, 22(4): 607-614. DOI:10.1016/S1001-0742(09)60139-X |
| [24] |
葛高飞, 郑彬, 王景, 等. 菲不同污染方式对土壤酶活性的影响[J]. 核农学报, 2013, 27(10): 1560-1566. GE Gao-fei, ZHENG Bin, WANG Jing, et al. Effect of phenanthrene pollution with one-time and cumulative patterns on soil enzymatic activity[J]. Journal of Nuclear Agricultural Sciences, 2013, 27(10): 1560-1566. DOI:10.11869/hnxb.2013.10.1560 |
| [25] |
宫璇, 李培军, 张海荣, 等. 菲对土壤酶活性的影响[J]. 农业环境科学学报, 2004, 23(5): 981-984. GONG Xuan, LI Pei-jun, ZHANG Hai-rong, et al. Effects of phenanthrene contamination on enzyme activity in soil[J]. Journal of AgroEnvironment Science, 2004, 23(5): 981-984. DOI:10.3321/j.issn:1672-2043.2004.05.032 |
| [26] |
杨骏达.多环芳烃对红树植物及其土壤的生态效应[D].深圳: 深圳大学, 2015. YANG Jun-da. Ecological effects of PAHs on mangroves and soil[D]. Shenzhen: Shenzhen University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10590-1015419157.htm |
| [27] |
王蒙蒙, 朱金峰, 贾健, 等. 植烟土壤化学性质与酶活性的典型相关分析[J]. 山东农业科学, 2016(1): 87-90. WANG Meng-meng, ZHU Jin-feng, JIA Jian, et al. Canonical correlation analysis between tobacco soil chemical properties and enzyme activity[J]. Shandong Agricultural Sciences, 2016(1): 87-90. |
| [28] |
Roscoe R, Vasconcellos C A, Furtini-Neto A E, et al. Urease activity and its relation to soil organic matter, microbial biomass nitrogen and urea-nitrogen assimilation by maize in a Brazilian Oxisol under notillage and tillage systems[J]. Biology and Fertility of Soils, 2000, 32(1): 52-59. DOI:10.1007/s003740000213 |
| [29] |
平立凤, 骆永明. 有机质对多环芳烃环境行为影响的研究进展[J]. 土壤, 2005, 37(4): 362-369. PING Li-feng, LUO Yong-ming. Effects of organic matter on environmental behaviors of polycyclic aromatic hydrocarbons[J]. Soils, 2005, 37(4): 362-369. DOI:10.3321/j.issn:0253-9829.2005.04.003 |
| [30] |
Nicol G W, Leininger S, Schleper C, et al. The influence of soil pH on the diversity, abundance and transcriptional activity of ammonia oxidizing archaea and bacteria[J]. Environmental Microbiology, 2010, 10(11): 2966-2978. |
| [31] |
Li M, Cao H L, Hong Y G, et al. Spatial distribution and abundances of ammonia-oxidizing archaea(AOA)and ammonia-oxidizing bacteria(AOB)in mangrove sediments[J]. Applied Microbiology and Biotechnology, 2011, 89(4): 1243-1254. DOI:10.1007/s00253-010-2929-0 |
| [32] |
Sun W, Xia C, Xu M, et al. Distribution and abundance of archaeal and bacterial ammonia oxidizers in the sediments of the Dongjiang River, a drinking water supply for Hong Kong[J]. Microbes and Environments, 2013, 28(4): 457-465. DOI:10.1264/jsme2.ME13066 |
| [33] |
Sims A, Horton J, Gajaraj S, et al. Temporal and spatial distributions of ammonia-oxidizing archaea and bacteria and their ratio as an indicator of oligotrophic conditions in natural wetlands[J]. Water Research, 2012, 46(13): 4121-4129. DOI:10.1016/j.watres.2012.05.007 |
| [34] |
Jennifer P, Dumont M G, Ralf C. Ammonia oxidation coupled to CO2 fixation by archaea and bacteria in an agricultural soil[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(10): 4170-4175. DOI:10.1073/pnas.1010981108 |
| [35] |
苏瑜, 王为东. 我国北方四类土壤中氨氧化古菌和氨氧化细菌的活性及对氨氧化的贡献[J]. 环境科学学报, 2017, 37(9): 3519-3527. SU Yu, WANG Wei-dong. Activity of AOA and AOB and their contributions to ammonia oxidization in four soils in north China[J]. Acta Scientiae Circumstantiae, 2017, 37(9): 3519-3527. |
 2019, Vol. 38
2019, Vol. 38