2. 中央民族大学生命与环境科学学院, 北京 100081
2. College of Life and Environment Science, Minzu University of China, Beijing 100081, China
当今,核能已被广泛应用于军事、能源、工业、航天等各个领域。目前,核能提供了约世界总能源的6.0%和总发电量的16%[1],为解决世界能源危机提供了有效途径,但同时也带来了潜在的核污染隐忧。美国核能研究所(NEI)研究发现,每年有大约2000~ 2300 t的核废物通过各种途径释放到环境中[2],对周围的水、土壤和大气造成放射性核污染。核污染的放射性元素成分包括铯(Cs-131、134、137),锶(Sr 90)及碘(I-131、135)等,其中放射性Cs约占16.9%,为主要成分[3-4]。放射性同位素134Cs和137Cs的半衰期分别为2.06年和30年,在衰变过程中会释放出强辐射性的ß射线和γ射线,即使含量很低也会对人们的健康造成长期的严重威胁,甚至致畸、致癌、致突变等[5-6]。此外,Cs+具有极高的水溶性(与K+和Na+类似),大气中的放射性Cs可通过降雨洒落到广阔的地面,一旦沉积在土壤中,将在土壤表层长期驻留,很难清除[7-8]。常规的物理和化学处理方法,包括挖掘收集、溶剂清洗[9]、吸附、生物降解[10]和电修复[11-12]等,因成本高、适用范围小、容易破坏土壤结构等使其应用受限[13-14]。目前认为,植物修复技术具有操作简便、成本低、不引起二次污染等特点,因而成为该领域的主要研究方向[15]。植物修复技术的关键在于超富集植物的筛选。Broadley等[16]研究认为藜科、苋科、菊科对放射性Cs吸收能力较强;唐永金等[17]研究了不同植物在高浓度Sr和Cs胁迫下的响应与修复植物的筛选。目前,对于植物修复土壤Cs污染的研究较多[18-19],但鲜有关于黄河三角洲地区盐地碱蓬对Cs富集规律的研究。
盐地碱蓬(Suaeda salsa)是黄河三角洲滨海湿地先锋植物,具有较高的耐盐性,是重度盐碱湿地的主要修复物种[20]。此前对于盐地碱蓬的报道多侧重于NaCl胁迫[21-22]、重金属胁迫等[23],但关于其对放射性Cs污染土壤修复的研究相对较少,这在一定程度上限制了本土盐生植物的开发与利用。由于放射性137Cs与稳定性133Cs化学性质相近,植物对二者的吸收不存在区别[24]。因此本实验以盐地碱蓬为试验对象,以稳定性133Cs代替放射性137Cs,在温室盆栽条件下研究不同Cs浓度对盐地碱蓬种子的萌发和富集特征的影响,以期能够为进一步挖掘本土盐生植物在植物修复技术中的利用价值提供一定的理论依据。
1 材料与方法 1.1 试验材料供试种子采自黄河三角洲地区滨海湿地内成熟的盐地碱蓬群落。将种子处理干净,于4 ℃冰箱内储存备用。试验在滨州学院山东省黄河三角洲生态环境重点实验室的温室大棚内进行。花盆采用5号全新PP树脂材料砖红色花盆,外径15.6 cm,底径11 cm,高15.4 cm,重量0.15 kg,容积1.7 L。试验用土为黄河口滨岸潮土,土壤背景值:pH 8.13±0.13,含盐量0.06%±0.020%,总碳5.57%±1.01%,总氮213.4±79.5 mg·kg-1,总磷249.2±56.2 mg·kg-1。
1.2 试验设计种子萌发实验,将经臭氧消毒的50粒饱满盐地碱蓬种子置于干净培养皿中(直径10 cm,内垫2层滤纸),分别加入浓度为100、200、400、800 mg·L-1的CsNO3溶液各6 mL,以蒸馏水处理作为对照(CK),各处理均重复4次。封口膜密封后放置于25 ℃恒温培养箱中培养,培养周期为7 d。每日观察记录种子发芽数,培养第7 d开始测量幼苗芽长和根长,统计种子的发芽率、发芽势、活力指数和发芽指数。
Cs污染土壤的制备,将土壤自然风干、研磨过2.5 mm筛,装盆,每盆土壤用量为1 kg(以干土计)。供试土壤Cs(以CsNO3形式加入)浓度分别为0(CK)、100、200、400、800 mg·kg-1,每盆浇400 mLCsNO3溶液或清水(CK),使土壤达到饱和持水量,以保证土壤得到均匀污染。每一浓度梯度均设置4组重复,共计20盆。经CsNO3处理的土壤放置于阴凉处8周,待土壤吸附后播种。每盆定苗6株,每1~2 d浇水1次,保持土壤持水量在60%~70%。播种90 d后收获,每盆取3株长势相近的植株,按处理分为根、茎、叶3部分。先用自来水清洗干净,再用超纯水清洗3次,然后用吸水纸吸去植物体表面水分,按照根、茎、叶分别编号后装入信封,最后将样品放置于70 ℃烘箱中烘至恒质量,计算生物量。
1.3 测定和计算方法盐地碱蓬种子的发芽率、发芽势、发芽指数、活力指数分别按照以下公式进行计算:

|
(1) |
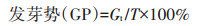
|
(2) |
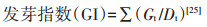
|
(3) |
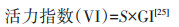
|
(4) |
式中:Gt为t日发芽数(发芽率7 d,发芽势3 d);Dt为相应的发芽天数;T为种子总数;S为根长,mm。种子萌发第7 d测定芽长和根长。
将盐地碱蓬根、茎、叶各部分研磨、消解后采用AA6800原子吸收分光光度计(日本岛津公司)测定Cs含量,测试分析均重复4次。Cs的富集系数和转运系数分别按公式(5)和公式(6)进行计算:
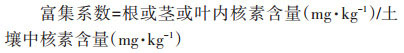
|
(5) |

|
(6) |
采用Excel 2013作图,SPSS 17.0进行数据计算及相关性分析。
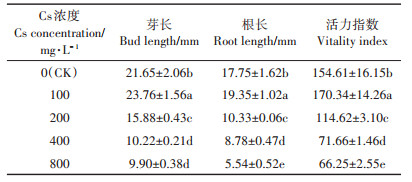
2 结果与分析 2.1 Cs对盐地碱蓬萌发特性的影响由表 1可知,与CK相比,不同浓度Cs处理对盐地碱蓬发芽率、发芽势和发芽指数影响均不显著。由表 2可知,不同浓度Cs处理对盐地碱蓬幼苗生长的影响不同,表现为“低促高抑”的双重作用。当Cs浓度为100 mg·L-1时对胚根、胚芽生长及活力指数具有显著的促进作用(P < 0.05);当浓度≥200 mg·L-1时对胚根、胚芽生长及活力指数具有显著的抑制作用(P < 0.05),且随着Cs浓度的升高对胚根抑制作用大于对胚芽的抑制作用。说明胚根对环境中的Cs更敏感,亦表明高浓度Cs对盐地碱蓬胚根的生长造成了一定的损害。
|
|
表 1 不同浓度Cs处理下盐地碱蓬萌发特性比较 Table 1 Comparison of germination characteristics of Suaeda salsa under different concentrations of Cs |
|
|
表 2 不同浓度Cs处理下盐地碱蓬发芽特性比较 Table 2 Root length, bud length and vitality index of Suaeda salsa seedlings as affected by different concentrations of Cs |
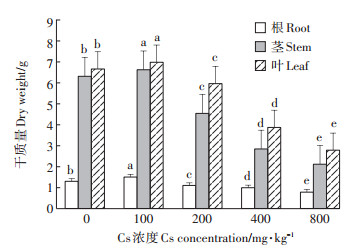
由图 1可知,不同Cs浓度处理对盐地碱蓬各部位干质量的影响不同。当土壤Cs浓度为100 mg·kg-1时,盐地碱蓬各部位生物量比CK组各部位略有增加,之后随着Cs浓度的升高盐地碱蓬各部位生物量逐渐降低。在土壤Cs浓度为800 mg·kg-1时,盐地碱蓬各部位生物量达到最低值,根部、茎部和叶片的生物量比CK组分别降低40.0%、66.56%、58.26%。
|
不同小写字母代表不同处理间在0.05水平上差异性显著。下同 Different lowercase letters represent significant differences between the different treatments at the 0.05 level. The same below 图 1 不同浓度Cs对盐地碱蓬各器官干质量的影响 Figure 1 Effect of different concentrations of Cs on the dry weight of different organs of Suaeda salsa |
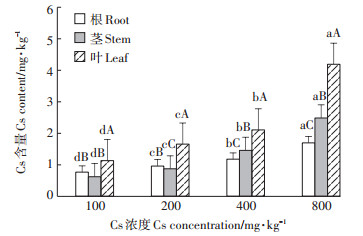
由图 2可知,盐地碱蓬各部位积累的Cs含量均随着处理浓度的升高而显著增加(P < 0.05)。在相同Cs浓度下盐地碱蓬各部位的富集量存在显著差异(P < 0.05),在不同Cs浓度下盐地碱蓬各部位的富集情况也不同,叶片中的Cs含量始终高于根部和茎部。当土壤Cs浓度≤200 mg·kg-1时,盐地碱蓬各部位积累的Cs含量表现为叶 > 根 > 茎;当土壤Cs浓度≥400 mg·kg-1时,各部位积累的Cs含量变为叶 > 茎 > 根;当土壤Cs浓度达到800 mg·kg-1时,根部、茎部和叶片积累的Cs含量达到最大,分别为1.69、2.48、4.18 mg·kg-1。
|
不同大写字母代表不同部位间在0.05水平上差异显著 Different capital letters represent significant differences between the different organs at the 0.05 level 图 2 Cs在盐地碱蓬体内分布 Figure 2 The absorption and distribution of Cs in Suaeda salsa |
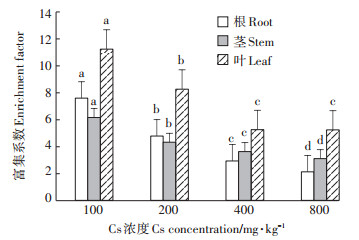
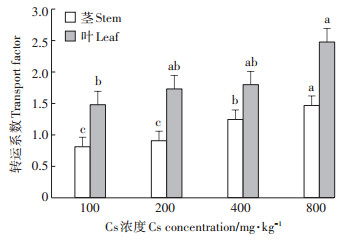
富集系数反映的是盐地碱蓬对Cs的富集能力,转运系数反映的是盐地碱蓬对Cs的转运能力。由图 3可知,在浓度为100 mg·kg-1时,盐地碱蓬根、茎、叶的富集系数最大,之后随着土壤Cs浓度的增加富集系数逐渐降低,在Cs浓度为800 mg·kg-1时达到最低值,分别比100 mg·kg-1时根、茎、叶的富集系数低72.23%、49.59%、53.39%。由图 4可知,随着土壤Cs浓度的增加,盐地碱蓬茎部和叶片的转运系数逐渐增大,在土壤Cs浓度为800 mg·kg-1时达到最大值,比100 mg·kg-1时茎和叶的转运系数分别提高81.48%和67.57%。
|
图 3 盐地碱蓬各器官对Cs的富集系数 Figure 3 Enrichment factor of Cs in various organs of Suaeda salsa |
|
图 4 盐地碱蓬茎、叶对Cs的转运系数 Figure 4 Transport factor of Cs from stem and leaf of Suaeda salsa |
Cs与K为同主族元素,在化学性质上具有相似性,进入到细胞中的Cs+能结合在K+相应的结合位点上,但不能激活需K+活化的多种蛋白酶,因此在某些生理功能上Cs+不能代替K+[26]。对植物的研究发现,当根部Cs浓度大于200 mmol·L-1时,会造成植物体内K的缺乏,影响植物正常生长[27]。本研究中发现,Cs浓度为100~800 mg·L-1时,对盐地碱蓬种子发芽率、发芽势、发芽指数的影响均不显著,这与陶宗娅等[27]对油菜种子的萌发实验结果一致,表明盐地碱蓬种子在萌动期对Cs具有较强的耐受力。盐地碱蓬胚根和胚芽的生长对Cs表现出一定的剂量效应:一方面,在一定浓度内能够促进盐地碱蓬胚根和胚芽的生长;另一方面,当浓度超过一定范围时即产生抑制,且胚根比胚芽更具敏感性。Patra等[28]认为在一定范围内,重金属对植物具有积极的“刺激作用”,表现为暂时性的生长发育增强,这是植物对胁迫产生的一种应激反应,但当超过一定浓度即表现出明显的毒性效应。
生物量是评价植物抗胁迫能力的重要指标之一。本研究中发现,低浓度Cs(100 mg·kg-1)处理能促进盐地碱蓬生长,使其生物量略有增加;高浓度Cs(≥200 mg·kg-1)处理则抑制盐地碱蓬的生长,生物量降低;且浓度越高抑制效果越明显。Hampton等[26]研究发现,137Cs会降低植物枝条重量,原因是137Cs能降低植物枝条中的K含量。Wang等[29]发现在Cs浓度为100 mg·kg-1时高粱生长状况良好,在400 mg·kg-1时受到抑制,这与本实验结果相似。
植物体内Cs含量、富集系数、转运系数是评价植物修复潜力的重要指标。本研究中发现,当土壤Cs浓度低时(≤200 mg·kg-1),盐地碱蓬各部位Cs的富集情况为叶 > 根 > 茎,盐地碱蓬将茎中的Cs转移到叶片中,此时茎部Cs含量小于根部和叶片;当浓度升高时(≥400 mg·kg-1)则表现为叶 > 茎 > 根。张晓雪等[7]、朱靖等[24]分别对鸡冠花和康定柳的Cs富集规律进行研究,实验结果为根 > 茎 > 叶,这可能是因为Cs浓度、植物种类、土壤类型影响了最终的富集结果。盐地碱蓬不同于鸡冠花和康定柳的富集特性,其根部的Cs含量低,这可能是因为盐地碱蓬叶片肉质化程度高,叶片内薄壁细胞组织大量增生,细胞数目多且体积大,可以吸收大量的水分而稀释从环境吸收的Cs,当根部Cs浓度过高时,为避免Cs对根部的损伤,盐地碱蓬将根部的Cs转移至地上部稀释,维持其正常生理功能,这个推测可通过盐地碱蓬转运系数随着土壤Cs浓度升高而逐渐增大得到证实。此外,随着浓度的升高,富集系数逐渐降低。富集系数与盐地碱蓬的总生物量和体内Cs含量有关,随着Cs浓度的升高,盐地碱蓬的富集量增大,受胁迫程度增加后生物量不断降低,所以富集能力受到一定抑制。不同植物类型的富集系数差异很大,邹玥等[30]得出木耳菜在紫色土壤中地上部对Cs的富集系数在2.76~6.04之间;地下部富集系数在5.52~13.06之间。陈柯罕等[31]通过计算得出,盐地碱蓬对Cd的富集系数最大可达到49.39。与邹玥、陈柯罕相比,本研究得出盐地碱蓬富集系数最大达到11.22,处于较高水平。结合富集量与转移系数,足以说明黄河三角洲滨海湿地先锋植物盐地碱蓬对Cs具有较强的富集能力。
4 结论(1)Cs浓度为100~800 mg·L-1时,对黄河三角洲滨海湿地盐地碱蓬的发芽率、发芽势、发芽指数影响不显著,但对胚根、胚芽的生长具有“低促高抑”的双重作用,且胚根对Cs更具敏感性。
(2)盐地碱蓬在低浓度Cs(100 mg·kg-1)下生物量略有增加,随着浓度的升高,盐地碱蓬生长受到抑制,生物量不断降低,且浓度越高抑制程度越大。
(3)随着土壤Cs浓度的升高,盐地碱蓬各部位的富集量不断增大,富集系数不断下降。
试验表明,黄河三角洲滨海湿地盐地碱蓬具有一定抗胁迫能力,在修复滨海湿地Cs污染土壤中具有一定的研究价值和应用潜力。
| [1] |
International Energy Agency. Key World Energy Statistics 2014[EB/OL].[2014]. http://www.iea.org/publications/freepublications/publication/KeyWorld2014.pdf.
|
| [2] |
Greenberg M R, George A, Timothy F, et al. Advancing risk-informed decision making in managing defense nuclear waste in the United States:Opportunities and challenges for risk analysis[J]. Risk Analysis, 2018, 39(2): 375-388. |
| [3] |
Lokobauer N, Zdenko Franić, Bauman A, et al. Radiation contamination after the Chernobyl accident and the effective dose received by the population of Croatia[J]. Journal of Environmental Radioactivity, 1998, 41(2): 137-146. DOI:10.1016/S0265-931X(97)00006-4 |
| [4] |
Fukushima Nuclear Accident: Information Sheet, 16 March 2011[EB/OL] https://www.iaea.org/newscenter/focus/fukushima/fukushima-nuclearaccident-information-sheet
|
| [5] |
Djedidi S, Kojima K, Yamaya H, et al. Stable cesium uptake and accumulation capacities of five plant species as influenced by bacterial inoculation and cesium distribution in the soil[J]. Journal of Plant Research, 2014, 127(5): 585-597. DOI:10.1007/s10265-014-0647-x |
| [6] |
Cook L L, Inouye R S, Mcgonigle T P. Evaluation of four grasses for use in phytoremediation of Cs-contaminated arid land soil[J]. Plant and Soil, 2009, 324(1/2): 169-184. |
| [7] |
张晓雪, 王丹, 钟钼芝, 等. 鸡冠花(Celosia cristata Linn)对Cs和Sr的胁迫反应及其积累特征[J]. 核农学报, 2010, 24(3): 628-633. ZHANG Xiao-xue, WANG Dan, ZHONG Mu-zhi, et al. Response of Celosia Cristata Linn to Cs and Sr stress and their accumulation characteristic[J]. Journal of Nuclear Agricultural Sciences, 2010, 24(3): 628-633. |
| [8] |
Smolders E, Tsukada H. The transfer of radiocesium from soil to plants:Mechanisms, data, and perspectives for potential countermeasures in Japan[J]. Integrated Environmental Assessment & Management, 2011, 7(3): 379-381. |
| [9] |
Deshpande S, Shiau B J, Wade D, et al. Surfactant selection for enhancing ex situ, soil washing[J]. Water Research, 1999, 33(2): 351-360. DOI:10.1016/S0043-1354(98)00234-6 |
| [10] |
Ryan J R, Loehr R C, Rucker E. Bioremediation of organic contaminated soils[J]. Journal of Hazardous Materials, 1991, 28(1/2): 159-169. |
| [11] |
Sun J H, Wang G L, Chai Y, et al. Distribution of polycyclic aromatic hydrocarbons(PAHs)in Henan Reach of the Yellow River, Middle China[J]. Ecotoxicology and Environmental Safety, 2009, 72(5): 1614-1624. DOI:10.1016/j.ecoenv.2008.05.010 |
| [12] |
Zhou D M, Deng C F, Cang L. Electrokinetic remediation of a Cu contaminated red soil by conditioning catholyte pH with different enhancing chemical reagents[J]. Chemosphere, 2004, 56(3): 265-273. DOI:10.1016/j.chemosphere.2004.02.033 |
| [13] |
聂惠, 安玉麟, 李素萍. 向日葵对重金属胁迫反应及其植物修复的研究进展[J]. 黑龙江农业科学, 2010(9): 88-91. NIE Hui, AN Yu-lin, LI Su-ping. Review on sunflower response and phytoremediation to heavy metal stress[J]. Heilongjiang Agricultural Sciences, 2010(9): 88-91. DOI:10.3969/j.issn.1002-2767.2010.09.030 |
| [14] |
邓小鹏, 彭克俭, 陈亚华, 等. 4种茄科植物对矿区污染土壤重金属的吸收和富集[J]. 环境污染与防治, 2011, 33(1): 46-51. DENG Xiao-peng, PENG Ke-jian, CHEN Ya-hua, et al. Absorption and accumulation of heavy metals by four Solanaceae palnts in mining contaminated soil[J]. Environmental Pollution & Control, 2011, 33(1): 46-51. DOI:10.3969/j.issn.1001-3865.2011.01.011 |
| [15] |
洪晓曦, 袁静, 郑现明, 等. 油菜对Cs胁迫的响应及其对Cs富集规律的研究[J]. 农业环境科学学报, 2017, 36(12): 2394-2400. HONG Xiao-xi, YUAN Jing, ZHENG Xian-ming, et al. Accumulation and physio-biochemical responses of Brassia campestris L. to Cs stress[J]. Journal of Agro-Environment Science, 2017, 36(12): 2394-2400. DOI:10.11654/jaes.2017-0688 |
| [16] |
Broadley M R, Willey N J. Differences in root uptake of radiocaesium by 30 plant taxa[J]. Environmental Pollution, 1997, 97(1/2): 11-15. |
| [17] |
唐永金, 罗学刚, 曾峰, 等. 不同植物对高浓度Sr、Cs胁迫的响应与修复植物筛选[J]. 农业环境科学学报, 2013, 32(5): 960-965. TANG Yong-jin, LUO Xue-gang, ZENG Feng, et al. The responses of plants to high concentrations of strontium, cesium stress and the screening of remediation plants[J]. Journal of Agro-Environment Science, 2013, 32(5): 960-965. |
| [18] |
Wang D, Wen F, Xu C, et al. The uptake of Cs and Sr from soil to radish(Raphanus sativus L.)potential for phytoextraction and remediation of contaminated soils[J]. Journal of Environmental Radioactivity, 2012, 110(12): 78-83. |
| [19] |
Moogouei R. Use of terrestrial plants for phytoremediation of pollutants from solutions[J]. Iranian Journal of Science & Technology Transactions A Science, 2018, 42(4): 1753-1759. |
| [20] |
管博, 于君宝, 陆兆华, 等. 黄河三角洲滨海湿地水盐胁迫对盐地碱蓬幼苗生长和抗氧化酶活性的影响[J]. 环境科学, 2011, 32(8): 2422-2429. GUAN Bo, YU Jun -bao, LU Zhao-hua, et al. Effects of water -salt stresses on seedling growth and activities of antioxidative enzyme of Suaeda salsa in coastal wetlands of the Yellow River Delta[J]. Environmental Science, 2011, 32(8): 2422-2429. |
| [21] |
Li W Q, Liu X J, Khan M A, et al. The effect of plant growth regulators, nitric oxide, nitrate, nitrite and light on the germination of dimorphic seeds of Suaeda salsa under saline conditions[J]. Journal of Plant Research, 2005, 118(3): 207-214. DOI:10.1007/s10265-005-0212-8 |
| [22] |
Wang F X, Xu Y G, Wang S, et al. Salinity affects production and salt tolerance of dimorphic seeds of Suaeda salsa[J]. Plant Physiology and Biochemistry, 2015, 95: 41-48. DOI:10.1016/j.plaphy.2015.07.005 |
| [23] |
王耀平, 白军红, 肖蓉, 等. 黄河口盐地碱蓬湿地土壤-植物系统重金属污染评价[J]. 生态学报, 2013, 33(10): 3083-3091. WANG Yao-ping, BAI Jun-hong, XIAO Rong, et al. Assessment of heavy metal contamination in the soil-plant system of the Suaeda salsa wetland in the Yellow River Estuary[J]. Acta Ecologica Sinica, 2013, 33(10): 3083-3091. |
| [24] |
朱靖, 陈珂, 张渊, 等. 康定柳对铯胁迫的生理生化响应及富集能力[J]. 环境工程学报, 2016, 10(3): 1515-1520. ZHU Jing, CHEN Ke, ZHANG Yuan, et al. Accumulation and physiobiochemical responses of Salix paraplesia to caesium stress[J]. Chinese Journal of Environmental Engineering, 2016, 10(3): 1515-1520. |
| [25] |
张宇. Cs对超富集植物藜萌发代谢生物学的影响[J]. 安全与环境学报, 2013, 13(3): 5-8. ZHANG Yu. Biological effects of Cs on the germination metabolism of Chenopodium album Linn[J]. Journal of Safety and Environment, 2013, 13(3): 5-8. DOI:10.3969/j.issn.1009-6094.2013.03.002 |
| [26] |
Hampton C R, Bowen H C, Broadley M R, et al. Cesium toxicity in Arabidopsis[J]. Plant Physiology, 2004, 136(3): 3824-3837. DOI:10.1104/pp.104.046672 |
| [27] |
陶宗娅, 朱磊, 罗学刚, 等. 铯对油菜萌发代谢生物学效应初探[J]. 生态与农村环境学报, 2011, 27(2): 64-68. TAO Zong-ya, ZHU Lei, LUO Xue-gang, et al. Biological effects of Cs on germination and metabolism of rape(Brassica napus)[J]. Journal of Ecology and Rural Environment, 2011, 27(2): 64-68. DOI:10.3969/j.issn.1673-4831.2011.02.012 |
| [28] |
Patra J, Lenka M, Panda B B. Tolerance and co-tolerance of the grass Chloris barbata Sw. to mercury, cadmium and zinc[J]. New Phytologist, 2010, 128(1): 165-171. |
| [29] |
Wang X, Chen C, Wang J. Cs phytoremediation by Sorghum bicolor cultivated in soil and in hydroponic system[J]. International Journal of Phytoremediation, 2016, 19(4): 402-412. |
| [30] |
邹玥, 唐运来, 王丹, 等. 木耳菜在4种土壤中对Cs的吸收与转运研究[J]. 西北植物学报, 2016, 36(1): 147-155. ZOU Yue, TANG Yun-lai, WANG Dan, et al. Uptake and transfer of cesium in Gynura cusimbua growing in four types of soils[J]. Acta Botanica Boreali-Occidentalia Sinica, 2016, 36(1): 147-155. |
| [31] |
陈柯罕, 张科, 李取生, 等. 四种盐生植物对Cd Pb复合污染提取修复效果比较研究[J]. 农业环境科学学报, 2017, 36(3): 458-465. CHEN Ke-han, ZHANG Ke, LI Qu-sheng, et al. Remediation effects of four halophytes on Cd and Pb compound pollution[J]. Journal of Agro-Environment Science, 2017, 36(3): 458-465. |
 2019, Vol. 38
2019, Vol. 38