2. 中国科学院沈阳应用生态研究所, 沈阳 110016;
3. 辽宁科技大学, 辽宁 鞍山 114051;
4. 中国科学院大学, 北京 100049
2. Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, China;
3. University of Science and Technology Liaoning, Anshan 114051, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是一类普遍存在于环境中,性质稳定、难于降解,具有潜在的致畸、致癌、致突变作用的持久性有机污染物,对生态环境和人类健康都带来了极大的威胁[1],而苯并[a]芘(Benzo[a] pyrene,BaP)是PAHs中具有代表性的强致癌物质之一。微生物具有很强的PAHs分解代谢能力和较高的代谢速率,且具有成本低、效率高、不易造成二次污染等优点[2]。通过改进菌种的筛选技术,从PAHs污染的土壤中筛选出高效降解PAHs的细菌、真菌和藻类等[3],如Li等[4]利用微生物菌群降解石油污染土壤和泥浆中的PAHs,去除率分别达到50.1%和55.4%。自然界中已探明具有降解PAHs能力的细菌包括分支杆菌属、芽孢杆菌属和假单胞杆菌属等[5]。与细菌相比,真菌能降解PAHs的种类相对较少,但降解PAHs的效率却往往高于细菌,尤其在降解环数较高的PAHs方面具有明显优势。在降解PAHs的过程中,微生物的胞外聚合物(Extracellular polymertic substances,EPS)在降解PAHs方面引起研究者的极大兴趣。
微生物EPS是细菌或真菌分泌体外的一类有机高分子多聚化合物,主要聚集在细胞外部形成保护层以抵制外界环境的压力,同时也起到储备碳源和能源的作用。EPS可以提高多环芳烃等疏水性物质的传质作用而有利于生物降解,通过范德华力或者乳化作用解吸PAHs,增强PAHs的生物可利用性。同时有些菌种的EPS由于本身含有氧化还原酶,能直接实现对多环芳烃的降解[6]。Zhang等[7]通过研究EPS对生物膜的控制形成及菲、芘的生物降解行为,提出EPS可以提高难溶性PAHs的生物利用度从而增强生物降解效率。Zhang等[8]发现EPS具有线性晶体结构,含有较丰富的羟基、羧基及氨基等官能团,对污染物PAHs的去除起到一定的作用。同时,EPS中多种官能团在溶液中离子化所表现出表面负电荷性,可以促进蛋白质-多糖反应、疏水反应、氢键、离子反应的发生[9],进而可以增强EPS与BaP的相互作用,增加BaP的溶解量。
为了更好地认识PAHs对微生物EPS的性质的影响,以毛霉(Mucor sp.)为研究对象,以BaP为目标污染物,用加热法提取毛霉EPS,研究PAHs对毛霉EPS主要成分和特性的影响,探索在BaP作用下毛霉EPS的变化特征,进一步完善PAHs污染土壤的微生物降解机理。
1 材料与方法 1.1 实验用菌及培养毛霉(Mucor sp.)菌种由中国科学院沈阳应用生态研究所土壤污染生态组提供。培养基配方:斜面培养基(PDA):马铃薯去皮后洗净,称取200 g切成小块,加1 L水煮沸20 min,滤去土豆块,冷却后加入20 g葡萄糖,用水定容至1 L,pH自然,1.013 25×105 Pa,灭菌30 min。种子培养基:蔗糖4.0%,(NH4)2HPO4 0.4%,KH2PO4 0.1%,MgSO4·7H2O 0.05%,维生素B1 0.005%,pH 6.5。在250 mL三角瓶中装入液体种子培养基150 mL,高压蒸汽灭菌20 min,冷却后接入筛选出的菌种,在摇床上振荡培养,培养温度25 ℃,转速120 r·min-1,培养至菌丝球长好为止[10]。
1.2 毛霉对苯并[a]芘的降解实验将已经在斜面上驯化好的真菌转接到液体培养基中,30 ℃培养3 d。制备成菌悬液,按10%接种量接种到BaP浓度均为10、20、40、80、120 mg·L-1的30 mL种子培养基中,30 ℃、130 r·min-1下振荡培养,取样分析培养基中BaP的残留浓度。
1.3 毛霉生物量的测定由于毛霉菌体呈球状,所以测定生物量所用菌体采用整瓶培养物全部过滤,于110 ℃下烘干至恒质量,使用万分之一天平称量毛霉的生物量。
1.4 毛霉EPS的提取方法取培养后的菌体培养液30 mL,于2000 r·min-1离心10 min,弃去上清液,补充无菌水至原体积,于2000 r·min-1离心3 min,弃去上清液,补充无菌水至原体积,重复2次,去除液体培养基中的杂质,然后用加热法提取EPS。将上述菌悬液放入60 ℃的水浴锅中加热30 min,然后样品在8000 r·min-1下离心10 min,上清液经过0.22 μm滤膜过滤后,得到的无色透明溶液为EPS溶液[11]。取加热法提取的EPS样品,通过mulit N/C 3000TOC测定仪测定。为了在生物量相同的基础上进行EPS含量的比较,本文以单位生物量所产生的TOC值代表毛霉EPS的含量,单位为mg·g-1。
1.5 苯并[a]芘的提取和测定方法[11]培养基中BaP采用二氯甲烷萃取,将培养基溶液过0.45 μm水相滤器,然后向滤后溶液中加入等体积的二氯甲烷,放入振荡器振荡20 min,28 ℃,转速170 r·min-1,全部移入50 mL分液漏斗中,静置30 min,分层后将下层有机相存入烧杯,每一样品按此步骤重复萃取3次。将萃取液混匀,转移至烧杯中使用氮气吹至近干,最后用2 mL甲醇定容过0.22 μm有机滤膜后移入液相色谱专用进样瓶中。
采用高效液相色谱法(Agilent-1200高效液相色谱仪)测定。色谱仪主要设定参数为:流动相为100%甲醇;流速为0.8 mL·min-1;VWD检测波长为254 nm;柱箱温度为35 ℃;进样量为10 μL。
1.6 分析方法 1.6.1 毛霉EPS组成成分含量测定EPS中的糖类含量采用硫酸-苯酚法[8]测量;蛋白质和腐植酸含量采用修正的Folin-Lowry法[12]测量;DNA含量采用二苯胺法[13]测量。为了在生物量相同的基础上进行比较,本文以单位生物量所产生的成分含量代表毛霉EPS的组成成分含量,单位为g·g-1。
1.6.2 EPS三维荧光光谱分析提取的EPS样品可直接进行三维荧光测定。荧光光度计参数设定:发射扫描波长250~650 nm,激发扫描波长200~550 nm,激发和发射狭缝宽度为5 nm,扫描速度为12 000 nm·min-1,响应时间为自动方式,扫描光谱进行仪器自动校正[14]。
1.6.3 EPS红外光谱分析红外光谱测定方法:将提取到的EPS经真空干燥(-60 ℃,24 h),取适量的粉末进行测定。用NICOLET380傅里叶红外光谱仪,分辨率4 cm-1,扫描次数32次·min-1,测定范围4000~500 cm-1[15]。
1.6.4 EPS形貌特征分析环境扫描电子显微镜检测(ESEM):将准备好的EPS样品冷冻干燥成粉末状,将制备好的EPS粉末粘于样品台上,镀金后照相检测。
1.7 数据处理与分析所有数据用Excel 2016统计,用Origin 2015处理。
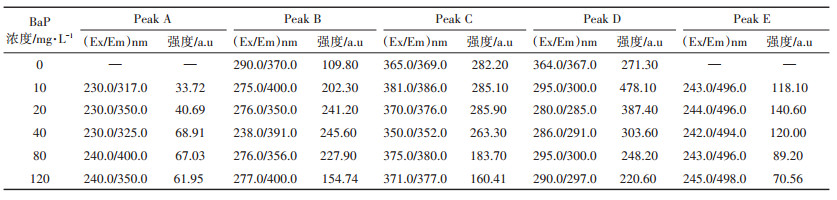
2 结果与讨论 2.1 不同浓度BaP诱导下对毛霉EPS分泌量的影响由图 1可见,当BaP的浓度为0 mg·L-1时,单位生物量产生的毛霉EPS的含量为1080 mg·g-1,EPS含量随着BaP浓度的增加而增加,当BaP的浓度增加到40 mg·L-1时,单位生物量产生的毛霉EPS的提取量达到最大值为1407 mg·g-1,而当BaP浓度为80 mg·L-1开始,则单位生物量产生的毛霉EPS的提取量发生了明显的降低,说明浓度小于40 mg·L-1时在共代谢的作用下可以促进真菌EPS的分泌,而过高浓度的BaP则对毛霉EPS的提取起到抑制作用。多环芳烃具有一定的毒性,同时也是一种可被微生物利用的碳源,培养基中其他底物的存在可以对BaP的代谢降解产生促进或抑制作用[16]。随着BaP浓度由10 mg·L-1增加到120 mg·L-1,毛霉对BaP的降解率呈明显下降趋势,由75.78%下降到25.45%,这说明底物BaP的浓度越高越难代谢。
|
图 1 不同浓度苯并芘诱导后毛霉EPS的提取量和降解率 Figure 1 EPS concentrations and PAHs degradation after Mucor sp. induced by BaP |
EPS含有较丰富的羟基、羧基及氨基的官能团,对污染物的去除起到很大的作用,可以促进蛋白质-多糖反应、疏水反应、氢键、离子反应的发生[8],进而可以增强EPS与BaP的相互作用,增加BaP的溶解量,故随着研究中BaP浓度的增大,代谢速率也增加。EPS在代谢降解PAHs过程中的作用主要包括:固定作用、增溶作用、保护作用和吸附作用。EPS可以通过增加疏水性而增大PAHs在土壤中的移动性,阻碍微生物细胞同有害物质的直接结合消化[17]。Jia等[11]发现毛霉是一种高效多环芳烃降解菌种,毛霉单独降解BaP的降解率可达81%,添加EPS后的毛霉降解BaP的降解率可达88%,EPS先与PAHs结合使其从污染物体系中分离出来,转而使PAHs到达微生物表面进行降解,EPS可以一定程度上增强PAHs的生物可降解性。同时底物浓度的增加刺激毛霉代谢速率的增长,毛霉EPS的含量呈先增大后减少的趋势,EPS提取量不断变化的原因可能是受BaP在其中的解吸速度的影响。由于BaP在初始解吸速度较快且容易解吸,解吸下的BaP浓度相对较高,溶液中生物可利用的BaP底物浓度大,代谢速率快,此时解吸不是降解的限制因素[15]。
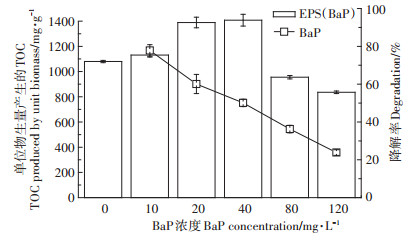
2.2 不同浓度BaP诱导下对毛霉EPS主要成分的影响由图 2可知,毛霉的EPS四种主要成分含量由高到低依次为糖类、蛋白质、腐植酸、DNA。随着BaP浓度的增加,EPS中单位生物量所含的糖类、蛋白质和腐植酸的含量均呈先增加后减少的规变化趋势,但是DNA的量基本不变,原因是毛霉属于真核微生物,其DNA多数在细胞核内,而实验采用加热法提取毛霉EPS,对细胞损坏较小,不会破坏细胞核结构,故DNA含量基本保持不变[18]。当BaP浓度为40 mg·L-1时,EPS中单位生物量产生的糖类含量为700 g·g-1,蛋白质含量为563 g·g-1,腐植酸的含量为174 g·g-1,均为同类中的最大值。
|
图 2 不同BaP浓度下EPS各生化成分含量 Figure 2 The content of EPS in different BaP concentrations |
毛霉菌对BaP进行代谢的过程中其EPS可有效阻止化学物质进入细胞内,而且EPS中各种成分含有影响微生物聚集体的黏附和沉降特性的官能团,与有机物有效结合[19]。当BaP浓度小于40 mg·L-1时,微生物以BaP为碳源和能源,促进了EPS的产生;当BaP浓度达到80 mg·L-1,微生物数量和EPS也逐渐减少,因此微生物EPS的提取量以及糖类、蛋白质和腐植酸的含量呈现先增大后减小的一般趋势。EPS中的葡萄糖对微生物代谢降解土壤中BaP的中后期起到了明显促进作用,EPS对BaP的代谢过程可以利用其中的多糖部分进行增溶作用[18]。
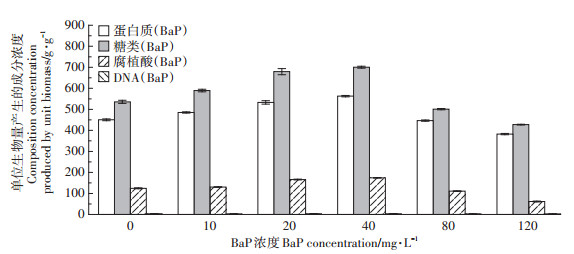
2.3 不同浓度BaP诱导下对毛霉EPS红外光谱分析将图 3中的b、c、d、e、f与a比较可知,a中3346 cm-1处宽而大的蛋白峰在b、c、d、e、f中分别为3217、3217、3360、3360、3382 cm-1,其中b、c中的C-O键的伸缩振动向低波数移动了129 cm-1,C-O键键长缩短,吸收峰发生红移与细胞中羰基、羧基、烷氧基、氨基、羟基的存在有关[20],而d、e、f中C-O键的伸缩振动向高波数移动了14、14、36 cm-1,C-O键键长增加,吸收峰发生蓝移则与大分子量物质分解形成小分子物质有关[21],说明在BaP诱导毛霉时EPS中的蛋白质参加了反应。a中1555 cm-1为酰胺(O=CN-H)Ⅰ带,是C=O的伸缩振动,BaP诱导后从1555 cm-1分别移动到1646、1646、1621、1646、1632 cm-1,吸收峰发生蓝移,与没有BaP诱导的毛霉EPS相比,这说明在不同BaP浓度的诱导下,毛霉的代谢活性发生改变,蛋白质中的羟基和酰胺基发生了变化,更多BaP大分子发生代谢分解。Karunakaran等[15]通过冰醋酸-离心法从污泥中提取蜡样芽孢杆菌中的EPS,其光谱结果说明蜡样芽孢杆菌EPS的细胞质蛋白质酰胺Ⅰ带和酰胺Ⅱ带分别在1695 cm-1和1545 cm-1。a中1038 cm-1处峰在不同浓度BaP诱导后的b、c、d、e、f中分别移至1073、1069、1041、1073、1046 cm-1,说明EPS中多糖上的-COO被消耗,减少了-COO的含量。由此说明,在不同BaP浓度的诱导下,EPS的主要成分蛋白质和糖类促进了毛霉代谢过程的进行。
|
(a) EPS: BaP, 0 mg·L-1; (b) EPS: BaP, 10 mg·L-1; (c) EPS: BaP, 20 mg·L-1; (d) EPS: BaP, 40 mg·L-1; (e) EPS: BaP, 80 mg·L-1; (f) EPS: BaP, 120 mg·L-1 图 3 以不同BaP作为底物的M. mucedo EPS的FTIR光谱 Figure 3 FTIR spectra of EPS from M. mucedo with different BaP as substrate |
根据Chen等[22]对天然环境中各种溶解有机质激发/发射(Ex/Em)荧光峰的位置进行归纳,由图 4可知,类蛋白荧光峰Peak A:Ex/Em=230~240/300~400 nm;类蛋白荧光峰Peak B:Ex/Em=230~290/350~400 nm。这两个峰据研究为蛋白质样峰,主要为芳族蛋白质样物质如酪氨酸(峰A)和色氨酸蛋白样物质(峰B)相关,可以证明蛋白质是EPS的主要成分。荧光峰Peak C:Ex/Em=350~381/350~390 nm,此峰位类腐植酸所在区域。荧光峰Peak D:Ex/Em=280~364/280~ 367 nm,此峰位类可溶性微生物副产品所在区域。荧光峰Peak E:Ex/Em=240~245/494~498 nm,此峰位类富里酸所在区域。
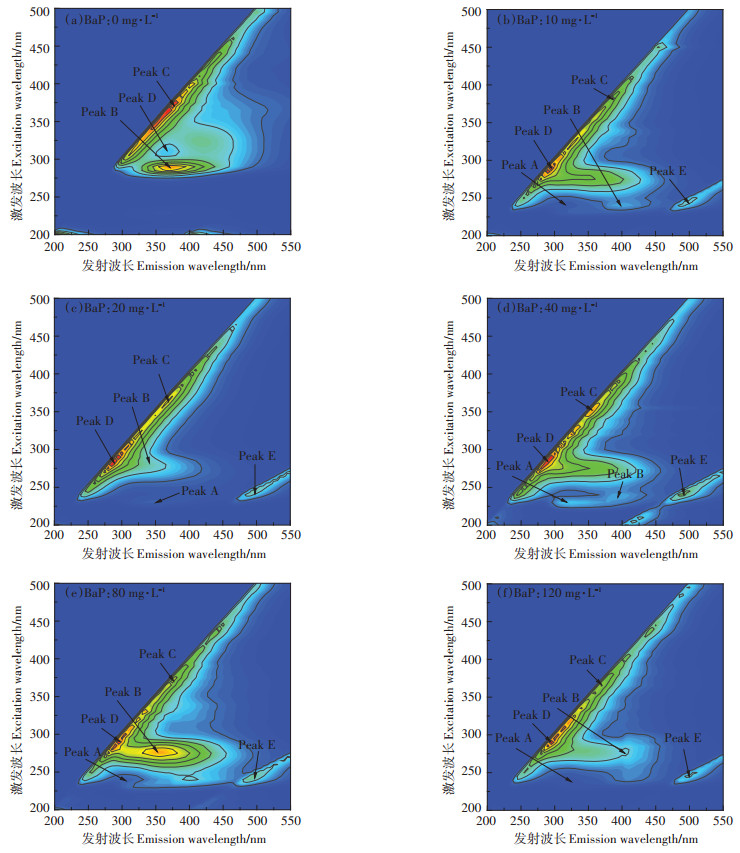
|
图 4 不同浓度BaP诱导下毛霉EPS三维荧光光谱 Figure 4 3D EEM fluorescence spectroscopy of M. mucedo with different BaP as substrate |
由图 4和表 1可知,当BaP的浓度由10 mg·L-1增加到40 mg·L-1,对毛霉向胞外分泌蛋白都有一定的促进作用,其中BaP的浓度为40 mg·L-1时,蛋白峰强度达到最大值;当BaP的浓度由80 mg·L-1增加到120 mg·L-1时,蛋白峰强度呈下降趋势,也就是说,大于80 mg·L-1的BaP抑制了毛霉向胞外分泌蛋白。当BaP处于低浓度的时候,BaP不利于与毛霉菌体充分接触,使得毛霉可利用的能源物质较少,菌体的生长代谢较慢。随BaP浓度的不断增大,毛霉的代谢活性不断增强,降解酶系较为活跃,所以蛋白峰强度明显增加。真菌代谢降解PAHs过程中,主要产生单加氧酶,在此酶的作用下,氧原子被加入到多环芳烃分子中,形成芳香氧化物。芳香氧化物经过结构重组形成酚类,酚类通过环氧化物水解酶的作用形成反式双氢乙醇,使苯环裂解,苯环数逐渐减少直至全部裂解开环[23]。毛霉具有分泌多种胞外蛋白酶的能力[24],而且其胞外蛋白酶系对PAHs有相对较强的降解能力。Zhu等[25]采用加热法分别提取污泥絮凝体、厌氧污泥和好氧污泥中的EPS,结果发现酪氨酸的激发/发射波长(Ex/Em)在220~230/340~370 nm,色氨酸的激发/发射波长(Ex/Em)在280/335~355 nm,并且发现类蛋白峰强度的改变意味着其在生物代谢降解过程中发挥重要作用。
|
|
表 1 不同浓度BaP诱导下毛霉EPS三维荧光光谱分析结果 Table 1 Different concentrations benzo[a] pyrene induced EPS dimensional fluorescence spectroscopy results |
由图 5可知,毛霉EPS呈板结块状,四周凸起部分呈锋利薄片状。随着BaP的浓度的改变,EPS粉末片逐渐变得松散,而且孔隙也在增加,其中40 mg·L-1BaP诱导得到的毛霉EPS呈毛绒状,这时的孔隙量和大小均达到最大值,而浓度由80 mg·L-1增加到120 mg·L-1BaP诱导的毛霉EPS粉末又逐渐变得板结、成块、孔隙减少。EPS能够通过架桥作用使微生物群体形成三维结构,使微生物间的结合更紧密,更好地进行生化作用,微生物颗粒结构更坚固。在EPS含量增加的同时,在BaP的影响下,毛霉EPS粉末又逐渐变得板结、成块、孔隙减少。EPS吸附BaP后,会增大变松散,破坏了原有的结构的紊乱度[26],从而有利于BaP的传质。Nielsen等[27]认为EPS与细胞表面结合较紧密,主要利用其微生物细胞的荚膜、松散或紧密结合的聚合物来吸附有机物,吸附有机物后的EPS会发生变化,打破原有的结构。

|
图 5 驯化后毛霉EPS的电镜图 Figure 5 Electron microscopy of EPS from M. mucedo after acclimation |
(1)污染物BaP的浓度由0增加到120 mg·L-1,毛霉EPS的提取量呈现先增大后减小的一般趋势,提取EPS中的糖类、蛋白质和腐植酸均呈先增大后减小的规律性变化,而DNA的量基本不变,且各含量最大值均发生在BaP为40 mg·L-1时,说明BaP在小于40 mg·L-1时在共代谢的作用下可以促进真菌EPS的分泌。
(2)由红外光谱和三维荧光光谱可知,随着污染物BaP浓度的增加,毛霉EPS的蛋白峰强度呈先增大后减小的趋势,在40 mg·L-1BaP诱导下蛋白峰强度达到最大值。而且毛霉EPS的细胞蛋白质酰胺带发生了红移现象,说明在毛霉代谢BaP时,EPS中蛋白质和多糖起到了主要作用。
(3)通过扫描电镜照片分析,毛霉EPS呈板结块状,四周凸起部分呈锋利薄片状,随着污染物BaP的浓度的增加,EPS粉末片又逐渐变得板结、成块、孔隙减少,破坏了EPS原有的结构的紊乱度。
| [1] |
Wang C, Sun H, Li J, et al. Enzyme activities during degradation of polycyclic aromatic hydrocarbons by white rot fungus Phanerochaete chrysosporium in soils[J]. Chemosphere, 2009, 77(6): 733-738. DOI:10.1016/j.chemosphere.2009.08.028 |
| [2] |
Juhasz A L, Naidu R. Bioremediation of high molecular weight polycyclic aromatic hydrocarbons:A review of the microbial degradation of benzo[a]pyrene[J]. International Biodeterioration & Biodegradation, 2000, 45(1): 57-88. |
| [3] |
Sun R, Belcher R W, Liang J, et al. Effects of cowpea (Vigna unguiculata) root mucilage on microbial community response and capacity for phenanthrene remediation[J]. Journal of Environmental Sciences, 2015, 33(7): 45-59. |
| [4] |
Li X, Li P, Lin X, et al. Biodegradation of aged polycyclic aromatic hydrocarbons (PAHs) by microbial consortia in soil and slurry phases[J]. Journal of Hazardous Materials, 2008, 150(1): 21-26. DOI:10.1016/j.jhazmat.2007.04.040 |
| [5] |
Seo J S, Keum Y S, Li Q X. Bacterial degradation of aromatic compounds[J]. International Journal of Environmental Research & Public Health, 2009, 6(1): 278. |
| [6] |
Jia C, Li P, Li X, et al. Degradation of pyrene in soils by extracellular polymeric substances (EPS) extracted from liquid cultures[J]. Process Biochemistry, 2011, 46(8): 1627-1631. DOI:10.1016/j.procbio.2011.05.005 |
| [7] |
Zhang Y, Wang F, Zhu X, et al. Extracellular polymeric substances govern the development of biofilm and mass transfer of polycyclic aromatic hydrocarbons for improved biodegradation[J]. Bioresour Technol, 2015, 193(1): 274-280. |
| [8] |
Zhang Z Q, Xia S Q, Wang X J, et al. A novel biosorbent for dye removal:Extracellular polymeric substance (EPS) of Proteus mirabilis TJ-1.[J]. Journal of Hazardous Materials, 2009, 163(1): 279-284. DOI:10.1016/j.jhazmat.2008.06.096 |
| [9] |
Morgan J W, Forster C F, Evison L. A comparative study of the nature of biopolymers extracted from anaerobic and activated sludges[J]. Water Research, 1990, 24(6): 743-750. DOI:10.1016/0043-1354(90)90030-A |
| [10] |
Jia C, Li X, Zhang L, et al. Extracellular polymeric substances from a fungus are more effective than those from a bacterium in polycyclic aromatic hydrocarbon biodegradation[J]. Water Air & Soil Pollution, 2017, 228(6): 195. |
| [11] |
Jia C, Li X, Allinson G, et al. Composition and morphology characterization of exopolymeric substances produced by the PAH-degrading fungus of Mucor mucedo[J]. Environ Sci Pollut Res Int, 2016, 23(9): 8421-8430. DOI:10.1007/s11356-015-5986-1 |
| [12] |
陶玉贵, 倪正, 王文强, 等. 活性污泥胞外聚合物(EPS)对Pb2+吸附性能的研究[J]. 农业环境科学学报, 2012, 31(5): 1021-1027. TAO Yu-gui, NI Zheng, WANG Wen-qiang, et al. The characteristics study on adsorption of Pb2+ by extracellular polymeric substances from activated sludge[J]. Journal of Agro-Environment Science, 2012, 31(5): 1021-1027. |
| [13] |
Antonio D B. Composition, fate and transformation of extracellular polymers in wastewater and sludge treatment processes[D]. New York, USA: Cornell University, 2000: 684.
|
| [14] |
Hudson N, Baker A, Ward D, et al. Can fluorescence spectrometry be used as a surrogate for the biochemical oxygen demand (BOD) test in water quality assessment? An example from South West England[J]. Science of the Total Environment, 2008, 391(1): 149-158. DOI:10.1016/j.scitotenv.2007.10.054 |
| [15] |
Karunakaran E, Biggs C A. Mechanisms of Bacillus cereus biofilm formation:An investigation of the physicochemical characteristics of cell surfaces and extracellular proteins[J]. Applied Microbiology & Biotechnology, 2011, 89(4): 1161-1175. |
| [16] |
Davis M W, Glaser J A, Evans J W, et al. Field evaluation of the lignin-degrading fungus Phanerochaete sordida to treat creosote-contaminated soil[J]. Journal of Environmental Science & Technology, 1993, 27(12): 2572-2576. |
| [17] |
Dohse D M, Lion L W. Effect of microbial polymers on the sorption and transport of phenanthrene in a low-carbon sand[J]. Environmental Science & Technology, 1994, 28(4): 541-548. |
| [18] |
张宇, 梁彦秋, 贾春云, 等. 不同方法提取PAHs高效降解菌EPS的特性[J]. 生态学杂志, 2014, 33(4): 1027-1033. ZHANG Yu, LIANG Yan-qiu, JIA Chun-yun, et al. Characteristics of EPS extracted from a high efficient PAHs-degrading bacterium by different methods[J]. Chinese Journal of Ecology, 2014, 33(4): 1027-1033. |
| [19] |
Henriques I D S, Love N G. The role of extracellular polymeric substances in the toxicity response of activated sludge bacteria to chemical toxins[J]. Water Research, 2007, 41(18): 4177-4185. DOI:10.1016/j.watres.2007.05.001 |
| [20] |
Chen J, Gu B, Leboeuf E J, et al. Spectroscopic characterization of the structural and functional properties of natural organic matter fractions[J]. Chemosphere, 2002, 48(1): 59-68. DOI:10.1016/S0045-6535(02)00041-3 |
| [21] |
Swietlik J, Dabrowska A, Raczykstanisławiak U, et al. Reactivity of natural organic matter fractions with chlorine dioxide and ozone[J]. Water Research, 2004, 38(3): 547-558. DOI:10.1016/j.watres.2003.10.034 |
| [22] |
Chen W, Westerhoff P, Leenheer J A, et al. Fluorescence excitationemission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 2003, 37(24): 5701-5710. |
| [23] |
牛秋雅.基于堆肥化和高效降解菌的多环芳烃降解研究[D].长沙: 湖南大学, 2013. NIU Qiu -ya. Researches on the biodegradation of PAHs based on composting and high efficient PAHs-degrading bacteria[D]. Changsha: Hunan University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10532-1013347897.htm |
| [24] |
潘进权.毛霉AS3. 2778胞外蛋白酶组分的纯化、鉴定及性质研究[D].广州: 华南理工大学, 2008. PAN Jin-quan. Purification, identification and characterization of extracellular protease fraction from Mucor AS3. 2778[D]. Guangzhou: South China University of Technology, 2008. |
| [25] |
Zhu L, Zhou J, Lv M, et al. Specific component comparison of extracellular polymeric substances (EPS) in flocs and granular sludge using EEM and SDS-PAGE[J]. Chemosphere, 2015, 121(5): 26-32. |
| [26] |
Busi S, Karuganti S, Rajkumari J, et al. Sludge settling and algal flocculating activity of extracellular polymeric substance (EPS) derived from Bacillus cereus SK[J]. Water and Environment Journal, 2017, 31(1): 97-104. |
| [27] |
Nielsen P H, Jahn A, Palmgren R. Conceptual model for production and composition of exopolymers in biofilms[J]. Water Science & Technology, 1997, 36(1): 11-19. |
 2019, Vol. 38
2019, Vol. 38