碳纳米材料(石墨烯、氧化石墨烯和碳纳米管)由于其独特的物理性质,在高灵敏度传感器制造、生物成像、药物输送和环境净化领域显示出巨大潜力[1]。石墨烯(G)是一种新兴碳素材料,是由碳原子组成六角型呈蜂巢晶格的平面薄膜,也是目前已知的最薄、最坚硬、导电性最好的纳米材料[2]。氧化石墨烯(GO)是重要的石墨烯衍生物之一,可作为新生代污水处理膜、新型吸附剂及监测环境污染的电极材料,可以改变污染物的环境行为[3]。碳纳米管(CNT)由于其稳定性、较强的金属性和导电性而广泛用于航空航天、汽车和电子工业、生物医学等领域[4]。然而,在大量生产和广泛应用的同时,碳纳米材料不可避免地被释放到生态系统中,这无疑增加了其环境和生态风险。近年来,碳纳米材料对不同生物的毒性效应受到关注。Zhu等[5]研究表明,400 mg·L-1和600 mg·L-1氧化石墨烯暴露36 h后,显著降低卤虫的孵化率,且幼虫中丙二醛含量、总抗氧化能力、活性氧和超氧化物歧化酶活性均显著增加。Myer等[6]的研究发现,添加0.318 mg·g-1的碳纳米管48 h后模糊网纹蚤的死亡率显著降低。
高羊茅是禾本科多年生植物,作为我国北方广泛应用的草坪草之一,其具有很强的抗逆性,能够耐寒、耐贫瘠,抗病能力强,在水土保持、城市绿化、草坪建植等方面发挥着巨大的作用[7]。蚯蚓是土壤生态系统中生物量最大的无脊椎动物,在土壤结构及肥力的形成和维持等诸多方面起着重要作用[8]。此外,蚯蚓在土壤中位于食物链的底端,能够和土壤中的各类物质直接接触,对土壤环境中的外源物质反应敏感,存在于土壤中的各种污染物质会对蚯蚓产生不同程度的影响[9]。赤子爱胜蚓(Eisenia foetida)已经被视为土壤生态毒理研究的主要模式生物。生物对环境胁迫的生物化学反应被认为是环境污染的早期警告指数,许多酶活性已被认为是环境污染的生物标志物[10-11]。暴露于环境污染物的生物体中会产生活性氧物质(ROS),过量的ROS能氧化诱导破坏脂质、蛋白质和核酸,从而干扰细胞的正常功能[12]。为了抵抗氧化应激,生物体内具有与ROS相互作用的酶,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、谷胱甘肽S-转移酶(GST)等。
有关碳纳米材料对蚯蚓的毒性效应已有一些报道,较多地集中于碳纳米管及其在蚯蚓体内的富集[13]。多壁碳纳米管的急性毒性实验显示其对蚯蚓有轻微的毒性[14];Zhao等[15]研究发现,改性纳米碳黑对蚯蚓具有一定的毒性,可抑制蚯蚓抗氧化酶的活性。但有关石墨烯、氧化石墨烯和碳纳米管在草坪建植体系中对蚯蚓的毒性研究未见报道。本研究选取具有代表性的高羊茅和赤子爱胜蚓为模式生物,石墨烯、氧化石墨烯和羧基化碳纳米管为实验材料,探究碳纳米材料作为吸附剂施于草坪基质中对高羊茅的生长、蚯蚓体内酶活性和丙二醛(MDA)含量的影响,以了解不同新型碳纳米吸附材料进行土壤修复的环境生态效应,为早期诊断和评价环境中碳纳米材料生态污染风险提供实验方法和数据参考。
1 材料与方法 1.1 实验材料供试土壤为天津师范大学校园土壤,其主要理化性质:含水量16.2%,pH 7.12,电导率1950 μS·cm-1,有机质、全氮和全磷含量分别为41.39、1.96、3.18 g·kg-1。草坪植物选用我国北方广泛应用的高羊茅(Festuca arundinacea)。生活垃圾堆肥来自天津小淀垃圾堆肥处理厂,基本性质:pH 7.49,电导率2300 μS·cm-1,有机质、全氮和全磷含量分别为131.84、25.09、6.81 g·kg-1。石墨烯(G)微片由南京吉仓纳米科技有限公司生产,为黑色无规则薄片,微片大小0.5~20 μm,比表面积40~60 m2·g-1;氧化石墨烯(GO)购自苏州恒球石墨烯科技有限公司,为黑色或褐黄色粉末,平均厚度3.4~7 nm,片层直径10~50 μm,比表面积100~300 m2·g-1;羧基化碳纳米管(CNT)购自北京博宇高科技新材料技术有限公司,直径20~40 nm,长度10~30 μm,比表面积>110 m2·g-1。蚯蚓选用赤子爱胜蚓(Eisenia foetida),实验前先驯化7 d,环带明显的蚯蚓清肠24 h后,选择体重300~500 mg的健壮成体放入不同处理进行培养,以牛粪为蚯蚓饲料。
1.2 实验设计采用塑料盆(高14 cm、内径18 cm),底部铺垫尼龙网以防蚯蚓爬出。每盆装校园土壤1000 g,3种碳纳米材料均设定土壤质量的1%和3%两个比例,每盆添加35 g垃圾堆肥供植物生长所需。另外,每盆再添加150 g牛粪作为蚯蚓饲料。以不添加碳纳米材料的处理为对照(CK),各处理设置3个平行。土壤与碳纳米材料、堆肥、牛粪混匀后装盆,每盆添加蚯蚓20条,播入草坪植物高羊茅种子3.5 g。塑料盆随机排列,每5 d移动位置以保证光照一致,实验期间温度为25~34 ℃,相对湿度45%~65%,光照为自然入射光,培养期间按需补充水分。
1.3 指标测定 1.3.1 高羊茅地上生物量的测定90 d后,将高羊茅齐地面刈割。先称鲜质量,然后置于烘箱85 ℃条件下烘干至恒质量。
1.3.2 蚯蚓抗氧化酶、GST活性和MDA含量的测定酶液制备过程如下:取清肠24 h后的蚯蚓洗净吸干水分称质量,按照质量体积比1:10加入预冷的磷酸盐缓冲液(pH 7.8)迅速研磨,之后离心5 min(10 000 r·min-1,4 ℃),提取上清液。采用考马斯亮蓝染色法进行酶液中蛋白质含量的测定,以牛血清白蛋白作为标准蛋白[16]。SOD活性采用氮蓝四唑(NBT)光还原法测定[17],以抑制NBT光化学还原50%所需要的酶量为一个酶活单位。CAT的测定参照徐镜波等[18]方法,25 ℃下,100 s内使H2O2分解50%时的酶蛋白量为一个酶活单位。POD活性的测定采用愈创木酚比色法[19],每分钟内470 nm下吸光值变化0.01为一个酶活单位。GST活性采用1-氯-2,4-二硝基苯(CDNB)比色法[20],用分光光度计测定340 nm下1 min OD340的变化值;MDA含量的测定采用硫代巴比妥酸(TBA)法[21]。
1.4 数据统计与处理采用SPSS 17.0软件完成数据处理,利用Oneway ANOVA单因素方差分析进行差异显著性分析(Duncan,P<0.05),采用SigmaPlot 12.5作图。
2 结果与分析 2.1 碳纳米材料对高羊茅株高和生物量的影响草坪植物的地上生长直接关系到草坪的质量和成坪效果,而株高和生物量是衡量高羊茅生长的重要指标。和CK相比,添加1% G使高羊茅株高增加3.4%,其余碳纳米材料处理株高均出现了降低,但各处理之间差异不显著(表 1,P>0.05)。高羊茅地上鲜质量和干质量以1%的GO为最低,但各处理间也均无显著性差异(P>0.05)。由此表明,碳纳米材料对高羊茅的地上生长没有显著性影响。
|
|
表 1 碳纳米材料对高羊茅株高和生物量的影响 Table 1 Effects of carbon nanomaterials on the plant height and biomass of Festuca arundinacea |
SOD广泛存在于各种动植物和微生物中,可以清除超氧化物自由基,是预防活性氧的第一道防线。由图 1可以看出,赤子爱胜蚓在含有1%和3%的碳纳米材料土壤中暴露3个月后,体内的SOD活性出现了显著性抑制(P<0.05),并随添加比例的增大,抑制率增加。1%G、3%G、1%GO、3%GO、1%CNT和3%CNT处理SOD活性抑制率分别为24.5%、30.7%、35.2%、35.9%、30.4%和39.3%。其中,3% CNT对SOD活性抑制作用最大,抑制率达到39.3%。

|
不同小写字母表示各处理水平之间差异显著(P<0.05)。下同 Different lowercase letters indicate significant differences between different treatments(P < 0.05). The same below 图 1 碳纳米材料对蚯蚓酶活性的影响 Figure 1 Effects of carbon nanomaterials on the enzyme activities of earthworm |
CAT是生物体内重要的抗氧化酶,可以缓解污染胁迫下H2O2的毒害,维持内环境的稳定。如图 1所示,暴露于1% GO,蚯蚓体内CAT活性略高于CK,但差异不显著。其他碳纳米材料处理,CAT活性被抑制,且随添加比例的增大抑制作用加大。暴露于3% G和3% CNT时,CAT活性的抑制率分别为22.4%和21.7%,与CK组差异不显著(P>0.05),但与1% GO相比,CAT活性显著降低(P<0.05)。
POD在细胞代谢过程中也可清除H2O2。从图 1可看出,赤子爱胜蚓暴露于碳纳米材料90 d,体内POD活性均出现了下降。3% GO处理组出现了显著的抑制作用(P<0.05),抑制率达到37.6%;其余处理组POD活性与CK组无显著性差异(P>0.05)。
GST参与生物体的异物代谢,是一种重要的解毒酶。图 1显示,1% G处理蚯蚓体内GST活性(70.62 nmol·min-1·mg-1Pr)被激活,其他处理GST活性有一定程度的降低,但和CK差异并不显著(P>0.05)。可见,碳纳米材料对GST活性无显著影响。
2.3 碳纳米材料对蚯蚓MDA含量的影响脂质过氧化是生物体中的有害过程,MDA含量可以反映细胞脂质过氧化水平。碳纳米材料对蚯蚓MDA含量的影响如图 2所示。与CK相比,各处理组中MDA含量有所波动,以3% GO处理的MDA含量(1.05 nmol·mg-1Pr)最高,但各处理和CK差异不显著(P>0.05)。
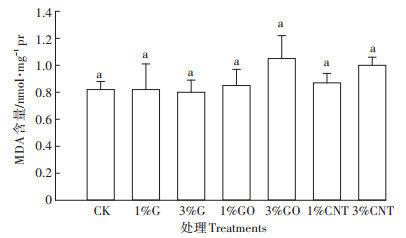
|
图 2 碳纳米材料对蚯蚓MDA含量的影响 Figure 2 Effects of carbon nanomaterials on the MDA content of earthworm |
已有研究表明,低浓度的碳纳米材料对植物生长发育具有积极作用,主要表现在促进种子萌发、根系伸长和提高生物量的积累等[22]。在水培实验中,多壁碳纳米管能显著增加植物种子的发芽率、根系和地上部的生长,和对照相比,大豆和大麦的发芽率提高50%,玉米提高90%[23]。也有研究表明,在一定的实验条件下,碳纳米材料对植物的生长发育产生负面影响,如生长抑制、生物量下降、活性氧含量增加等[2]。碳纳米材料对植物的影响可能与其作用方式和吸收途径、对植物基因表达和根际微生物的影响有关[2],但具体的作用机理还不清楚,有待于进一步深入研究。本研究结果显示,1%和3%碳纳米材料未对高羊茅的株高、地上干质量和鲜质量产生显著影响,表明高羊茅对碳纳米材料具有一定的耐受性。
抗氧化酶(SOD、CAT、POD)被认为是保护生物大分子免受氧化损伤的主要防御系统,可以协同清除其体内产生的活性氧,从而保护细胞免遭破坏[24]。蚯蚓体内各种酶活性及MDA含量对碳纳米材料响应特征不同。土壤中添加碳纳米材料使得SOD活性显著降低,而CK组中SOD活性处于较高水平,表明SOD活性受到抑制。通常情况下,当蚯蚓受到轻度污染胁迫时,SOD活性被诱导,当受到重度逆境胁迫时,SOD活性会降低[25]。在碳纳米材料胁迫下,蚯蚓的代谢平衡受到破坏,引起代谢产物活性氧的积累。SOD活性的降低可能是由于清除过多的氧自由基而导致酶失活[26]。碳纳米材料含量越高,蚯蚓体内产生的氧自由基数量越多,且3% CNT引起的损伤更大,SOD活性受抑制更显著。Zhao等[15]的研究也发现,改性纳米碳黑均显著降低了蚯蚓的SOD活性,这与本实验的结果相一致。
在活性氧转化过程中,产生的H2O2对细胞也有一定的毒害作用,CAT可以将其分解,使细胞免受毒害[27]。本实验中,3% CNT和3% G显著抑制CAT活性,这可能与纳米材料本身的性质、浓度大小和持续时间有关。高含量的碳纳米材料处理下CAT活性降低,可能是自由基导致的酶失活,或与合成相关酶的蛋白质减少或受损有关;其活性的抑制将导致H2O2的累积,有可能对蚯蚓造成过氧化损伤[28]。
POD与CAT对于清除生物体内过量的H2O2具有很好的协同作用,二者在细胞中存在的位置不同,而使其分工存在差异[29]。添加碳纳米材料后POD活性降低,其中3% GO抑制作用最显著,这可能与碳纳米材料本身的尺寸、层数、团聚状态、结构缺陷、氧化程度等性质有关[30]。总体来说,添加碳纳米材料后,蚯蚓体内SOD、POD和CAT活性出现了降低,SOD对碳纳米材料的敏感性大于CAT和POD。
GST作为第二阶段解毒酶,可催化污染物与GSH结合,生成极性的小分子物质,从而减轻其毒性[31]。而碳纳米材料并未引起GST活性的显著变化,这可能是因为其毒性未超过蚯蚓的耐受范围,GST未发挥作用。MDA是细胞脂质在受活性氧胁迫后而形成的脂质过氧化产物,它反映了蚯蚓机体内的抗氧化防御系统和活性氧间的平衡,进一步间接反映了蚯蚓对外源干扰的适应能力[32]。MDA含量各处理与CK无明显差异,说明蚯蚓体内可以通过抗氧化酶的调节,缓解脂质过氧化,使机体处于平衡状态。
4 结论(1)草坪基质中添加一定比例的碳纳米材料未对高羊茅产生明显的毒性效应,高羊茅对碳纳米材料的耐受性较好,抗逆性强。
(2)蚯蚓体内抗氧化酶活性对碳纳米材料的响应总体上表现为下降,表明碳纳米材料能引起蚯蚓体内的毒性效应,抑制抗氧化酶的活性。其中SOD活性均显著低于CK,因此在蚯蚓抗氧化酶中可以选取SOD作为碳纳米材料污染程度的指示指标。
(3)碳纳米材料对蚯蚓体内的GST酶活和MDA含量无明显影响,蚯蚓可能通过抗氧化防御系统或其他机制进行自我修复,减轻毒害作用。
| [1] |
Han X, Li S, Peng Z, et al. Interactions between carbon nanomaterials and biomolecules[J]. Journal of Oleo Science, 2016, 65(1): 1-7. DOI:10.5650/jos.ess15248 |
| [2] |
赵振杰, 梁太波, 陈千思, 等. 碳纳米材料对植物生长发育的调节作用[J]. 作物杂志, 2017(2): 7-13. ZHAO Zhen-jie, LIANG Tai-bo, CHEN Qian-si, et al. The growth and development of plants regulated by carbon nano-materials[J]. Crops, 2017(2): 7-13. |
| [3] |
杜佳媛, 魏永鹏, 刘菲菲, 等. 氧化石墨烯对环境污染物的吸附行为及吸附机理[J]. 地球科学进展, 2016, 31(11): 1125-1136. DU Jia-yuan, WEI Yong-peng, LIU Fei-fei, et al. Adsorption behavior and mechanism of environmental pollutants on graphene oxide[J]. Advances in Earth Science, 2016, 31(11): 1125-1136. |
| [4] |
Francis A P, Devasena T. Toxicity of carbon nanotubes:A review[J]. Toxicology & Industrial Health, 2018, 34(3): 200-210. |
| [5] |
Zhu S, Luo F, Chen W, et al. Toxicity evaluation of graphene oxide on cysts and three larval stages of Artemia salina[J]. Science of the Total Environment, 2017, 595: 101-109. DOI:10.1016/j.scitotenv.2017.03.224 |
| [6] |
Myer M H, Black M C. Multi-walled carbon nanotubes reduce toxicity of diphenhydramine to Ceriodaphnia dubiain water and sediment exposures[J]. Bulletin of Environmental Contamination & Toxicology, 2017, 99(3): 321-327. |
| [7] |
李惠英, 娄燕宏, 胡涛, 等. 中国高羊茅种质资源遗传多样性的RAPD分析[J]. 草业学报, 2010, 19(6): 208-214. LI Hui-ying, LOU Yan-hong, HU Tao, et al. Genetic diversity analysis of Chinese natural tall fescue(Festuca arundinacea) germplasms by RAPD[J]. Acta Prataculturae Sinica, 2010, 19(6): 208-214. |
| [8] |
颜增光, 何巧力, 李发生. 蚯蚓生态毒理试验在土壤污染风险评价中的应用[J]. 环境科学研究, 2007, 20(1): 134-142. YAN Zeng-guang, HE Qiao-li, LI Fa-sheng. The use of earthworm ecotoxicological test in risk assessment of soil contamination[J]. Research of Environmental Sciences, 2007, 20(1): 134-142. DOI:10.3321/j.issn:1001-6929.2007.01.026 |
| [9] |
Spurgeon D J, Weeks J M, Van Gestel C A M. A summary of eleven years progress in earthworm ecotoxicology:The 7th international symposium on earthworm ecology. Cardiff. Wales. 2002[J]. Pedobiologia, 2003, 47(5/6): 588-606. |
| [10] |
曹佳, 刁晓平, 胡继业, 等. 异恶草酮对蚯蚓抗氧化酶活性及DNA损伤的研究[J]. 农业环境科学学报, 2013, 32(5): 925-931. CAO Jia, DIAO Xiao-ping, HU Ji-ye, et al. Effects of clomazone on antioxidative enzymes activity and DNA damage of earthworm(Eisenia foetida)[J]. Journal of Agro-Environment Science, 2013, 32(5): 925-931. |
| [11] |
Song Y, Zhu L S, Wang J, et al. DNA damage and effects on antioxidative enzymes in earthworm (Eisenia foetida) induced by atrazine[J]. Soil Biology and Biochemistry, 2009, 41(5): 905-909. DOI:10.1016/j.soilbio.2008.09.009 |
| [12] |
Liu S, Zhou Q, Chen C. Antioxidant enzyme activities and lipid peroxidation in earthworm Eisenia fetida exposed to 1, 3, 4, 6, 7, 8-hexahydro-4, 6, 6, 7, 8, 8-hexamethyl-cyclopenta-γ-2-benzopyran[J]. Environmental Toxicology, 2012, 27(8): 472-479. DOI:10.1002/tox.v27.8 |
| [13] |
Liné C, Larue C, Flahaut E. Carbon nanotubes:Impacts and behaviour in the terrestrial ecosystem:A review[J]. Carbon, 2017, 123: 767-785. DOI:10.1016/j.carbon.2017.07.089 |
| [14] |
Zhang L, Hu C, Wang W, et al. Acute toxicity of multi-walled carbon nanotubes, sodium pentachlorophenate, and their complex on earthworm Eisenia fetida[J]. Ecotoxicology & Environmental Safety, 2014, 103(1): 29-35. |
| [15] |
Zhao S, He L, Lu Y, et al. The impact of modified nano-carbon black on the earthworm Eisenia fetida under turfgrass growing conditions:Assessment of survival, biomass, and antioxidant enzymatic activities[J]. Journal of Hazardous Materials, 2017, 338: 218-223. DOI:10.1016/j.jhazmat.2017.05.035 |
| [16] |
Bradford M M. A rapid sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1): 248-254. |
| [17] |
Luo Y, Zang Y, Zhong Y, et al. Toxicological study of two novel pesticides on earthworm Eisenia fetida[J]. Chemosphere, 1999, 39(13): 2347-2356. DOI:10.1016/S0045-6535(99)00142-3 |
| [18] |
徐镜波, 袁晓凡, 郎佩珍. 过氧化氢酶活性及活性抑制的紫外分光光度测定[J]. 环境化学, 1997, 16(1): 73-76. XU Jing-bo, YUAN Xiao-fan, LANG Pei-zhen. The determination of enzymic activity and its inhibition on catalase by ultraviolet spectrophotometry[J]. Environmental Chemistry, 1997, 16(1): 73-76. |
| [19] |
Kochba J, Lavee S, Spiegel-Roy P. Differences in peroxidase activity and isoenzymes in embryogenic and non-embryogenic 'Shamouti' orange ovular callus lines[J]. Plant & Cell Physiology, 1977, 18(2): 463-467. |
| [20] |
Habig W H, Pabst M J, Jakoby W B. Glutathione S-transferases:The first enzymatic step in mercapturic acid formation[J]. The Journal of Biological Chemistry, 1974, 249(22): 7130-7139. |
| [21] |
Livingstone D R. Biotechnology and pollution monitoring:Use of molecular biomarkers in the aquatic environment[J]. Journal of Chemical Technology & Biotechnology, 1993, 57(3): 195-211. |
| [22] |
Mukherjee A, Majumdar S, Servin A D, et al. Carbon nanomaterials in agriculture:A critical review[J]. Frontiers in Plant Science, 2016, 7(1770): 172. |
| [23] |
Lahiani M H, Dervishi E, Chen J, et al. Impact of cabon nanotube exposue to seeds of valuable crops[J]. ACS Applied Materials & Interfaces, 2013, 5(16): 7965-7973. |
| [24] |
Roubalová R, Procházková P, Dvořák J, et al. The role of earthworm defense mechanisms in ecotoxicity studies[J]. Invertebrate Survival Journal, 2015, 12: 203-213. |
| [25] |
史雅静, 徐晓宇, 王宇, 等. 非致死剂量的四溴双酚A胁迫下蚯蚓的生长和抗氧化防御反应[J]. 生态毒理学报, 2017, 12(5): 304-312. SHI Ya-jing, XU Xiao-yu, WANG Yu, et al. Growth inhibition and antioxidant enzyme response in earthworms (Eisenia fetida) exposed to tetrabromobisphenol A at non-lethal dose[J]. Asian Journal of Ecotoxicology, 2017, 12(5): 304-312. |
| [26] |
Sun Y, Yin Y, Zhang J, et al. Bioaccumulation and ROS generation in liver of freshwater fish, goldfish Carassius auratus under HC Orange No. 1 exposure[J]. Environmental Toxicology, 2010, 22(3): 256-263. |
| [27] |
Liu T, Wang X, Xu J, et al. Biochemical and genetic toxicity of dinotefuran on earthworms (Eisenia fetida)[J]. Chemosphere, 2017, 176: 156-164. DOI:10.1016/j.chemosphere.2017.02.113 |
| [28] |
姜锦林, 单正军, 周军英, 等. 常用农药对赤子爱胜蚓急性毒性和抗氧化酶系的影响[J]. 农业环境科学学报, 2017, 36(3): 466-473. JIANG Jin-lin, SHAN Zheng-jun, ZHOU Jun-ying, et al. Influence of commonly used pesticides on acute toxicity to earthworm Eisenia fetida and alteration of antioxidant enzyme activities[J]. Journal of Agro-Environment Science, 2017, 36(3): 466-473. |
| [29] |
吴尔苗, 王军良, 赵士良, 等. 菲和芘单一及复合污染对蚯蚓抗氧化酶活性和丙二醛含量的影响[J]. 环境科学学报, 2011, 31(5): 1077-1085. WU Er-miao, WANG Jun-liang, ZHAO Shi-liang, et al. Effect of single and combined pollution of Phe, Pyr on SOD, CAT activities and MDA content of Eisenia foetida in soils[J]. Acta Scientiae Circumstantiae, 2011, 31(5): 1077-1085. |
| [30] |
吕小慧, 陈白杨, 朱小山. 氧化石墨烯的水环境行为及其生物毒性[J]. 中国环境科学, 2016, 36(11): 3348-3359. LÜ Xiao-hui, CHEN Bai-yang, ZHU Xiao-shan. Fate and toxicity of graphene oxide in aquatic environment[J]. China Environmental Science, 2016, 36(11): 3348-3359. DOI:10.3969/j.issn.1000-6923.2016.11.019 |
| [31] |
薛银刚, 王晓蓉, 顾雪元, 等. 四溴双酚A对赤子爱胜蚓的急性毒性及抗氧化防御系统酶的影响[J]. 生态毒理学报, 2009, 4(1): 93-100. XUE Yin-gang, WANG Xiao-rong, GU Xue-yuan, et al. Acute toxicity of tetrabromobisphenol A to earthworms Eisenia fetida and its effects on antioxidant defense system enzymes[J]. Asian Journal of Ecotoxicology, 2009, 4(1): 93-100. |
| [32] |
Fazeli F, Ghorbanli M, Niknam V. Effect of drought on biomass, protein content, lipid peroxidation and antioxidant enzymes in two sesame cultivars[J]. Biologia Plantarum, 2007, 51(1): 98-103. DOI:10.1007/s10535-007-0020-1 |
 2019, Vol. 38
2019, Vol. 38



