2. 贵州大学应用生态研究所, 贵阳 550025;
3. 贵州省喀斯特环境生态工程研究中心, 贵阳 550025
2. Institute of applied ecology, Guizhou University, Guiyang 550025, China;
3. Karst Eco-Environmental Engineering Research Center of Guizhou Province, Guiyang 550025, China
贵州黔西北铅锌冶炼活动已有上百年的历史,是我国土法炼锌活动最为典型的区域之一[1]。虽然该区域土法炼锌活动已在2006年时被彻底取缔,但在长期冶炼活动中产生的大量铅锌废渣中Pb、Zn、Cd、Cu等重金属含量高,且因废渣物理结构差、植物必需的营养元素缺乏、微生物活性低等因素,严重限制了铅锌废渣堆场植物的生长及其他生物的活动[2]。长期裸露的铅锌废渣中的重金属极易通过降雨冲刷及地表径流、渗滤液、地下水和大风扬尘等途径迁移扩散至周边水体、土壤、大气等环境介质中及覆盖农作物表面,严重威胁周边及下游地区的水质安全、农产品食品安全和生态安全[3-4],故亟需在铅锌冶炼废渣堆场上及时开展生态恢复及其污染控制的工作。
植被重建是一种经济且持续有效的矿渣废弃地植物生态恢复措施[5]。由于废渣堆场特殊的生境,在一定程度上影响了植物的生长繁殖。然而在自然条件下,部分植物能够适应矿渣堆场恶劣的生态环境并在堆场上自然生长、定植[6-7]。在长期自然选择的作用下,对矿渣高重金属污染的特殊生境产生了独特的耐性机制[8-9]以适应环境变化,成为废渣堆场自然恢复植被中的先锋植物。这类修复植物不仅生长速度快、性状优良,还能改善恶劣生境[10],为后期各类植物的着生创造优良的条件,从而为植物群落的演替奠定良好的基础[11]。因此,选择能对高重金属污染矿渣堆场进行生境改善的修复植物是生态恢复成功与否的关键因素。许多学者对铅锌尾矿上生长的植物的生态适应性进行了广泛研究。研究结果表明银合欢[12](Leucaena leucocephala)、长喙田菁[13](Sesbania rostrata)对Pb、Zn等重金属有一定的耐性;邢丹等[14]在筛选黔西北铅锌冶炼废渣堆场中的耐重金属植物优势种时,发现大叶醉鱼草(Buddleja davidii)具有耐旱、耐贫瘠的特点,可作为铅锌废渣堆场重金属耐性先锋植物。本课题组野外调查发现,土法炼锌废渣堆场上自然定居有许多类芦[Neyraudia reynaudiana(Kunth)Keng ex Hitchc.]和土荆芥(Chenopodium ambrosioides L.),而目前关于铅锌冶炼废渣上自然定居的类芦和土荆芥的生态适应性及其生态修复潜力的研究尚未见报道。此外,作为植物受污染胁迫时优先作出响应的根际微环境,因其特殊的物理、化学及生物学特性,已成为研究植物-土壤-微生物之间相互作用的重要微域[15],先锋植物根际微环境对废渣重金属的生物地球化学过程[16]、尾矿基质理化特性及微生物活性[17]等方面具有重要的影响。
因此,本文以贵州省威宁县猴场镇群发村土法炼锌废渣堆场上自然定居的类芦和土荆芥为研究对象,分析自然定居植物根际重金属的迁移转化特征以及两种植物对废渣基质养分积累及酶活性改善的状况,旨在明晰两种自然定居植物对土法炼锌废渣堆场的生态适应性及生态修复潜力,以期更好地为黔西北铅锌废渣重金属污染治理和植被恢复物种的选择提供理论依据。
1 材料与方法 1.1 研究区概况黔西北(水城、赫章、威宁等)是贵州铅锌矿分布的主要地区(26°21′ ~27°46′ N,103°36′ ~106°43′ E),属亚热带季风气候。地势西高东低,海拔差在2000 m左右,气候垂直差异大。夏季温凉,冬季寒冷,年平均气温10.5~15.5 ℃,年平均降雨量950~1100 mm。该区属于亚热带常绿阔叶林区,植物资源十分丰富。
研究区域位于贵州省威宁县猴场镇群发村(26°41′ 34″ N,104°44′ 0.384″ E),堆场主体废弃物为土法炼锌后排放的废渣,主要包括铅锌矿冶炼矿渣、烧结罐残片、耐火砖块、煤灰渣等,废渣中Pb、Zn、Cu、Cd等重金属含量很高。该废渣堆场多年来无人管护,自然生长着几种植物,处于自然恢复状态。
类芦[Neyraudia reynaudiana(Kunth)Keng ex Hitchc.]属于多年生禾本科类芦属,秆形高大,为强阳性草种,生长速度快,自然更新能力强,生物量大,能够适应各种逆境因子,抗逆性强,耐干旱、瘠薄、盐碱、高温、严寒。土荆芥(Chenopodium ambrosioides L.)为黎科黎属一年生或多年生草本,有强烈臭气,茎直立,分枝繁茂,具有生长快、生物量大的特点。实验采集的类芦和土荆芥均为多年生植物,在废渣堆场自然生长多年。
1.2 样品采集与测定以研究区域内成群生长的两种自然定居植物(土荆芥和类芦)为研究对象,选取长势基本相同的两种先锋植物各5株,小心将植株连根拔起,采用抖落法分别获得根际和非根际废渣,同时在同一区域内选择无植被生长的裸露废渣作为对照。将所采集的废渣样品混匀后装入无菌袋密封保存带回实验室,采回的废渣去除其中的大颗粒石子及植物根系后采用四分法分成两份,一份废渣置于4 ℃冰箱中保存,用于废渣酶活性、呼吸强度等指标的测定。另一份废渣放在室内通风处自然风干后研磨、过筛,用于测定铅锌冶炼废渣的理化性质等指标。两种植物样品先用自来水洗净后,再用去离子水漂洗干净,105 ℃杀青30 min,75 ℃烘干,称量后粉碎,过100目尼龙筛,放入干燥箱备用。
废渣理化性质测定主要参照《土壤农化分析方法》 [18]。pH和电导率(EC)分别采用玻璃电极法和原位电极法(废渣:水=1:2.5)测定,有效氮采用碱解扩散法测定,有效磷采用0.5 mol·L-1NaHCO3溶液浸提-钼锑抗比色法测定,总氮采用H2SO4-HClO4消煮-蒸馏法测定,总磷采用H2SO4-HClO4消煮-钼锑抗比色法测定,有机质采用高温外加热重铬酸钾氧化-容量法测定,速效钾含量采用1 mol·L-1乙酸铵浸提-原子吸收分光光度法测定。
基质脲酶活性采用靛酚蓝比色法测定,蔗糖酶活性采用3,5-二硝基水杨酸比色法测定,碱性磷酸酶活性采用磷酸苯二钠比色法测定,过氧化氢酶活性采用高锰酸钾滴定法测定[19];废渣呼吸作用强度采用静止培养-碱液吸收滴定法测定[18]。所用容器均用5%HNO3浸泡24 h后使用,避免重金属的各种可能性污染。废渣重金属总量采用盐酸-硝酸-高氯酸消解;植物样品重金属含量采用硝酸-高氯酸消解;参照张朝阳等[20]改进BCR连续提取法,将废渣中重金属的形态分为可交换态、可还原态、可氧化态及残渣态。植物样品消解液和重金属总量及各形态提取液中Cu、Pb、Zn、Cd的含量采用原子吸收光谱仪(ICE3500,美国热电)测定。
1.3 数据处理转运系数=[(茎部某重金属含量×茎部质量+叶部该重金属含量×叶部质量)(/茎部质量+叶部质量)]/根部该重金属含量
富集系数=[(根部某重金属含量×根部质量+茎部该重金属含量×茎部质量+叶部该重金属含量×叶部质量)(/根部质量+茎部质量+叶部质量)]/废渣中该重金属含量
用Excel 2017对实验数据进行处理和分析,IBM SPSS Statistics 22.0软件进行ANOVA方差分析、多重比较(Duncans法)和Pearson相关性分析。
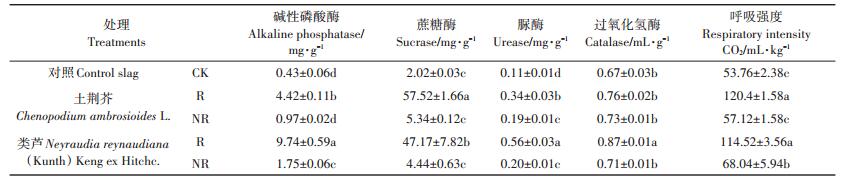
2 结果与分析 2.1 先锋植物对废渣基质基本理化性质的影响由废渣基质pH和EC的变化可知(表 1),土荆芥和类芦根际废渣的pH值均显著低于对照废渣(P <0.05),表明两种自然定居植物在铅锌废渣堆场上的生长对其根际废渣具有一定的酸化作用。废渣EC值总体表现为:非根际>根际>对照。其中,土荆芥非根际废渣中EC显著高于对照废渣、土荆芥根系废渣、类芦根际和非根际废渣(P <0.05),土荆芥和类芦生长可不同程度地增加其根际和非根际废渣的电导率。
|
|
表 1 植物根际和非根际废渣基质理化性质 Table 1 Physico-chemical characteristics of the rhizosphere and non-rhizosphere slags |
与对照废渣相比(表 1),植物存在可显著增加其根际废渣基质养分含量(P <0.05),土荆芥和类芦根际废渣基质中全磷、全氮、有效磷、有效氮、速效钾和有机质含量分别是对照废渣的4.15、4.94、3.76、2.43、7.05、1.99倍和3.69、2.85、3.37、3.09、2.95、1.75倍,表现出明显的根际聚集现象。不同植物根际废渣中的养分也存在显著差别,土荆芥根际废渣基质中全磷、全氮、有效磷、速效钾和有机质含量均高于类芦根际废渣,且两种植物根际废渣基质中全氮和速效钾的含量存在显著差异(P <0.05);就有效氮而言,类芦根际废渣基质有效氮含量显著高于对照及土荆芥根际废渣(P <0.05)。
2.2 先锋植物对废渣基质酶活性及呼吸作用强度的影响从废渣基质酶活性(表 2)可看出,同有植被覆盖的废渣相比,裸露废渣(对照)酶活性较低,其碱性磷酸酶、蔗糖酶、脲酶、过氧化氢酶活性分别为0.43 mg· g-1、2.02 mg·g-1、0.11 mg·g-1、0.67 mL·g-1。土荆芥和类芦植被的自然定居和生长增加了其根际废渣基质中的酶活性,根际废渣基质酶活性除过氧化氢酶外均显著高于非根际及对照(P <0.05),两种先锋植物表现出强烈的根际修复效应。但两种植物对废渣基质酶活性的影响存在显著差异,具体表现为:类芦根际废渣中碱性磷酸酶、脲酶及过氧化氢酶活性显著高于土荆芥根际及非根际废渣(P <0.05),而类芦根际废渣基质蔗糖酶活性却显著低于土荆芥根际废渣(P <0.05)。就废渣基质呼吸强度而言,对照废渣的呼吸强度为53.76 mL·kg-1,土荆芥、类芦根际废渣基质的呼吸强度均显著高于对照及其相应的非根际废渣(P <0.05),但两种先锋植物根际废渣的呼吸强度间无显著差异(P>0.05)。
|
|
表 2 植物根际和非根际废渣基质酶活性及呼吸强度 Table 2 Enzyme activity and respiratory intensity of the rhizosphere and non-rhizosphere slags |
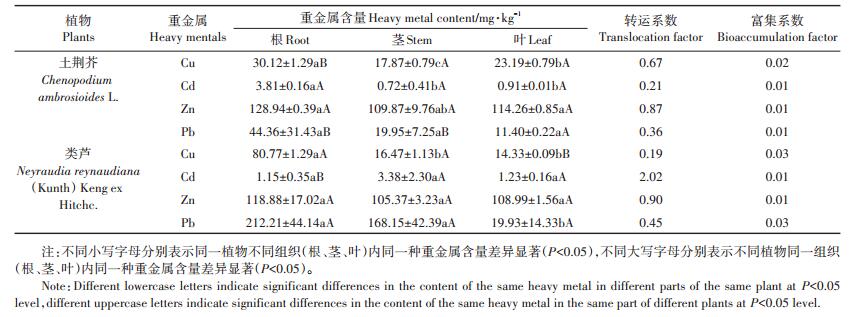
从植物不同部分重金属含量(表 3)可知,土荆芥和类芦根部组织中Cd、Cu、Zn、Pb的含量均高于茎部或叶部的含量(除类芦根部Cd的含量较低外),且土荆芥根部Cu、Cd含量及类芦根部Cu含量显著高于其茎部或叶部相应的重金属含量(P <0.05),说明两种先锋植物的根部是吸收积累废渣中Cd、Cu、Zn、Pb的主要部位。但两种植物根部对重金属的吸收积累能力不同,类芦根部Cu、Pb含量显著高于土荆芥根部(P <0.05),分别是土荆芥根部的2.68、4.78倍。就两种先锋植物对重金属的富集系数和转移系数而言,土荆芥和类芦对Cu、Pb、Zn、Cd的富集系数均较低(0.01~ 0.03);除类芦对Cd具有较高的转运系数(2.02)外,土荆芥和类芦对其他重金属Cu、Cd、Zn、Pb的转运系数均小于1。
|
|
表 3 植物体内重金属含量及其转运系数与富集系数 Table 3 Heavy metal contents in different parts of plants and their translocation and bioaccumulation factors |
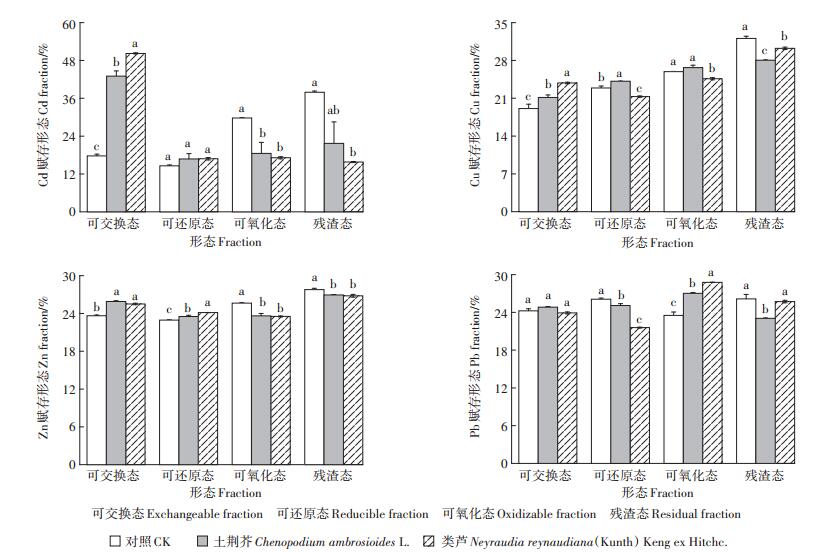
由两种自然定居植物根际微域及对照废渣重金属的赋存形态特征可知(图 1),对照废渣中Cd、Cu、Zn、Pb化学形态分布比例分别为:残渣态˃可氧化态˃可交换态˃可还原态;残渣态˃可氧化态˃可还原态˃可交换态;残渣态˃可氧化态˃可交换态˃可还原态;残渣态˃可还原态˃可交换态˃可氧化态;残渣态是对照废渣重金属Cd、Cu、Zn、Pb的主要存在形态。与对照废渣相比,两种先锋植物生长对其根际废渣基质中Cd、Cu、Zn、Pb赋存形态所占比例具有明显影响。总体上,植物生长促进根际废渣基质中残渣态Cd、Cu、Zn、Pb向可交换态转化,具体表现如下:
|
不同小写字母表示不同植物根际废渣相同重金属形态比例差异显著(P<0.05) The different lowercase letters indicate significant differences in the same heavy metal fraction in the rhizosphere slags of different plants at P<0.05 level 图 1 植物根际废渣基质各重金属赋存形态分布 Figure 1 Distribution of chemical fractions of heavy metals in the rhizosphere slags |
土荆芥根际废渣基质中Cd以可交换态为主(占43.04%),Cd可交换态比例较对照废渣增加了25.31%,而Cd可氧化态和残渣态所占比例分别较对照废渣降低了11.24%、16.23%。土荆芥根际废渣基质中的Cu以残渣态为主,但其残渣态比例(28.04%)较对照废渣(32.08%)要低,土荆芥根际废渣中Cu可交换态、可还原态比例均显著高于对照废渣(P <0.05)。土荆芥根际废渣基质残渣态是Zn的主要赋存形态,但根际废渣基质中Zn残渣态、可氧化态比例较对照均有显著降低,而Zn可交换态和可还原态比例较对照废渣有显著增加(P <0.05)。土荆芥根际废渣基质中Pb以可氧化态为主,可氧化态比例(27.03%)高于对照废渣(23.52%),但其可还原态和残渣态比例均显著低于对照废渣(P <0.05),可交换态比例有所增加,但与对照相比差异不显著(P>0.05)。
类芦根际废渣基质中Cd以可交换态为主,占50.23%,较对照废渣Cd可交换态比例增加了32.50%,而类芦根际废渣Cd可氧化态、残渣态比例分别较对照废渣降低了12.61%、22.14%。残渣态是类芦根际废渣基质中Cu、Zn的主要赋存形态,但根际废渣基质中Cu除可交换态比例较对照废渣增加外,可还原态、可氧化态、残渣态比例均显著低于对照(P <0.05);类芦根际废渣基质中Zn可交换态和可还原态比例高于对照废渣,而根际废渣基质中Zn可氧化态、残渣态比例较对照均有所降低,且差异显著(P <0.05)。与对照废渣相比,类芦根际废渣基质中Pb以可氧化态为主,所占比例较高(28.77%),可还原态比例为21.58%,显著低于对照(P <0.05),而其交换态、残渣态比例与对照相比差异不明显(P>0.05)。
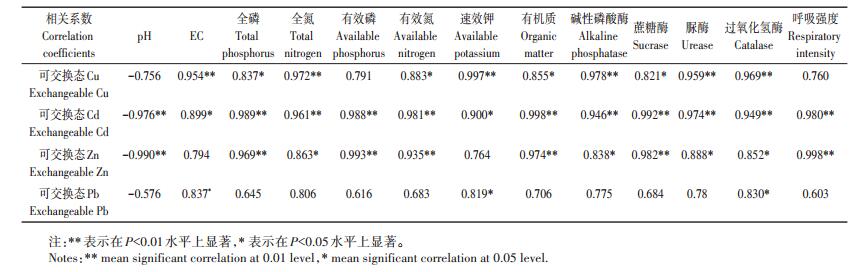
2.5 植物根系废渣重金属可交换态含量及其理化性质的相关性根系废渣中重金属可交换态含量的变化与废渣基质理化因子之间表现出一定的相关性(表 4),废渣中可交换态Cu、Cd、Zn、Pb与EC、全磷、全氮、有效磷、有效氮、速效钾、有机质、酶活性及呼吸作用强度间均呈正相关关系。可交换态Cu与全磷、有效氮、有机质及蔗糖酶之间,可交换态Cd与EC和速效钾之间,可交换态Zn与全氮、碱性磷酸酶、脲酶及过氧化氢酶之间,可交换态Pb与EC、速效钾及过氧化氢酶之间呈显著正相关(P <0.05)。可交换态Cu与EC、全氮、速效钾、碱性磷酸酶、脲酶及过氧化氢酶之间呈极显著(P <0.01)正相关;可交换态Cd与全磷、全氮、有效磷、有效氮、有机质、酶活性及呼吸强度间呈极显著(P <0.01)正相关;可交换态Zn与全磷、有效磷、有效氮、有机质、蔗糖酶和呼吸强度之间呈极显著正相关(P <0.01)。pH与可交换态Cu、Cd、Zn、Pb呈负相关,且可交换态Cd、Zn与pH表现出极显著负相关性(P <0.01)。整体而言,修复植物根际废渣中EC、全磷、全氮、有效磷、有效氮、速效钾、有机质、酶活性及呼吸作用强度等含量越高,废渣中Cu、Cd、Zn、Pb可交换态重金属含量也相应增加。
|
|
表 4 先锋植物根际废渣重金属可交换态含量及其理化性质间的相关系数 Table 4 Correlation coefficients between exchangeable heavy metals and physico-chemical factors in rhizosphere |
土法炼锌废渣堆场由于重金属含量高、极端pH值(强碱性)、物理结构差、养分贫瘠等特性,加上黔西北威宁高寒地区降雨偏少、蒸发量大,不利于植被恢复。长期以来大量废弃铅锌渣场处于寸草不生的裸露状态。尽管如此,随着废渣在自然环境中堆置时间的增加,少数适应这种极端生境的先锋植物逐渐在废渣堆场上自然定居。这些自然定居的先锋植物根系可通过呼吸、分泌、吸收等作用[7]改善废渣基质理化及微生物学特性。废渣pH和EC的变化(表 1)表明,与对照废渣相比,土荆芥和类芦生长可分别降低和增加废渣基质的pH和EC值,其原因可能是两种自然定居植物在响应环境胁迫时所释放的根际分泌物对废渣具有一定的酸化作用[21-22],解离出的H+使基质中阴阳离子吸收失衡,从而导致植物根际微域的pH值下降;先锋植物在酸化根际废渣的同时对废渣矿物质也有一定的溶解作用,进而可不同程度增加根际废渣基质溶液离子浓度。
两种先锋植物根际废渣基质养分(有效磷、有效氮、全磷、全氮、速效钾和有机质)含量显著增加(表 1),根际聚集现象明显,这与孟令军等[23]研究结果相似。其原因主要有两个方面:一是植物可以通过调节自身生命过程来适应极端生境,当环境中各种矿物营养缺乏时会刺激根系向周围环境中释放大量有机物和无机物[24],使根际土壤养分含量明显提高。二是植物根系分泌物中含有较高浓度的碳水化合物、氨基酸等物质,为根际微生物的生存和繁殖提供了丰富的碳源和氮源,促进根际微生物大量繁殖。根系分泌物中的一些有机酸和活性物质也可通过溶解及络合溶解作用、羧基配位交换作用、还原作用等解离和转化一些难溶性矿物,释放养分元素进而增加基质养分有效性[25]。
废渣的呼吸强度是指废渣微生物活动中释放CO2的过程,可用来衡量废渣微生物的总活性。两种先锋植物根际废渣呼吸强度增加(表 2),主要是由于植物根际效应的存在,根系分泌物中大量小分子化合物可作为化感物质为微生物的大量增殖创造有利条件,使得根际范围内具有很高的微生物生物活性[26-27],从而增加基质的呼吸强度。先锋植物根际废渣基质酶活性的提高,不仅与根系响应环境胁迫促进酶类物质的分泌有关[28],而且微生物活性的增加使微生物在其生命活动中能不断地向外界环境释放胞外酶,或者死亡后由细胞自溶作用解脱出胞内酶[29-30],使酶活性增强。
土荆芥和类芦根部是Cu、Cd、Zn、Pb的主要吸收积累部位。Mendez等[31]研究表明,植物通过将吸收的重金属元素囤积在根部,减少其向地上部转移,从而减少对光合、呼吸、生殖系统的伤害,来维持植物正常的生长。类芦对Cd具有较高的转运系数,表明类芦在吸收重金属Cd后表现出一定的向茎或叶转移的能力,可能发展了某种特殊的生理机制,如通过主动运输将重金属运送到液泡、叶脉、木质部等部位贮存起来,减少重金属毒性并保障植物正常生长[32]。两种自然定居植物对Cu、Cd、Zn、Pb富集系数均较小,表明土荆芥和类芦对Cu、Cd、Zn、Pb富集能力较低。虽然对重金属的富集能力远弱于超积累植物,但两种植物能够在高重金属的土法炼锌废渣堆场上自然生长,表明其对废渣的极端生境具有较强的生态适应性,可能通过某种外部机制,不吸收或者少吸收生长环境中高含量的重金属进行自我保护,从而避免遭受生理毒害。因此,土荆芥和类芦可作为土法炼锌废渣堆场植被重建或生态修复前期工程的先锋优势植物。
由植物根际微域和对照废渣重金属的赋存形态可知(图 1),对照废渣中Cd、Cu、Zn、Pb主要以残渣态存在,可能是因为废渣经过长时间的地球化学风化过程,所释放的重金属被硅酸盐和其他原生、次生的稳定矿物固定[33]。根据重金属各形态的生物利用性大小可以把各种化学形态分为生物有效态、潜在有效态和不可利用态[34]。其中可交换态的重金属容易被生物吸收,也被称作生物有效态,生物有效性高[35]。先锋植物的定居改变了废渣微环境,促进废渣基质中Cd、Cu、Zn、Pb化学形态再分布,总体上交换态含量增加,即生物有效态含量增加。影响重金属生物有效态含量的因素有很多,包括pH、EC、有机质、重金属元素的化合物种类甚至土壤根系分泌物等[36]。只要外界环境条件稍加改变,就可能立刻引起废渣对重金属的吸附-解吸行为,进而导致重金属存在形态的改变。
重金属生物有效态含量增加主要有以下几方面的原因:一是废渣酸碱度(pH),它是影响废渣重金属形态转化的主要因素,不仅决定了各种废渣矿物的溶解度,而且影响废渣中重金属离子在固相上的吸附程度[37-38]。在两种植物根际环境中,根际pH显著低于对照废渣,可交换态Cd、Cu、Zn、Pb与pH值表现出负相关性(表 4),根际pH值的降低对重金属产生了一定的活化作用,增加了重金属生物有效态含量。二是电导率(EC)的大小反映废渣中水溶性盐类的含量,废渣中存在着诸如Na+、K+、Ca2+、Mg2+等强电解质在内的水溶性盐类,它们与重金属离子竞争废渣表面的吸附位点,植物根系电导率的增加,使两者之间的竞争力增大,从而会降低废渣对重金属的专性吸附。表 4中可交换态Cu、Cd、Zn、Pb与EC值呈显著正相关的结果也证明了这一点。三是有机质是控制重金属迁移、生物可利用程度及毒性的影响因素之一,是形成重金属络合物的重要组分。废渣有机质含有大量的功能基团,可以和废渣中重金属通过螯合或者络合作用,形成有机-金属配合物,在一定程度上提高了重金属的可溶性[39-40]。四是根系分泌物是保持根际微生态系统活力的关键因素。根际环境由于根系分泌物的存在,不仅有效改善了根际环境中废渣养分状况,而且根际活动能改变重金属在废渣中的存在形态,通过酸化根际环境,与废渣重金属发生络合等作用而使根际废渣中的重金属活化[41]。而且根系分泌物能为根际废渣微生物提供碳源和氮源,由于根际废渣中动物、植物和微生物的联合作用,使重金属在根际废渣中的活动更旺盛[42],增加了根际废渣基质重金属的生物有效性。
4 结论(1)土法炼锌废渣呈碱性且养分贫瘠,土荆芥和类芦在铅锌废渣上的自然定居生长可有效改善废渣基质的理化性质及微生物特性。同无植被覆盖的裸渣(对照)相比,废渣基质养分、酶活性及呼吸强度均有显著的增加,使废渣朝着良性方向发展,可以作为生境改善植物应用于废渣堆场的前期生态修复中。
(2)两种自然定居植物根部是重金属的主要吸收积累部分,除类芦对Cd的转运系数较高,土荆芥对Cd、Cu、Zn、Pb及类芦对Cu、Zn、Pb的转运系数均小于1。两种植物都能在高重金属的极端生境中生长,表现出对土法炼锌废渣环境较强的生态适应性。
(3)根际废渣基质中全磷、全氮、有效磷、速效钾、有机质等理化因子与可交换态Cd、Cu、Zn、Pb之间呈正相关关系。土荆芥和类芦的定居改变了根际废渣的微环境,促进了Cd、Cu、Zn、Pb残渣态向可交换态转化,重金属生物有效态含量增加,提高了重金属的生物有效性。
| [1] |
Yang Y G, Li S, Bi X Y, et al. Lead, Zn, and Cd in slags, stream sediments, and soils in an abandoned Zn smelting region, southwest of China, and Pb and S isotopes as source tracers[J]. Journal of Soils and Sediments, 2010, 10(8): 1527-1539. DOI:10.1007/s11368-010-0253-z |
| [2] |
林文杰, 肖唐付, 敖子强, 等. 黔西北土法炼锌废弃地植被重建的限制因子[J]. 应用生态学报, 2007, 18(3): 631-635. LIN Wen-jie, XIAO Tang-fu, AO Zi-qiang, et al. Limiting factors of waste land revegation in indigenous zinc smelting areas of western Guizhou[J]. Chinese Journal of Applied Ecology, 2007, 18(3): 631-635. DOI:10.3321/j.issn:1001-9332.2007.03.029 |
| [3] |
Zhang X W, Yang L S, Li Y H, et al. Impacts of lead/zinc mining and smelting on the environment and human health in China[J]. Environment Monitoring and Assessment, 2012, 184(4): 2261-2273. DOI:10.1007/s10661-011-2115-6 |
| [4] |
Bi X Y, Feng X B, Yang Y G, et al. Environmental contamination of heavy metals from zinc smelting areas in Hezhang County western Guizhou, China[J]. Environment International, 2006, 32(7): 883-890. DOI:10.1016/j.envint.2006.05.010 |
| [5] |
Mcgrath S P, Zhao F J, Lombi E, et al. Phytoremediation of metals, metalloids, and radionuclides[J]. Advances in Agronomy, 2002, 75(2): 1-56. |
| [6] |
赵玉红, 敬久旺, 王向涛, 等. 藏中矿区先锋植物重金属积累特征及耐性研究[J]. 草地学报, 2016, 24(3): 598-603. ZHAO Yu-hong, JING Jiu-wang, WANG Xiang-tao, et al. Study of heavy metal bioaccumulation characteristic and tolerance of pioneer plants from central tibet mining area[J]. Acta Agrestia Sinica, 2016, 24(3): 598-603. |
| [7] |
Lei D M, Duan C Q. Restoration potential of pioneer plants growing on lead-zinc mine tailings in Lanping, southwest China[J]. Journal of Environmental Sciences, 2008, 20(10): 1202-1209. DOI:10.1016/S1001-0742(08)62210-X |
| [8] |
雷冬梅, 段昌群, 张红叶. 矿区废弃地先锋植物齿果酸模在Pb、Zn污染下抗氧化酶系统的变化[J]. 生态学报, 2009, 29(10): 5417-5423. LEI Dong-mei, DUAN Chang-qun, ZHANG Hong-ye. Lead and zinc induced changes in activity of antioxidant enzymes of rumexdentatus, a kind of pioneer plant growing on mining tailings[J]. Acta Ecologica Sinica, 2009, 29(10): 5417-5423. DOI:10.3321/j.issn:1000-0933.2009.10.028 |
| [9] |
Hall J L. Cellular mechanisms for heavy metal detoxification and tolerance[J]. Journal of Experimental Botany, 2002, 53(366): 1-11. |
| [10] |
Mahdavian K, Ghaderian S M, Torkzadeh-Mahani M, et al. Accumulation and phytoremediation of Pb, Zn, and Ag by plants growing on Koshk lead-zinc mining area, Iran[J]. Journal of Soils and Sediments, 2017, 17(5): 1310-1320. DOI:10.1007/s11368-015-1260-x |
| [11] |
任海, 彭少麟, 陆宏芳. 退化生态系统恢复与恢复生态学[J]. 生态学报, 2004, 24(8): 1760-1768. REN Hai, PENG Shao-lin, LU Hong-fang. The restoration of degraded ecosystems and restoration ecology[J]. Acta Ecological Sinica, 2004, 24(8): 1760-1768. |
| [12] |
Zhang Z Q, Shu W S, Lan C Y, et al. Soil seed bank as an input of seed source in revegetation of lead/zinc mine tailings[J]. Restoration Ecology, 2001, 9(4): 378-385. DOI:10.1046/j.1526-100X.2001.94007.x |
| [13] |
Wong M H. Ecological restoration of mine degraded soils, with emphasis on metal contaminated soils[J]. Chemosphere, 2002, 50(6): 775-780. |
| [14] |
邢丹, 刘鸿雁, 于萍萍, 等. 黔西北铅锌矿区植物群落分布及其对重金属的迁移特征[J]. 生态学报, 2012, 32(3): 796-804. XING Dan, LIU Hong-yan, YU Ping-ping, et al. The plant community distribution and migration characteristics of heavy metals in tolerance dominant species in lead/zinc mine areas in Northwestern Guizhou Province[J]. Acta Ecologica Sinica, 2012, 32(3): 796-804. |
| [15] |
Watt M, Silk W K, Passioura J B, et al. Rates of root and organism growth, soil conditions, and temporal and spatial development of the rhizosphere[J]. Annals of Botany, 2006, 97(5): 839-855. DOI:10.1093/aob/mcl028 |
| [16] |
Kidd P, Barceló J, Bernal M P, et al. Trace element behaviour at the root-soil interface:Implications in phytoremediation[J]. Environmental and Experimental Botany, 2009, 67(1): 243-259. DOI:10.1016/j.envexpbot.2009.06.013 |
| [17] |
Tao S, Liu W X, Chen Y J, et al. Evaluation of factors influencing root-induced changes of copper fractionation in rhizosphere of a calcareous soil[J]. Environmental Pollution, 2004, 129(1): 5-12. |
| [18] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999: 239-240. LU Ru-kun. Methods for chemical analysis of soil agriculture[M]. Beijing: China Agricultural Science and Technology Press, 1999: 239-240. |
| [19] |
关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986: 274-340. GUAN Song-yin. Soil enzyme and its research methods[M]. Beijing: Agricultural Press, 1986: 274-340. |
| [20] |
张朝阳, 彭平安, 刘承帅, 等. 改进BCR法分析国家土壤标准物质中重金属化学形态[J]. 生态环境学报, 2012, 21(11): 1881-1884. ZHANG Chao-yang, PENG Ping-an, LIU Cheng-shuai, et al. Utilization of modified BCR procedure for the chemical speciation of heavy metals in Chinese soil reference material[J]. Ecology and Environmental Sciences, 2012, 21(11): 1881-1884. DOI:10.3969/j.issn.1674-5906.2012.11.019 |
| [21] |
赵宽, 周葆华, 马万征, 等. 不同环境胁迫对根系分泌有机酸的影响研究进展[J]. 土壤, 2016, 48(2): 235-240. ZHAO Kuan, ZHOU Bao-hua, MA Wan-zheng, et al. The influence of different environmental stresses on root-exuded organic acids:A review[J]. Soils, 2016, 48(2): 235-240. |
| [22] |
López-Bucio J, Nieto-Jacobo M F, Ramírez-Rodríguez V, et al. Organic acid metabolism in plants:From adaptive physiology to transgenic varieties for cultivation in extreme soils[J]. Plant Science, 2000, 160(1): 1-13. DOI:10.1016/S0168-9452(00)00347-2 |
| [23] |
孟令军, 耿增超, 殷金岩, 等. 秦岭太白山区6种中草药根际与非根际土壤化学性质及酶活性[J]. 应用生态学报, 2012, 23(10): 2685-2692. MENG Ling-jun, GENG Zeng-chao, YIN Jin-yan, et al. Chemical properties and enzyme activities of rhizosphere and nonrhizosphere soils under six Chinese herbal medicines on Mt. Taibai of Qinling Mountains, Northwest China[J]. Chinese Journal of Applied Ecology, 2012, 23(10): 2685-2692. |
| [24] |
旷远文, 温达志, 钟传文, 等. 根系分泌物及其在植物修复中的作用[J]. 植物生态学报, 2003(5): 709-717. KUANG Yuan-wen, WEN Da-zhi, ZHONG Chuan-wen, et al. Root exudates and their roles in phytoremediation[J]. Acta Phytoecologica Sinica, 2003(5): 709-717. DOI:10.3321/j.issn:1005-264X.2003.05.020 |
| [25] |
罗永清, 赵学勇, 李美霞. 植物根系分泌物生态效应及其影响因素研究综述[J]. 应用生态学报, 2012, 23(12): 3496-3504. LUO Yong-qing, ZHAO Xue-yong, LI Mei-xia. Ecological effect of plant root exudates and related affecting factors:A review[J]. Chinese Journal of Applied Ecology, 2012, 23(12): 3496-3504. |
| [26] |
Wurst S, Wagenaar R, Biere A, et al. Microorganisms and nematodes increase levels of secondary metabolites in roots and root exudates of Plantago lanceolata[J]. Plant and Soil, 2010, 329(1/2): 117-126. |
| [27] |
Broeckling C D, Broz A K, Bergelson J, et al. Root exudates regulate soil fungal community composition and diversity[J]. Applied and Environmental Microbiology, 2008, 74(3): 738-744. DOI:10.1128/AEM.02188-07 |
| [28] |
Georgea T S, Gregory P J, Wooda M, et al. Phosphatase activity and organic acids in the rhizosphere of potential agroforestry species and maize[J]. Soil Biology and Biochemistry, 2002, 34(10): 1487-1494. DOI:10.1016/S0038-0717(02)00093-7 |
| [29] |
Burns R G. International conference:Enzymes in the environment:Activity, ecology and applications[J]. Soil Biology and Biochemistry, 2000, 32(13): 1815. DOI:10.1016/S0038-0717(00)00154-1 |
| [30] |
魏亮, 汤珍珠, 祝贞科, 等. 水稻不同生育期根际与非根际土壤胞外酶对施氮的响应[J]. 环境科学, 2017, 38(8): 3489-3496. WEI Liang, TANG Zhen-zhu, ZHU Zhen-ke, et al. Responses of extracellular enzymes to nitrogen application in rice of various ages with rhizosphere and bulk soil[J]. Environmental Science, 2017, 38(8): 3489-3496. |
| [31] |
Mendez M O, Maier R M. Phytostabilization of mine tailings in arid and semiarid environments:An emerging remediation technology[J]. Environmental Health Perspectives, 2007, 116(3): 278-283. |
| [32] |
Salt D E, Blaylock M, Kumar N P, et al. Phytoremediation:A novel strategy for the removal of toxic metals from the environment using plants[J]. Biotechnology, 1995, 13(5): 468-474. |
| [33] |
李宇庆, 陈玲, 仇雁翎, 等. 上海化学工业区土壤重金属元素形态分析[J]. 生态环境, 2004, 13(2): 154-155. LI Yu-qing, CHEN Ling, QIU Yan-ling, et al. Speciation of heavy metals in soil from Shanghai chemical industry park[J]. Ecological Environment, 2004, 13(2): 154-155. DOI:10.3969/j.issn.1674-5906.2004.02.002 |
| [34] |
王美青, 章明奎. 杭州市城郊土壤重金属含量和形态的研究[J]. 环境科学学报, 2002, 22(5): 603-608. WANG Mei-qing, ZHANG Ming-kui. Concentrations and chemical associations of heavy metals in urban and suburban soils of Hangzhou City, Zhejiang Province[J]. Acta Scientiae Circumstantiae, 2002, 22(5): 603-608. DOI:10.3321/j.issn:0253-2468.2002.05.012 |
| [35] |
Violante A, Cozzolino V, Perelomov L, et al. Mobility and bioavailability of heavy metals and metalloids in soil environments[J]. Journal of Soil Science and Plant Nutrition, 2010, 10(3): 268-292. |
| [36] |
廉梅花.根际土壤中重金属的活化因素及作用机理研究[D].沈阳: 东北大学, 2016: 29-35. LIAN Mei-hua. Study on the activating factors and mechanisms of heavy metals in rhizosphere soil[D]. Shenyang: Northeastern University, 2016: 29-35. http://cdmd.cnki.com.cn/Article/CDMD-10145-1018079453.htm |
| [37] |
Mcbride M B. Cadmium uptake by crops estimated from soil total Cd and pH[J]. Soil Science, 2002, 167(1): 62-67. DOI:10.1097/00010694-200201000-00006 |
| [38] |
Chaignon V, Bedin F, Hinsinger P. Copper bioavailability and rhizosphere pH changes as affected by nitrogen supply for tomato and oilseed rape cropped on an acidic and a calcareous soil[J]. Plant and Soil, 2002, 243(2): 219-228. DOI:10.1023/A:1019942924985 |
| [39] |
Williams P N, Zhang H, Davison W, et al. Organic matter-solid phase interactions are critical for predicting arsenic release and plant uptake in Bangladesh paddy soils[J]. Environmental Science and Technology, 2011, 45(14): 6080-6087. DOI:10.1021/es2003765 |
| [40] |
Zhou P, Yan H, Gu B H, et al. Competitive complexation of metal ions with humic substances[J]. Chemosphere, 2005, 58(10): 1327-1337. DOI:10.1016/j.chemosphere.2004.10.017 |
| [41] |
Xin J L, Huang B F, Dai H W, et al. Roles of rhizosphere and root-derived organic acids in Cd accumulation by two hot pepper cultivars[J]. Environmental Science and Pollution Research, 2015, 22(8): 6254-6261. DOI:10.1007/s11356-014-3854-z |
| [42] |
Nelson D R, Mele P M. Subtle changes in rhizosphere microbial community structure in response to increased boron and sodium chloride concentrations[J]. Soil Biology and Biochemistry, 2007, 39(1): 340-351. DOI:10.1016/j.soilbio.2006.08.004 |
 2019, Vol. 38
2019, Vol. 38