2. 特色植物资源研究与利用山西省重点实验室, 太原 030006
2. Key Laboratory for Research and Development of Regional Plants, Taiyuan 030006, China
近年来,随着工农业生产的迅速发展,我国土壤重金属污染愈演愈烈,造成的农业经济损失越来越严重[1],特别是耕地重金属污染会直接影响农产品产量和品质,危害人体健康,因此了解植物对重金属胁迫的应答机理成为近几年的研究热点。镉(Cd)是其中一种毒性强且污染范围广的重金属。已有研究表明,Cd能够引起植物体内抗氧化酶系统紊乱,破坏细胞膜的结构和功能[2],使植物叶绿素、糖及蛋白质合成受阻[3],降低碳同化作用,抑制光合及呼吸作用[4],甚至最终导致植物死亡。气体信号分子硫化氢(H2S)被报道可以缓解重金属对植物的毒害作用[5-6],而关于Cd胁迫下H2S对植物光合作用的调节鲜有报道。
H2S是目前公认的除一氧化氮(NO)、一氧化碳(CO)之外的第三种气体信号分子,在参与植物生长发育、调节植物抵抗多种逆境方面我们已取得了诸多进展[6]。植物在遭受到重金属胁迫时,体内的H2S合成增加,其能够促进小分子抗氧化剂还原型谷胱甘肽、抗坏血酸合成,同时增强一系列抗氧化酶活性来调控细胞内氧化还原状态的平衡,降低胁迫造成的氧化损伤[7]。H2S可以通过提高植物细胞膜上Na+-ATPase、K+-ATPase和H+-ATPase的活性来减少对Al的吸收[8];另外可激活液泡膜上的转运通道,将胞质中Cd2+转运至液泡,降低胞质内重金属离子的浓度[9]。外源H2S还可以通过促进细胞内叶绿体类囊体的发育,增加线粒体数目来缓解Cd胁迫[10]。
光合作用是植物生长和生物量递增所必需的重要生理过程,对重金属离子的作用较为敏感[11]。Rubp羧化酶(Ribulose-1,5-hisphpsphate carboxylase)是植物光合作用过程中固定CO2的关键酶,RBCS基因编码Rubp羧化酶的小亚基,小亚基控制Rubp羧化酶的催化效率,大多数高等植物包含4~10个RBCS基因[12-13]。大白菜是十字花科芸薹属一年或两年生草本,栽培面积和消费量居各类蔬菜之首,是北方重要的经济作物。本研究旨在探讨外源H2S对Cd胁迫下大白菜幼苗生长、光合特性、叶绿素荧光参数及光合碳同化效率的影响,为H2S调节植物抗逆在农业生产中的应用提供理论基础。
1 材料与方法 1.1 试验植物材料获取供试材料为津育75号大白菜。挑选籽粒饱满、大小均匀一致的大白菜种子,4 ℃浸泡过夜后,将种子均匀播种在90 mm培养皿中,培养皿底部铺一层滤纸,每皿30粒。23 ℃黑暗培养2 d,然后在23 ℃,相对湿度60%,光照强度3000 lx,光照周期16 h/8 h(昼夜),每皿每天补充1/2 MS培养液5 mL,保证幼苗生长所需的营养,培养7 d后进行处理。
1.2 Cd胁迫处理以CdCl2配制成1、2.5、5、10、15 mmol·L-1的处理液,每个浓度3皿,每皿加5 mL,对照为蒸馏水处理。在12 h和24 h后进行生理指标测定。
1.3 H2S相关处理CK组:蒸馏水处理;CdCl2组:5 mmol·L-1 CdCl2溶液处理12 h,光合作用指标在此浓度几乎都为半抑制;NaHS组:5 μmol·L-1 NaHS熏蒸12 h,实验室之前得到的对大白菜Cd胁迫有缓解作用的预处理浓度为5 μmol·L-1;HT(次牛磺酸,H2S清除剂)组:0.1 mmol·L-1 HT处理12 h;NaHS+CdCl2组:5 μmol·L-1 NaHS熏蒸幼苗12 h后,皿中加5 mmol·L-1 CdCl2溶液再处理12 h;HT+CdCl2组:0.1 mmol·L-1 HT处理幼苗12 h后加5 mmol·L-1 CdCl2溶液处理12 h。熏蒸装置为容积7 L的透明玻璃罩,将相应浓度的NaHS溶液分别加入1.5 mL离心管,开盖暴露在玻璃罩内进行熏蒸处理,其余处理组内放入盛有蒸馏水的离心管。将HT溶液加入培养皿中,CK组加入等量蒸馏水,所有实验组进行12 h处理后,去掉玻璃罩进行Cd胁迫。
1.4 光合指标的测定用乙醇提取法测定大白菜幼苗叶绿素含量;AquaPen-C AP-C 100掌上水体叶绿素荧光仪(Photon systems instruments)测定光系统Ⅱ(PSⅡ)最大光能转化率(Fv/Fm)、PSⅡ潜在活性(Fv/F0)和以吸收光能为基础的性能指数(PIabs);在光源充足且稳定的情况下,使用SY-1020光合作用测定仪(中国河北省石家庄世亚科技有限公司)对净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)以及胞间二氧化碳浓度(Ci)等大白菜幼苗的光合特性相关指数进行检测。
1.5 Rubp羧化酶活性的测定Rubp羧化酶活性的测定参照王维光等[14]的方法,以每分钟催化1 μmol CO2固定所需的酶量为一个活力单位(U)。
1.6 H2S含量的测定叶片H2S含量测定参考金竹萍等[15]的方法。盐酸与植物组织匀浆直接反应释放H2S,放出的H2S在氧化剂FeCl3作用下,与N,N-二甲基-苯二胺反应生成的亚甲基蓝在670 nm处有强吸收峰可被检测,通过标准曲线计算得到浓度,H2S含量=H2S浓度×测定体积/鲜质量。
1.7 大白菜幼苗RBCS基因表达量的检测提取大白菜幼苗的总RNA,Real-Time PCR检测,荧光染料为SYBR GreenⅠ,使用Applied Biosystems 7500 Fast荧光定量PCR仪,2-ΔΔ C 法分析基因表达水平。
1.8 数据的统计学分析依据3次独立实验,所有数据用平均值±标准差表示(M±SD)。使用SPSS 17.0软件进行Duncan检验,分析处理组间的差异。
2 结果与分析 2.1 Cd胁迫对大白菜幼苗叶片生长及光合特性的影响 2.1.1 对大白菜幼苗叶片生长的影响对大白菜幼苗进行不同浓度Cd处理后,发现Cd胁迫对大白菜幼苗生长有明显的抑制作用(图 1)。≥2.5 mmol·L-1处理组叶片明显失绿,且萎蔫卷曲;随着处理时间的延长,Cd对生长的抑制作用加重。

|
图 1 Cd胁迫对大白菜幼苗生长状况的影响 Figure 1 The cabbage seedlings growth status under Cd stress |
如图 2A所示,不同处理时间下,Cd对叶绿素影响趋势一致,即随着Cd浓度升高(>2.5 mmol·L-1),叶绿素含量与对照组相比显著降低(P < 0.05)。叶绿素吸收的光能主要流向3个方向:光合作用、热耗散、激发叶绿素荧光,因此检测叶绿素荧光可以间接反映光合作用的情况。受到Cd胁迫后,大白菜幼苗叶绿素含量、叶绿素荧光参数Fv/Fo、Fv/Fm在处理浓度为1、2.5 mmol·L-1时与对照组相比变化不显著(P>0.05),当处理浓度达到5 mmol·L-1时,Fv/Fo和Fv/Fm分别下降18.7%和20.2%(P < 0.05)(图 2B、图 2C)。叶绿素荧光参数PIabs从Cd处理浓度为1 mmol·L-1时就开始随着处理浓度的增加而逐渐下降,在Cd浓度为15 mmol·L-1时,与对照组相比下降了46%(P < 0.05)(图 2D)。以上结果表明,高浓度Cd胁迫对大白菜幼苗光能的吸收和光化学反应都有抑制作用。

|
不同小写字母表示不同处理间差异显著(P<0.05)。下同 Different lowercase letters indicate significant at 0.05 level between different treatments. The same below 图 2 Cd胁迫对大白菜幼苗叶绿素含量和叶绿素荧光参数的影响 Figure 2 Influences of Cd treatment on chlorophyll content and chlorophyll fluorescence parameters of cabbage seedlings |
大白菜幼苗叶绿素含量和叶绿素荧光在Cd胁迫下均受到影响,因此叶片光合作用速率也必然受到影响。测定光合作用相关指标后发现,在不同处理时间段内,当Cd浓度达到5 mmol·L-1时,Pn、Tr和Gs 3个指标均开始显著降低(P < 0.05),分别下降为对照组的20%、42%和65%(图 3),而Ci呈现逐渐升高的趋势。

|
图 3 Cd胁迫对大白菜幼苗叶片净光合速率、蒸腾速率、气孔导度和胞间二氧化碳浓度的影响 Figure 3 The cabbage seedlings Pn, Tr, Gs and Ci under Cd stress |
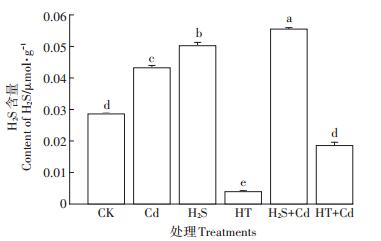
药理学处理后检测大白菜幼苗叶片中的H2S含量(图 4)。单独Cd和单独H2S处理后H2S含量显著升高(P < 0.05);HT能有效清除大白菜幼苗体内H2S,HT+Cd处理组与单独Cd处理组相比H2S含量显著降低了56.9%(P < 0.05)。
|
图 4 不同处理对大白菜幼苗H2S含量的影响 Figure 4 The content of H2S in cabbage seedlings with different treatments |
从图 5可以看出,对照组和H2S、HT单独处理组的大白菜幼苗生长无明显变化,H2S熏蒸再经Cd胁迫的幼苗与单独Cd处理组相比,叶片的萎蔫卷曲程度有明显缓和,相对长势较好,而经HT预处理后Cd胁迫下的大白菜幼苗与单独Cd处理组相比长势较弱,叶片萎蔫卷曲严重。Cd胁迫会显著抑制大白菜幼苗的生长,施加外源H2S在一定程度上可以显著促进Cd胁迫下大白菜幼苗的生长。

|
图 5 H2S对Cd胁迫下大白菜幼苗生长状况的影响 Figure 5 Influences of H2S on growth statu of cabbage seedlings under Cd stress |
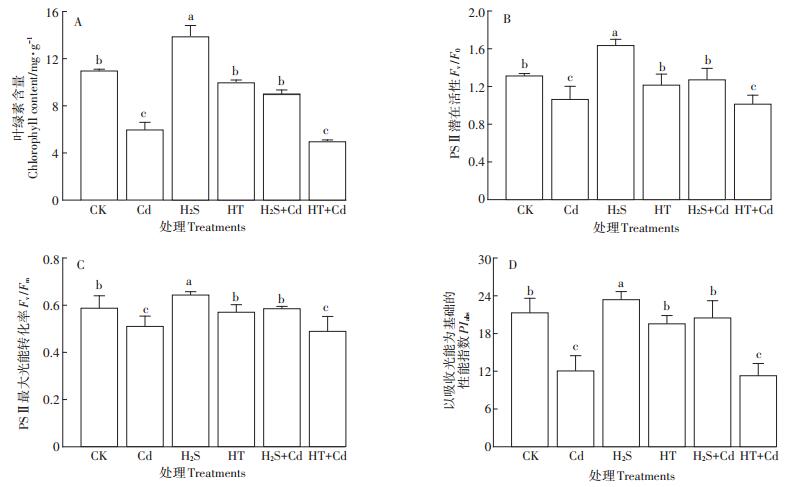
H2S减轻Cd毒害大白菜幼苗的萎蔫缺绿,可能是通过提高叶绿素含量和叶绿素荧光强度来实现。实验结果与预期一致,叶绿素含量和叶绿素荧光参数经不同处理之后变化趋势相似,二者在经H2S预处理后显著升高(图 6)。H2S+Cd处理后的相关指标均较单独Cd处理组显著提高(P < 0.05),其中叶绿素含量升高了50%,Fv/F0、Fv/Fm和PIabs分别升高了19.4%、14.6%和69.4%,而在HT+Cd处理下无显著(P>0.05)变化。结果表明H2S可以提高Cd胁迫下大白菜幼苗叶绿素含量和叶绿素荧光参数,从而增强Cd胁迫下大白菜幼苗的光能吸收和转化。
|
图 6 H2S对Cd胁迫下大白菜幼苗叶绿素含量和叶绿素荧光参数的影响 Figure 6 Influences of H2S on chlorophyll content and chlorophyll fluorescence parameters of cabbage seedlings under Cd stress |
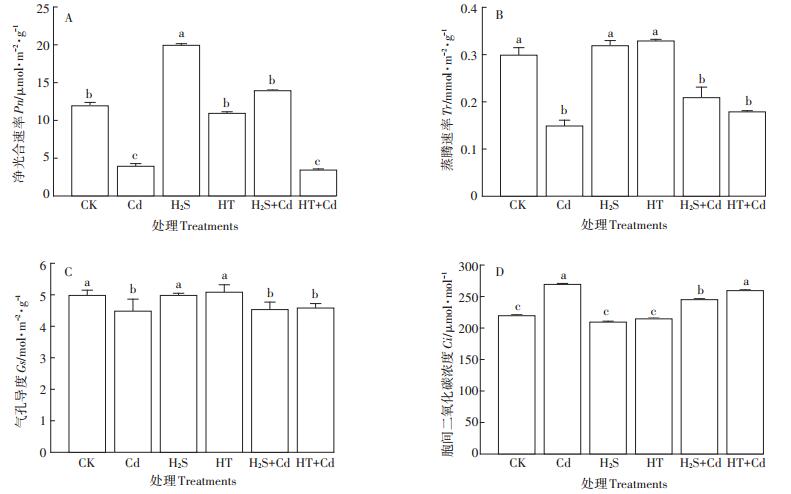
外源施加H2S能够提高Cd胁迫时大白菜幼苗光合作用色素的含量,那么是否有助于光合速率的提高?进一步检测发现,H2S预处理使大白菜幼苗叶片净光合速率Pn显著升高了66.7%(P < 0.05);与Cd胁迫相比,大白菜幼苗叶片Pn在H2S+Cd处理下升高了3.5倍(P < 0.05),而在HT+Cd处理下无显著变化(P>0.05)(图 7A);H2S和HT处理大白菜幼苗叶片Tr和Gs与对照组在同一水平,同时H2S+Cd和HT+Cd处理组与单独Cd处理组相比差异也不明显,表明H2S对大白菜幼苗叶片Cd胁迫下的Tr和Gs没有影响(图 7B、图 7C)。H2S和HT处理叶片后Ci没有变化,Cd胁迫后Ci显著升高(P < 0.05),进而抑制了大白菜的光合作用,H2S+Cd处理下的白菜幼苗与单独Cd处理相比Ci有显著的降低(P < 0.05,图 7D)。该结果表明H2S预处理可以提高Cd胁迫下大白菜幼苗的净光合速率。
|
图 7 H2S对Cd胁迫下大白菜幼苗叶片净光合速率、蒸腾速率、气孔导度和胞间二氧化碳浓度的影响 Figure 7 Influences of H2S on Pn, Tr, Gs and Ci in cabbage seedling leaves under Cd stress |
从图 8可以看出,H2S处理可以显著提高Rubp羧化酶的活性,HT单独处理与对照组相比无显著变化,Cd胁迫下大白菜幼苗叶片Rubp羧化酶活性与对照组相比下降了55.7%,受到显著抑制(P < 0.05),H2S+Cd处理组与单独Cd处理组相比无显著变化,HT+Cd处理组与对照组相比Rubp羧化酶活性显著下降了67%(P < 0.05),相对单独Cd处理组降幅更大,该结果表明内源H2S参与了大白菜幼苗响应Cd胁迫的过程,可以在一定程度上缓解Cd胁迫对大白菜幼苗Rubp羧化酶活性的抑制作用。

|
图 8 H2S对Cd胁迫下大白菜幼苗叶片Rubp羧化酶活性的影响 Figure 8 Influences of H2S on rubisco carboxylase activity in cabbage seedling leaves under Cd stress |
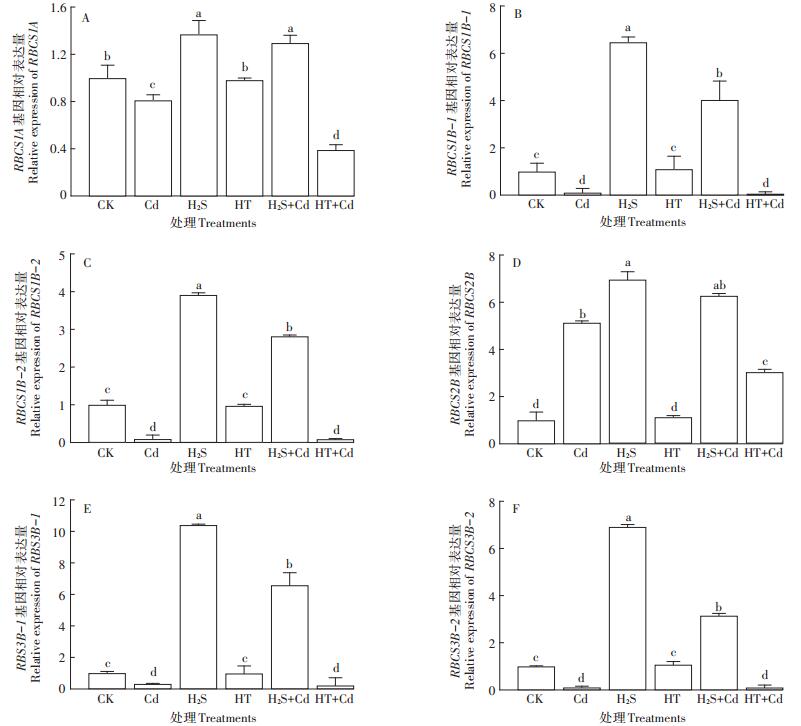
在Cd胁迫条件下,大白菜幼苗RBCS1A、RBCS1B-1、RBCS1B-2、RBCS3B-1、RBCS3B-2的表达量被显著抑制(P < 0.05),而H2S + Cd处理中RBCS1A、RBCS1B-1、RBCS1B-2、RBCS2B、RBCS3B-1、RBCS3B-2的表达量显著高于Cd处理(P < 0.05),HT+Cd处理对RBCS1A基因表达的抑制作用较单独Cd胁迫程度更强。外源H2S可以提高RBCS基因家族中RBCS1A、RBCS1B-1、RBCS1B-2、RBCS2B、RBCS3B-1、RBCS3B-2的表达量,并且可以在一定程度上缓解由于Cd胁迫造成的表达抑制(图 9)。
|
图 9 H2S对Cd胁迫下大白菜幼苗叶片RBCS基因表达量的影响 Figure 9 Influences of H2S on the expression of RBCS genes in cabbage seedlings under Cd stress |
本研究发现正常生长条件下H2S预处理通过提高大白菜幼苗Pn增加其叶片光合作用速率,这一结果与Chen等[16]的研究中H2S提高光合作用的结果一致。在逆境中,主要通过Ci值的大小判断植物Pn降低是由气孔限制还是非气孔限制因素引起的:当Pn、Gs、Ci同时减小时,Pn的下降是由气孔限制因素引起的;当Pn、Gs减小,Ci增大时,Pn的下降是由非气孔限制因素引起的[17]。在本实验中,H2S增强Cd胁迫下大白菜幼苗的光合作用强度可能是通过非气孔限制因素作用的,这与王鸿蕉等[18]的研究结果H2S仅通过直接影响白菜幼苗叶片的Pn和Ci来提高冷胁迫下白菜幼苗的光合作用强度一致。而有研究[19]报道,H2S通过诱导干旱胁迫下拟南芥气孔关闭维持较高的Ci,从而提高光合作用强度,与我们的结果相矛盾,初步推测可能是由于植物在响应不同的环境胁迫时,H2S对气孔运动的调控有所差异,从而导致光合作用强度与气孔开度之间并没有特定的相关性。
叶绿素是光合作用的主要色素,叶绿素含量与光合作用强弱直接相关。叶绿素荧光参数分别代表PSⅡ反应中心光合量子转换和光化学效率,两者可以反映植物光合作用强弱及生长状态,是研究环境胁迫对植物光合作用影响的重要参数[20]。本研究中,外源H2S预处理可以显著提高Cd胁迫下大白菜幼苗Fv/Fo、Fv/Fm、PIabs的值和叶绿素含量,说明外源H2S可以通过调控PSⅡ反应中心的电子传递,提高荧光强度,同时促进叶绿素合成,提高Cd胁迫下大白菜幼苗的光合作用强度,促进白菜的生长。
Rubp羧化酶是光合作用的限速酶。实验结果表明,HT+Cd处理下大白菜幼苗的Rubp羧化酶活性与单独Cd胁迫处理相比受到的抑制作用更为明显,表明内源H2S通过参与调节大白菜幼苗Rubp羧化酶的活性来增强光合作用。Rubp羧化酶在拟南芥中有4个小亚基,分别为1A、1B、2B、3B,用拟南芥的小亚基序列在大白菜数据库中比对出6条编码小亚基的基因序列。外源H2S处理后,大白菜5个小亚基RBCS的表达量上调,但是Cd胁迫下大白菜Rubp羧化酶的活性却没有显著提高。有研究发现Rubp羧化酶的活性是由大小亚基共同决定的[13]。这一实验结果可能是因为H2S虽然提高了小亚基的表达量,但是缺乏足够量大亚基的匹配,造成整体活性的不足;也可能是Cd毒性对酶活性有强烈的影响,即使在酶总量增加的情况下,这种毒性仍然抑制了Rubp羧化酶的活性。Chen等[16]研究发现,正常生长条件下生理浓度的H2S可以通过促进Rubp羧化酶活性以及其大亚基蛋白表达来提高光合作用速率。这一结论与本研究的结论有不同之处,可能是不同物种间存在差异,也可能是研究方法间的差异,值得深入探讨。
H2S的作用机制一直是H2S领域的研究热点,目前已经揭示的H2S的作用机制有涉及到蛋白质硫巯基化修饰、与其他信号的互作以及通过ROS发挥作用等方面。关于H2S对光合作用的影响,就已有文献来看可能有以下几方面的作用方式:NO信号能增强冷胁迫下大白菜幼苗的光合作用强度[21],H2S与NO之间存在互作关系也已经有研究报道证实[22];外源H2S可以增强水杨酸(SA)对植物应对Cd胁迫的耐受,SA对Cd胁迫下叶绿素含量的缓解作用需要H2S的参与[23];H2S通过巯基化修饰目的蛋白来调节其活性[24],因此其作用方式除了对光合相关基因转录水平影响,极有可能还通过翻译后修饰的方式介导光合相关蛋白的活性调节。在本研究中,我们只探讨了H2S对Rubp羧化酶小亚基转录水平表达量的影响,对其他影响植物光合作用的因素进行系统深入的探讨仍是一个令人好奇和充满挑战的研究领域。
4 结论(1)H2S可以促进Cd胁迫下大白菜幼苗叶绿素合成,提高叶绿素荧光强度。
(2)Cd胁迫下,H2S通过调节Pn和Ci增加大白菜幼苗的光合作用速率,促进其生长。
(3)H2S调节Rubp羧化酶活性并不完全依赖于小亚基。
| [1] |
Wei B G, Yang L S. A review of heavy metal contaminations in urban soils, urban road dusts and agricultural soils from China[J]. Microchemical Journal, 2010, 94(2): 99-107. DOI:10.1016/j.microc.2009.09.014 |
| [2] |
Yilmaz D D, Parlak K U. Changes in proline accumulation and antioxidative enzyme activities in Groenlandia densa under cadmium stress[J]. Ecological Indicators, 2011, 11(2): 417-423. DOI:10.1016/j.ecolind.2010.06.012 |
| [3] |
Gogorcena Y, Larbi A, Andaluz S, et al. Effects of cadmium on cork oak (Quercus suber L.) plants grown in hydroponics[J]. Tree Physiology, 2011, 31(12): 1401-1412. DOI:10.1093/treephys/tpr114 |
| [4] |
Baszynski T, Wajda L, Krol M, et al. Photosynthetic activities of cadmium-treated tomato plants[J]. Physiologia Plantarum, 2010, 48(3): 365-370. |
| [5] |
方慧慧, 裴雁曦. H2S信号在植物抵御重金属胁迫过程中的作用[J]. 中国细胞生物学学报, 2017, 36(6): 139-145. FANG Hui-hui, PEI Yan-xi. Physiological functions of gasotransmitter hydrogen sulfide in plant defense against heavy metals stress[J]. Chinese Journal of Cell Biology, 2017, 36(6): 139-145. |
| [6] |
裴雁曦. 植物中的气体信号分子硫化氢:无香而立, 其臭如兰[J]. 中国生物化学与分子生物学, 2016, 32(7): 721-733. PEI Yan-xi. Gasotransmitter hydrogen sulfide in plants: Stinking to high heaven, but refreshing to fine life[J]. Chinese Journal of Biochemistry and Molecular Biology, 2016, 32(7): 721-733. |
| [7] |
Dawood M, Cao F, Jahangir M M, et al. Alleviation of aluminum toxicity by hydrogen sulfide is related to elevated ATPase, and suppressed aluminum uptake and oxidative stress in barley[J]. Journal of Hazardous Materials, 2012, 209/210: 121-128. DOI:10.1016/j.jhazmat.2011.12.076 |
| [8] |
Sun J, Wang R, Zhang X, et al. Hydrogen sulfide alleviates cadmium toxicity through regulations of cadmium transport across the plasma and vacuolar membranes in Populus euphratica cells[J]. Plant Physiology and Biochemistry, 2013, 65: 67-74. DOI:10.1016/j.plaphy.2013.01.003 |
| [9] |
Chen J, Wang W H, Wu F H, et al. Hydrogen sulfide alleviates aluminum toxicity in barley seedlings[J]. Plant and Soil, 2013, 362(1/2): 301-318. |
| [10] |
Chen X, Wang J, Shi Y, et al. Effects of cadmium on growth and photosynthetic activities in pakchoi and mustard[J]. Botanical Studies, 2011, 52(1): 41-46. |
| [11] |
Dean C, Pichersky E, Dunsmuir P. Structure, evolution, and regulation of RbcS genes in higher plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1989, 40(1): 415-439. DOI:10.1146/annurev.pp.40.060189.002215 |
| [12] |
Sclmeider G, Lindqvist Y, Branden C I. Rubisco: Structure and mechanism[J]. Annual Review of Biophysics and Biomolecular Structure, 1992, 21: 119-143. DOI:10.1146/annurev.bb.21.060192.001003 |
| [13] |
Spreitzer R J. Role of the small subunit in ribulose-1, 5-bisphosphate carboxylase/oxygenase[J]. Archives of Biochemistry and Biophysics, 2003, 414(2): 141-149. DOI:10.1016/S0003-9861(03)00171-1 |
| [14] |
王维光, 李立人. 菠菜二磷酸核酮糖(RuBP)羧化酶简化提纯研究[J]. 植物生理学报, 1980(3): 257-262. WANG Wei-guang, LI Li-ren. Simplified purification of spinosa diphosphate ketone (RuBP) carboxylase[J]. Plant Physiology Journal, 1980(3): 257-262. |
| [15] |
金竹萍, 裴雁曦. 植物H2S气体信号分子的生理功能研究进展[J]. 中国细胞生物学学报, 2013, 35(6): 880-888. JIN Zhu-ping, PEI Yan-xi. Research progress on hydrogen sulfide signaling in plants[J]. Chinese Journal of Cell Biology, 2013, 35(6): 880-888. |
| [16] |
Chen J, Wu F H, Wang W H, et al. Hydrogen sulphide enhances photosynthesis through promoting chloroplast biogenesis, photosynthetic enzyme expression, and thiol redox modification in Spinacia oleracea seedlings[J]. Journal of Experimental Botany, 2011, 62(13): 4481-4493. DOI:10.1093/jxb/err145 |
| [17] |
冯世静, 杨途熙, 张艳军, 等. 镉胁迫对杨树光合特性的影响[J]. 农业环境科学学报, 2013, 32(3): 539-547. FENG Shi-jing, YANG Tu-xi, ZHANG Yan-jun, et al. Effects of cadmium on photosynthetic gas exchange and chlorophyll fluorescence of two species of Poplar[J]. Journal of Agro-Environment Science, 2013, 32(3): 539-547. |
| [18] |
王鸿蕉, 张丽萍, 刘志强, 等. 外源硫化氢对冷胁迫下白菜幼苗生长和光合作用的影响[J]. 西北植物学报, 2015, 35(4): 780-786. WANG Hong-jiao, ZHANG Li-ping, LIU Zhi-qiang, et al. Influence of H2S on growth and photosynthesis of Brassica rapa var. pekinensis under chilling stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(4): 780-786. |
| [19] |
孙丽敏, 金竹萍, 钱嘉航, 等. 干旱胁迫下H2S信号增强植物叶片的光合作用[J]. 中国细胞生物学学报, 2017, 35(12): 1583-1591. SUN Li-min, JIN Zhu-ping, QIAN Jia-hang, et al. H2S enhanced photosynthesis in response to drought stress[J]. Chinese Journal of Cell Biology, 2017, 35(12): 1583-1591. |
| [20] |
Krause G H, Weis E. Chlorophyll fluorescence and photosynthesis: The basics[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1991, 42(1): 313-349. DOI:10.1146/annurev.pp.42.060191.001525 |
| [21] |
裴雁曦, 贺烽, 解梦洁, 等. 气体信号分子H2S和NO对冷胁迫下大白菜幼苗光合作用的影响[J]. 山西大学学报(自然科学版), 2017, 40(3): 596-601. PEI Yan-xi, HE Feng, XIE Meng-jie, et al. Effects of gasotransmitters NO and H2S on photosynthesis of Chinese cabbage seedlings under chilling stress[J]. Journal of Shanxi University (Natural Science Edition), 2017, 40(3): 596-601. |
| [22] |
Denise S, Lorenzo L, Carlos G, et al. Gasotransmitters and stomatal closure: Is there redundancy, concerted action, or both?[J]. Frontiers in Plant Science, 2016, 7: 1-5. |
| [23] |
Qiao Z J, Jing T, Liu Z Q, et al. H2S acting as a downstream signaling molecule of SA regulates Cd tolerance in Arabidopsis[J]. Plant and Soil, 2015, 393: 137-146. DOI:10.1007/s11104-015-2475-8 |
| [24] |
Mustafa A K, Gadalla M M, Sen N, et al. H2S signals through protein S-sulfhydration[J]. Science Signaling, 2009, 2(96): ra72. |
 2019, Vol. 38
2019, Vol. 38


