2. 南京农业大学资源与环境科学学院, 南京 210095
2. College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China
漆酶(Laccase,EC 1.10.3.2)是由微生物、植物和昆虫等生物体分泌的一类胞外含铜多酚氧化酶[1-2],其催化中心包含4个铜离子。漆酶不仅可以催化低分子有机物的氧化耦合形成大分子聚合产物,也能够介导高分子有机物的降解作用形成小分子化合物[3-4]。该过程漆酶以水体中溶解的分子氧作为最终电子接受体,催化多种有机物的单电子氧化反应形成活性自由基中间体,随后这些活性中间体导致底物发生同源/异源耦合或键断裂反应[5-6]。与过氧化物酶对比,漆酶催化有机物转化的最大优点是反应条件温和、处理效率高、操作可控、无需添加过氧化氢,以及生成的副产物仅包含水,是一种无二次污染的环境友好型绿色催化剂[7]。因此,漆酶在生物技术领域中存在广阔的实际应用潜力,备受国际研究者关注。
目前,漆酶的研究内容主要涵盖微生物学、植物学、生物化学、酶学、光谱学、分子生物学和遗传学等方面,其结构特征、底物谱、催化功能、基因克隆和异源表达等已经逐渐被研究者熟知[8-9]。例如,Alexandre等[10]利用已知真菌和植物漆酶的保守氨基酸序列比对及其二级结构预测结果,证实漆酶广泛存在于细菌中。基于漆酶介导有机物氧化耦合与降解反应的双功能机制,其已经被广泛地应用于生物修复、染料脱色、纤维改性、有机合成和纸浆漂白等生物技术领域[5, 11]。此外,漆酶的双功能属性也能够参与生物体内有机物合成与分解代谢过程,进而影响生物体的正常生命代谢活动和生理生化指标[12-15]。采用基因组、转录组、质谱分析和遗传分析等现代技术手段为生物体内漆酶基因的获取和异源表达提供了有力保障,有助于深入研究生物体内漆酶的活性表达及其涉及到的木质素降解、纤维素合成、黑色素生成和角质层硬化等多功能过程[15-16]。本文简要综述漆酶分子的结构特征、底物谱及其催化功能,重点剖析酚类化合物对漆酶介导生物体内有机物合成与分解代谢的影响及其双功能作用机制,总结并展望漆酶的双功能属性在生物技术领域中的最新应用前景,旨在为拓展和开发漆酶的多功能应用提供新颖的见解和思路。
1 漆酶的化学结构、底物谱和催化功能漆酶是一种糖蛋白,其肽链大约由500~600个氨基酸组成,糖配基占整个分子的10%~45%。漆酶分子结构中包含4个铜离子,即1个Ⅰ型铜离子(T1 Cu2+)、1个Ⅱ型铜离子(T2 Cu2+)和2个Ⅲ型铜离子(T3 Cu2+)[5, 17]。其中T1 Cu2+与半胱氨酸S配位结合形成的共价键在610 nm处有强烈的特征吸收峰,致使漆酶分子呈蓝色。漆酶分子中1个T1 Cu2+形成单核位点参与底物的催化氧化过程,能够从底物分子中获得电子并传递给水体中的溶解氧分子;2个T3 Cu2+由单个羟基桥偶联形成双核,该双核与1个T2 Cu2+结合形成3核铜簇中心,其可以接收来自T1 Cu2+单核位点传递的电子,将分子氧还原成水[3, 18]。整个漆酶介导的单电子催化氧化循环过程中,单个分子的氧被还原成2个分子的水,4个底物分子被氧化形成4个相应的反应活性自由基中间体[19]。
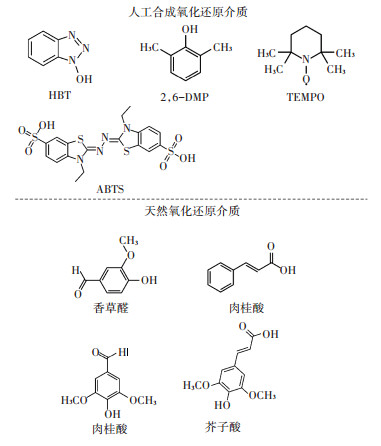
漆酶具有广泛的底物谱,可以催化多种有机物发生氧化耦合反应或参与目标底物的降解过程[5, 8, 15]。漆酶也能够在含有羟基、羧基、氨基和苯基等官能团的聚合材料表面发生催化氧化反应,该类反应有效地扩展了漆酶的底物谱及其在材料合成中的应用价值[20]。如图 1所示,在漆酶介导氧化还原过程中,1-羟基苯并三唑(HBT)、2,6 -二甲氧基苯酚(2,6 - DMP)、2,2,6,6-四甲基哌啶氧化物(TEMPO)和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)等人工合成的氧化还原介质起到电子载体等作用,促进漆酶在生物体外的催化氧化效能[21];而天然存在的低分子酚醛树脂类化合物也可以作为漆酶的氧化还原介质,增加漆酶在生物体内的表达量和催化氧化活性[14]。需强调,人工合成的氧化还原介质在环境中的应用成本较高,且能够造成二次污染,在实际应用中受到限制[22]。漆酶-氧化还原介质体系催化底物氧化耦合与降解反应的双功能机制也广泛地存在于生物体内有机物合成与分解代谢过程中[13, 15, 23]。明确漆酶的双功能属性对生物体内有机物合成与分解代谢的影响及其作用机理,可以为拓展和研发漆酶在生物技术领域中的应用提供新颖的见解和思路。
|
图 1 漆酶反应体系中常见的几种人工合成和天然氧化还原介质的化学结构 Figure 1 The chemical structures of several synthetic and natural redox mediators in laccase-catalyzed oxidation reaction systems |
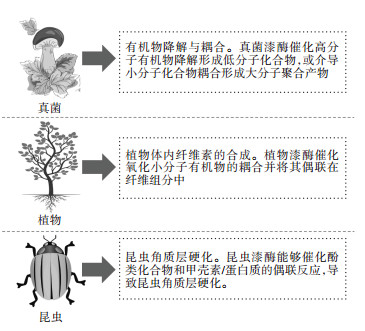
目前,在微生物、植物和昆虫等生物体内均发现了漆酶介导有机物合成与分解代谢的氧化还原反应[2, 24]。不同生物体内的漆酶存在分子结构和酶学性能差异,其参与有机物的氧化耦合或降解作用也有所不同,进而影响生物体内有机物合成和分解代谢过程[15, 24]。如图 2所示,真菌来源的漆酶在催化氧化高分子木质素降解(通过氧化、脱甲基化等途径)和低分子酚类、胺类化合物同源/异源耦合的反应中扮演着重要角色[5, 25-26];植物漆酶在生物体内纤维素的合成代谢中起到关键作用[27],该过程可以利用漆酶介导的反应活性自由基耦合机制将低分子酚类化合物聚合并偶联在植物纤维组分中;而昆虫漆酶能够催化氧化酚类化合物和甲壳素/蛋白质的交叉偶联反应形成高分子聚合物,导致昆虫角质层硬化[15, 28-29]。与植物和昆虫分泌的漆酶相比,真菌漆酶研究最为广泛和深入,主要集中于担子菌门(Basidiomycota)、子囊菌门(Ascomycota)和半知菌门(Deuteromycota)[5]。研究者主要采用添加诱导剂和基因工程提高真菌漆酶的产量及其氧化还原电位。与其他类型的天然酶对比(如木质素酶和过氧化物酶),漆酶不仅避免了反应过程对生态环境的破坏,也不需要通过活化过氧化氢进行氧化还原反应[5, 26]。因此,漆酶已经在生物修复、染料脱色、纤维改性、有机合成和纸浆漂白等生物技术领域中得到了广泛的应用[5, 11]。
|
图 2 真菌、植物和昆虫体内漆酶参与有机物的合成与分解代谢 Figure 2 Laccase-mediated anabolism and catabolism processes of organics in microorganisms, plants, and insects |
低分子酚类化合物是漆酶介导生物体内有机物合成与分解代谢过程中的关键底物分子[23]。研究指出,微生物、植物和昆虫等生物体内的漆酶能够催化氧化低分子酚类化合物产生苯氧活性自由基中间体,该活性中间体不仅可以通过同源耦合或异源耦合反应形成大分子聚合产物,也能够作为氧化还原介质促进大分子化合物的氧化降解反应形成小分子有机物,实现自然界中的碳、氮循环[5, 13-15]。在生物体内,漆酶介导有机物的合成代谢过程主要是以低分子酚类化合物作为结构单元,催化氧化其参与单电子氧化耦合反应生成多种二聚体同分异构体[5, 30]。这些二聚体可以进一步发生单电子转移,再次形成苯氧活性自由基中间体并与酚类单体氧化耦合形成三聚体、四聚体和高分子聚合物[5, 22]。
目前,已经有研究者从功能缺失的突变体中获取了关于漆酶介导天然低分子酚类化合物参与生物体内有机物合成代谢反应的直接证据。例如,Pourcel等[31]指出,拟南芥(Arabidopsis thaliana)种皮中漆酶表达量的减少与类黄酮单体浓度的增加呈显著相关性,表明生物体内漆酶活性的降低能够影响天然酚类化合物的氧化聚合反应。此外,植物体内漆酶活性的变化也能够影响木质部组织的木质化程度[30]。Berthet等[32]证实,植物体内漆酶基因LAC4和LAC17的缺失可以导致其茎中木质化程度呈现显著下降趋势。漆酶介导生物体内有机物的合成代谢过程也能够影响昆虫的角质层硬化和真菌的黑色素生成[29, 33-34]。例如,Arakane等[23]采用RNAi技术敲除甲虫角质层中的漆酶基因,证实甲虫体内的漆酶可以显著地影响其角质层硬化和色素沉积,缺乏漆酶会导致甲虫外壳无色、柔软。另有研究指出,漆酶能够催化昆虫体内来源于多巴胺和二羟基苯乙醇的邻苯二酚,其氧化形成醌中间体后与蛋白质通过C-N和C-O连接生成异源耦合产物是导致昆虫角质层硬化的关键步骤[29, 33]。昆虫漆酶参与角质层的硬化不仅有利于保护昆虫免受外界损伤,也能够在昆虫运动、呼吸和交流等方面发挥至关重要的作用。在真菌体内,外源或内源酚类化合物如儿茶素、儿茶酚、二羟基萘和二羟基苯丙氨酸能够被漆酶活性氧化,随后这些化合物发生以自由基耦合为基础的同源或异源聚合反应生成黑色素[35-36]。此外,真菌漆酶介导酚类化合物的氧化耦合反应也能够引起生物体内活性氧(ROS)、生色团和抗菌性能发生改变[15, 37]。这些变化与真菌体内有机物合成代谢过程中的生物学功能具有密切相关性,如细胞壁完整性、机体免疫功能、毒性效应和色素沉淀等[14-15]。
与合成代谢对比,生物体内涉及到漆酶参与的分解代谢过程主要存在于白腐真菌中[38-39]。例如,Bermek等[40]利用白腐真菌的漆酶缺陷突变体诱导大分子木材降解,证实木材的降解需要白腐真菌分泌的漆酶参与;但是漆酶的氧化还原电位无法覆盖木材表面的非酚类官能团,其驱动木材的降解过程也需要借助天然酚类化合物的协助[41]。研究者总结了漆酶催化氧化大分子木材降解为小分子化合物的作用机理,主要包括两个方面[42]:(1)在Fe2+存在条件下,漆酶催化氧化2,5-二甲氧基氢醌形成ROS,进而诱导木材的氧化降解反应形成低分子化合物;(2)另一方面,低分子酚类化合物作为漆酶降解大分子木材的氧化还原介质,能够促进漆酶催化底物形成苯氧活性自由基,导致木材转化成氧化的聚合产物,随后该类聚合物进一步发生氧化降解或键断裂反应形成低分子有机物。漆酶-低分子酚类化合物构成的氧化还原介质体系也涉及到大分子木材的彻底矿化和腐殖化作用,这些过程能够参与生态系统中的碳、氮循环[14-15]。该系统催化生物体内有机物分解代谢的效率主要取决于漆酶的氧化还原电位及其催化氧化底物形成苯氧活性自由基的结构稳定性和半衰期长短[43]。
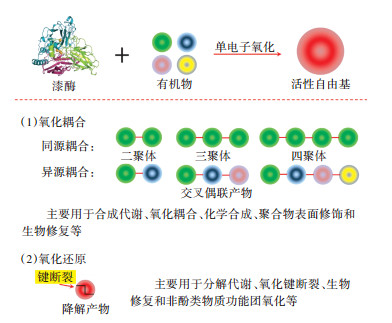
3 漆酶介导生物体内有机物合成与分解代谢的双功能机制在生物体内,漆酶能够催化氧化酚类有机物合成与分解代谢过程;而在生物体外,漆酶的催化底物更为广泛,包括酚类、胺类、芳香类和硝酰基类等化合物[5, 13, 15, 44]。研究证实,漆酶催化生物体内有机物合成与分解代谢的双功能机制包括活性自由基介导小分子有机物的氧化耦合反应和漆酶-氧化还原介质介导大分子化合物的分解反应[15, 23]。耦合反应促进了生物体内小分子有机物的合成代谢形成同源或异源大分子聚合产物[30],而分解反应增强了生物体内大分子难降解化合物的分解代谢形成小分子有机物[38]。明确漆酶介导生物体内有机物合成与分解代谢的双功能机制,有望为开拓和研发漆酶在生物技术领域中的最新应用潜力提供理论依据和技术指导。
漆酶催化生物体内有机物合成代谢的机理是活性自由基介导的氧化耦合反应(图 3)。研究指出,漆酶不仅能够催化氧化单一低分子有机物通过C-C、C-O或C-N耦合反应形成多种同源二聚体的同分异构体,也可以催化氧化两种或两种以上不同低分子有机物的共价耦合作用形成多种异源聚合物的同分异构体,这些低聚物能够进一步参与底物的氧化耦合反应形成高分子聚合产物[5, 45-46]。一方面,研究者可以在自由基介导的氧化耦合反应发生前,利用反应活性自由基中间体的电子位移作用获得多种不同化学结构的转化产物[47];而经过长时间的反复耦合过程能够诱导同源或异源大分子高聚物的产生。另一方面,漆酶催化低分子有机物的氧化耦合反应也可以通过结合作用促使大分子聚合物表面形成具有特殊作用的化学功能团[48-49]。研究已经证实,同源耦合和异源耦合过程是漆酶参与生物体内有机物合成代谢的主要机制[23]。例如,漆酶介导生物体内的木质化过程、类黄酮合成和黑色素生成等合成代谢过程[31-34]。此外,漆酶介导的ROS清除、生色团形成和黏附功能也能够显著地改变生物体内有机物的多羟基苯官能团、双键结合和芳香性等结构特征[14-15]。漆酶催化生物体内有机物的合成代谢性质增加了其在生物合成工艺领域中的应用范围。
|
图 3 漆酶介导有机物合成与分解代谢的双功能机制 Figure 3 The bi-functional mechanisms of the anabolism and catabolism of organics in in-vivo by laccase-mediated oxidation reactions |
漆酶介导生物体内有机物分解代谢的过程主要通过漆酶-氧化还原介质体系完成(图 3)。在早期的研究中,人工合成的氧化还原介质(如HBT和ABTS)应用较为广泛,而天然氧化还原介质主要来源于生物体内木质素降解过程中衍生的低分子酚类化合物,如香草酸、丁香酸、香草醛和香豆酸等[31]。与漆酶催化有机物的合成代谢机制不同,氧化还原介质在漆酶催化氧化有机物分解代谢过程中起到关键作用,如电子转移或氢原子转移[22, 50]。在氧化还原介质存在条件下,漆酶催化有机物的单电子氧化过程中形成的反应活性自由基可以恢复目标底物中的氢原子或电子。例如,HBT可以通过氢原子转移实现漆酶催化目标底物降解的氧化还原过程,该过程中漆酶催化单电子的去除,随后从HBT介质的N-OH中自发释放质子[22];而ABTS则能够通过电子转移机制促进漆酶催化氧化有机物的C-C、C-O或C-N键断裂形成小分子降解产物[50]。此外,研究者发现在漆酶-TEMPO介质系统中存在一种非自由基离子机理,该反应过程中能够形成相应的氧代铵离子参与目标化合物的氧化降解反应[51]。由此可见,漆酶-氧化还原介质体系能够促使酚类化合物和非酚类化合物的快速氧化或官能团裂解,形成多种小分子降解产物。例如,漆酶-HBT介质体系可以催化三氯生的醚键断裂,形成2,4-二氯苯酚、3-氯苯酚及其脱氯和开环的小分子化合物[22]。因此,漆酶-氧化还原介质体系催化生物体内大分子有机物的分解代谢机制可用于生物体外纤维漂白和难降解有机物的环境修复,其反应速率主要取决于反应活性自由基的氧化还原电位和结构稳定性[5, 22, 52]。基于漆酶介导生物体内有机物合成与分解代谢的双功能机制,有望在生物体外拓展和研发出多种新型技术应用于生物技术领域。
4 漆酶双功能属性在生物技术领域中的应用漆酶催化氧化生物体内有机物的双功能属性表现为合成和分解代谢过程,表 1总结了漆酶的双功能特性在生物技术领域中的应用。目前,漆酶介导有机物的氧化耦合反应主要用于有机合成和聚合物表面官能团的功能化[48-49]。例如,采用漆酶催化氨基苯酚的氧化聚合反应可以用于合成放线菌素和吩恶嗪酮抗生素,该过程包括同源耦合和环缩合反应[37]。同时,漆酶也能够催化氧化具有天然生物活性的有机物同源耦合反应。例如,Nicotra等[53]利用漆酶催化反式白藜芦醇合成的二聚体可以用于反应过程中ROS的清除。此外,研究者也提出了利用不同有机物的交叉偶联反应制备具有特殊功能的异源聚合产物。例如,Schroeder等[54]利用漆酶介导3-(3-叔丁基-4-羟基苯基)丙酸甲酯和HBT的交叉偶联反应,成功合成了紫外线吸收试剂。漆酶介导小分子酚类有机物的同源/异源氧化耦合反应形成的功能性聚合物也具有黏附、导电和形成生色团等特殊功能[14]。
|
|
表 1 漆酶介导有机物耦合与降解的双功能属性在生物技术领域中的应用 Table 1 Applications of laccase-mediated coupling and degradation of organics in biotechnological areas |
利用漆酶的双功能属性拓展和开发具有特殊物理化学功效的生物试剂应用于化妆品、摄影和制药行业也具有一定的可行性。例如,采用漆酶催化氧化天然酚类化合物的同源或异源耦合作用形成的新型生色团化合物可以用作环保型染发剂[45]。López等[55]研究指出,利用漆酶催化4-氟-2-甲氧基苯酚氧化耦合形成具有高热阻、低熔点和发光性能的聚合产物在摄影制作方面发挥重要作用。此外,研究者通过改变漆酶催化氧化耦合过程中使用的有机溶剂能够控制合成产物的分子量大小和化学结构,也可以通过筛选低分子有机物或利用漆酶催化低分子有机物与聚合材料的结合反应获得具有特殊功能的新型聚合材料[3]。例如,可以将抗生素和抗氧化剂引入到目标聚合物表面,合成具有抗菌和抗氧化性能的多功能聚合材料[49, 56]。另一方面,漆酶介导的催化氧化耦合作用也能够用于水体中大分子难降解有机污染物的去除和净化。例如,Sun等[6, 57]研究证实,漆酶能够催化水体中三氯生和17β-雌二醇的单电子氧化耦合反应形成高分子聚合物,聚合物的形成显著地降低了母体化合物的生物有效性和毒性。该方法首先将水体中的有机污染物氧化耦合形成高分子聚合沉淀物,随后通过简单的过滤或沉降作用即可达到污染物的高效去除[57]。
漆酶-氧化还原介质体系可以催化醇、烯烃和醚等非酚类官能团的氧化降解,表明该体系能够用于生物氧化或降解工艺,如天然大分子聚合物的漂白作用和合成染料的脱色反应[25, 58-59]。该过程类似于生物体内漆酶-低分子酚类化合物介质体系降解大分子木质素,普遍用于生物炼制和纸浆研磨工业中的去木质化过程[58-61]。另有研究指出,在氨基酸的协同作用下,漆酶可以增加纤维原料中的羧基含量,进而影响纤维负电性、提升成纸性能[61-62]。此外,漆酶-氧化还原介质体系也能够用于游离或结合态纸浆谷甾醇的降解,增加纤维的亮度和韧性[63]。其中人工合成的氧化还原介质,如HBT和紫尿酸具有相对较高的漂白效率[64-65],而某些天然氧化还原介质也具有类似效果[21, 66]。另一方面,漆酶-氧化还原介质体系将漆酶的生物修复潜力扩展到非酚类污染物的降解和解毒作用。该介质体系能够有效地降解合成染料、雌激素、抗生素、三氯生、杀虫剂和多环芳烃等难降解有机污染物[22, 59, 67-68]。例如,漆酶-ABTS反应体系能够高效地降解土壤中大分子多环芳烃苯并[a]芘[69]。与漆酶介导的氧化耦合反应相比,漆酶-氧化还原介质体系显著地增加了大分子难降解有机污染物的去除效率,并缩短了其降解半衰期。该体系含有较高的能量,可以诱导大分子难降解有机污染物氧化键裂解形成小分子化合物,甚至将其矿化为二氧化碳和水[5, 70-71]。
此外,漆酶的双功能机制也能够应用于医疗诊断、食品改性、生物监测和环境评估等生物技术领域[72-76]。在医疗诊断方面,将漆酶固定在网状电极上能够用于快速测定脑神经组织成分中的儿茶酚,该方法避免了抗坏血酸对检测结果的干扰;同时,漆酶的固定化技术也可以用于人体内氢醌和对苯二胺含量的分析检测[77]。在食品工业方面,漆酶不仅能够生产出稳定和澄清的果汁,也可以提高果汁的感官品质和风味[73]。在生物监测和环境评估方面,采用漆酶和葡萄糖脱氢酶构建的双酶电极可以显著地提高二茂铁和肾上腺素的检测灵敏度[74],而利用漆酶修饰的纳米电极能够制作生物传感器[78]。近年来,随着漆酶双功能机制的深入研究,其也逐渐被用于生物发电、纳米反应器制备和复合材料接枝等方面[79-81]。因此,拓展和研发漆酶的双功能属性在生物技术领域中的应用具有巨大的商业价值。
5 结论与展望在生物体外,漆酶拥有氧化耦合和降解有机物的双功能属性,其对微生物、植物和昆虫等生物体内有机物合成与分解代谢过程发挥着至关重要的作用。在合成代谢过程中,漆酶能够催化生物体内低分子有机物的同源/异源氧化耦合形成高分子聚合产物。该机制可以用于制备多功能聚合材料、水污染净化和有机合成等方面。在分解代谢过程中,漆酶能够介导大分子有机物的氧化降解和键断裂反应形成小分子化合物。该机制可以利用低分子酚类化合物作为漆酶的氧化还原介质,强化目标化合物的氧化还原循环过程。这种漆酶-氧化还原介质体系能够有效地用于纤维漂白、去木质化和难降解有机污染物的去除。
能否利用生物体内涉及到漆酶催化氧化小分子酚类物质合成代谢与大分子有机物分解代谢的双功能机制,拓展和开发漆酶在生物技术领域中的潜在应用价值仍然是研究者亟待解决的难点问题之一。鉴于此,我国研究者今后应当从以下几个方面着手:(1)明确漆酶在微生物、植物和昆虫等生物体内的催化氧化功能,并将其应用于生物体外的化学合成与降解工艺;(2)利用漆酶的催化偶联机制将低分子有机物结合在聚合材料表面,获得具有多功能属性的新型聚合材料;(3)采用基因工程和分子生物学技术对生物体内漆酶进行异源表达,挖掘漆酶的双功能属性在环境、生物、医学和化工等领域中新的应用前景和商业价值。
| [1] |
Rodríguez C S, Toca Herrera J L. Industrial and biotechnological applications of laccases:A review[J]. Biotechnology Advances, 2006, 24(5): 500-513. DOI:10.1016/j.biotechadv.2006.04.003 |
| [2] |
Mayer A M, Staples R C. Laccase:New functions for an old enzyme[J]. Phytochemistry, 2002, 60(6): 551-565. DOI:10.1016/S0031-9422(02)00171-1 |
| [3] |
Kudanga T, Nyanhongo G S, Guebitz G M, et al. Potential applications of laccase-mediated coupling and grafting reactions:A review[J]. Enzyme and Microbial Technology, 2011, 48(3): 195-208. DOI:10.1016/j.enzmictec.2010.11.007 |
| [4] |
Zille A, Munteanu F D, Gübitz G M, et al. Laccase kinetics of degradation and coupling reactions[J]. Journal of Molecular Catalysis B:Enzymatic, 2005, 33(1): 23-28. |
| [5] |
龚睿, 孙凯, 谢道月. 真菌漆酶在绿色化学中的研究进展[J]. 生物技术通报, 2018, 34(4): 24-34. GONG Rui, SUN Kai, XIE Dao-yue. Applications of fungal laccase in green chemistry[J]. Biotechnology Bulletin, 2018, 34(4): 24-34. |
| [6] |
Sun K, Kang F, Waigi M G, et al. Laccase-mediated transformation of triclosan in aqueous solution with metal cations and humic acid[J]. Environmental Pollution, 2017, 220(Pt A): 105-111. |
| [7] |
Theerachat M, Guieysse D, Morel S, et al. Laccases from marine organisms and their applications in the biodegradation of toxic and environmental pollutants:A review[J]. Applied Biochemistry and Biotechnology, 2018, 7: 1-29. |
| [8] |
司静, 李伟, 崔宝凯, 等. 真菌漆酶性质、分子生物学及其应用研究进展[J]. 生物技术通报, 2011, 2: 48-55. SI Jing, LI Wei, CUI Bao-kai, et al. Advances of research on characteristic, molecular biology and applications of laccase from fungi[J]. Biotechnology Bulletin, 2011, 2: 48-55. |
| [9] |
Yaropolov A I. Laccase:Properties, catalytic mechanism, and applicability[J]. Applied Biochemistry and Biotechnology, 1994, 49(3): 257-280. |
| [10] |
Alexandre G, Zhulin I B. Laccases are widespread in bacteria[J]. Trends in Biotechnology, 2000, 18(2): 41-42. |
| [11] |
Senthivelan T, Kanagaraj J, Panda R C. Recent trends in fungal laccase for various industrial applications:An eco-friendly approach-A review[J]. Biotechnology and Bioprocess Engineering, 2016, 21(1): 19-38. |
| [12] |
李佳琪, 陈颖君, 唐利华, 等. 刺芹侧耳栽培料及菌体中漆酶介体分子的挖掘[J]. 菌物学报, 2018, 37(5): 584-594. LI Jia-qi, CHEN Ying-jun, TANG Li-hua, et al. Exploration of laccase-natural mediator from the compost and fruiting bodies of Pleurotus eryngii[J]. Mycosystema, 2018, 37(5): 584-594. |
| [13] |
Evans C S. Laccase activity in lignin degradation by Coriolus versicolor in vivo and in vitro studies[J]. FEMS Microbiology Letters, 2010, 27(3): 339-343. |
| [14] |
Jeon J R, Baldrian P, Murugesan K, et al. Laccase-catalysed oxidations of naturally occurring phenols:From in vivo, biosynthetic pathways to green synthetic applications[J]. Microbial Biotechnology, 2012, 5(3): 318-332. DOI:10.1111/mbt.2012.5.issue-3 |
| [15] |
Jeon J R, Chang Y S. Laccase-mediated oxidation of small organics:Bifunctional roles for versatile applications[J]. Trends in Biotechnology, 2013, 31(6): 335-341. DOI:10.1016/j.tibtech.2013.04.002 |
| [16] |
Moreno L F, Feng P, Weiss V A, et al. Phylogenomic analyses reveal the diversity of laccase-coding genes in Fonsecaea genomes[J]. PLoS One, 2017, 12(2): e0171291. DOI:10.1371/journal.pone.0171291 |
| [17] |
Shanmugam S, Ulaganathan P, Sivasubramanian S, et al. Trichoderma asperellum, laccase mediated crystal violet degradation-optimization of experimental conditions and characterization[J]. Journal of Environmental Chemical Engineering, 2017, 5(1): 222-231. |
| [18] |
王国栋, 陈晓亚. 漆酶的性质、功能、催化机理和应用[J]. 植物学报, 2003, 20(4): 469-475. WANG Guo-dong, CHEN Xiao-ya. The properties, functions, catalytic mechanism and applicability of laccase[J]. Chinese Bulletin of Botany, 2003, 20(4): 469-475. |
| [19] |
Tadesse M A, D' Annibale A, Galli C, et al. An assessment of the relative contributions of redox and steric issues to laccase specificity towards putative substrates[J]. Organic and Biomolecular Chemistry, 2008, 6(5): 868-878. DOI:10.1039/b716002j |
| [20] |
Ba S, Arsenault A, Hassani T, et al. Laccase immobilization and insolubilization:From fundamentals to applications for the elimination of emerging contaminants in wastewater treatment[J]. Critical Reviews in Biotechnology, 2013, 33(4): 404-418. |
| [21] |
Fillat A, Colom J F, Vidal T. A new approach to the biobleaching of flax pulp with laccase using natural mediators[J]. Bioresource Technology, 2010, 101(11): 4104-4110. DOI:10.1016/j.biortech.2010.01.057 |
| [22] |
孙凯, 李舜尧. 漆酶催化氧化水溶液中三氯生转化的作用机理[J]. 中国环境科学, 2017, 37(8): 2947-2954. SUN Kai, LI Shun-yao. Laccase-mediated transformation mechanism of triclosan in aqueous solution[J]. China Environmental Science, 2017, 37(8): 2947-2954. |
| [23] |
Arakane Y, Muthukrishnan S, Beeman R W, et al. Laccase 2 is the phenoloxidase gene required for beetle cuticle tanning[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(32): 11337-11342. DOI:10.1073/pnas.0504982102 |
| [24] |
Dwivedi U N, Singh P, Pandey V P, et al. Structure-function relationship among bacterial, fungal and plant laccases[J]. Journal of Molecular Catalysis B:Enzymatic, 2011, 68(2): 117-128. DOI:10.1016/j.molcatb.2010.11.002 |
| [25] |
Ma H F, Meng G, Cui B K, et al. Chitosan crosslinked with genipin as supporting matrix for biodegradation of synthetic dyes:Laccase immobilization and characterization[J]. Chemical Engineering Research and Design, 2018, 132: 664-676. DOI:10.1016/j.cherd.2018.02.008 |
| [26] |
Leonowicz A, Cho N S, Luterek J, et al. Fungal laccase:Properties and activity on lignin[J]. Journal of Basic Microbiology, 2010, 41(3/4): 185-227. |
| [27] |
Bao W, O' Malley D M, Whetten R, et al. A laccase associated with lignification in loblolly pine xylem[J]. Science, 1993, 260(5108): 672-674. DOI:10.1126/science.260.5108.672 |
| [28] |
Ni J F, Tokuda G. Lignocellulose-degrading enzymes from termites and their symbiotic microbiota[J]. Biotechnology Advances, 2013, 31(6): 838-850. DOI:10.1016/j.biotechadv.2013.04.005 |
| [29] |
Suderman R J, Dittmer N T, Kanost M R, et al. Model reactions for insect cuticle sclerotization:Cross-linking of recombinant cuticular proteins upon their laccase-catalyzed oxidative conjugation with catechols[J]. Insect Biochemistry and Molecular Biology, 2006, 36(4): 353-365. DOI:10.1016/j.ibmb.2006.01.012 |
| [30] |
Gavnholt B, Larsen K. Molecular biology of plant laccases in relation to lignin formation[J]. Physiologia Plantarum, 2010, 116(3): 273-280. |
| [31] |
Pourcel L, Routaboul J M, Kerhoas L, et al. TRANSPARENT TESTA10 encodes a laccase-like enzyme involved in oxidative polymerization of flavonoids in Arabidopsis seed coat[J]. Plant Cell, 2005, 17(11): 2966-2980. DOI:10.1105/tpc.105.035154 |
| [32] |
Berthet S, Demontcaulet N, Pollet B, et al. Disruption of LACCASE4 and 17 results in tissue-specific alterations to lignification of Arabidopsis thaliana stems[J]. Plant Cell, 2011, 23(3): 1124-1137. DOI:10.1105/tpc.110.082792 |
| [33] |
Kramer K J, Kanost M R, Hopkins T L, et al. Oxidative conjugation of catechols with proteins in insect skeletal systems[J]. Tetrahedron, 2001, 57(2): 385-392. DOI:10.1016/S0040-4020(00)00949-2 |
| [34] |
Piscitelli A, Del V C, Faraco V, et al. Fungal laccases:Versatile tools for lignocellulose transformation[J]. Comptes Rendus Biologies, 2011, 334(11): 789-794. DOI:10.1016/j.crvi.2011.06.007 |
| [35] |
Nagai M, Kawata M, Watanabe H, et al. Important role of fungal intracellular laccase for melanin synthesis:Purification and characterization of an intracellular laccase from Lentinula edodes fruit bodies[J]. Microbiology, 2003, 149(9): 2455-2462. DOI:10.1099/mic.0.26414-0 |
| [36] |
Ma S, Cao K, Liu N, et al. The StLAC2 gene is required for cell wall integrity, DHN-melanin synthesis and the pathogenicity of Setosphaeria turcica[J]. Fungal Biology, 2017, 121(6/7): 589-601. |
| [37] |
Osiadacz J, Al-Adhami A J H, Bajraszewska D, et al. On the use of Trametes versicolor laccase for the conversion of 4-methyl-3-hydroxyanthranilic acid to actinocin chromophore[J]. Journal of Biotechnology, 1999, 72(99): 141-149. |
| [38] |
Hatakka A. Lignin-modifying enzymes from selected white-rot fungi:Production and role from in lignin degradation[J]. FEMS Microbiology Reviews, 2010, 13(2/3): 125-135. |
| [39] |
Rouches E, Herpoëlgimbert I, Steyer J P, et al. Improvement of anaerobic degradation by white-rot fungi pretreatment of lignocellulosic biomass:A review[J]. Renewable and Sustainable Energy Reviews, 2016, 59: 179-198. DOI:10.1016/j.rser.2015.12.317 |
| [40] |
Bermek H, Li K, Eriksson E L. Laccase-less mutants of the white-rot fungus Pycnoporus cinnabarinus, cannot delignify kraft pulp[J]. Journal of Biotechnology, 1998, 66(2/3): 117-124. |
| [41] |
Giardina P, Faraco V, Pezzella C, et al. Laccases:A never-ending story[J]. Cellular and Molecular Life Sciences, 2010, 67(3): 369-385. DOI:10.1007/s00018-009-0169-1 |
| [42] |
Wei D, Houtman C J, Kapich A N, et al. Laccase and its role in production of extracellular reactive oxygen species during wood decay by the brown rot basidiomycete Postia placenta[J]. Applied and Environmental Microbiology, 2010, 76(7): 2091-2097. DOI:10.1128/AEM.02929-09 |
| [43] |
Camarero S, Ibarra D, Martínez M J, et al. Lignin-derived compounds as efficient laccase mediators for decolorization of different types of recalcitrant dyes[J]. Applied and Environmental Microbiology, 2005, 71(4): 1775-1784. DOI:10.1128/AEM.71.4.1775-1784.2005 |
| [44] |
Cañas A I, Camarero S. Laccases and their natural mediators:Biotechnological tools for sustainable eco-friendly processes[J]. Biotechnology Advances, 2010, 28(6): 694-705. DOI:10.1016/j.biotechadv.2010.05.002 |
| [45] |
Jeon J R, Kim E J, Murugesan K, et al. Laccase-catalysed polymeric dye synthesis from plant-derived phenols for potential application in hair dyeing:Enzymatic colourations driven by homo-or hetero-polymer synthesis[J]. Microbial Biotechnology, 2010, 3(3): 324-335. DOI:10.1111/mbt.2010.3.issue-3 |
| [46] |
Mikolasch A, Schauer F. Fungal laccases as tools for the synthesis of new hybrid molecules and biomaterials[J]. Applied Microbiology and Biotechnology, 2009, 82(4): 605-624. DOI:10.1007/s00253-009-1869-z |
| [47] |
Marjasvaara A, Torvinen M, Hanne Kinnunen A, et al. Laccase-catalyzed polymerization of two phenolic compounds studied by matrix-assisted laser desorption/ionization time-of-flight and electrospray ionization fourier transform ion cyclotron resonance mass spectrometry with collision-induced dissociation experiments[J]. Biomacromolecules, 2006, 7(5): 1604-1609. DOI:10.1021/bm060038p |
| [48] |
Fillat A, Roncero M B, Vidal T. Elucidating the effects of laccasemodifying compounds treatments on bast and core fibers in flax pulp[J]. Biotechnology and Bioengineering, 2012, 109(1): 225-233. |
| [49] |
Widsten P, Heathcote C, Kandelbauer A, et al. Enzymatic surface functionalisation of lignocellulosic materials with tannins for enhancing antibacterial properties[J]. Process Biochemistry, 2010, 45(7): 1072-1081. DOI:10.1016/j.procbio.2010.03.022 |
| [50] |
Baiocco P, Barreca A M, Fabbrini M, et al. Promoting laccase activity towards non-phenolic substrates:A mechanistic investigation with some laccase-mediator systems[J]. Organic & Biomolecular Chemistry, 2003, 1(1): 191-197. |
| [51] |
D' Acunzo F, Baiocco P, Fabbrini M, et al. A mechanistic survey of the oxidation of alcohols and ethers with the enzyme laccase and its mediation by TEMPO[J]. European Journal of Organic Chemistry, 2010, 2002(24): 4195-4201. |
| [52] |
Kleen M, Ohra-Aho T, Tamminen T. On the interaction of HBT with pulp lignin during mediated laccase delignification:A study using fractionated pyrolysis-GC/MS[J]. Journal of Analytical & Applied Pyrolysis, 2003, 70(2): 589-600. |
| [53] |
Nicotra S, Cramarossa M R, Mucci A, et al. Biotransformation of resveratrol:Synthesis of trans-dehydrodimers catalyzed by laccases from Myceliophtora thermophyla and from Trametes pubescens[J]. Tetrahedron, 2004, 60(3): 595-600. DOI:10.1016/j.tet.2003.10.117 |
| [54] |
Schroeder M, Pereira L, Couto S R. Enzymatic synthesis of Tinuvin[J]. Enzyme and Microbial Technology, 2007, 40(7): 1748-1752. DOI:10.1016/j.enzmictec.2006.11.026 |
| [55] |
López J, Alonso-Omlin E M, Hernández-Alcántara J M, et al. Novel photoluminescent material by laccase-mediated polymerization of 4-fluoroguaiacol throughout defluorination[J]. Journal of Molecular Catalysis B:Enzymatic, 2014, 109: 70-75. DOI:10.1016/j.molcatb.2014.08.003 |
| [56] |
Silva C, Matamá T, Kim S Y, et al. Antimicrobial and antioxidant linen via laccase-assisted grafting[J]. Reactive and Functional Polymers, 2011, 71(7): 713-720. DOI:10.1016/j.reactfunctpolym.2011.03.011 |
| [57] |
Sun K, Luo Q, Gao Y, et al. Laccase-catalyzed reactions of 17β-estradiol in the presence of humic acid:Resolved by high-resolution mass spectrometry in combination with 13C labeling[J]. Chemosphere, 2016, 145: 394-401. DOI:10.1016/j.chemosphere.2015.11.117 |
| [58] |
Dwivedi P, Vivekanand V, Pareek N, et al. Bleach enhancement of mixed wood pulp by xylanase-laccase concoction derived through coculture strategy[J]. Applied Biochemistry and Biotechnology, 2010, 160(1): 255-268. |
| [59] |
Jeon S J, Lim S J. Purification and characterization of the laccase involved in dye-decolorization by the white rot fungus Marasmius scorodonius[J]. Journal of Microbiology and Biotechnology, 2017, 27(6): 1120-1127. |
| [60] |
Spectrums C. Paper pulp delignification using laccase and natural mediators[J]. Enzyme and Microbial Technology, 2007, 40(5): 1264-1271. DOI:10.1016/j.enzmictec.2006.09.016 |
| [61] |
Barreca A M, Fabbrini M, Galli C, et al. Laccase/mediated oxidation of a lignin model for improved delignification procedures[J]. Journal of Molecular Catalysis B:Enzymatic, 2003, 26(1): 105-110. |
| [62] |
Witayakran S, Ragauskas A J. Modification of high-lignin softwood kraft pulp with laccase and amino acids[J]. Enzyme and Microbial Technology, 2009, 44(3): 176-181. DOI:10.1016/j.enzmictec.2008.10.011 |
| [63] |
Virk A P, Sharma P, Capalash N. Use of laccase in pulp and paper industry[J]. Biotechnology Progress, 2012, 28(1): 21-32. |
| [64] |
Vails C, Colom J F, Baffert C. Comparing the efficiency of the laccase-NHA and laccase-HBT systems in eucalyptus pulp bleaching[J]. Biochemical Engineering Journal, 2010, 49(3): 401-407. |
| [65] |
Xu Q, Qin M, Shi S, et al. Structural changes in lignin during the deinking of old newsprint with laccase-violuric acid system[J]. Enzyme and Microbial Technology, 2006, 39(5): 969-975. DOI:10.1016/j.enzmictec.2006.01.031 |
| [66] |
Moldes D, Díaz M, Tzanov T, et al. Comparative study of the efficiency of synthetic and natural mediators in laccase-assisted bleaching of eucalyptus kraft pulp[J]. Bioresource Technology, 2008, 99(17): 7959-7965. DOI:10.1016/j.biortech.2008.04.002 |
| [67] |
丁惠君, 吴亦潇, 钟家有, 等. 两种介体物质在漆酶降解磺胺类抗生素中的作用[J]. 中国环境科学, 2016, 36(5): 1469-1475. DING Hui-jun, WU Yi-xiao, ZHONG Jia-you, et al. Role of two mediators in sulfonamide antibiotics degradation by laccase oxidation system[J]. China Environmental Science, 2016, 36(5): 1469-1475. |
| [68] |
Johannes C, Majcherczyk A. Natural mediator in the oxidation of polycyclic aromatic hydrocarbon by laccase mediator system[J]. Applied and Environmental Microbiology, 2000, 66(2): 524-528. |
| [69] |
林先贵, 吴宇澄, 曾军, 等. 多环芳烃的真菌漆酶转化及污染土壤修复技术[J]. 微生物学通报, 2017, 44(7): 1720-1727. LIN Xian-gui, WU Yu-cheng, ZENG Jun, et al. Transformation of polycyclic aromatic hydrocarbon by fungal laccases and potential application in soil remediation[J]. Microbiology China, 2017, 44(7): 1720-1727. |
| [70] |
Ashe B, Nguyen L N, Hai F I, et al. Impacts of redox-mediator type on trace organic contaminants degradation by laccase:Degradation efficiency, laccase stability and effluent toxicity[J]. International Biodeterioration and Biodegradation, 2016, 113: 169-176. DOI:10.1016/j.ibiod.2016.04.027 |
| [71] |
Wu Y, Teng Y, Li Z, et al. Potential role of polycyclic aromatic hydrocarbons(PAHs)oxidation by fungal laccase in the remediation of an aged contaminated soil[J]. Soil Biology and Biochemistry, 2008, 40(3): 789-796. DOI:10.1016/j.soilbio.2007.10.013 |
| [72] |
Zhang G Q, Wang Y F, Zhang X Q, et al. Purification and characterization of a novel laccase from the edible mushroom Clitocybe maxima[J]. Process Biochemistry, 2010, 45(5): 627-633. DOI:10.1016/j.procbio.2009.12.010 |
| [73] |
Lettera V, Pezzella C, Cicatiello P, et al. Efficient immobilization of a fungal laccase and its exploitation in fruit juice clarification[J]. Food Chemistry, 2016, 196: 1272-1278. DOI:10.1016/j.foodchem.2015.10.074 |
| [74] |
Qiu S, Lin Z, Zhou Y, et al. A label-free fluorometric method for monitoring conformational flexibility of laccase based on a new selective laccase sensor[J]. Analytical Chemistry, 2013, 85(22): 11041-11046. DOI:10.1021/ac402693k |
| [75] |
宁娜, 谭慧军, 孙新新, 等. 真核生物来源漆酶的异源表达研究进展[J]. 生物工程学报, 2017, 33(4): 565-577. NING Na, TAN Hui-jun, SUN Xin-xin, et al. Advance of heterologous expression study of eukaryote-origin laccases[J]. Chinese Journal of Biotechnology, 2017, 33(4): 565-577. |
| [76] |
Liu J, Niu J, Yin L, et al. In situ encapsulation of laccase in nanofibers by electrospinning for development of enzyme biosensors for chlorophenol monitoring[J]. Analyst, 2011, 136(22): 4802-4808. DOI:10.1039/c1an15649g |
| [77] |
Yang J, Li D, Fu J, et al. TiO2-CuCNFs based laccase biosensor for enhanced electrocatalysis in hydroquinone detection[J]. Journal of Electroanalytical Chemistry, 2016, 766: 16-23. DOI:10.1016/j.jelechem.2016.01.030 |
| [78] |
Almeida I, Henriques F, Carvalho M D, et al. Carbon disulfide mediated self-assembly of laccase and iron oxide nanoparticles on gold surfaces for biosensing applications[J]. Journal of Colloid and Interface Science, 2017, 485: 242-250. DOI:10.1016/j.jcis.2016.09.042 |
| [79] |
Kacem S H, Galai S, Ríos A P D L, et al. New efficient laccase immobilization strategy using ionic liquids for biocatalysis and microbial fuel cells applications[J]. Journal of Chemical Technology and Biotechnology, 2018, 93(1): 174-183. DOI:10.1002/jctb.2018.93.issue-1 |
| [80] |
Bao C, Yin Y, Zhang Q. Synthesis and assembly of laccase-polymer giant amphiphiles by self-catalyzed CuAAC click chemistry[J]. Biomacromolecules, 2018, 19(5): 1539-1551. DOI:10.1021/acs.biomac.8b00087 |
| [81] |
Iqbal H M N, Kyazze G, Tron T, et al. Laccase from Aspergillus niger:A novel tool to graft multifunctional materials of interests and their characterization[J]. Saudi Journal of Biological Sciences, 2018, 25(3): 545-550. DOI:10.1016/j.sjbs.2016.01.027 |
 2019, Vol. 38
2019, Vol. 38