2. 吉首大学生物资源与环境科学学院, 湖南 吉首 416000;
3. 湘西州环保局, 湖南 湘西 416000
2. College of Biology and Environmental Science, Jishou University, Jishou 416000, China;
3. Xiangxi Environmental Protection Bureau, Xiangxi 416000, China
尾矿是有色金属矿山开采出的矿石利用各种分选方法选取精矿后产生的大量脉石废渣,其综合利用率低,处置方式主要以露天堆存为主[1]。尾矿主要由粉粒或颗粒状大小的砂粒组成,结构松散、无土壤团粒结构、微生物群落结构简单、持水保肥能力差、水蚀风蚀现象严重[2]。原位基质改良与植被重建技术是近年发展起来的最具有发展潜力的尾矿废弃地生态恢复技术,该技术的核心思想是在尾矿中添加改良材料,改善尾矿的理化性质并降低重金属毒性,使植物在较短的时间内在尾矿废弃地上生长、定居,形成稳定的植物群落[3-4]。生态恢复不仅能够美化矿区景观、涵养水源、防风固沙,而且有利于降低土壤重金属毒性、改变土壤微生物群落结构、加速土壤熟化过程[5-6]。
目前判断矿山废弃地生态恢复成功与失败的标准大都依赖于反映土壤理化性质的常规指标(包括重金属、有机质、氮、磷等)和在视觉上可分辨的地上植被指标,如盖度、生产力和物种多样性等[7-8]。由于矿山废弃地土壤成分的复杂性,植物生长不仅受土壤常规理化性质的影响,同时也受土壤中微生物的制约。这些常规指标和地上指标没能说明土壤微生物群落的状况,这可能会导致人们对生态系统恢复的片面理解。微生物是土壤重要的活体成分,它以各种不同的方式改变着土壤的物理、化学和生物学特性,参与土壤有机质的分解与合成、养分的释放与固定、环境污染物净化、土壤团聚体的形成等过程,是地球生物化学循环,特别是碳、氮、磷循环过程的主要驱动者[9]。因此,分析土壤微生物群落结构组成、多样性及微生物生物量等指标可为认识退化生态系统的恢复过程提供有价值的信息[10]。Zornoza等[11]分别施用猪粪、猪粪堆肥和生物炭改良矿区土壤,结果表明添加3种改良剂显著促进了细菌和真菌的生长,增加了微生物生物量、微生物活性。Shen等[12]比较了长期施用N肥和堆肥对农田土壤细菌群落的影响,结果表明,与堆肥相比,长期施用N肥显著改变了土壤细菌的群落组成并减少了细菌数量。Li等[13]在澳大利亚昆士兰PbZn-Cu尾矿上添加锯木屑作为改良剂,并种植乡土植物以研究土壤微生物群落结构变化,发现添加改良剂与种植乡土植物显著增加了微生物多样性、微生物生物量和相对丰度,主要微生物类群从无机营养型的Truepera、Thiobacillus和Rubrobacter转变为有机营养型的Nocardioides和Altererythrobacter。碳、氮和磷是保证植物正常生长发育的重要生源元素[14]。添加碳氮磷源改良剂可直接改善尾矿的营养状况,促进植物在尾矿废弃地上存活、生长和定居,但其对土壤微生物群落结构影响的研究鲜见报道。
近年来,随着分子生物学技术的快速发展,PCR、克隆文库、DNA测序、T-RFLP和16S rRNA基因高通量测序等技术得到了广泛的应用,并已渗透到土壤、环境修复领域[15-16]。这使得利用基因组学的研究策略探讨矿山废弃地生态恢复过程中土壤的形成、养分的循环与贮存、土壤微生物群落的结构成为可能。本研究假设采用添加不同碳氮磷源改良剂与植被重建的方式对铅锌尾矿废弃地进行生态恢复,能够改变土壤微生物群落结构、微生物多样性及微生物生物量,进而促进土壤熟化过程,加快尾矿废弃地的生态恢复进程。为此,采用高通量测序技术,研究不同碳氮磷源改良剂对铅锌尾矿土壤微生物群落结构的影响,为采取人工辅助手段加快重金属尾矿废弃地生态恢复提供科学依据和技术支持。
1 材料与方法 1.1 实验方案与样品采集2014年3月在湖南湘西花垣县浩宇化工有限公司铅锌尾矿废弃地建立了900 m2的实验地。试验区为丘陵地貌,海拔300~1800 m,属中亚热带山地气候,年平均气温15~16.9 ℃,年降水量1250~1500 mm,年平均日照时数1291~1406 h,原始植被为中亚热带典型山地植被。尾矿的基本理化性质为:pH值8.5± 0.3,电导率1.7±0.14 dS·m-1,有机碳160±38 mg·kg-1,全氮27.1±6.5 mg·kg-1,全磷17.9±5.3 mg·kg-1,总Cd 16.4 ± 0.38 mg · kg-1、总Cu 25.6 ± 0.68 mg · kg-1,总Pb 671±54.6 mg·kg-1,总Zn 1412±228 mg·kg-1。分别选用中药渣(Medicinal herb residue,MHR)、尿素([NH2)2CO]、磷肥[Ca(H2PO4)2]作为碳源、氮源和磷源改良剂。中药渣采自湘泉制药厂,其主要成分为中草药植物熬制成中药后形成的废渣,有机碳含量为531±10.4 g·kg-1(含有机碳≥50%);尿素为石家庄柏坡正元化肥有限公司生产(含氮≥46.4%);磷肥为湖北吉顺磷化有限公司生产(有效P2O5≥12%)。实验地分割成28个2 m×2 m实验小区,设计7种不同处理:①尾矿(CK)、②尾矿+尿素(N)、③尾矿+磷肥(P)、④尾矿+中药渣(MHR)、⑤尾矿+中药渣+尿素(MHR+N)、⑥尾矿+中药渣+磷肥(MHR+P)、⑦尾矿+中药渣+尿素+磷肥(MHR+N+P),每个处理4个重复,随机排列。中药渣、尿素、磷肥的添加量分别为15 t·hm-2、150 kg·hm-2和300 kg·hm-2。将上述改良剂均匀地平铺在实验小区地表,采用犁耕法与0~30 cm尾矿混匀。在每个实验小区内采用混播法播入10种乡土耐性植物种子:芒(Miscanthus sinensis)、狼尾草(Pennisetum alo pecuroides)、苍耳(Xanthium sibiricum)、黄花蒿(Arte misia annua)、苎麻(Boehmeria nivea)、斑花败酱(Pa trinia punctiflora)、胡枝子(Lespedeza bicolor)、马棘(In digofera pseudotinctoria)、百花泡桐(Paulownia fortu nei)和柏树(Platycladus orientalis)。本实验植物在自然条件下生长,试验期间不采取灌溉或其他管理措施。
在生态恢复两年后对实验小区进行全面调查与样品采集,采用梅花布点法从各个试验小区采集5个亚土样混合成1个土壤样品,采集深度0~30 cm,采集量1 kg左右。土样采集后立即过20目尼龙筛,装入塑料密封袋,做好标记,运回实验室。在实验室内将土样分成两份:一份装入无菌离心管,-20 ℃储存,供土壤微生物DNA提取;另一份4 ℃储存,供土壤微生物活性与微生物生物量分析。
1.2 土壤微生物总DNA提取、PCR扩增与信息分析 1.2.1 土壤微生物总DNA提取土壤微生物总DNA的提取使用FastDNA Spin kit试剂盒(MPBiomedieals,Santa Ana,CA,USA)。具体步骤如下:(1)称取0.3~0.4 g土壤样品加入到Lysing Matrix E Tube中,再加入978 µL SPB和122 µL MT Buffer,盖紧盖子,置于破碎机上,对管内物质进行振荡破碎均质化,时间为30 s,取出后离心5 min(8000 r·min-1);(2)将管中上清液转移至1.5 mL微离心管中,加入250 µL PPS,离心5 min(8000 r·min-1);(3)吸取1.0 mL Binding Matrix加入离心管中,上下颠倒2 min,静置3 min,使DNA附着于Bingding Matrix上;(4)小心移除600 µL上清液,加入500 µL SEWS-M溶液,混匀,离心2 min(8000 r · min-1),去除残留的SEWS-M溶液,更换为1.5 mL离心管(若发现残余溶液较多,可重复此步骤);(5)在室温下,将SPIN Filter风干5 min,加入80 µL DES溶液,混匀,65 ℃水浴15 min(有利于DNA的溶出),离心2 min(8000 r·min-1),得到约50 µL的DNA溶液,再加入80 µL DES溶液重复此操作,一共得到约100 µL DNA溶液。将提取的DNA溶液在Nanodrop 2000分光光度计(Thermo Sci entific,USA)上测定其浓度,记录DNA浓度及OD260/ 280数值。
1.2.2 PCR扩增与测序目的片段PCR扩增的区域为微生物16S rRNA基因的V4高变区,使用双端引物F515和R806。为区分样品,在引物R806的尾端给每个样品加入不同的长度为8个碱基Barcode的标签进行标记。PCR反应体系为20 μL:515F和806R引物各0.4 μL,10×Ex.taq buffer和dNTP各2 μL,BSA(Takara,Japan)0.2 μL,Ex. taq 0.1 μL(Takara,Japan),DNA模板10 ng,用无菌水补足20 μL。扩增反应通过PCR仪(ABI-Veriti96well)实现。PCR扩增条件为:94 ℃预变性5 min;94 ℃变性20 s,52 ℃退火30 s,72 ℃延伸30 s,32个循环;72 ℃延伸7 min,最后16 ℃保温。程序结束后立即取出PCR产物。每个样品扩增3个平行样,混合成一管后再将所有样品的PCR产物等摩尔体积混合均匀,并用QIAquick Gel Extraction Kit(Qiagen,USA)试剂盒进行纯化,之后送至北京诺禾致源生物信息科技有限公司采用Illmina Miseq平台进行高通量测序。
1.2.3 16S微生物信息分析利用FastQC软件对Miseq高通量测序得到的原始数据进行质量控制,筛查并剔除低质量序列和嵌合体序列。将有效序列相似性≥97%的序列合并成一个操作分类单元(Operational taxonomic unit,OTU),并将得到的OTU代表序列与RDP classifier数据库进行比对,按照80%的置信度对OTU进行物种分类[17]。利用QIIME分析平台分析各微生物群落的物种组成,以样品中最小序列数(13 527条)进行重抽样,计算其多样性指数,包括ACE、Chao1、Simpson和Shannon[18]。
1.3 土壤微生物活性与微生物生物量测定 1.3.1 土壤微生物活性测定称取30 g鲜土于500 mL广口试剂瓶中(为增强呼吸作用,可加入0.1 g葡萄糖),摊平。将装有10 mL 0.1 mol·L-1 NaOH的30 mL塑料小瓶放入广口试剂瓶中,盖好盖子,用封口膜密封。在25 ℃下培养24 h后取出塑料小瓶,加入2 mL 1 mol·L-1 BaCl2和3~ 4滴酚酞,摇匀,用0.1 mol · L-1 HCl滴定剩余的NaOH[19]。
1.3.2 土壤微生物生物量碳测定称取10 g新鲜土样于50 mL烧杯中,放入真空干燥器,在25 ℃黑暗条件下熏蒸24 h。熏蒸结束后将土样全部转移至80 mL塑料瓶中,加入50 mL 0.5 mol·L-1的K2SO4溶液,180 r·min-1振荡30 min,过滤。同时称取等量未熏蒸的新鲜土样于80 mL塑料瓶中,加入50 mL K2SO4溶液浸提。准确吸取熏蒸和未熏蒸的浸提液5 mL放入消化管中,加入重铬酸钾标准液2 mL,HgO 0.07 g、双酸溶液(H2SO4:H3PO4=2:1)15 mL,220 ℃消煮30 min,冷却后倒入150 mL三角瓶中,加入1滴邻啡罗啉指示剂,用硫酸亚铁溶液滴定剩余的重铬酸钾溶液。土壤微生物生物量碳为未熏蒸土样有机碳量与熏蒸土样有机碳量之差[20]。
1.3.3 土壤微生物生物量氮测定称取10 g新鲜土样于50 mL烧杯中,放入真空干燥器,在25 ℃的黑暗条件下熏蒸24 h,熏蒸结束后将土样全部转移至80 mL塑料瓶中,加入50 mL 2 mol· L-1的KCl溶液,180 r·min-1振荡30 min,过滤。同时称取等量未熏蒸的新鲜土样于80 mL塑料瓶中,加入50 mL KCl溶液浸提。准确吸取熏蒸和未熏蒸的浸提液10 mL于50 mL比色管中,加入5 mL苯酚溶液、5 mL次氯酸钠碱性溶液,摇匀,室温下放置1 h后加1 mL掩蔽剂,定容。在625 nm波长处进行比色,读取吸光度值。土壤微生物生物量氮为未熏蒸土样有效氮量与熏蒸土样有效氮量之差[20]。
1.3.4 土壤微生物生物量磷测定称取10 g新鲜土样于50 mL烧杯中,放入真空干燥器,在25 ℃的黑暗条件下熏蒸24 h,熏蒸结束后将土样全部转移至80 mL塑料瓶中,加入50 mL 0.5 mol·L-1的NaHCO3溶液,180 r·min-1振荡30 min,过滤。同时称取等量未熏蒸的新鲜土样于80 mL塑料瓶中,加入50 mL NaHCO3液浸提。准确吸取熏蒸和未熏蒸的浸提液10 mL于50 mL比色管中,加入2滴二硝基酚指示剂、5 mL钼锑抗显色剂,定容,室温下放置30 min。在700 nm波长处进行比色,读取吸光度值。土壤微生物生物量磷为未熏蒸土样有效磷量与熏蒸土样有效磷量之差[20]。
1.4 数据分析所有数据采用Excel 2007和SPSS 19.0进行处理与统计分析,不同处理间的显著性检验采用最小显著差数法(LSD,P < 0.05)。Pearson相关性分析用于土壤微生物活性、微生物生物量与主要微生物类群的相关性分析。作图软件采用Excel 2007、Origin 8.0和R语言程序包(http://www.r-project.org)。
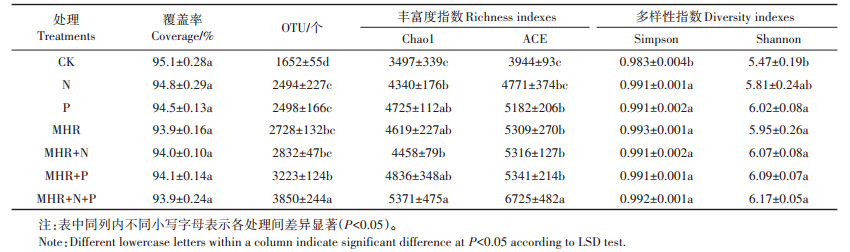
2 结果与分析 2.1 对土壤微生物群落多样性的影响本研究高通量测序的覆盖率≥93.9%,表明测序结果能够覆盖到样品微生物群落的绝大部分物种信息。总体来看,添加不同碳氮磷源改良剂显著提高了土壤微生物的OTU数和微生物群落多样性(表 1)。从OTU来看,没有添加改良剂的对照小区OTU数最少,仅为1652个,添加碳氮磷源改良剂的实验小区OTU数提高了0.5~1.3倍。从丰富度指数来看,与对照相比,添加碳氮磷源改良剂均显著提高了土壤微生物群落的Chao1指数和ACE指数。其中,MHR+N+P处理小区效果最好,Chao1指数和ACE指数分别为对照小区的1.5倍和1.7倍;N、P、MHR、MHR+N、MHR+ P处理小区间没有显著差异。从多样性指数来看,与对照相比,添加碳氮磷源改良剂均显著提高了土壤微生物群落的Simpson指数和Shannon指数,但各添加改良剂处理小区间没有显著性差异。
|
|
表 1 不同碳氮磷源改良剂对土壤微生物多样性的影响(均值±标准误差,n=4) Table 1 Effects of amendments with different C/N/P ratios on microbial community diversity(mean±S.E., n=4) |
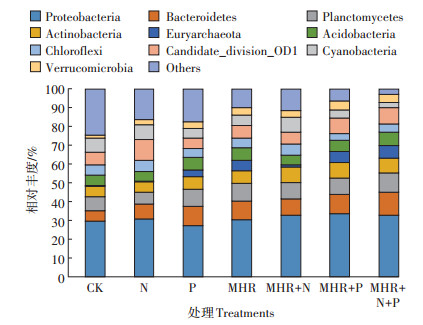
整个数据集共发现24个门,相对丰度最具优势的10个门分别是变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、放线菌门(Actinobacteria)、广古菌门(Euryarchaeota)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、Candidate_di vision_OD1、蓝藻门(Cyanobacteria)和疣微菌门(Ver rucomicrobia),分别占总的高质量序列的31.1%、9.3%、8.6%、7.0%、3.4%、6.1%、4.9%、7.6%、5.7%和3.5%(图 1)。总体来看,添加不同碳氮磷源改良剂提高了这10个优势门的总体相对丰度。与对照相比,添加碳氮磷源改良剂的处理小区中Bacteroidetes、Eu ryarchaeota和Verrucomicrobia相对丰度均显著提高;Acidobacteria相对丰度在P、MHR、MHR+P和MHR+ N+P处理小区中显著提高,Candidate_division_OD1相对丰度在N、MHR+P和MHR+N+P处理小区中显著提高;Cyanobacteria相对丰度在P、MHR、MHR + P和MHR+N+P处理小区中显著下降;添加碳氮磷源改良剂对Proteobacteria、Planctomycetes、Acidobacteria和Chloroflexi的相对丰度没有显著影响。
|
图 1 不同碳氮磷源改良剂对土壤微生物群落主要优势门的影响 Figure 1 Effects of amendments with different C/N/P ratios on the dominant phyla of soil microbial community |
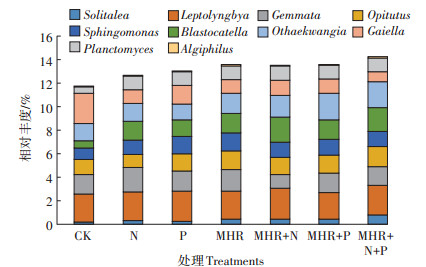
整个数据集共发现211个属,相对丰度最具优势的10个属分别是Solitalea、Leptolyngbya、Gemmata、Opitutus、Sphingomonas、Blastocatella、Ohtaekwangia、Gaiella、Planctomyces和Algiphilus,分别占总序列的0.39%、2.46%、1.65%、1.46%、1.31%、1.57%、1.75%、1.42%、1.09%和0.06%(图 2)。总体来看,添加不同碳氮磷源改良剂提高了这10个优势属的总体相对丰度。与对照相比,添加碳氮磷源改良剂的处理Solitalea、Sphingomonas、Blastocatella和Planctomyces相对丰度均显著提高;Gaiella相对丰度显著下降;Opitutus相对丰度在P、MHR、MHR+N、MHR+P和MHR+N+P处理小区中显著提高,Ohtaekwangia相对丰度在MHR+N、MHR+P和MHR+N+P处理小区中显著提高,Gemmata相对丰度在N处理小区中显著提高;添加碳氮磷源改良剂对Leptolyngbya和Algiphilus 的相对丰度没有显著影响。
|
图 2 不同碳氮磷源改良剂对土壤微生物主要优势属的影响 Figure 2 Effects of amendments with different C/N/P ratios on the dominant genus of soil microbial community |
添加不同碳氮磷源改良剂对铅锌尾矿土壤微生物活性和微生物生物量的影响见图 3。与对照相比,添加碳氮磷源改良剂不同程度地增加了微生物活性和微生物生物量。从微生物活性来看,添加碳氮磷源改良剂均显著增加了微生物活性,为对照的1.1~2.7倍。从微生物生物量碳来看,N、P处理小区与对照相比没有显著差异,MHR、MHR+N、MHR+P和MHR+N+ P处理小区微生物生物量碳显著增加,分别为对照的2.1、2.1、2.8倍和2.8倍。从微生物生物量氮来看,P、MHR、MHR+N、MHR+P和MHR+N+P处理小区显著增加了微生物生物量氮,其中MHR+N+P处理小区效果最好,为对照的2.5倍。从微生物生物量磷来看,N、MHR、MHR+N处理小区与对照相比没有显著差异,P、MHR+P和MHR+N+P处理小区显著增加了微生物生物量磷,分别为对照处理的1.3、1.7倍和1.8倍。
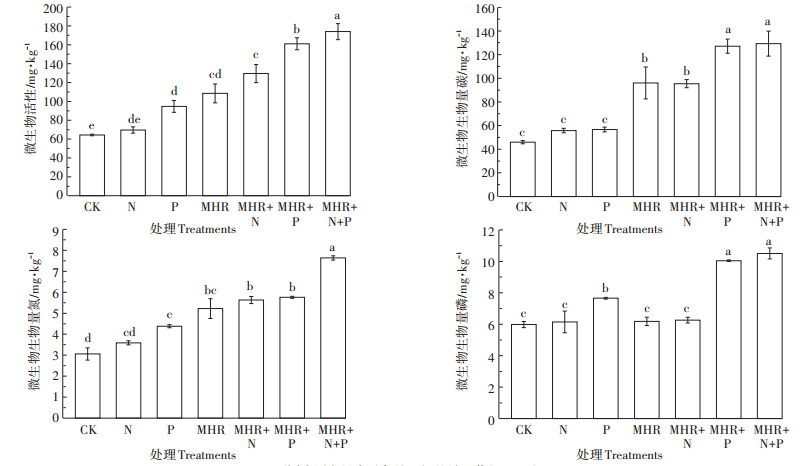
|
不同小写字母表示各处理间差异显著(P < 0.05) The different lowercase letters indicate significant differences among different treatments(P < 0.05) 图 3 不同碳氮磷源改良剂对土壤微生物活性与微生物生物量的影响(均值±标准误差,n=4) Figure 3 Effects of amendments with different C/N/P ratios on microbial activity and biomass C, N and P (mean±S.E., n=4) |
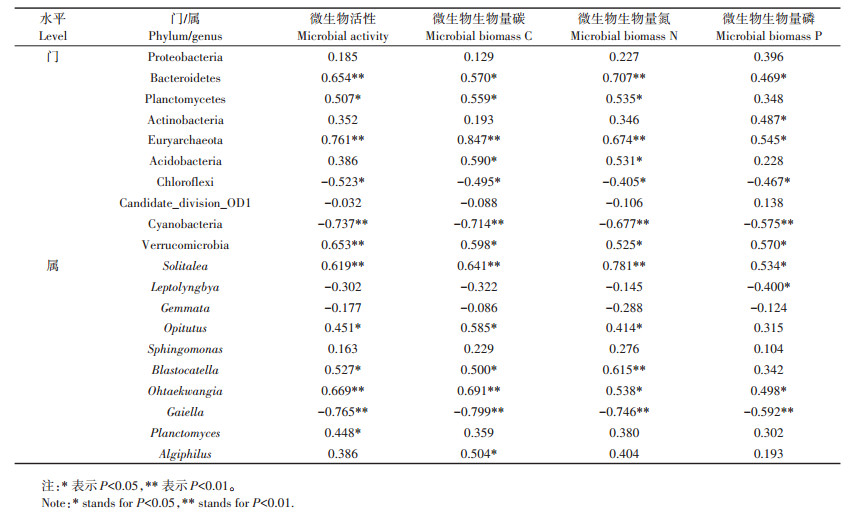
通过Gheatmap程序包进行聚合促进树(Aggre gated boosted tree,ABT)分析添加碳氮磷源改良剂对微生物群落结构格局的影响。结果表明:在门水平上,CK、N、MHR+N处理聚在一起,P、MHR、MHR+P和MHR+N+P处理聚在一起(图 4a);在属水平上,CK单列,N、P、MHR、MHR+N、MHR+P和MHR+N+P处理聚在一起,其中N和P,MHR和MHR+N,MHR+P和MHR+N+P又分别聚在一起(图 4b)。利用Pearson相关性分析对主要微生物类群与土壤微生物活性、微生物生物量进行相关性分析,结果表明(表 2):10个主要优势门中Bacteroidetes、Planctomycetes、Euryar chaeota、Verrucomicrobia与微生物活性和微生物生物量呈显著(P < 0.05)或极显著(P < 0.01)正相关;Chloro flexi、Cyanobacteria与微生物活性和微生物生物量呈显著(P < 0.05)或极显著(P < 0.01)负相关。10个主要优势属中Solitalea、Opitutus、Blastocatella和Ohtae kwangia与微生物活性和微生物生物量呈显著(P < 0.05)或极显著(P < 0.01)正相关;Gaiella与微生物活性和微生物生物量呈极显著(P < 0.01)负相关。
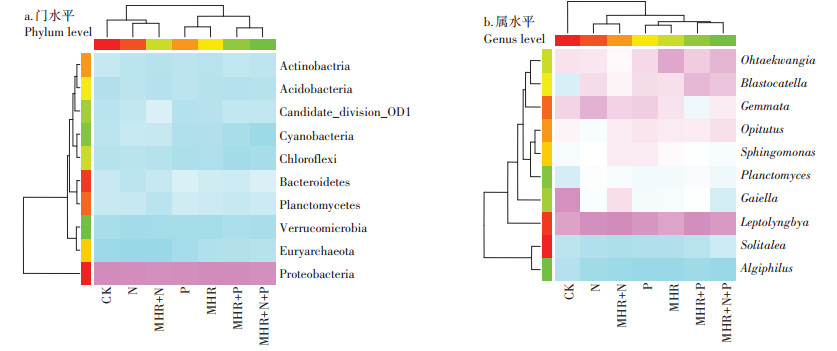
|
图 4 添加不同碳氮磷源改良剂对尾矿微生物群落组成影响的热图 Figure 4 Heat maps of amendments with different C/N/P ratios on the overall microbial communities evaluated by aggregated boosted tree models |
|
|
表 2 土壤微生物活性、微生物生物量与主要微生物类群的相关性分析 Table 2 Pearson′s correlation coefficients between microbial activity and biomass and the dominant phyla and genera of microbial community |
尾矿废弃地作为矿山新形成的生态系统,具有微生物群落结构简单、有机质和营养元素(氮、磷等)不足、重金属浓度高等特点,因此,对于研究生态系统恢复过程中的微生物群落结构特征,尾矿是非常理想的自然实验室[21]。本研究中,添加碳氮磷源改良剂不同程度地提高了土壤微生物OTU数、微生物多样性、微生物活性和微生物生物量(表 1、图 3)。其原因可能是碳氮磷源改良剂的添加直接提供了土壤微生物生长、代谢所需要的碳源、氮源和磷源等营养物质,这与前人研究结果是一致的。袁红朝等[22]研究了长期施用氮磷钾肥、氮磷钾肥+秸秆还田对稻田土壤细菌、古菌多样性和群落结构的影响,发现长期施肥影响了土壤细菌和古菌的群落结构,细菌和古菌的多样性和数量显著增加。
土壤有机质、营养元素(氮、磷等)及矿物质颗粒共同参与土壤团聚体的形成,为土壤微生物提供了良好的栖居环境,调控土壤微生物群落的代谢功能和结构[23]。本研究中,添加不同碳氮磷源改良剂改变了尾矿废弃地土壤微生物群落主要优势门类和属类的组成。与对照相比,添加碳氮磷源改良剂后10个主要优势门中Bacteroidetes、Euryarchaeota、Verrucomicro bia、Acidobacteria和Candidate_division_OD1的相对丰度增加,Cyanobacteria的相对丰度在某些处理中降低(图 1);10个主要优势属中Solitalea、Sphingomonas、Blastocatella、Planctomyces、Opitutus、Ohtaekwangia和Gemmata的相对丰度在某些处理中增加,Gaiella的相对丰度降低(图 2);其原因可能是添加碳氮磷源改良剂刺激或抑制了某一类或几类微生物的生长。类似的研究也有报道,Li等[9]发现在Pb-Zn-Cu尾矿废弃地上添加表土作为改良剂,尾矿土壤中的Bacteroide tes和Euryarchaeota相对丰度显著性增加。Li等[24]在煤矿废弃地上开展长期复垦和再植被过程,发现这极大增加了土壤中Bacteroidetes和Verrucomicrobia的相对丰度。其原因是添加改良剂和再植被过程增加了土壤碳库和碳周转率,改变了土壤环境和养分含量,影响了土壤中某些微生物的生长和代谢活动[9, 24]。Solitalea是2009年被发现的一个新属,目前对其功能了解的还不是很深入,但比较明确的是该属微生物都是中度嗜温的,因此可以推测在尾矿废弃地生态恢复过程中,植被的建立有效避免了尾矿表面温度冬季过低或夏季过高的情况,从而增加了Solitalea的相对丰度[25]。
碳是植物必需的生命元素,氮、磷是植物生长必不可少的矿质性营养元素和关键的限制性养分[26]。在尾矿废弃地基质改良中添加碳氮磷源改良剂不仅促进尾矿土壤的熟化过程,有利于植物的生长,而且会对土壤微生物的生长和代谢产生影响[27]。本研究中,添加不同碳氮磷源改良剂不同程度地增加了微生物活性和微生物生物量(图 3),这与添加碳氮磷源改良剂增加了土壤微生物某些优势门(如Bacteroidetes、Euryarchaeota、Verrucomicrobia、Acidobacteria和Can didate_division_OD1)和某些优势属(如Solitalea、Sphingomonas、Blastocatella、Planctomyces、Opitutus、Ohtaekwangia和Gemmata)的相对丰度有关。这种相关性在Bacteroidetes、Planctomycetes、Euryarchaeota、Verrucomicrobia(门)和Solitalea、Opitutus、Blastocatella和Ohtaekwangia(属)与微生物活性、微生物生物量碳、氮、磷呈显著正相关的关系中得到进一步验证(表 2)。综合分析发现,添加碳氮磷源改良剂对土壤微生物群落组成、多样性、微生物活性和微生物生物量均有显著影响,7种改良处理中MHR+P和MHR+N+P处理效果最好。
4 结论(1)添加不同碳氮磷源改良剂显著增加了土壤微生物OTU数、微生物多样性、微生物活性和微生物生物量。
(2)添加不同碳氮磷源改良剂显著改变了土壤微生物群落组成,10个主要优势门中Bacteroidetes、Eu ryarchaeota、Verrucomicrobia、Acidobacteria、Candi date_division_OD1的相对丰度显著增加,Cyanobacte ria的相对丰度显著降低;10个主要优势属中Soli talea、Sphingomonas、Blastocatella、Planctomyces、Opitu tus、Ohtaekwangia和Gemmata的相对丰度显著增加,Gaiella的相对丰度显著降低。
(3)Pearson相关性分析表明,10个主要优势门中Bacteroidetes、Planctomycetes、Euryarchaeota、Verruco microbia与微生物活性和微生物生物量呈显著正相关,Chloroflexi、Cyanobacteria与微生物活性和微生物生物量呈显著负相关;10个主要优势属中Solitalea、Opitutus、Blastocatella、Ohtaekwangia与微生物活性和微生物生物量呈显著正相关,Gaiella与微生物活性和微生物生物量呈显著负相关。
(4)聚合促进树分析表明,在门水平上,CK、N、MHR+N处理聚在一起,P、MHR、MHR+P、MHR+N+P处理聚在一起;在属水平上,CK单列,N、P、MHR、MHR+N、MHR+P和MHR+N+P处理聚在一起。总体来看,7种改良处理中MHR+P和MHR+N+P处理效果最好。
| [1] |
Karaca O, Cameselle C, Reddy K R. Mine tailing disposal sites:Contamination problems, remedial options and phytocaps for sustainable remediation[J]. Reviews in Environmental Science and Bio-technology, 2018, 17(1): 205-228. DOI:10.1007/s11157-017-9453-y |
| [2] |
Clémence M B, Pardo T, Bernal M P, et al. Assessment of the environmental risks associated with two mine tailing soils from the La UniónCartagena(Spain)mining district[J]. Journal of Geochemical Exploration, 2014, 147(Part B): 98-106. |
| [3] |
Lee S H, Ji W H, Lee W S, et al. Influence of amendments and aided phytostabilization on metal availability and mobility in Pb/Zn mine tailings[J]. Journal of Environmental Management, 2014, 139: 15-21. |
| [4] |
Yang S X, Cao J B, Li F M, et al. Field evaluation of the effectiveness of three industrial by-products as organic amendments for aided phytostabilization of a Pb/Zn mine tailings[J]. Environmental Science Processes & Impacts, 2016, 18(1): 95-103. |
| [5] |
Wang L, Ji B, Hu Y H, et al. A review on in situ phytoremediation of mine tailings[J]. Chemosphere, 2017, 184: 594-600. DOI:10.1016/j.chemosphere.2017.06.025 |
| [6] |
Yang T T, Liu J, Chen W C, et al. Changes in microbial community composition following phytostabilization of an extremely acidic Cu mine tailings[J]. Soil Biology and Biochemistry, 2017, 114: 52-58. DOI:10.1016/j.soilbio.2017.07.004 |
| [7] |
Kabas S, Faz A, Acosta J A, et al. Effect of marble waste and pig slurry on the growth of native vegetation and heavy metal mobility in a mine tailing pond[J]. Journal of Geochemical Exploration, 2012, 123(12): 69-76. |
| [8] |
Pardo T, Bernal M P, Clemente R. Efficiency of soil organic and inorganic amendments on the remediation of a contaminated mine soil:Ⅰ. Effects on trace elements and nutrients solubility and leaching risk[J]. Chemosphere, 2014, 107: 121-128. DOI:10.1016/j.chemosphere.2014.03.023 |
| [9] |
Li X F, You F, Bond P L, et al. Establishing microbial diversity and founctions in weathered and neutral Cu-Pb-Zn tailings with native soil addition[J]. Geoderma, 2015, 247/248: 108-116. DOI:10.1016/j.geoderma.2015.02.010 |
| [10] |
Li Y, Sun Q Y, Zhan J, et al. Soil-covered strategy for ecological restoration alters the bacterial community structure and predictive energy metabolic functions in mine tailings profiles[J]. Applied Microbiology and Biotechnology, 2017, 101(6): 2549-2561. DOI:10.1007/s00253-016-7969-7 |
| [11] |
Zornoza R, Acosta J A, Faz A, et al. Microbial growth and community structure in acid mine soils after addition of different amendments for soil reclamation[J]. Geoderma, 2016, 272: 64-72. DOI:10.1016/j.geoderma.2016.03.007 |
| [12] |
Shen J P, Zhang L M, Guo J F, et al. Impact of long-term fertilization practices on the abundance and composition of soil bacterial communities in northeast China[J]. Applied Soil Ecology, 2010, 46(1): 119-124. DOI:10.1016/j.apsoil.2010.06.015 |
| [13] |
Li X F, Bond P L, Van Nostrand J D, et al. From lithotroph-to organotroph-dominant:Directional shift of microbial community in sulphidic tailings during phytostabilization[J]. Scientific Reports, 2015, 5: 12978. DOI:10.1038/srep12978 |
| [14] |
Deng L, Shangguan Z P. Afforestation drives soil carbon and nitrogen changes in China[J]. Land Degradation & Development, 2017, 28(1): 151-165. |
| [15] |
刘驰, 李家宝, 芮俊鹏, 等. 16S rRNA基因在微生物生态学中的应用[J]. 生态学报, 2015, 35(9): 2769-2788. LIU Chi, LI Jia-bao, RUI Jun-peng, et al. The applications of the 16S rRNA gene in microbial ecology:Current situation and problems[J]. Acta Ecologica Sinica, 2015, 35(9): 2769-2788. |
| [16] |
于水强, 王文娟, Li B Larry. 环境DNA技术在地下生态学中的应用[J]. 生态学报, 2015, 35(15): 4968-4976. YU Shui-qiang, WANG Wen-juan, LI B-Larry. Applied environmental DNA technology to study underground ecology[J]. Acta Ecologica Sinica, 2015, 35(15): 4968-4976. |
| [17] |
Wang Q, Garrity G M, Tiedje J M, et al. Naive bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267. DOI:10.1128/AEM.00062-07 |
| [18] |
Caporaso J G, Kuczynski J, Stombaugh J, et al. QⅡME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [19] |
Anderson J P E. Methods of soil analysis[M]. 2nd Edition, Madison: American Society of Agronomy Inc Press, 1982: 837-839.
|
| [20] |
Turner B L, Bristow A W, Haygarth P M. Rapid estimation of microbial biomass in grassland soils by ultra-violet absorbance[J]. Soil Biology and Biochemistry, 2001, 33(7): 913-919. |
| [21] |
Li J J, Zhou X M, Yan J X, et al. Effects of regenerating vegetation on soil enzyme activity and microbial structure in reclaimed soils on a surface coal mine site[J]. Applied Soil Ecology, 2015, 87: 56-62. DOI:10.1016/j.apsoil.2014.11.010 |
| [22] |
袁红朝, 吴昊, 葛体达, 等. 长期施肥对稻田土壤细菌、古菌多样性和群落结构的影响[J]. 应用生态学报, 2015, 26(6): 1807-1813. YUAN Hong-chao, WU Hao, GE Ti-da, et al. Effects of long-term fertilization on bacterial and archaeal diversity and community structure within subtropical red paddy soils[J]. Chinese Journal of Applied Ecology, 2015, 26(6): 1807-1813. |
| [23] |
Wessen E, Nyberg K, Jansson J K, et al. Responses of bacterial and archaeal ammonia oxidizers to soil organic and fertilizer amendments under long-term management[J]. Applied Soil Ecology, 2010, 45(3): 193-200. DOI:10.1016/j.apsoil.2010.04.003 |
| [24] |
Li Y Y, Wen H Y, Chen L Q, et al. Succession of bacterial community structure and diversity in soil along a chronosequence of reclamation and re-vegetation on coal mine spoils in China[J]. PLoS One, 2014, 11: 1-24. |
| [25] |
Weon H Y, Kim B Y, Lee C M, et al. Solitalea koreensis gen. nov., sp. nov. and the reclassification of[Flexibacter] canadensis as Solitalea canadensis comb. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59: 1969-1975. DOI:10.1099/ijs.0.007278-0 |
| [26] |
Zeng Q C, Liu Y, Fang Y, et al. Impact of vegetation restoration on plants and soil C:N:P stoichiometry on the Yunwu Mountain Reserve of China[J]. Ecological Engineering, 2017, 109(Part A): 92-100. |
| [27] |
Li Y, Sun Q Y, Zhan J, et al. Soil-covered strategy for ecological restoration alters the bacterial community structure and predictive energy metabolic functions in mine tailings profiles[J]. Applied Microbiology and Biotechnology, 2017, 101(6): 2549-2561. DOI:10.1007/s00253-016-7969-7 |
 2019, Vol. 38
2019, Vol. 38