泥炭地面积仅占陆地总面积的4%~5%,其碳储量却占全球碳储量的三分之一,Catotelm层处于泥炭地的下层(图 1),长期处于淹水状态,无机盐含量低,孔隙水电导率极低,积累了大量有机碳,因此泥炭地是一个重要碳库,对全球碳循环起关键作用[1~3]。全球80%的泥炭地位于北半球寒温带气候区[4],当泥炭地外界环境条件发生改变[5],会使泥炭地中的有机质分解并排放二氧化碳(CO2)和甲烷(CH4)到大气中[1],此时泥炭地便由碳汇转变为碳源。CO2和CH4都是重要的温室气体,其中CH4排放量虽仅约占温带沼泽地和寒温带泥炭地净初级生产力的3%[6],但由于CH4较强的温室效应而对气候变化起着重要作用[7-8]。此外,由气候变化可以直接或间接引起的泥炭沼泽的温度、pH值、泥炭底质等发生变化,进而显著影响其碳排放的过程[2],因此关注变化环境下泥炭地碳排放的变化有着重要的意义。

|
图 1 泥炭沼泽垂直剖面示意图 Figure 1 Schematic of peat bog vertical section |
国内有不少学者通过野外观测实验发现,泥炭地的碳排放与地下水位[9-10]以及土壤温度[3, 9]、充水孔隙率[9]、干湿交替[11-12]等有关,其中郝庆菊等[3]发现CO2和CH4的排放速率与土壤温度呈显著正相关,欧阳扬等[11]发现干湿交替能促进CO2排放,但是当前国内甚少有土壤底质和pH值与碳排放关系的研究。然而国外的前期泥炭土室内培养实验发现,随着培养时间增加,CO2和CH4排放出现减缓甚至完全停滞的现象,有学者推断可能是由于化学因素或热力学因素导致[13-15]。
本文以加拿大Mer Bleue沼泽泥炭地的Catotelm层土壤为研究对象,通过培养实验监测CO2和CH4在不同的温度、pH值和泥炭土底质条件下的排放,探求环境因子对CO2和CH4产生速率的影响,厘清泥炭土碳排放过程抑制效应受环境因子的影响程度。
1 材料与方法 1.1 样品采集本培养实验的样品取自加拿大安大略省渥太华以东的Mer Bleue(45°24′ 35″ N,75°31′ 04″ W)典型雨养泥炭地(无机盐含量极低)(图 2),采样时间为2018年4月9日。采样点地表长期处于淹水状态,并且该地区1971—2000年的年平均气温为6 ℃,年平均降水量为944 mm,符合温带气候特征[16]。

|
图 2 采样点位置 Figure 2 Sampling site in Mer Bleue (Ontario, Canada) |
使用芬兰箱式采样器(Peat profile sampler,type wardennaar,Eijkelkamp,Dutch)采集深度为50 cm的样品,俄罗斯泥炭采样器(Peat sampler,Eijkelkamp,Dutch)采集深度为100、150 cm和250 cm的样品,待用样品在培养实验开始前,需淹水静置2周,促使微生物群落将泥炭土重新调整至无氧条件。
1.2 培养实验方法各个处理组的泥炭土样品质量均为25 g(湿质量),且置于平均容量为266 mL的广口瓶中(图 3)。为研究温度对泥炭土分解过程的影响,取深度为50 cm的泥炭土样品分别置于3个不同温度条件:5.4、13.1、20.1 ℃(以下简称“T5.4”、“T13.1”、“T20.1”)。对于研究pH值的影响,取4份深度为50 cm原始pH值为4.28的泥炭土样品,在其中2份样品中加入50 mL 0.07 mol·L-1 pH值为5的磷酸盐缓冲剂(Sörensenphosphate),另外2份样品分别加入50 mL 0.07 mol· L-1 pH值为6、7的磷酸盐缓冲剂,然后用0.5 mol·L-1的氢氧化钠(NaOH)溶液将4份样品滴定调节至pH值为4、5、6、7四个水平(以下简称“pH4”、“pH5”、“pH6”、“pH7”),并且置于(20.1±2.0)℃下培养。

|
图 3 培养实验广口瓶示意图 Figure 3 Schematic of incubation jar |
由于泥炭土的分解程度随深度变化较大[16],故本研究选取不同深度的泥炭土处理组进行培养实验,培养温度为(20.1±2.0)℃,深度处理分别取深度为50、90~110、140~160、240~260 cm(以下简称“D50”、“D100”、“D150”、“D250”)的泥炭土作为处理组。实验开始前测得不同深度处溶解性有机碳(DOC)浓度差别不大:50 cm为19.1 mg C·L-1,100 cm为18.5 mg C·L-1,150 cm为18.9 mg C·L-1,250 cm为19.2 mg C·L-1。
每个环境因子处理组设置3个重复,分别记作A、B、C,培养时间为73 d,所有培养瓶均用锡箔纸包裹遮光。实验开始前,通过三通旋塞充氮气(N2)[14],然后注射50 mL去氧蒸馏水来模拟Catotelm层中的厌氧和饱和水条件。泥炭土培养实验过程中CO2和CH4排放量的检测为每隔2~7 d抽取2 mL气体样品,利用气相色谱仪(SRI 8610C,美国)测定CO2和CH4的浓度[14]。
1.3 数据分析方法计算所有样品中每个取样时间对应的生成气体的物质的量,即确定广口瓶内分压的CO2和CH4的物质的量,同时利用亨利定律确定液相中物质的量[17]。
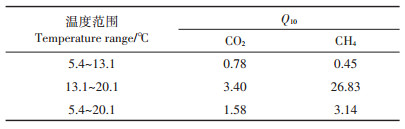
初始产生速率是指碳排放量的变化量,单位为μmol·g-1DW·d-1。首先将实验过程每次测量的CO2和CH4的浓度转化为碳排放的总量,即用浓度除以泥炭的干质量,单位为μmol·g-1DW,然后利用实验开始后的前三个碳排放总量对时间进行线性回归并计算初始产生速率,且仅当R2 > 0.8才能判断为有效初始产生速率[16]。温度常数Q10可以衡量温度变化10 ℃对CO2和CH4排放速率的影响程度[18-19]。
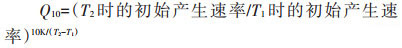
|
(1) |
培养实验碳排放阈值出现时间的确定方法为从第一次测量值开始,做3点滑动平均,当相邻2组平均值的差异小于5%视为阈值出现的时间。阈值则定义为从阈值出现时间对应的测量值至最后一次测量的所有测量浓度的平均值。利用Origin 8.0对原始数据进行处理并绘图,利用SPSS 23进行Pearson相关分析及单因素方差分析。
2 结果与分析 2.1 泥炭土培养过程碳排放的初始产生速率在所有的温度处理组中,对于CO2的排放情况,从图 4可知,T20.1的CO2初始产生速率最高,为(0.939±0.309)μmol·g-1DW·d-1,T13.1的CO2初始产生速率为(0.399±0.024)μmol·g-1DW·d-1,略小于T5.4的CO2初始产生速率(0.481±0.259)μmol·g-1DW·d-1,这是由于T5.4的重复实验C的产生速率较高导致的,不同温度处理组之间差异显著(P < 0.01)。对于CH4的排放,T20.1处理组的初始产生速率为(0.180 ± 0.091)μmol · g-1DW · d-1,T13.1的为(0.018 ± 0.009)μmol·g-1DW·d-1,而T5.4处理组计算得出的CH4初始产生速率不是有效初始产生速率(见1.3)。由于CH4只有T20.1和T13.1处理组为有效初始产生速率,因此不能分析其处理组之间是否具有显著差异。不同温度范围计算的Q10值如表 1所示,当温度范围为13.1~20.1、5.4~20.1 ℃时,CH4的Q10值比CO2的大,说明在较高温度条件下,CH4的排放速率受温度影响较CO2大。

|
图 4 不同处理组中CO2和CH4的初始产生速率 Figure 4 Initial production rates of CO2 and CH4 in different treatments |
|
|
表 1 不同温度范围Q10的值 Table 1 Q10 values for different temperature ranges |
不同pH条件下培养实验变化规律如图 4所示。对于CO2,其初始产生速率随pH值升高而增加,且增加趋势显著(P < 0.01),pH4和pH5的平均初始产生速率与T20.1的相当,pH6和pH7的平均初始产生率则分别是T20.1的1.7倍和2.5倍,这是因为pH处理组与T20.1的采样深度相同且放置于同一温度下,而T20.1中的泥炭土并未进行pH处理,可代表原位泥炭土的pH值。对于CH4,pH值处理组的CH4初始产生速率均较T20.1的低,且随pH值增加没有呈现显著变化趋势(P > 0.01)。
对于不同深度的处理,利用1.3的计算方法得出的不是其有效初始产生速率(R2 < 0.8),因此此处不讨论深度处理的初始产生速率的变化情况。
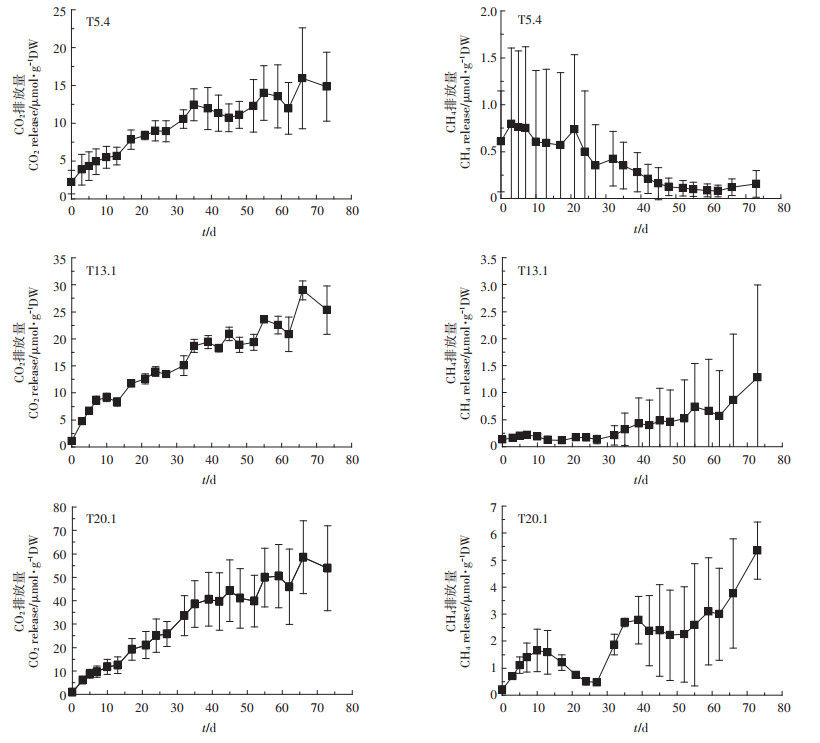
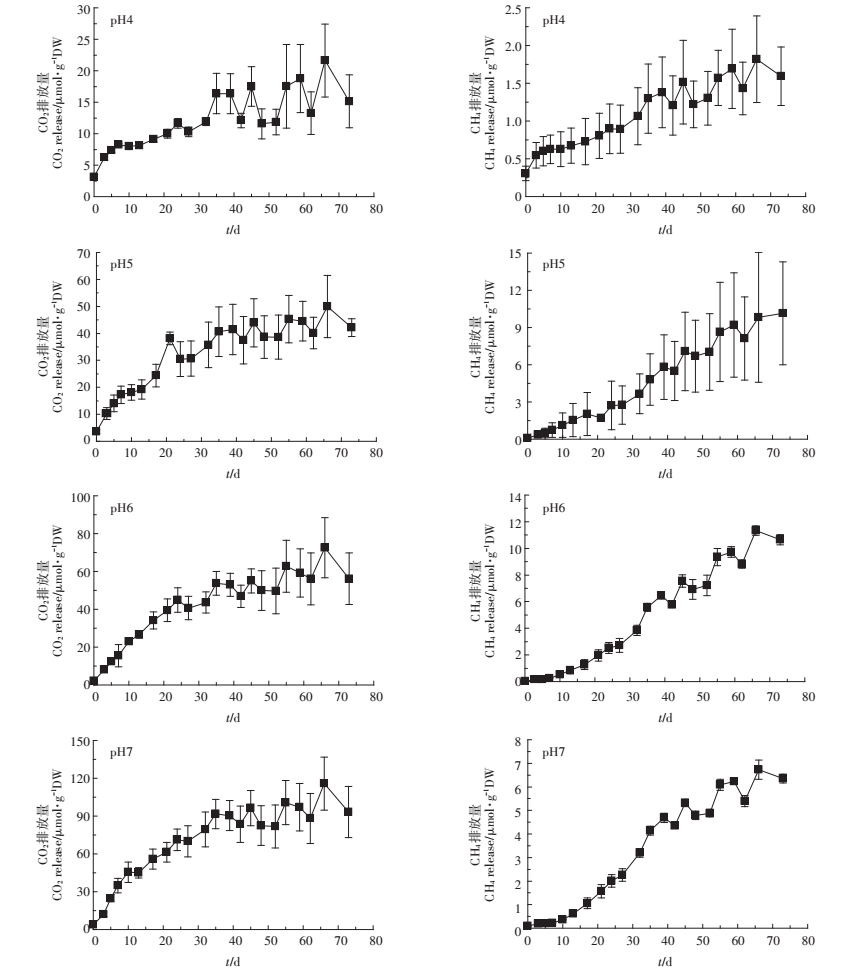
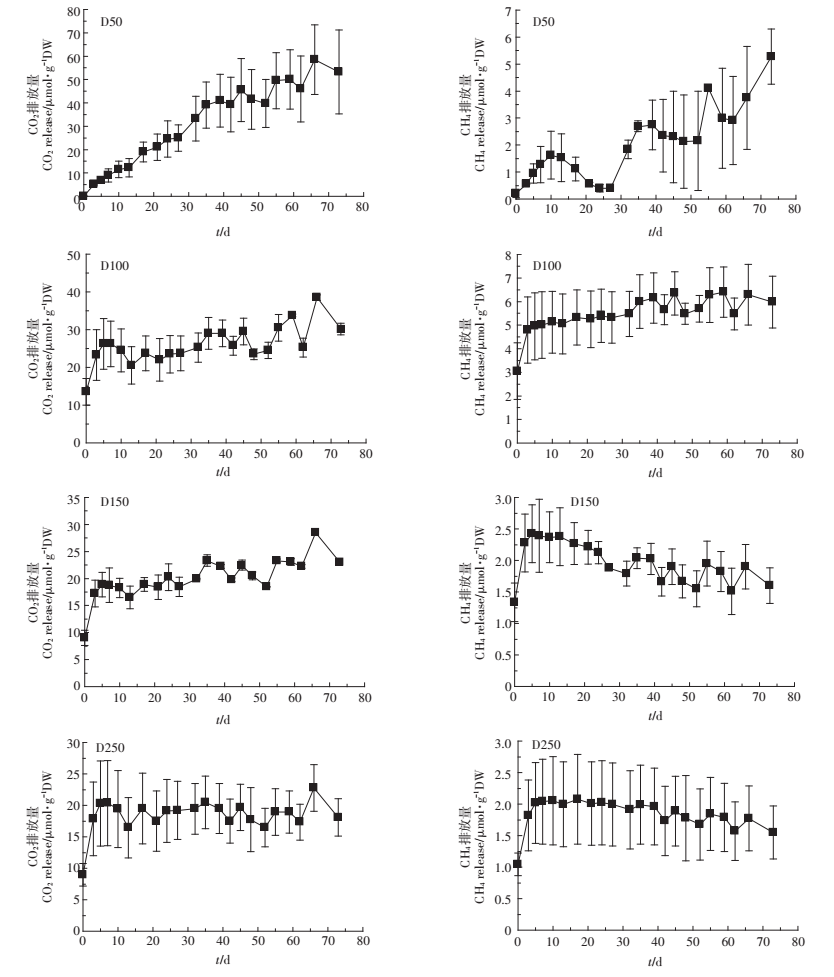
2.2 泥炭土培养过程碳排放的阈值范围及阈值出现时间所有处理组中,对于泥炭分解过程排放的碳总量(μmol·g-1DW)而言,CO2远高于CH4(图 5~图 7)。
|
图 5 不同温度处理组中CO2和CH4排放量随时间的变化 Figure 5 Comparison of the amount of substance released by temperature replicates |
|
图 6 不同pH值处理组中CO2和CH4排放量随时间的变化 Figure 6 Comparison of the amount of substance released by pH-value replicates |
|
图 7 不同深度泥炭土处理培养实验中CO2和CH4排放量随时间的变化 Figure 7 Comparison of the amount of substance released by peat quality replicates |
对于温度处理组(图 5),所有处理组的CO2排放量在实验开始3 d后减慢,并且持续10 d没有发生明显变化,而后开始增加到第35 d时逐步放缓。T5.4 CO2排放量阈值最小,为(9.93 ± 0.40)μmol · g-1DW,T20.1最大,为(45.91±13.54)μmol·g-1DW(图 8),且T5.4和T20.1处理组之间的差异显著(P < 0.01)。对于CH4的排放,T5.4的CH4排放量从第3 d开始减少,T13.1则从第27 d开始迅速增加,而T20.1中CH4的排放量没有明显的变化趋势。因此,温度处理组中的CH4排放量不能确定阈值出现的时间,因而也不能确定其阈值(图 8)。

|
图 8 不同处理组中CO2和CH4的阈值 Figure 8 Threshold levels of CO2 and CH4 in different treatments |
对于pH处理(图 6),所有处理中的CH4和CO2排放量均随培养时间增加而逐步变缓。其中,pH4的CO2排放量在实验开始后第5 d达到阈值,而其他pH处理则在第32~39 d分别达到阈值。CO2的排放量阈值(μmol·g-1DW)范围为(13.94±2.02,pH4)~(91.61± 16.22,pH7),阈值随pH值增大而增大(P < 0.01),pH7的阈值是pH4的7倍,约是pH5和pH6的2倍(图 8)。对CH4而言,从pH4处理组的第3 d起,pH5的第52 d起,pH6的第39~52 d以及pH7的第39 d起,其排放量随时间增加开始减缓,阈值范围为(1.12±0.35 μmol· g-1DW,pH4)~(9.02±1.49 μmol·g-1DW,pH6),pH5和pH6处理组的CH4阈值较大(图 8),因此,pH为5~6时有利于CH4的排放。所有pH处理组之间关于阈值时间的差异不显著(P > 0.01)。
对于不同深度处理(图 7),由于泥炭土样品均置于(20.1±2.0)℃的温度下,因此D50处理组即为T20.1处理组。D50中CO2排放量阈值时间出现在第35 d,阈值为(9.93±0.40)μmol·g-1DW,而CH4的排放量不能计算出其阈值出现的时间和阈值。深度大于50 cm的处理组在扣除残留气体本底值后,几乎没有监测到气体的排放,因此深度大于50 cm的处理不能计算相应的阈值时间和阈值。
3 讨论 3.1 不同环境条件下培养实验碳排放初始产生速率的变化本文中,CO2的产生速率为399~2267 nmol ·g-1DW·d-1(2~335 nmol·cm-3·d-1),CH4的产生速率为18~180 nmol·g-1DW·d-1(2~21 nmol·cm-3·d-1),该结果与前期研究结果相近。Dunfield等[18]研究发现CH4的产生速率为43.7~54.9 nmol·g-1·h-1(1049~1318 nmol· g-1DW·d-1),Bergman等[20]研究发现CH4的产生速率为60~408 nmol·g-1DW·d-1,分别比本研究高出2~73倍和3~4倍,这是由于上述两个研究的培养基质是将泥炭土与除氧水混合成泥浆,且持续搅拌进行培养测定的,因此可以显著影响碳的排放速率。Goldhammer等[14]通过培养实验测得CO2的产生速率为16~357 nmol·cm-3·d-1,CH4为0~2.8 nmol·cm-3·d-1,与本实验结果相比,CO2的产生速率相当,但本实验的CH4产生速率几乎是Goldhammer的10倍,这可能是因为培养过程中对泥炭的搅拌会影响CH4排放。此外,Blodau等[21]针对泥炭土进行原位监测发现CO2产生速率为5~10 nmol·cm-3·d-1,CH4为2~5 nmol·cm-3·d-1,CH4的产生速率与本实验相近。基于以上不同实验结果对比发现,本研究中泥炭搅拌混匀时间短,培养实验开始后处于静止、无氧状态,因此本文实验获得的碳排放初始速率更接近自然系统中泥炭的真实情况。
与前人已有研究结果相同[14-15, 22],本研究发现CH4的产生速率远比CO2的低。针对此现象,Scanlon等[13]认为,泥炭培养实验通常是在介质中赋存一定有效浓度的活性基质,这部分活性基质中可能存在某种电子受体,如溶解性有机质[23],而电子受体按照能级顺序被逐步利用,且优先用于CO2的生成过程,因此在电子受体被耗尽之前,CH4的生成受到一定程度的抑制[24],因此CH4的产生速率比CO2的低。
3.2 不同环境条件下培养实验碳排放阈值的变化前期泥炭土培养实验发现,培养过程中CH4和CO2排放过程中均出现了变缓的现象,本研究把此现象定义为碳排放阈值的出现。对于所有的实验处理组,CH4排放量的阈值范围为1.12~9.02 μmol·g-1DW,CO2为1.38~91.6 μmol·g-1DW。Goldhammer等[14]利用Mer Bleue沼泽泥炭通过实验发现,CO2的阈值为2500 μmol ·L-1,CH4的阈值为58 μmol·L-1,而Blodau等[22]用市售的沼泽泥炭土测得CO2的阈值为5800~ 9500 μmol·L-1,CH4为400~600 μmol·L-1,以上两个研究的结果均比本实验高,Blodau等[22]推断Catotelm沉积层中生成的CO2和CH4的累积会使相应的反应能量增加,进而抑制气体生成。但本研究中广口瓶顶部有一定的空间,泥炭分解过程中产生的气体可以外逸,因此分解产物的累积情况与实际湿地有所区别。
Scanlon等[13]以及Moore等[15]分别通过开展12 d的短期培养实验发现,CO2的产生速率变化与培养体系中有效底物浓度显著相关。本培养实验发现,CH4和CO2的排放阈值出现时间比原位泥炭土阈值出现时间提前,一个可能的原因是室内培养实验开始前需要与无氧水充分混匀,导致泥炭土中底物的有效浓度较野外高;另一可能的原因是实验准备过程中对泥炭土进行搅拌而混入氧气,导致厌氧微生物死亡,由此,泥炭土中的活性基质就均作为产生CO2所需的底物[25]。说明了有效底物浓度越高,气体产生速率越快,达到阈值所需要的时间就越短。
本实验所有处理组的泥炭土初始培养条件一致,并且实验前测得泥炭土样品的DOC浓度范围为18~ 20 mg C·L-1,但培养实验结束后发现,不同处理组出现明显不同的阈值,由此可以推断环境因子必定影响了底物的活性而导致阈值不同。此外,乙酸菌把CO2转化为乙酸[26]也能影响阈值,但本研究中并未检测出乙酸,因此该推论不能成立。
3.3 温度、pH值以及不同深度泥炭土培养对碳排放的影响 3.3.1 温度的影响本实验结果显示CO2和CH4的产生速率都随温度升高而增加,与前期研究结果一致[13, 15, 20]。对于CO2,由于温度较高时微生物的呼吸作用较强,因而其产生速率随温度升高而增加。对于CH4,前期研究发现其生成的最适宜温度约为20~30 ℃[18, 27],而低温条件下产甲烷菌活性下降[15, 28]会导致CH4的产生速率较低[18, 29]。另外,低温还对产氢细菌有影响。氢气作为生成CH4的反应物之一,如果由于低温导致氢气不足,则会抑制CH4的生成。
本实验所有温度处理组的底物都取自同一深度的泥炭土,因此底物浓度相似,假设底物浓度是阈值的唯一限制因素,则最高温度的处理组(T20.1)应当先达到阈值,最低温度的处理组(T5.4)最后达到阈值,且各组阈值大小相等。然而本研究中CH4的温度处理组直到实验结束都没有达到阈值,因此不能比较它们的值,但是CO2排放阈值出现时间并没有随温度升高而提前,而阈值随温度升高而增大,因此,温度也是影响阈值出现时间和阈值大小的重要因素。
3.3.2 pH值的影响本文研究发现,对于CO2,其初始产生速率和阈值都随pH值升高而增加,这可能是因为生产CO2的微生物的最适生存pH值较高,同时,pH值升高可以激活底物活性,有效底物浓度高可驱使泥炭土加速分解[13]。另外,某些研究发现,CO2的产生会受到未知电子受体,如腐植酸[30]的影响。腐植酸在碱性条件下更易于溶解[31],因此,pH值越高,可用的电子受体越多,CO2的排放量越多,阈值也越高。
对于CH4而言,CH4的生成受电子受体的可用性抑制[24]。本研究中,置于20.1 ℃下的所有pH处理组中的CH4初始产生速率都比同一温度下不作pH处理的泥炭土低,说明了pH值较高时未知电子受体被激活,从而抑制CH4的生成[24]。本研究发现pH值为5~6时利于CH4的生成,Dunfield等[18]研究发现,pH值为5~6时CH4的排放量最高,原因之一是产甲烷菌最适pH值为5~6,另一原因可能是酸性条件促使H2产量增加,从而可提高H2还原CO2的效率进而提高CH4的产率。通常情况下,原位泥炭土的pH值很低,CH4排放量很少,所以本研究中pH处理组的CH4排放阈值随pH值升高而逐渐增加,但当达到产甲烷菌的最适宜pH值后,阈值不会随pH值升高而增加。
3.3.3 不同深度泥炭土的影响本培养实验的深度处理组中,深度大于50 cm的泥炭土在扣除残留气体本底值后,几乎没有监测到气体的排放,这可能是因为缺乏分解泥炭土的微生物以及易被分解的基质。Blodau等[16]研究发现分解程度较高的泥炭土中CH4抑制效应较为明显,而通常情况下这样的泥炭土分布在较深的位置[1]。Yavitt等[29]将葡萄糖和H2注入深层泥炭土(30~45 cm)中以提高有效底物的浓度,实验结果显示气体的产生速率增加,证实了有效底物浓度增加能促进CO2和CH4的产生。Bergman等[20]也在不同深度的泥炭土中加入了葡萄糖,实验结果显示,较浅层的泥炭土受到的影响比深层明显,表明了在深层的泥炭土中不仅缺少有效底物,还缺乏微生物。在本培养实验中,直到实验期末,CO2和CH4才生成。在此期间,如果底物满足微生物的生长需要,则微生物可以生长,然后产生CO2和CH4,但是如果缺乏有效底物或微生物,都能抑制气体排放,所以底物和微生物的影响很难区别开来。另外,深层的泥炭土由于受到压力作用、土壤孔隙度低、土壤溶液中活性物质较少、高活性有机质含量低和微生物活性低等因素也能导致碳排放量较低。因此本培养实验的深层泥炭土中碳排放量极低还存在很多可能性。
4 结论(1)所有环境因子处理组中,CO2和CH4的初始产生速率的范围分别是0.399~2.27 μmol·g-1DW·d-1和0.018~0.180 μmol·g-1DW·d-1,CO2和CH4的阈值范围分别是1.38~91.6 μmol · g-1DW和1.12~9.02 μmol · g-1DW,以上获取实验数据与前期相似纬度泥炭地观测实验的研究结果有较好的可比性。
(2)CO2和CH4的初始产生速率取决于温度,而且温度较高时CH4的排放速率受温度影响比CO2大。随着温度升高,CO2的排放阈值增加。由于温度处理组中CH4排放没有出现阈值,因此后续可以调整培养实验的温度梯度设置,进一步探究温度对CH4排放阈值的影响。
(3)CO2的初始产生速率和阈值都随pH值升高而增加。CH4的初始产生速率受pH值的影响不显著,而当pH值为5~6时,CH4的阈值较高,因此,需要进一步开展相应的微生活活性检测并探讨pH变化下微生物活性与泥炭地碳排放的关系。
(4)本培养实验中位于50 cm深度以上的泥炭土排放的CO2和CH4较多,而50 cm深度以下的泥炭土中检测到的气体含量极低。
| [1] |
Limpens J, Berendse F, Blodau C, et al. Peatlands and the carbon cycle:From local processes to global implications-a synthesis[J]. Biogeosciences, 2008, 5(6): 1475-1491. |
| [2] |
Dierssen K, Dierssen B. Moore[M]. Stuttgart: Ulmer, 2001: 44-50.
|
| [3] |
郝庆菊, 王跃思, 宋长春, 等. 三江平原湿地土壤CO2和CH4排放的初步研究[J]. 农业环境科学学报, 2004, 23(5): 846-851. HAO Qing-ju, WANG Yue-si, SONG Chang-chun, et al. Primary study on CO2 and CH4 emissions from wetland soils in the Sanjiang plain[J]. Journal of Agro-Environment Science, 2004, 23(5): 846-851. DOI:10.3321/j.issn:1672-2043.2004.05.003 |
| [4] |
Gorham E. Northern peatlands:Role in the carbon cycle and probable responses to climatic warming[J]. Ecological Applications, 1991, 1(2): 182-195. DOI:10.2307/1941811 |
| [5] |
滕良慧.全球气候变化背景下金川泥炭沼泽湿地水文动态及影响因素研究[D].长春: 东北师范大学, 2016. TENG Liang-hui. Study of wetland hydrological dynamics and influencing factors in Jinchuan peatland, under the background of global climate change[D]. Changchun: Northeast Normal University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10200-1016118273.htm |
| [6] |
Bernstein L. IPCC(2007)Climate change 2007:Synthesis report. Intergovernmental panel on climate change[J]. Encyclopedia of Energy Natural Resource & Environmental Economics, 2007, 27(1): 48-56. |
| [7] |
Aselmann I, Crutzen P J. Global distribution of natural freshwater wetlands and rice paddies, their net primary productivity, seasonality and possible methane emissions[J]. Journal of Atmospheric Chemistry, 1989, 8(4): 307-358. DOI:10.1007/BF00052709 |
| [8] |
Fourth Assessment Report of the Working Group I Report. Changes in atmospheric constituents and in radiative forcing[R]. Geneva: IPCC(Intergovernmental panel on climate change), 2007.
|
| [9] |
朱晓艳.三江平原草本泥炭沼泽温室气体排放及其对气候变化的响应[D].北京: 中国科学院大学, 2015. ZHU Xiao-yan. The greenhouse gas emissions from the herbaceous peatland in the Sanjiang plain and the responses to climate change[D]. Beijing: University of Chinese Academy of Sciences, 2015. http://cdmd.cnki.com.cn/Article/CDMD-80062-1015950646.htm |
| [10] |
翟生强, 史长光, 杜乐山, 等. 若尔盖泥炭地地下水位和土壤温度对二氧化碳排放的影响[J]. 湿地科学, 2015, 13(3): 332-337. ZHAI Sheng-qiang, SHI Chang-guang, DU Le-shan, et al. Effect on CO2 emissions of water tables and soil temperatures in Zoigê peatlands[J]. Wetland Science, 2015, 13(3): 332-337. |
| [11] |
欧阳扬, 李叙勇. 干湿交替频率对不同土壤CO2和N2O释放的影响[J]. 生态学报, 2013, 33(4): 1251-1259. OUYANG Yang, LI Xu-yong. Impacts of drying-wetting cycles on CO2 and N2O emissions from soils in different ecosystems[J]. Acta Ecologica Sinica, 2013, 33(4): 1251-1259. |
| [12] |
包振宗, 侯艳艳, 赵成义, 等. 干湿交替和模拟氮沉降对巴音布鲁克高寒湿地土壤CO2排放的影响[J]. 农业环境科学学报, 2018, 37(3): 598-604. BAO Zhen-zong, HOU Yan-yan, ZHAO Cheng-yi, et al. Effect of alternating wetting and drying and simulated nitrogen deposition on soil CO2 emission in alpine wetlands of Bayinbulak[J]. Journal of AgroEnvironment Science, 2018, 37(3): 598-604. |
| [13] |
Scanlon D, Moore T. Carbon dioxide production from peatland soil profiles:The influence of temperature, oxic/anoxic conditions and substrate[J]. Soil Science, 2000, 165(2): 153-160. |
| [14] |
Goldhammer T, Blodau C. Desiccation and product accumulation constrain heterotrophic anaerobic respiration in peats of an ombrotrophic temperate bog[J]. Soil Biology & Biochemistry, 2008, 40(8): 2007-2015. |
| [15] |
Moore T R, Dalva M. The influence of temperature and water table position on carbon dioxide and methane emissions from laboratory columns of peatland soils[J]. European Journal of Soil Science, 1993, 44(4): 651-664. DOI:10.1111/ejs.1993.44.issue-4 |
| [16] |
Blodau C, Siems M. Drainage-induced forest growth alters belowground carbon biogeochemistry in the Mer Bleue bog, Canada[J]. Biogeochemistry, 2012, 107(1/2/3): 107-123. |
| [17] |
Sander R. Compilation of Henry's law constants for inorganic and organic species of potential importance in environmental chemistry (Version 3)[J]. Estuarine Coastal & Shelf Science, 1999, 115(1): 63-74. |
| [18] |
Dunfield P, Knowles R, Dumont R, et al. Methane production and consumption in temperate and subarctic peat soils:Response to temperature and pH[J]. Soil Biology & Biochemistry, 1993, 25(3): 321-326. |
| [19] |
Sadava D, Orians G, Heller H C, et al. Purves, biologie[M]. Springer Spektrum, 2012: 193-232.
|
| [20] |
Bergman I, Bo H S, Nilsson M. Regulation of methane production in a Swedish acid mire by pH, temperature and substrate[J]. Soil Biology & Biochemistry, 1998, 30(6): 729-741. |
| [21] |
Blodau C, Roulet N T, Heitmann T, et al. Belowground carbon turnover in a temperate ombrotrophic bog[J]. Global Biogeochemical Cycles, 2007, 21(1): GB1021. |
| [22] |
Blodau C, Siems M, Beer J. Experimental burial inhibits methanogenesis and anaerobic decomposition in water-saturated peats[J]. Environmental Science & Technology, 2011, 45(23): 9984-9989. |
| [23] |
Cory R M, Mcknight D M. Fluorescence spectroscopy reveals ubiquitous presence of oxidized and reduced quinones in dissolved organic matter[J]. Environmental Science & Technology, 2005, 39(21): 8142-8149. |
| [24] |
Succow M, Joosten H. Landschaftsökologische moorkunde[M]. Stuttgart: E. Schweizerbart'sche Verlagsbuchhandlung, 2001: 8-17.
|
| [25] |
Bleam W F. Soil and environmental chemistry[M]//Bleam W F. Soil and environmental chemistry(2nd Edition). Amsterdam: Elservier, 2012: 449-462.
|
| [26] |
Diekert G, Wohlfarth G. Metabolism of homoacetogens[J]. Antonie Van Leeuwenhoek, 1994, 66(1/2/3): 209-221. |
| [27] |
Svensson B H. Different temperature optima for methane formation when enrichments from acid peat are supplemented with acetate or hydrogen[J]. Appl Environ Microbiol, 1984, 48(2): 389-394. |
| [28] |
Conrad R, Schütz H, Babbel M. Temperature limitation of hydrogen turnover and methanogenesis in anoxic paddy soil[J]. Fems Microbiology Letters, 1987, 45(5): 281-289. DOI:10.1111/fml.1987.45.issue-5 |
| [29] |
Yavitt J B, Lang G E, Wieder R K. Control of carbon mineralization to CH4, and CO2, in anaerobic, Sphagnum-derived peat from Big Run Bog, West Virginia[J]. Biogeochemistry, 1987, 4(2): 141-157. DOI:10.1007/BF02180152 |
| [30] |
Blodau C, Deppe M. Humic acid addition lowers methane release in peats of the Mer Bleue Bog, Canada[J]. Soil Biology & Biochemistry, 2012, 52(3): 96-98. |
| [31] |
方芳, 刘国强, 郭劲松, 等. 活性污泥法对水溶性腐植酸的去除效能与机制研究[J]. 环境科学, 2008, 29(8): 2266-2270. FANG Fang, LIU Guo-qiang, GUO Jing-song, et al. Removal efficiency and mechanism of aqueous humic acids by activated sludge process[J]. Environmental Science, 2008, 29(8): 2266-2270. DOI:10.3321/j.issn:0250-3301.2008.08.030 |
 2019, Vol. 38
2019, Vol. 38