2. 中国科学院大学, 北京 100049;
3. 中国药科大学, 南京 210009
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. China Pharmaceutical University, Nanjing 210009, China
水稻田作为一类特殊的人工湿地,是我国农田生态系统的重要组成部分,由于水稻生长过程中需淹水栽培,导致水稻土不论在结构、功能还是物质循环过程方面均显著有别于旱地土壤[1]。我国水稻田氮肥投入量高,占世界水稻氮肥用量的37%[2],但稻田氮肥利用率低下(28.3%)[3],导致大量的活性氮经各种途径损失进入环境,从而引发一系列的生态环境问题。研究发现,淹水稻田土壤的氮转化途径以反硝化(Denitrification)、厌氧氨氧化(Anaerobic ammonium oxidation,Anammox)和硝酸根异化还原成铵过程(Dissimilatory nitrate reduction to ammonium,DNRA)为主[4-6]。其中,反硝化和Anammox过程可将土壤中的硝氮和亚硝氮转化为N2排放到大气中,而DNRA过程可以将硝氮直接异化还原为铵氮,使更多的氮素滞留在土壤中[7-8]。具体到氮素转化过程层面,反硝化、Anammox和DNRA途径都涉及硝酸根的还原过程,硝酸根是其共同底物,因此,三者之间在同一体系中可能存在竞争关系。由于终端产物都是N2,反硝化和Anammox会导致肥料氮(尤其是硝氮)损失,但同时反硝化和Anammox也是将活性氮最终转化为惰性氮,终止其负面环境影响的最重要自然过程,而DNRA过程则是一个保氮过程,也是农学上所希望的。如何在同一体系下,准确量化上述几个硝酸根还原过程的发生速率,明确其关键限制因素,进而探寻相关过程的调控途径,对于降低硝酸根还原过程导致的稻田氮素损失和负面环境效应,具有十分重要的理论与现实意义。
过去有关稻田厌氧氮转化过程的研究大多集中在反硝化方面,然而稻田反硝化的研究一直受测定方法的限制,因为大气背景N2浓度高达79%,要在如此高N2背景环境中直接测定反硝化产物N2,需要方法的精度达到0.1%,一般方法难以满足此要求[9]。以往采用的稻田反硝化研究方法主要包括乙炔抑制法、差值法和大田15N标记肥料示踪法[10]。这几种方法缺陷都很明显,乙炔抑制法虽然简单快捷、成本低,但是会严重低估土壤反硝化速率,并且特别不适用于淹水环境。对于差值法而言,所有其他氮素去向测定的误差都累计到了反硝化过程中[11],导致结果变异非常大。大田15N肥料示踪法存在土壤微生物优先利用轻质同位素、标记15N肥料和土壤本身15N混合不均匀等问题,所获取的结果只能定性解释氮的去向,而不能准确定量各种氮转化过程通量[12]。相对于海洋和河口生态系统,稻田生态系统中Anammox和DNRA的研究还较少[13-14],而稻田土壤特有的干湿交替环境和氧化还原梯度很可能有利于Anammox和DNRA过程的发生。有研究表明,一些Anammox菌如K. stuttgartiensis也能进行DNRA作用[15],而DNRA作用产生的NH4+可进一步经过Anammox被转化为N2导致氮素损失,但在稻田生态系统,DNRA能否与Anammox耦合发生还有待进一步明确。目前用于测定稻田Anammox和DNRA速率的方法多是基于15N示踪的气相色谱-同位素比质谱(GC-IRMS)分析方法[16],由于IRMS价格昂贵,一定程度上限制了其广泛应用。
近年来,基于N2 / Ar测定原理的膜进样质谱(Membrane Inlet Mass Spectrometer,MIMS)法的出现和快速发展,使得直接、精确和原位测定淹水环境溶解性N2成为可能,极大地推动了淹水环境氮转化过程的研究[17-18]。前期,通过引进美国马里兰大学的Kana等[19]开发的MIMS装置,将MIMS和原状沉积物采样及15N同位素配对技术联用,我们陆续建立了基于MIMS测定湿地底泥净脱氮[20]、反硝化和Anammox速率的方法体系[21]。针对稻田生态系统的特点,我们进行了相关培养方法的改进,进一步通过将MIMS与15N同位素配对、15NH4+化学氧化法[7]和Flow-through培养装置联用,既可以实现对同一体系下水稻土NO3-还原各过程(反硝化、Anammox和DNRA)的测定,也可以用土柱模拟稻田土壤实现净脱氮速率的测定。利用该方法,本文研究5种典型水稻土中反硝化、Anammox、DNRA和净脱氮的速率,并分析了环境因素对这几种厌氧氮转化速率的影响,相关结果可为深入理解稻田厌氧氮转化过程提供科学依据。
1 材料和方法 1.1 土壤样品的采集和处理为了验证MIMS测定方法的可靠性和测定结果的稳定性,实验采集了辽宁营口(YK)、江苏宜兴(YX)、浙江金华(JX)、广西桂林(GL)和四川广安(GA)5种较为典型的水稻土作为研究对象,保证了研究对象的代表性。
用土钻采集稻田表层0~20 cm的湿土,置于装有冰袋的保温箱带回实验室,在通风阴凉处稍作风干后过10目筛后混匀。然后分成两部分,一份置于阴凉通风处完全风干用于测定土壤背景基本理化性质及速效组分;另一份置于4 ℃冰箱保存,用于4种厌氧氮转化速率的测定。
每次采集稻田土样时,记录稻田近期的施肥情况、地理位置等背景信息,测定的基本理化性质和速效组分包括pH、总氮(TN)、铵氮(NH4+)、硝氮(NO3-)、有机碳(SOC)、溶解性有机碳(DOC)、亚铁(Fe2+)含量、土壤机械组成(Soil mechanical composition)等如表 1所示。硝氮、铵氮用2 mol·L-1的KCl浸提、过滤后用流动分析仪(Skalar Analytical,Breda,The Netherlands)测定;可溶解性有机碳可用去离子水按土水比1:5浸提后过0.45 μm的滤膜,然后用TOC分析仪(Analytik Jena AG,Germany)测定。
|
|
表 1 5种水稻土的基本理化性质和速效组分 Table 1 Physicochemical properties and available component of the five paddy soils |
在厌氧情况下,称取2.5 g过筛土样于12 mL Labco圆底顶空瓶中,每种土样设置24个重复,5种水稻土共120个样品,加入充氦纯水(取纯水2 L曝氦气30 min),混匀泥浆后紧盖瓶盖(瓶内不能有气泡),室温25 ℃下放于垂直旋转培养器(转速为8 r·min-1)预培养一周,消耗土样中的背景硝酸根和O2。
用充氦气至饱和的纯水配制K15NO3溶液,预培养结束后用该K15NO3溶液标记样本,标记后使其每个样本中15N的浓度为100 μmol·L-1(该值根据田面水和土壤背景硝氮含量设定;前期研究[13, 22-23]在测定水稻土Anammox时进行3种处理,分别是NH4+、NH4++15NO3-和仅加15NO3-处理,结果已证明水稻土中存在Anammox过程,因此这里仅进行了加15NO3-处理)。取60个预培养结束的样品(每个土样12个重复,5个土样)分3份,每份20个样品(每个土样4个重复,5个土样)在25 ℃恒温水浴培养箱中分别培养0、3、6 h,每个取样点4个重复,加入200 μL 7 mol·L-1的ZnCl2溶液进行灭菌终止培养(ZnCl2通过破坏细菌细胞膜而起到灭菌作用)。结束后将60个样品用离心机以2000 r· min-1的转速离心5 min后置于恒温水浴培养箱中25 ℃保温,通过MIMS测定29N2和30N2浓度(设置温度25 ℃),计算反硝化和Anammox速率。
剩余60个样品用于DNRA的测定,具体为:首先,制备NH4+氧化剂(次溴酸盐碘溶液),将120 mL溴水缓慢滴入600 mL 16 mol·L-1的NaOH溶液中,注意此时装有NaOH溶液的烧杯要置于5 ℃以下的冰水混合物中,整个过程需要持续搅拌并始终保持冰水混合物的温度在5 ℃以下,混合后的溶液置于4 ℃冰箱静置一周后,取出用分液漏斗过滤,取上清液与0.2%的KI溶液等体积混合后保存于4 ℃冰箱,即得到次溴酸盐碘溶液[24]。其次,制作标准曲线,用充氦纯水配制0、2、4、6、8、10、20 μmol·L-1 15NH4Cl溶液,分别装满12 mL Labco圆底顶空瓶,盖紧瓶盖,然后加入200 µL NH4+氧化剂将15NH4+全部氧化为29N2和30N2后用MIMS(设置温度25 ℃)进行测定,并用总15N(29N2+ 2×30N2)浓度与初始15NH4Cl的浓度线性回归做成标准曲线,用于DNRA速率的计算。需要指出的是60个样品的标记培养与反硝化、Anammox培养过程一致,但DNRA的测定还需将培养结束的60个样品按不同处理分别倒入100 mL广口瓶中进行充氦0.5 h,排出样品中反硝化、Anammox等过程产生的28N2、29N2和30N2后分装到干净的12 mL顶空瓶中,加入200 µL NH4+氧化剂,充分摇匀使得样品中DNRA过程产生的15NH4+几乎全部被氧化为29N2和30N2后,同样离心后置于恒温水浴培养箱中25 ℃保温,用MIMS测定总15N(29N2+2×30N2)浓度,通过标准曲线计算DNRA速率。
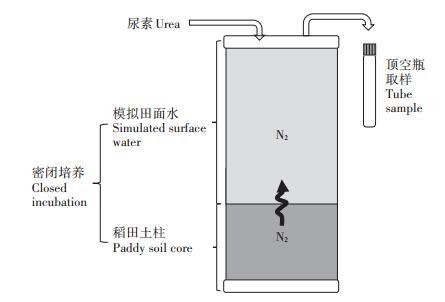
1.3 净脱氮过程速率的测定通过将MIMS装置与Flow-through培养系统(图 1)联用,可以实现不添加15N标记物而直接测定体系内的净脱氮速率,能最大限度地代表近似原位情况下的N2产生速率。具体地,称取800 g水稻土(实验前种植黑麦草使水稻土的硝氮含量降至10 mg·kg-1以下)加入柱状采泥器,土柱高度约15 cm,上浮水高度约25 cm,共3个平行样。将采泥器用带有磁转子的盖子密封,连接好进水管与出水管,用事先混合及气体平衡好的去离子水通过虹吸缓慢加入至采泥器,避免土样表面被水流冲起,直至采泥器内无气泡。将采泥器放入水浴磁力搅拌培养装置中,打开磁力搅拌器,预培养1~2 d。用注射器将尿素溶液通过进水孔橡胶塞注入采泥器,使其中起始尿素氮含量为60 mg· kg-1,等待尿素在上覆水中混合均匀后采集水样,作为0 h的水样并记录时间,并在培养至24、48 h时分别再次采样,每个时间点每个土柱采集3个平行样品,所以每个土样有27个样品(3个平行土柱×3个时间点×每个时间点取3个平行样),故5种水稻土共需要采集135个样品。采样时先空排20 mL水样,消除管道内水样影响,从7 mL的Labco顶空瓶瓶底注入水样,防止产生气泡,水样采集后拧紧盖子,加入200 μL 7 mol·L-1 ZnCl2,混匀后置于4 ℃冰箱保存待测。
|
图 1 室内模拟原位土柱-稻田田面水密闭培养系统示意图 Figure 1 Schematic diagram of near in-situ core incubation system of rice paddy field |
反硝化和Anammox过程得到的29N2和30N2浓度用于反硝化和Anammox速率的计算[23, 25],其基本原理是将高丰度的15NO3-(>99%)加入到体系中,经培养后,通过测定最终产物N2及其同位素组分(29N2、30N2)的比例,并利用N2产生过程的随机配对原则计算反硝化和Anammox的速率[25],具体计算过程可参考Shan等[23]文章。
计算DNRA速率时,先通过标准曲线计算出不同时间段DNRA过程产生的15NH4+的含量,并与培养时间回归得到15NH4+的产生速率,单位为µmol·L-1·h-1,进一步用公式(1)求出DNRA的速率。
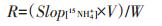
|
(1) |
式中:R为DNRA的潜势,nmol · g-1 · h-1;Slop[15NH4+]为15NH4+浓度与培养时间回归得到斜率(15NH4+的产生速率);V为培养瓶的容积;W为干土质量。
1.4.2 净脱氮速率计算在密闭的flow-through培养体系中,土壤净脱氮过程的终端产物N2的溶解浓度的变化可以计算得到(△C=Cin-Cout),在一段时间内,净脱氮速率可以根据不同培养时间N2浓度和时间做线性回归得到,直线斜率即是土柱上覆水中N2浓度变化速率(μmol N2·L-1· h-1)。通过测定加入尿素后培养0、24、48 h的样本中28N2的浓度(µmol·L-1)与时间回归得到28N2的产生速率(µmol·L-1·h-1)。然后用公式(2)计算出净脱氮速率如下:
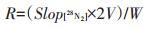
|
(2) |
式中:R为净脱氮的潜势,nmol·g-1·h-1;Slop[28N2]为28N2浓度与培养时间回归得到斜率(28N2的产生速率);V为培养柱子的容积;W为干土质量。
1.5 数据处理和统计分析采用Origin 8.6中的一元线性回归法将MIMS测定的29N2、30N2、总15N(29N2+2×30N2)及28N2浓度分别与时间回归后得到29N2、30N2和总15N的产生速率,用于判定29N2、30N2、总15N和28N2的浓度是否随时间线性增加和计算反硝化、Anammox、DNRA及净脱氮速率。采用SAS 8.0软件中单因素方差分析和Duncan分析分别对不同水稻土间的反硝化、Anammox、DNRA及净脱氮4种氮转化速率进行显著性分析(α=0.05)。利用SPSS 14.0皮尔逊相关分析法考察了反硝化、Anammox、DNRA和净脱氮速率与土壤背景理化性质包括总氮(TN)、铵氮(NH4+)、硝氮(NO3-)、有机碳(SOC)、溶解性有机碳(DOC)和亚铁(Fe2+)含量之间的相关性。
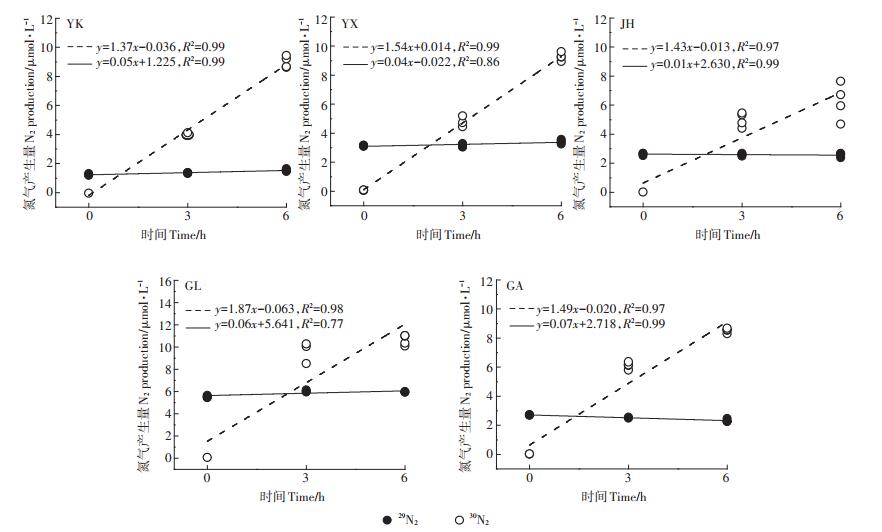
2 结果与讨论 2.1 4种氮转化速率的方法评估本实验中5种水稻土15N标记培养0、3、6 h后的29N2和30N2的浓度如图 2所示,5种水稻土中的29N2和30N2的浓度随0、3、6 h均呈显著的线性变化(P < 0.05)。30N2的增长要明显高于29N2的增长,这与赵永强等[21]在河口沉积物中的研究一致,说明稻田中的反硝化速率高于Anammox速率,也表明了基于MIMS法与15N示踪技术可以准确测定水稻土的反硝化和Anammox潜势。
|
图 2 5种水稻土培养0、3、6 h后的29N2和30N2的浓度 Figure 2 Concentration of 29N2 and 30N2 in five paddy soils after incubation for 0, 3 and 6 h |
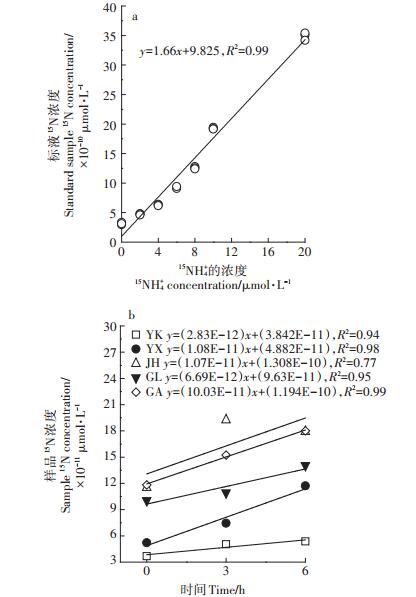
DNRA速率的测定中,制作的标准曲线如图 3a,MIMS测定得到的总15N(29N2+2×30N2)随15NH4+浓度增大呈显著线性增加(P < 0.01),表明次溴酸盐碘溶液能将15NH4+彻底氧化为29N2和30N2。5种水稻土随0、3、6 h培养后产生的总15N如图 3b所示,5种水稻土样本的总15N均随培养时间呈线性增长趋势(P < 0.05),从而能够成功得到5种水稻土的DNRA速率,这表明了利用MIMS和15NH4+氧化法测定DNRA速率是可行的。
|
图 3 标准曲线(a)和培养时间0、3、6 h与总15N(29N2+2×30N2)浓度之间的线性关系(b) Figure 3 Relationship of the known 15NH4+ concentrations with measured signal intensities of total 15N (29N2+2×30N2)(a)and the concentration of total 15N in five paddy soils after incubation of 0, 3 and 6 h (b) |
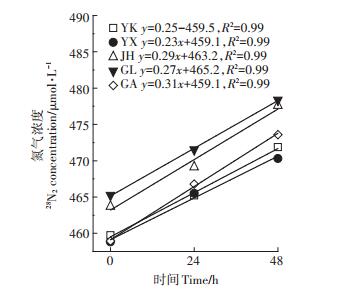
同样地,测定净脱氮时,MIMS测定的28N2的浓度随0、24、48 h呈显著线性增长趋势(图 4;P < 0.01),表明了实验模拟原位土柱以及结合MIMS可以精确测定水稻土中添加尿素后的净脱氮速率。
|
图 4 5种水稻土培养0、24、48 h的28N2浓度 Figure 4 Concentration of 28N2 in five paddy soils after incubation of 0, 24 and 48 h |
5个采样点的反硝化、Anammox、DNRA速率分别在(11.52±0.81)~(15.50±0.69)、(-0.44±0.06)~(0.15± 0.04)、(0.82±0.41)~(3.50±0.12)nmol N·g-1·h-1之间(图 5a)。其中,营口(YK)和桂林(GL)水稻土的反硝化速率显著高于其他3种水稻土(P < 0.01),而金华(JH)的反硝化潜势最低。5种水稻土的Anammox潜势均很低,尤其金华和广安(GA)出现了负值,可能水稻土中存在的固氮菌固定的29N2大于反硝化和Anammox过程产生的29N2所致[26]。基于15N示踪技术和同位素比质谱仪(IRMS),Gu等[27]对常熟水稻土的研究发现其反硝化速率在17.18~21.96 nmol N·g-1·h-1之间,Anammox速率为1.80~2.08 nmol N·g-1·h-1之间;Nie等[28]对福建水稻土的研究发现反硝化速率在20.10~36.10 nmol N · g-1 · h-1之间,Anammox速率为1.70~2.40 nmol N·g-1·h-1,与本实验结果具有可比性。其他研究结果,如浙江嘉兴及淮安等地的反硝化和Anammox速率[29-30]也均与本实验基于MIMS的15N示踪技术测定结果具有很好的可比性。
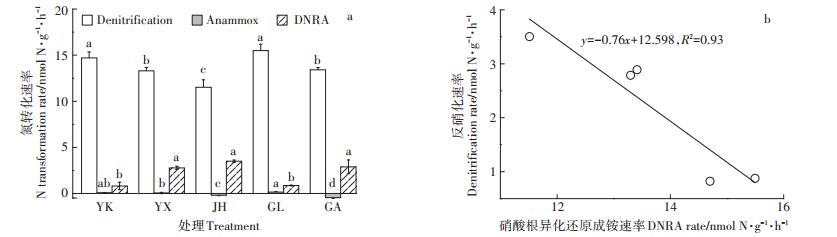
|
不同小写字母表示同一速率在不同水稻土样本中的显著性差异(P < 0.01) Different lowercase letters indicate significant differences of the same N transformation rate among different soil samples(P < 0.01) 图 5 5种水稻土的反硝化、Anammox和DNRA潜势(n=3)(a)及DNRA与反硝化速率之间的关系(b) Figure 5 Potential rates of denitrification, Anammox and DNRA(n=3)(a)and relationship between denitrification and DNRA rates (b)in the five paddy soils |
宜兴(YX)、金华(JH)和广安(GA)的DNRA潜势显著高于营口(YK)和桂林(GL)水稻土样本(P < 0.01)。需指出DNRA过程与反硝化过程出现了此消彼长的现象(图 5b),可能与两种过程共同和竞争利用硝氮和DOC有关[23],而DNRA与Anammox速率并不相关。Lu等[31]基于15N同位素示踪法和IRMS研究测得日本筑波水稻田的DNRA速率在8.06~28.08 nmol N·g-1·h-1之间,在数量级上也具有可比性。Shan等[23, 32]基于MIMS的15N示踪手段测定了江苏常熟水稻土的DNRA速率,测定值在0.20~1.10 nmol N·g-1· h-1之间,与本实验结果类似,说明这一方法具有很好的稳定性。
2.3 水稻土总脱氮潜势本实验中,5种水稻土的净脱氮速率分别为(1.65±0.01)、(1.06±0.29)、(2.32±0.37)、(2.14±0.19)、(1.61±0.30)nmol N·g-1·h-1,此速率均小于利用15N同位素配对法测定的5种土相对应的反硝化与Anammox速率之和,我们推测加入的尿素先转化为NO3-,再通过反硝化和Anammox过程脱氮,这个过程并不像直接加入硝氮那样顺利地进行脱氮过程,进而使得净脱氮速率相对低于直接加NO3-的处理,又因稻田中施用尿素而非KNO3,所以这能更好地反映稻田中原位净脱氮速率。目前有关稻田中的净脱氮速率的研究很少,此前Shan等[23]利用MIMS测定净脱氮速率时,未消耗土样中的背景NO3-,从而有利于反硝化和Anammox过程的发生,测出的净脱氮速率范围为8.27~30.00 nmol N·g-1·h-1之间,此速率高于本实验结果是可理解的。而李晓波等[33]对常熟农田生态系统稻作农田的研究中,采用PVC柱从稻田采集原状土样在室内进行混施和表施尿素处理,通过MIMS测得N2产生速率在0.92~1.66 nmol N·g-1·h-1之间,这与我们实验测得的净脱氮速率在数值上保持一致,从而表明了MIMS装置结合Flow-through系统可以通过室内模拟原位培养精确测定净脱氮潜势,而且操作过程简单,样本量少,省去了在稻田原位测定带来的困扰。需要指出的是,由于田间原位情况下,稻田氮素厌氧转化受土壤理化性质、温度、水分、水稻生长周期时长的影响,目前我们的实验体系测得的厌氧氮转化速率仅能表征田间情况下氮素实际转化速率的潜势,并不能真正指示田间原位氮素厌氧转化速率,未来还需进一步结合田间原位采样技术进行研究。此外,由于实际水稻田并非完全厌氧状态,而本文4种速率的测定过程均在密闭厌氧条件下进行,相比较于田间状况可能会抑制NH4+转化为NO3-这一过程,导致低估脱氮速率。另外,由于N2O也是反硝化过程产生的中间产物,可以直接被土壤释放,而本研究只测定了N2,也会一定程度上导致反硝化及净脱氮速率偏低。但此方法通过简单操作能在较短时间内同时测定反硝化、Anammox、DNRA和净脱氮4种速率,在比较同一样本不同速率间的差异时避免了测定时间不同带来的误差,这一优势不可忽略。
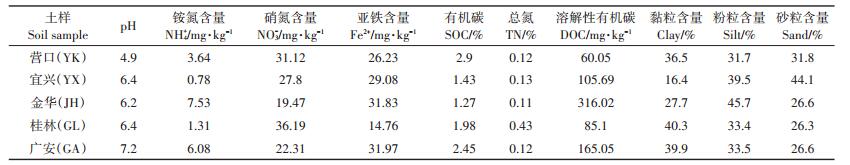
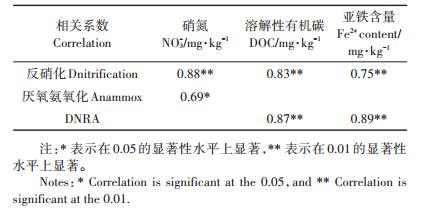
2.4 环境因素对几种厌氧氮转化速率的影响5种水稻土的4种氮转化速率与土壤基本理化性质之间的关系如表 2所示。反硝化速率的主要环境影响因子是NO3-、DOC和土壤Fe2+含量;Anammox过程的主要限制性因素为土壤NO3-;而DNRA过程的主要影响因子为DOC和土壤Fe2+含量。反硝化速率与水稻土背景硝氮含量呈显著正相关(表 2;P < 0.01)关系,硝氮为反硝化过程提供了底物,水稻土中其含量越大,反硝化潜势则越高,我们的分析结果与之相符。土壤DOC不仅能够为反硝化和DNRA过程提供能量和电子[8],还能促使土壤有机氮的矿化[34],进而促进这两种氮转化过程的发生,本文分析结果也是如此(表 2)。已有大量研究证明亚铁离子氧化与反硝化过程或DNRA过程发生耦合,进而促进这两种过程的发生[35],本实验结果(表 2)也证明了这一点,亚铁背景值高的水稻土反硝化和DNRA速率也显著较高(P < 0.01)。
|
|
表 2 氮转化过程与土壤理化性质间的皮尔逊相关分析 Table 2 Pearson′s correlation analyses between the N transformation rates and the physiochemical parameters of the five paddy soils (n=5) |
(1)本文完善了基于MIMS的方法体系,实现了同一体系下对稻田土壤反硝化、Anammox和DNRA的测定,同时也能实现对稻田土壤净脱氮速率的近似原位表征,相关结果与其他方法研究结果具有可比性,且操作简单、实验周期短,在未来稻田土壤厌氧氮转化过程方面有很好的应用前景。
(2)所研究的5种稻田土壤中,反硝化、Anammox、DNRA、净脱氮速率范围分别为(11.52±0.81)~(15.50 ± 0.69)、(- 0.44 ± 0.06)~(0.15 ± 0.04)、(0.82 ± 0.41)~(3.50±0.12)、(1.06±0.29)~(2.32±0.37)nmol N· g-1·h-1,即(358.63±25.37)~(479.96±22.12)、(-14.81±0.22)~(5.29±1.22)、(25.76±12.71)~(109.87±3.88)、(33.33±11.16)~(72.74±14.18)g N·hm-2·h-1。另外,水稻土反硝化过程的主要限制因素有土壤NO3-、DOC和土壤Fe2+含量;Anammox的关键限制因素是NO3-;DNRA过程的主要限制因素有土壤DOC和土壤Fe2+含量。
| [1] |
徐琪, 杨林章, 董元华. 中国稻田生态系统[M]. 北京: 中国农业出版社, 1998. XU Qi, YANG Lin-zhang, DONG Yuan-hua. Paddy ecosystem in China[M]. Beijing: China Agriculture Press, 1998. |
| [2] |
彭少兵, 黄见良, 钟旭华, 等. 提高中国稻田氮肥利用率的研究策略[J]. 中国农业科学, 2002, 35(9): 1095-1103. PENG Shao-bing, HUANG Jian-liang, ZHONG Xu-hua, et al. Research strategy in improving fertilizer-nitrogen use efficiency of irrigated rice in China[J]. Scientia Agricultura Sinica, 2002, 35(9): 1095-1103. DOI:10.3321/j.issn:0578-1752.2002.09.012 |
| [3] |
张福锁, 王激清, 张卫峰, 等. 中国主要粮食作物肥料利用率现状与提高途径[J]. 土壤学报, 2008, 45(5): 915-924. ZHANG Fu-suo, WANG Ji-qing, ZHANG Wei-feng, et al. Nutrient use efficiencies of major cereal crops in China and measures for improvement[J]. Acta Pedologica Sinica, 2008, 45(5): 915-924. DOI:10.3321/j.issn:0564-3929.2008.05.018 |
| [4] |
蔡祖聪. 尿素和KNO3对水稻土无机氮转化过程和产物的影响Ⅰ无机氮转化过程[J]. 土壤学报, 2003, 40(2): 239-245. CAI Zu-cong. Effects of urea and KNO3 on processes and products of inorganic nitrogen transformation in paddy soils Ⅰ. Processes of inorganic nitrogen[J]. Acta Pedologica Sinica, 2003, 40(2): 239-245. DOI:10.3321/j.issn:0564-3929.2003.02.012 |
| [5] |
Kuypers M M M, Marchant H K, Kartal B. The microbial nitrogen-cycling network[J]. Nature Reviews Microbiology, 2018, 16(5): 263-276. DOI:10.1038/nrmicro.2018.9 |
| [6] |
胡晓婷, 程吕, 林贤彪, 等. 沉积物硝酸盐异化还原过程的温度敏感性与影响因素——以长江口青草沙水库为例[J]. 中国环境科学, 2016, 36(9): 2624-2632. HU Xiao-ting, CHENG Lü, LIN Xian-biao, et al. Temperature sensitivity and controlling factors of dissimilatory nitrate reduction processes in sediments of Qingcaosha reservoir, Yangtze Estuary[J]. China Environmental Science, 2016, 36(9): 2624-2632. DOI:10.3969/j.issn.1000-6923.2016.09.011 |
| [7] |
Yin G Y, Hou L B, Liu M, et al. DNRA in intertidal sediments of the Yangtze Estuary[J]. Journal of Geophysical Research:Biogeosciences, 2017, 122(8): 1988-1998. DOI:10.1002/jgrg.v122.8 |
| [8] |
Van den Berg E M, Elisario M P, Kuenen J G, et al. Fermentative bacteria influence the competition between denitrifiers and DNRA bacteria[J]. Frontiers in Microbiology, 2017, 8: 1684. DOI:10.3389/fmicb.2017.01684 |
| [9] |
Butterbach-Bahl K, Willibald G, Papen H, et al. Soil core method for direct simultaneous determination of N2 and N2O emissions from forest soils[J]. Plant and Soil, 2002, 240(1): 105-116. DOI:10.1023/A:1015870518723 |
| [10] |
Groffman P M, Altabet M A, Bohlke J K, et al. Methods for measuring denitrification:Diverse approaches to a difficult problem[J]. Ecological Applications, 2006, 16(6): 2091-2122. DOI:10.1890/1051-0761(2006)016[2091:MFMDDA]2.0.CO;2 |
| [11] |
David M B, Wall L G, Royer T V, et al. Denitrification and the nitrogen budget of a reservoir in an agricultural landscape[J]. Ecological Applications, 2006, 16(6): 2177-2190. DOI:10.1890/1051-0761(2006)016[2177:DATNBO]2.0.CO;2 |
| [12] |
Cornwell J C, Kemp W M, Kana T M. Denitrification in coastal ecosystems:methods, environmental controls, and ecosystem level controls, a review[J]. Aquatic Ecology, 1999, 33(1): 41-54. DOI:10.1023/A:1009921414151 |
| [13] |
Yang X R, Li H, Nie S A, et al. The potential contribution of Anammox to nitrogen loss from paddy soils in Southern China[J]. Applied and Environmental Microbiology, 2014, 81(3): 938-947. |
| [14] |
Sato Y, Ohta H, Yamagishi T, et al. Detection of Anammox activity and 16S rRNA genes in ravine paddy field soil[J]. Microbes and Environments, 2012, 27(3): 316-319. DOI:10.1264/jsme2.ME11330 |
| [15] |
Kartal B, Kuypers M M M, Lavik G, et al. Anammox bacteria disguised as denitrifiers:Nitrate reduction to dinitrogen gas via nitrite and ammonium[J]. Environmental Microbiology, 2007, 9(3): 635-642. DOI:10.1111/emi.2007.9.issue-3 |
| [16] |
Saggar S, Jha N, Deslippe J, et al. Denitrification and N2O:N2 production in temperate grasslands:Processes, measurements, modelling and mitigating negative impacts[J]. Science of the Total Environment, 2013, 465: 173-195. DOI:10.1016/j.scitotenv.2012.11.050 |
| [17] |
Hou L J, Zheng Y L, Liu M, et al. Anaerobic ammonium oxidation (Anammox)bacterial diversity, abundance, and activity in marsh sediments of the Yangtze Estuary[J]. Journal of Geophysical Research:Biogeosciences, 2013, 118(3): 1237-1246. DOI:10.1002/jgrg.v118.3 |
| [18] |
陈能汪, 吴杰忠, 段恒轶, 等. N2:Ar法直接测定水体反硝化产物溶解N2[J]. 环境科学学报, 2010, 30(12): 2479-2483. CHEN Neng-wang, WU Jie-zhong, DUAN Heng-yi, et al. N2:Ar method for direct measurement of denitrification product(dissolved N2)using membrane inlet mass spectrometry(MIMS)[J]. Acta Scientiae Circumstantiae, 2010, 30(12): 2479-2483. |
| [19] |
Kana T M, Darkangelo C, Hunt M D, et al. Membrane inlet massspectrometer for rapid high-precision determination of N2, O2, and Ar in environmental water water samples[J]. Analytical Chemistry, 1994, 66(23): 4166-4170. DOI:10.1021/ac00095a009 |
| [20] |
李晓波, 夏永秋, 郎漫, 等. N2:Ar法直接测定淹水环境反硝化产物N2的产生速率[J]. 农业环境科学学报, 2013, 32(6): 1284-1288. LI Xiao-bo, XIA Yong-qiu, LANG Man, et al. N2:Ar technique for direct determination of denitrification rate of aquatic ecosystems using membrane inlet mass spectrometry[J]. Journal of Agro-Environment Science, 2013, 32(6): 1284-1288. |
| [21] |
赵永强, 夏永秋, 李博伦, 等. 利用膜进样质谱同时测定河流沉积物反硝化和Anammox[J]. 农业环境科学学报, 2014, 33(4): 794-802. ZHAO Yong-qiang, XIA Yong-qiu, LI Bo-lun, et al. Simultaneous determination of denitrification and anaerobic ammonium oxidation in river sediments using membrane inlet mass spectrometry[J]. Journal of Agro-Environment Science, 2014, 33(4): 794-802. |
| [22] |
聂三安, 於辰佳, 李虎, 等. 水稻土厌氧氨氧化活性测定的同位素示踪法方法探讨[J]. 农业现代化研究, 2015, 36(4): 680-683. NIE San-an, YU Chen-jia, LI Hu, et al. Determination of Anammox activity in paddy soils with isotope-tracing technique[J]. Research of Agricultural Modernization, 2015, 36(4): 680-683. |
| [23] |
Shan J, Zhao X, Sheng R, et al. Dissimilatory nitrate reduction processes in typical Chinese paddy soils:Rates, relative contributions, and influencing factors[J]. Environmental Science & Technology, 2016, 50(18): 9972-9980. |
| [24] |
尹国宇.河口近岸氮素的削减途径及抗生素的机理研究[D].上海: 华东师范大学, 2014. YIN Guo-yu. Processes of nitrogen removal and effects of antibiotic residues on denitrification in estuarine and coastal regions[D]. Shanghai: East China Normal University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10269-1015543011.htm |
| [25] |
Thamdrup B, Dalsgaard T. Production of N2 through anaerobic ammonium oxidation coupled to nitrate reduction in marine sediments[J]. Applied and Environmental Microbiology, 2002, 68(3): 1312-1318. DOI:10.1128/AEM.68.3.1312-1318.2002 |
| [26] |
Hayashi K, Tokida T, Matsushima M Y, et al. Free-air CO2 enrichment(FACE)net nitrogen fixation experiment at a paddy soil surface under submerged conditions[J]. Nutrient Cycling in Agroecosystems, 2014, 98(1): 57-69. DOI:10.1007/s10705-013-9595-4 |
| [27] |
Gu C, Zhou H F, Zhang Q C, et al. Effects of various fertilization regimes on abundance and activity of anaerobic ammonium oxidation bacteria in rice-wheat cropping systems in China[J]. Science of the Total Environment, 2017, 599: 1064-1072. |
| [28] |
Nie S A, Lei X M, Zhao L X, et al. Response of activity, abundance, and composition of Anammox bacterial community to different fertilization in a paddy soil[J]. Biology and Fertility of Soils, 2018, 54(8): 977-984. DOI:10.1007/s00374-018-1320-7 |
| [29] |
Pan F X, Chapman S J, Li Y Y, et al. Straw amendment to paddy soil stimulates denitrification but biochar amendment promotes anaerobic ammonia oxidation[J]. Journal of Soils and Sediments, 2017, 17(10): 2428-2437. DOI:10.1007/s11368-017-1694-4 |
| [30] |
Yang Y J, Zhang H P, Shan Y H, et al. Response of denitrification in paddy soils with different nitrification rates to soil moisture and glucose addition[J]. Science of the Total Environment, 2019, 651(2): 2097-2104. |
| [31] |
Lu W W, Riya S, Zhou S, et al. In situ dissimilatory nitrate reduction to ammonium in a paddy soil fertilized with liquid cattle waste[J]. Pedosphere, 2012, 22(3): 314-321. DOI:10.1016/S1002-0160(12)60018-6 |
| [32] |
Shan J, Yang P P, Rahman M M, et al. Tetracycline and sulfamethazine alter dissimilatory nitrate reduction processes and increase N2O release in rice fields[J]. Environmental Pollution, 2018, 242(A): 788-796. |
| [33] |
李晓波.基于膜进样质谱法的湿地和稻田反硝化研究[D].南京: 中国科学院南京土壤研究所, 2013. LI Xiao-bo. Study of denitrification in the wetland and flooded ricepaddy in Eastern China by means of membrane inlet mass spectrometry[D]. Nanjing: Institute of Soil Science, Chinese Academy of Sciences, 2013. http://d.wanfangdata.com.cn/Thesis/Y2430132 |
| [34] |
韩成卫, 李忠佩, 刘丽, 等. 溶解性有机质在红壤水稻土碳氮转化中的作用[J]. 生态环境, 2006, 15(6): 1300-1304. HAN Cheng-wei, LI Zhong-pei, LIU Li, et al. Influence of dissolved organic matter on transformations of carbon and nitrogen in paddy soils in subtropical China[J]. Ecology and Environment, 2006, 15(6): 1300-1304. DOI:10.3969/j.issn.1674-5906.2006.06.035 |
| [35] |
Robertson E K, Thamdrup B. The fate of nitrogen is linked to iron(Ⅱ) availability in a freshwater lake sediment[J]. Geochimica et Cosmochimica Acta, 2017, 205: 84-99. DOI:10.1016/j.gca.2017.02.014 |
 2019, Vol. 38
2019, Vol. 38