2. 农业农村部环境保护科研监测所, 天津 300191
2. Agro-Environmental Protection Institute, Ministry of Agriculture and Rural Affairs, Tianjin 300191, China
镉(Cd)作为一种毒性极强的重金属,经由水源、食物的摄入可对人体产生致癌作用或引发慢性疾病[1]。据估算,我国被镉、砷等污染的耕地近0.12亿hm2,仅Cd污染的耕地就高达533万hm2,点位超标率为7.0%。水稻是对Cd吸收较强的作物之一,也是超过六成国人的主粮。甄燕红等[2]在2007年对随机抽取的91种市售大米的检测中发现Cd超标率高达10%。采用适当的措施降低介质中(土壤)Cd的有效性,减少水稻根系和籽粒对Cd的吸收累积[3],不仅能够保障水稻安全生产,同时也能降低因污染造成的粮食减产等后续影响带来的经济损失。目前的土壤修复技术在解决大面积的农田重金属污染问题的同时存在某些局限性,例如:成本较高,效率低下,贻误农时等,因此,抑制重金属在植物中的转移和积累是现阶段的研究热点之一[4]。研究表明,施加外源物质如水杨酸、褪黑素、硒、硅、谷胱甘肽、抗坏血酸等可有效缓解植物Cd胁迫[5]。此外,海藻糖(TR)可以保护蛋白质和细胞膜在盐[6]、干旱[7]和低温[8]等胁迫情况下引起的失活或变性,显示出高水平耐受性[9],但对TR如何影响水稻幼苗Cd吸收的研究鲜有报道。不过Duman等[10]的研究中表明,TR对浮萍(Lemna gibba L.)Cd吸收具有抑制作用,并推测Cd2+可能与TR分子中的羟基发生络合反应,从而中断植物对Cd2+的积累。
TR是由两个葡萄糖分子以1,1-糖苷键构建而成的非还原性二糖,其中虽然有3种可能的海藻糖异构体,但目前只有α,α-海藻糖能从生物体中分离出来并生物合成[11]。这种糖普遍存在于各种各样的生物中,通常作为能量、碳源、信号分子存在,当它们暴露于各种形式的应激时,会在许多微生物和无脊椎动物中积累[12]。植物自身合成内源性海藻糖的量是有限的[13],高等植物更是微乎其微,但植物体内普遍都含有海藻糖酶,可能正是为了维持体内TR水平的平衡[14]。如何利用TR良好的抗逆性来应对非生物胁迫已是当前的一个研究热点,André等[15]通过在烟草植物中过表达TR合成基因提高了对高温的耐受性。本研究旨在探讨TR对Cd胁迫下水稻幼苗生长状态的影响,以期为TR影响水稻Cd吸收的生理机制提供科学依据。
1 材料与方法 1.1 供试材料试验所用水稻品种为购买自湖南隆平种业有限公司的T优705,海藻糖由上海源叶生物科技有限公司提供,所有化学品均为分析纯试剂级,其纯度均超过98%。
1.2 水稻培育将水稻种子置于5%(V/V)的30%过氧化氢溶液中浸泡10~15 min,用去离子水清洗干净,均匀铺在湿润网格育苗盘上,在恒温培养箱(28 ℃,湿度80%)中暗培养48 h进行催芽。待种子胚芽露白后将育苗盘转移至人工气候室继续培养,当水稻幼苗长至两叶一心后转移到含1/10 Hoagland营养液的8 L水培箱中进行培育,待三叶一心时,挑选长势一致的幼苗饥饿处理2 d后放入不同Cd-TR浓度的处理液,在500 mL PVC黑色罐中进行处理。人工气候室条件参数:温度25±3 ℃,光照时长16 h·d-1,空气湿度60%,光照强度400 μmol·m-2·s-1。
1.3 试验设计 1.3.1 水稻对Cd2+的时间动力学吸收设置两个处理分别为仅Cd处理且浓度为88.96 μmol·L-1(M4)和含26.43 mmol·L-1海藻糖且Cd浓度为88.96 μmol·L-1(M4+T3)的处理,处理时间梯度(h)为:1、2、3、5、7、9、11、14、26、29、32、35、39、48。Cd以CdCl2·2.5H2O的形式加入,每个处理重复3次。
1.3.2 水稻在不同Cd浓度下的吸收动力学设置Cd处理浓度:0(M0)、8.89(M1)、17.79(M2)、44.48(M3)、88.96(M4)μmol·L-1,TR处理浓度:0(T0)、2.64(T1)、13.21(T2)、26.43(T3)、39.64(T4)、52.85(T5)mmol·L-1,其中M0+T0处理为空白对照,即CK,处理时间为18 h。Cd以CdCl2·2.5H2O的形式加入,每个处理重复3次。
1.4 水稻生物量的测定处理结束后,用5 mmol·L-1氯化钙溶液浸泡幼苗根系15 min,以除去附着在根系表面的Cd2+,然后用去离子水冲洗干净。
将水稻幼苗分为茎叶、根系两部分,迅速称取其鲜质量,然后装入信封,置于烘箱中75 ℃下烘至恒质量。
1.5 镉、钙、镁含量的测定将已经烘干至恒质量的水稻茎叶和根系剪碎并分别称取0.20 g于聚四氟乙烯消解管中,加入7 mL硝酸在通风橱中静置12 h,用消解仪(ED54,莱伯泰科,美国)加热至110 ℃消解2.5 h,待其冷却后各加入1 mL 30% H2O2继续于110 ℃消解1.5 h,然后升温于180 ℃蒸发溶液至0.5 mL左右。将消解管中剩余液体用去离子水定容至25 mL,用ICP - MS(agilent 7500a,USA)测定样品中镉(Cd)、钙(Ca)、镁(Mg)的含量。
1.6 叶绿素含量的测定将新鲜收取的水稻叶片用去离子水冲洗干净,用滤纸擦干,剪碎后称取0.2 g用95%乙醇定容于25 mL的容量瓶中,避光浸提12 h后,以95%乙醇为空白对照,用分光光度计分别在665 nm测定吸光值A665并计算叶绿素a浓度Ca、在649 nm处测定吸光值A649并计算叶绿素b浓度Cb。叶绿素a、b浓度相加即得叶绿素总浓度CT进而求得叶绿素含量(Chl)。
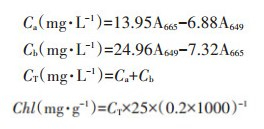
|
所有数据采用Excel 2007和Origin8.6进行统计分析和作图,并用SPSS 16.0软件进行方差分析。
2 结果与分析 2.1 TR对Cd胁迫下水稻鲜质量的影响与试验期间的CK相比,单独的TR处理以及单独的Cd胁迫对植株的鲜质量没有显著影响(表 1)。相对于CK,M1+T5、M2+T5、M3+T5、M4+T5处理下幼苗茎叶的相对鲜质量分别为88.21%、96.93%、92.94%、98.70%。在所有处理中,根系鲜质量均无明显变化,应当是由于处理时间较短,对根系生物量未形成明显影响。与M+T0系列处理的幼苗相比,TR和Cd交互作用的幼苗鲜质量有所下降。在相同Cd处理下,不同浓度TR的施用对水稻鲜质量影响较大,相对于M4+T0而言,M4+T5、M4+T4、M4+T3、M4+T2、M4+T1处理下茎叶鲜质量分别降低了11.6%、6.2%、3.2%、1.1%、3.4%。
|
|
表 1 不同浓度外源TR及Cd处理后的水稻鲜质量(g·pot−1) Table 1 Fresh weight of rice treated with different concentrations of exogenous trehalose and cadmium(g·pot−1) |
不同处理下的水稻幼苗Cd含量随时间的变化如图 1所示,结果表明,M4和M4+T3处理下的水稻幼苗茎叶和根系的Cd含量均随着时间的延长显著增加,并呈现出两个快速吸收期,同时根系Cd含量明显高于茎叶。当处理时间≤7 h时,两种处理下水稻茎叶对Cd的吸收差异不大,随着时间的增加,M4+T3处理的水稻幼苗对Cd的吸收速率明显低于M4处理的,处理时间为14 h时,M4处理的水稻幼苗茎叶部分Cd含量是M4+T3处理的1.7倍。当处理时间≥14 h时,茎叶中的Cd积累速率进入缓慢增长期,处理时间达到26 h后,茎叶中的Cd积累速率再次跃升。M4+T3处理的水稻幼苗在处理39 h后逐渐趋于平缓,而M4处理的水稻幼苗仍旧快速吸收Cd,在48 h时两种处理的水稻幼苗Cd含量差值达到最大。此时,M4+T3处理下的水稻叶片Cd含量比M4的降低了42.0%。
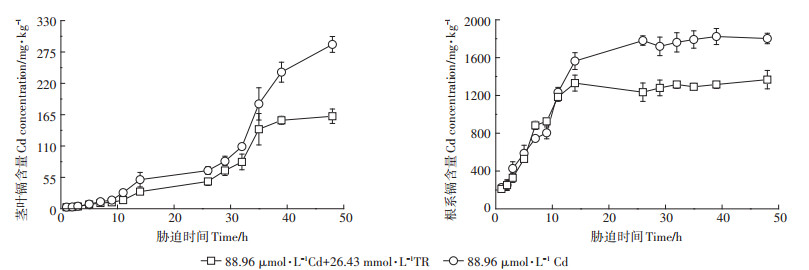
|
图 1 时间吸收动力学 Figure 1 Time absorption kinetics |
水稻根系Cd含量在处理时间≤11 h时呈快速增长趋势,但两个处理间无明显差异。处理时间达到14 h后,M4+T3处理的水稻根系Cd积累趋于饱和,而M4处理的继续缓慢增长并于26 h后逐渐稳定。与M4处理的幼苗相比,M4+T3处理的水稻幼苗根系在处理48 h时降低了24.2%。
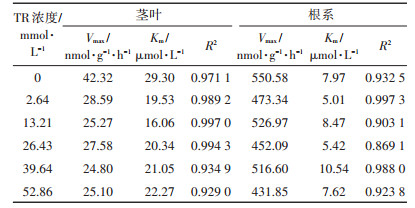
2.3 水稻幼苗对Cd2+吸收的浓度动力学特征TR和Cd交互作用对水稻吸收Cd的影响见图 2,水稻幼苗的Cd积累浓度随着处理液中Cd浓度的增加而增加,且水稻茎叶和根系对Cd的吸收速率均能良好地拟合米氏方程。根据动力学方程得到水稻幼苗在不同处理下对Cd吸收的最大速率和米氏常数如表 2所示,从中可以看出,Cd胁迫下,无TR处理和含TR处理的根系Vmax值差异较小,而茎叶部分Vmax值差异较大。随着TR浓度的增大,Vmax值逐渐减小。M+T系列处理的茎叶和根系的吸收速率分别比M+T0系列处理的减少了32.44%~41.4%和4.29%~21.56%。Cd胁迫下经TR处理的水稻幼苗在茎叶及根系内的Cd吸收速率均呈现一定程度的下降趋势,其中以M+ T5处理的效果最为明显。

|
图 2 浓度吸收动力学 Figure 2 Concentration absorption kinetics |
|
|
表 2 拟合米氏方程的Cd吸收动力学参数 Table 2 Fitted Michaelis Menten kinetics parameters of cadmium uptake |
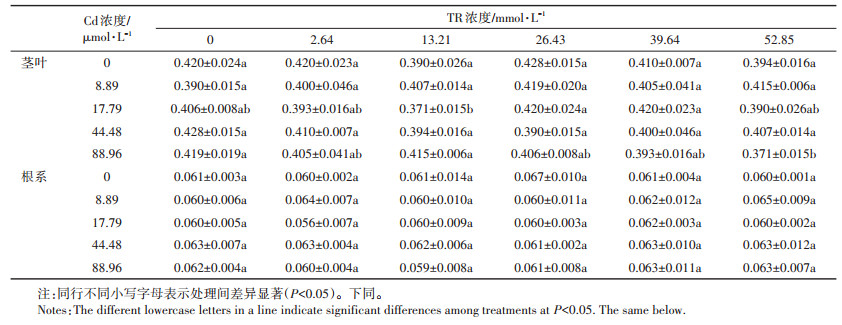
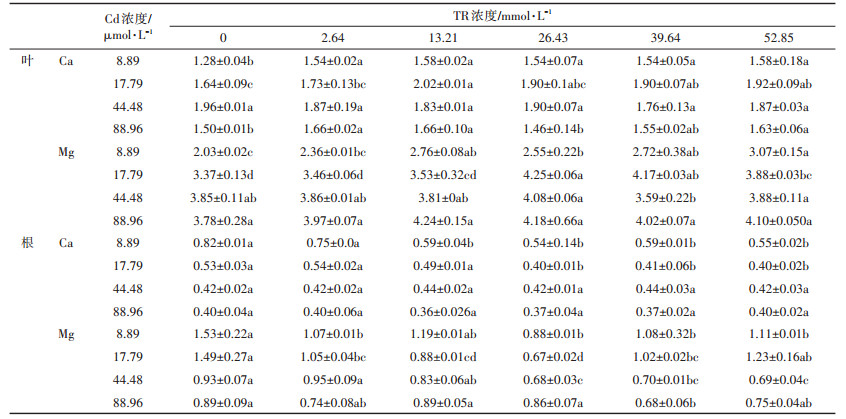
表 3数据显示,M+T0系列处理下的幼苗叶片Ca、Mg含量随着Cd浓度的增加呈增加趋势,同时根部Ca、Mg含量逐渐减少。与M1相比,M2、M3、M4处理的水稻茎叶Ca含量分别上升了28.4%、52.8%、17.3%,根系则相应下降了35.9%、49.2%、51.0%。TR显著提高了相同Cd处理下幼苗叶片的Ca、Mg含量(P<0.05)(表 3)。在M1、M2、M4 Cd处理下,13.21 mmol·L-1海藻糖对叶片Ca含量的增幅最大,分别提高了23.65%、22.97%、10.74%,此时根系Ca含量降低了27.5%、6.9%、11.5%。同时数据表明在M1、M2、M3、M4 Cd处理下,TR对叶片Mg含量的增幅在16.26%~50.91%、2.43%~26.03%、0.16%~6.08%和4.94%~12.16%之间,根系则降低了22.6%~42.4%、17.2%~55.0%、10.2%~26.6%和3.0%~3.4%。结果表明,在Cd胁迫下TR可有效提高水稻叶片内Ca、Mg含量。
|
|
表 3 不同浓度外源TR对Cd胁迫下水稻Ca、Mg积累的影响(g·kg−1) Table 3 Effects of various concentrations of TR on Ca and Mg accumulation in rice leaves exposed to Cd(g·kg−1) |
在处理期间内,M0+T系列处理的水稻叶绿素含量与CK相比差异不显著,而M+T0系列处理的幼苗叶绿素含量伴随着Cd浓度的增加呈下降趋势(图 3)。此外,Cd胁迫下添加TR处理的幼苗叶绿素含量降低幅度较大,且M+T4处理降幅最大,此时M1+T4、M2+ T4、M3+T4、M4+T4处理后的幼苗叶绿素含量与CK相比,分别下降了27.6%、29.9%、36.2%、35.9%。
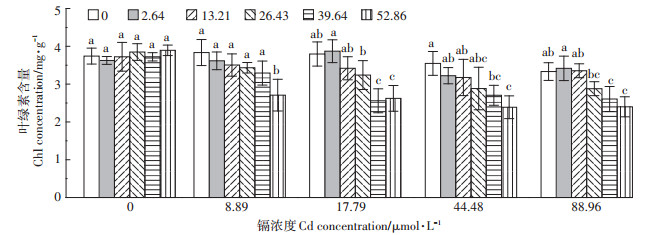
|
同组不同小写字母表示处理间差异显著(P<0.05) The different lowercase letters in a group indicate significant differences among treatments at P < 0.05. 图 3 海藻糖对叶绿素的影响 Figure 3 Effect of trehalose on chlorophyll |
植物在极端环境下会产生并积累TR帮助生存[16],外源TR的应用也可以改善某些胁迫下部分植物的生长状况,并且已知TR可以保护植物中蛋白质和膜的结构和功能[17]。而关于对重金属的耐受性,植物自身也开发了多种机制来维持和调节细胞金属稳态[18]。在本试验中,增加外源TR的量可减少水稻幼苗Cd的积累。Cd处理后,各幼苗的株高和根长并未发生显著变化(未显示数据),但随着处理时间的延长,M+T系列处理的幼苗叶片相继出现不同程度的萎蔫症状,基于这些发现,推测可能是由于M+T系列处理的溶液水势较低引起。在高渗透压环境中,细胞内水分快速流出,同时通过积累渗透物质来增强抗逆性,从而引起细胞脱水[19-20]。Laetitia等[21]在Cd2+对拟南芥水分损失影响的研究中提出Cd胁迫能够抑制植物根系和叶片的伸长,降低植物鲜质量。如表 1所示,本研究中水稻茎叶鲜质量出现不同程度的下降,特别是M4+T5处理下的水稻幼苗表现最为明显,其在胁迫5 h后,叶片尖端便出现轻微萎蔫,随着Cd浓度或TR浓度的降低,这种症状得到减轻。
李勤锋等[22]研究发现红蛋植物在长时间内对Cd的吸收呈快速吸收和缓慢吸收两个阶段,并提出可能与细胞内外质流速率不同有关。本研究发现随着处理时间的延长,水稻幼苗的Cd含量随之不断累积(图 2),水稻茎叶Cd吸收存在两个跃升期,在第一个跃升期Cd的积累速度比较缓慢,可能是由于此时大部分Cd2+被吸附在根系表面,根系是第一个受到Cd影响的器官,其表面具有大量负电荷,作为阻止重金属进入细胞的第一道屏障,细胞壁通常能吸附大量的Cd2+[23],少数被转运进入地上部的Cd2+在茎叶部分积累[24]。短时间刺激下植物可通过增加清除活性氧的酶的表达来降低氧化应激[25]或者诱导膜成分发生变化来抑制Cd造成的损伤[26]。随着处理时间的延长,水稻抗氧化水平降低,细胞膜受损,Cd2+迅速得到累积,这可能是出现第二个跃升期的原因。由于TR对膜的保护特性[27],在添加了TR的Cd溶液中,水稻幼苗对Cd的积累得到明显的抑制。
目前尚未发现Cd转运蛋白,但已有研究表明Cd2+可通过Ca2+、Mg2+等特异性较低通道进入细胞内[28]。图 2显示Cd胁迫下添加TR处理后水稻的Cd浓度明显降低,由于Cd2+与植物细胞内的营养元素如锌、铁、钙、锰等具有相似的化学性质,可通过有益金属元素运输系统进入根部[29],大量积累并转运至地上部分[30]。同时由于它们的相互竞争作用,在胁迫浓度较高或时间过长时,Cd2+的吸收也可能受到抑制[31]。从表 3可以看出在M系列处理中幼苗叶片Ca、Mg含量随着Cd浓度的增加相继提高,同时根系Ca、Mg含量下降。Peel等[32]提出当竞争性离子的浓度越高,管壁上负电荷位点的阳离子越容易被交换下来,促进其向上运输。另外,木质部中养分是从地下运往地上的单向运输,且Ca2+在韧皮部中难以移动,所以水稻中幼苗的Ca2+会出现随着胁迫程度的增强,Ca、Mg大幅度的从根系转移至茎叶部位的现象。表 3中数据显示,TR的添加使得Cd胁迫下的幼苗叶片在有效降低Cd积累的同时提高了Ca、Mg含量。有研究发现外源施加的TR通过氢键和磷酸基团来稳定生物膜[33],所以推测由于TR对膜的稳定性,增强了Ca2+、Mg2+同Cd2+的竞争能力,有效地保护了有益元素转运通道,从而减少了转运蛋白对Cd的转运,降低了植物内Cd的含量,且可能通过增加Ca2+、Mg2+在木质部中的移动性来提高叶片内的Ca、Mg含量。
Bazzaz等[34]研究认为,随着Cd胁迫浓度的增加,植物叶绿素含量呈下降趋势。由于根系是植物吸收水分的一个重要部位,根系的损伤也将对植物吸水造成不利影响,并且在胁迫条件下,随着植物的抗逆性增强,细胞自由水的相对量也可能减少。随着Cd处理浓度的增加水稻幼苗叶绿素含量逐渐下降,试验结果与Stobart等[35]研究结果相一致。在Cd溶液中,同时添加了TR处理后水稻叶绿素含量明显下降可能是由于植物缺水从而抑制了叶绿素的合成,甚至导致原有叶绿素的分解。
4 结论(1)随着处理时间的延长,水稻茎叶部分的Cd积累量出现两个跃升期,并且TR+Cd处理的幼苗茎叶部分和根系部分的Cd积累都得到了有效抑制。
(2)TR可以有效缓解Cd对水稻幼苗的胁迫作用,并且在相同Cd浓度下,随着TR浓度的升高,Cd积累量降低,同时,Ca、Mg含量有所提升。
(3)在相同Cd浓度处理下,TR的添加引起水稻叶绿素减少,光合作用的降低,会导致水稻幼苗生物量降低。
| [1] |
Järup, Lars. Hazards of heavy metal contamination[J]. British Medical Bulletin, 2003, 68: 167-182. DOI:10.1093/bmb/ldg032 |
| [2] |
甄燕红, 成颜君, 潘根兴, 等. 中国部分市售大米中Cd、Zn、Se的含量及其食物安全评价[J]. 安全与环境学报, 2008, 8(1): 119-122. ZHEN Yan-hong, CHENG Yan-jun, PAN Gen-xing, et al. Cd, Zn and Se content of the polished rice samples from some Chinese open markets and their relevance to food safety[J]. Journal of Safety and Environment, 2008, 8(1): 119-122. |
| [3] |
Li H, Luo N, Li Y W, et al. Cadmium in rice:Transport mechanisms, influencing factors, and minimizing measures[J]. Environmental Pollution, 2017, 224: 622-630. DOI:10.1016/j.envpol.2017.01.087 |
| [4] |
高宇, 程潜, 张梦君, 等. 镉污染土壤修复技术研究[J]. 生物技术通报, 2017, 33(10): 103-110. GAO Yu, CHENG Qian, ZHANG Meng-jun, et al. Research advance on remediation technology of cadmium contaminated soil[J]. Biotechnology Bulletin, 2017, 33(10): 103-110. |
| [5] |
Rasheed R, Ashraf M A, Hussain I, et al. Exogenous proline and glycinebetaine mitigate cadmium stress in two genetically different spring wheat(Triticum aestivum L.)cultivars[J]. Brazilian Journal of Botany, 2014, 37(4): 399-406. DOI:10.1007/s40415-014-0089-7 |
| [6] |
Abdallah M S, Abdelgawad Z A, El-Bassiouny H M S. Alleviation of the adverse effects of salinity stress using trehalose in two rice varieties[J]. South African Journal of Botany, 2016, 103: 275-282. DOI:10.1016/j.sajb.2015.09.019 |
| [7] |
Redillas M C F R, Park S H, Lee J W, et al. Accumulation of trehalose increases soluble sugar contents in rice plants conferring tolerance to drought and salt stress[J]. Plant Biotechnology Reports, 2012, 6(1): 89-96. DOI:10.1007/s11816-011-0210-3 |
| [8] |
谢冬微, 王晓楠, 付连双, 等. 外源海藻糖对冬小麦低温下胚芽长及幼苗抗寒性的影响[J]. 麦类作物学报, 2015, 35(2): 215-223. XIE Dong-wei, WANG Xiao-nan, FU Lian-shuang, et al. Effects of exogenous trehalose on germ length and seedling freeze resistance of winter wheat under cold stress[J]. Journal of Triticeae Crops, 2015, 35(2): 215-223. |
| [9] |
罗音, 杨兴洪, 王玮. 海藻糖介导的信号转导与植物抗逆性(英文)[J]. 生态学报, 2007, 27(12): 5382-5389. LUO Yin, YANG Xing-hong, WANG Wei. Trehalose-mediated signal transduction and stress tolerance in plants[J]. Acta Ecologica Sinica, 2007, 27(12): 5382-5389. |
| [10] |
Duman F, Aksoy A, Aydin Z, et al. Effects of exogenous glycinebetaine and trehalose on cadmium accumulation and biological responses of an aquatic plant(Lemna gibba L.)[J]. Water Air Soil Pollut, 2011(217): 545-556. |
| [11] |
Clemens S, Ma J F. Toxic heavy metal and metalloid accumulation in crop plants and foods[J]. Annual Review of Plant Biology, 2016, 67(1): 489-512. DOI:10.1146/annurev-arplant-043015-112301 |
| [12] |
Welsh D T, Herbert R A. Osmotically induced intracellular trehalose, but not glycine betaine accumulation promotes desiccation tolerance in Escherichia coli[J]. Fems Microbiology Letters, 2010, 174(1): 57-63. |
| [13] |
Abuchowski A, Mccoy J R, Palczuk N C, et al. Effect of trehalose on protein structure[J]. Protein Science, 2010, 18(1): 24-36. |
| [14] |
Lunn J E, Delorge I, Dijck P V, et al. Trehalose metabolism in plants[J]. Plant Journal for Cell & Molecular Biology, 2015, 79(4): 544-567. |
| [15] |
André D A, Enrique V, Susana J, et al. Expression of trehalose-6-phosphate synthase gene from Arabidopsis thaliana in transgenic tobacco:A strategy to increase temperature stress tolerance[J]. Microbial Cell Factories, 2006, 5(Suppl 1): 1-2. |
| [16] |
龙正龄, 马文广, 崔明昆, 等. 海藻糖在植物对逆境胁迫响应与适应中的作用[J]. 安徽农业科学, 2014, 42(16): 4956-4959. LONG Zheng-ling, MA Wen-guang, CUI Ming-kun, et al. Role of trehalose in response and adaptation of plants to environmental stresses[J]. Journal of Anhui Agricultural Sciences, 2014, 42(16): 4956-4959. |
| [17] |
Garg A K, Kim J K, Owens T G, et al. Trehalose accumulation in rice plants confers high tolerance levels to different abiotic stresses[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(25): 15898-15903. DOI:10.1073/pnas.252637799 |
| [18] |
Gallego S M, Pena L B, Barcia R A, et al. Unravelling cadmium toxicity and tolerance in plants:Insight into regulatory mechanisms[J]. Environmental & Experimental Botany, 2012, 83: 33-46. |
| [19] |
Hare P D, Cress W A, Staden J V, et al. Dissecting the roles of osmolyte accumulation during stress[J]. Plant Cell & Environment, 2010, 21(6): 535-553. |
| [20] |
Kempf, Bettina, Bremer E. Uptake and synthesis of compatible solutes as microbial stress responses to high-osmolality environments[J]. Archives of Microbiology, 1998, 170(5): 319-330. DOI:10.1007/s002030050649 |
| [21] |
Laetitia P B, Nathalie L, Alain V, et al. Heavy metal toxicity:Cadmium permeates through calcium channels and disturbs the plant water status[J]. The Plant Journal For Cell and Molecular Biology, 2002, 32(4): 539-548. |
| [22] |
李勤锋, 张超兰, 张鹏, 等. 红蛋植物对重金属镉、锌的吸收动态研究[J]. 生态环境学报, 2012, 21(6): 1138-1142. LI Qin-feng, ZHANG Chao-lan, ZHANG Peng, et al. Absorption dynamics of Cd and Zn by Echinodorus osiris[J]. Ecology and Environmental Sciences, 2012, 21(6): 1138-1142. |
| [23] |
Arduini I, Godbold D L, Onnis A. Cadmium and copper uptake and distribution in Mediterranean tree seedlings[J]. Physiologia Plantarum, 1996, 97(1): 111-117. |
| [24] |
Vázquez, Saúl, Goldsbrough, et al. Assessing the relative contributions of phytochelatins and the cell wall to cadmium resistance in white lupin[J]. Physiologia Plantarum, 2006, 128(3): 487-495. |
| [25] |
Clijsters H, Cuypers A, Vangronsveld J, et al. Physiological responses to heavy metals in higher plants; defence against oxidative stress[J]. Zeitschrift für Naturforschung C, 1999(54): 730-734. |
| [26] |
Guschina I A, Harwood J L. Effect of copper and lead on lipid metabolism in bryophytes and lichens[J]. Biochemical Society Transactions, 2000, 28(6): 910-912. |
| [27] |
Drennan P M, Smith M T, Goldsworthy D, et al. The occurrence of trehalose in the leaves of the desiccation-tolerant angiosperm Myrothamnus flabellifolius welw[J]. Journal of Plant Physiology, 1993, 142(4): 493-496. |
| [28] |
He S, Yang X, He Z, et al. Morphological and physiological responses of plants to cadmium toxicity:A review[J]. Pedosphere, 2017, 27(3): 421-438. DOI:10.1016/S1002-0160(17)60339-4 |
| [29] |
Verbruggen N, Hermans C, Schat H. Mechanisms to cope with arsenic or cadmium excess in plants[J]. Current Opinion in Plant Biology, 2009, 12(3): 364-372. DOI:10.1016/j.pbi.2009.05.001 |
| [30] |
Williams L E, Pittman J K, Hall J L, et al. Emerging mechanisms for heavy metal transport in plants[J]. Biochimica et Biophysica Acta, 2000, 1465(1): 104-126. |
| [31] |
Krämer U, Talke In, Hanarikenne M. Transition metal transport[J]. Febs Letters, 2007, 581: 2263-2272. DOI:10.1016/j.febslet.2007.04.010 |
| [32] |
Peel A J. Transport of nutrients in plants[M]. Butterworths, 1974: 5-40.
|
| [33] |
Kawai H, Sakurai M, Inoue Y, et al. Hydration of oligosaccharides:Anomalous hydration ability of trehalose[J]. Cryobiology, 1992, 29(5): 599-606. DOI:10.1016/0011-2240(92)90064-9 |
| [34] |
Bazzaz F A, Rolfe G L, Carlson R W. Effect of Cd on photosynthesis and transpiration of excised leaves of corn and sunflower[J]. Physiol Planta, 2010, 32(4): 373-376. |
| [35] |
Stobart A K, Griffiths W T, Ameen-Bukhari I, et al. The effect of Cd2+ on the biosynthesis of chlorophyll in leaves of barley[J]. Physiologia Plantarum, 1985, 63(3): 293-298. |
 2019, Vol. 38
2019, Vol. 38