近年来,由于工业污染源的排放以及化肥农药的不合理使用,导致农田土壤镉污染问题日趋严重。据统计我国受重金属污染耕地面积近2000万hm2[1]。镉在土壤中迁移能力强,易被植物吸收利用,且镉对植物的毒性是其他重金属的2~10倍[2]。当过量镉进入植物体后,会通过影响植物生长发育、抑制叶片的光合呼吸作用、减少其对营养元素的吸收等途径破坏植物的产量、品质和安全。镉通过食物链进入人体后,会对人体的骨骼、免疫系统、神经系统等造成损伤,严重还会有致癌致畸致突变的风险[3]。
重金属被植物吸收以后,会在植物的各个细胞、组织和器官中呈现出选择性分布来减轻重金属毒害作用[4]。有些超积累植物可以在地上部富集大量的镉,自身却不受镉毒害的影响,而有些不同基因型的作物各器官镉积累量相同,但受害程度却有很大差异,这些都与细胞内镉的亚细胞分布以及化学形态密切相关[5]。研究发现超积累植物东南景天细胞壁与可溶性部分镉的含量远大于细胞器镉含量,化学形态以氯化钠(NaCl)提取态、醋酸(HAc)提取态和水(H2O)提取态占优势[6]。生物量相对低的非矿山型水蜈蚣草(Kyllinga brevifolia Rottb)根细胞壁镉的占比大于生物量相对高的矿山型水蜈蚣草[7]。镉敏感型萝卜品种中细胞壁镉含量水平明显高于镉耐受型萝卜品种,而且NaCl提取态和HAc提取态的镉含量也相对较高[8]。因此对镉在亚细胞内的分布和其以何种化学形态存在的研究,更有利于我们明析镉在植物体内的迁移转化和植物耐受机理。
黄瓜是世界上栽培面积最大的蔬菜作物之一,其对镉响应敏感,易受毒害[9],但目前的研究主要集中于黄瓜对镉的富集能力以及生理适应性[10],无法全面反映黄瓜对镉胁迫下的响应。鉴于此,作者前期对32种东北常见黄瓜品种进行了镉的耐性筛选,本文选用其中相对敏感品种,采用营养液培养法,探究不同镉污染条件下,黄瓜幼苗地上部与根部镉的累积、化学形态特征和亚细胞分布,旨在探究黄瓜吸收镉的第一高峰期——苗期对镉的积累特征和耐性机理[11],为黄瓜对镉的适应性和重金属污染防治提供理论参考。
1 材料与方法 1.1 试验材料供试黄瓜品种为“津春9号”。选取饱满种子在10% H2O2溶液中浸泡30 min,彻底清洗后在30 ℃温水中避光催芽24 h,播种于全蛭石育苗盘。待幼苗长至两叶一心时选取大小均一的幼苗,移栽至泡沫板上于1.5 L全营养液的黑色塑料盆中培养,每盆6株幼苗。水培整个过程都在人工气候箱中培养(昼/夜12 h/12 h,温度28 ℃/20 ℃,相对湿度65%,光照度10 000 lx/0 lx)。每2 d更换一次营养液并随机移动塑料盒。营养液配方如下(mmol·L-1):0.75 K2SO4,0.65 MgSO4,0.01 KCl,0.25 KH2PO4,2.0 Ca(NO3)2,0.1 Fe - EDTA,0.01 H3BO3,1.0×10-3 MnSO4,1.0×10-4 CuSO4,0.05×10-4(NH4)6Mo7O4,1.0×10-3 ZnSO4,采用去离子水配制成盐溶液,用HCl和NaOH调节溶液pH至6[12]。
1.2 试验方法黄瓜幼苗在营养液体系中培养1周后进行镉处理,实验共设6个处理,镉浓度分别为:0(CK)、10、50、100、200、300 µmol·L-1。其中镉以CdCl2·2.5H2O形式加入。每个处理3次重复,共6株幼苗。分别在镉处理1、5、9、13、17 d时取黄瓜幼苗第三片真叶进行亚细胞分布的测定,镉处理17 d时测量黄瓜地上部与根部的镉含量及叶片镉的化学形态。
1.3 测定项目 1.3.1 样品镉的测定及转移系数的计算用去离子水将植物样品洗净,将根系用25 mmol·L-1的Na2-EDTA溶液浸泡15 min,去除表面吸附的镉及其他离子。将清洗干净的植株分成根部和地上部两个部分,在信封中烘干至恒质量,磨碎备用。采用GB 5009.15—2014的方法进行湿式消解,取植物干样各0.50 g于三角瓶中,加入HNO3-HClO4(9:1)混合酸10 mL过夜。调节沙浴逐级升温至(196±5)℃,消煮至澄清,润洗过滤,用1% HNO3定容至25 mL待测,原子吸收分光光度计测定消化液中镉含量,采用下式确定试样中镉含量。

|
式中:X为试样中镉含量,mg·kg-1;C1为试样消化液中镉含量,ng·mL-1;C0为空白液中镉含量,ng·mL-1;V为试样消化液总体积,mL;m为试样质量,g;1000为换算系数。
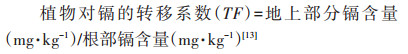
|
参考Weigel等[14]的技术,称取去离子水洗净后的新鲜叶片0.50 g,在预冷的缓冲液中[250 mmol·L-1蔗糖、50 mmol·L-1 Tris-HCl(pH 7.5)和1.0 mmol·L-1二硫苏糖醇]研磨至匀浆,使匀浆最终体积为20 mL。所有处理均在4 ℃下进行:匀浆在3000 r·min-1下离心15 min,分离得到的沉淀部分为细胞壁组分;将所得上清液在15 000 r·min-1下离心30 min,再次分离得到的沉淀部分为细胞器组分;上清液为细胞可溶性部分。
1.3.3 镉化学结合形态测定镉化学形态的提取分离采用改进的化学试剂逐步提取法[15]。将0.50 g新鲜黄瓜叶片置于冷冻研钵中,加入20 mL提取剂研磨至匀浆后转入50 mL离心管,在25 ℃条件下进行恒温振荡浸提,22 h后离心分离(5000 r·min-1、10 min)并回收上清液。残渣加入10 mL相同提取剂后继续振荡提取,并每隔2 h更换1次提取剂(重复2次),每种试剂提取3次,合并3次上清液(共40 mL)于三角瓶中,加入混合酸进行消解。提取剂依次采用(1)80%乙醇(提取硝酸盐、氯化物为主的无机盐以及氨基酸盐);(2)去离子水(H2O,提取有机酸盐);(3)1 mol·L-1氯化钠(NaCl,提取果胶盐、与蛋白质结合态或呈吸附态的重金属);(4)2%醋酸(HAc,提取难溶性重金属磷酸盐);(5)0.6 mol·L-1盐酸(HCl,提取草酸盐)。
1.4 数据处理试验数据采用SPSS 19.0软件中的One-way ANOVA模块进行方差分析和显著性检验,采用LSD对数据进行多重比较;用重复度量法分析不同时间、不同浓度镉处理及二者交互效应对黄瓜叶片中亚细胞镉含量的影响,采用Origin 2018作图。
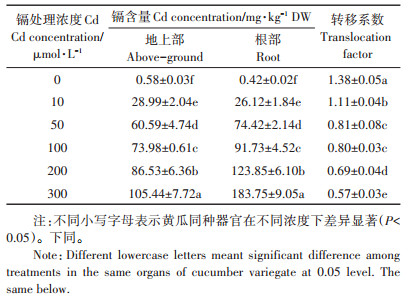
2 结果与分析 2.1 黄瓜不同器官中的镉积累通过17 d的水培处理后可以看出(表 1),黄瓜地上部和根部的镉含量都随添加的镉处理浓度增加而显著上升。当镉处理浓度≤10 µmol·L-1时,黄瓜地上部镉含量大于根部镉含量;相反,当镉处理浓度大于10 µmol·L-1时,黄瓜幼苗内的镉主要累积在根部。根部的镉含量变化范围为74.42~183.75 mg·kg-1,约为地上部的1.23~1.74倍。转移系数是衡量植物将镉从根部转运到地上部能力大小的重要指标,转移系数越大,其转运能力就越强。本研究中,黄瓜的转移系数介于0.57~1.38之间,随着镉处理浓度的升高,转移系数逐渐下降。
|
|
表 1 不同浓度镉处理下黄瓜幼苗中的镉含量 Table 1 Cadmium contents in cucumber seedlings under the treatments with different concentrations of Cd |
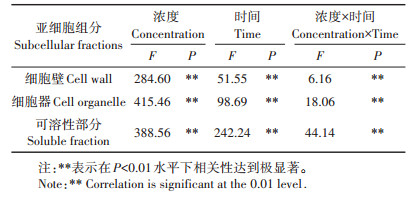
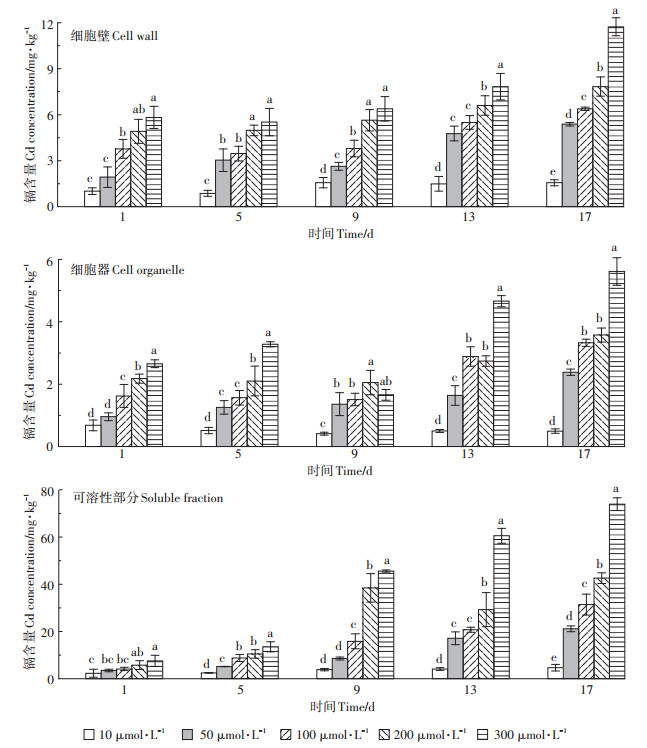
表 2表明不同镉处理浓度、时间及其交互处理对镉在黄瓜叶片中各亚细胞的分布产生极显著影响。由图 1可知,随着处理时间的延长和镉处理浓度的增大,镉在各亚细胞组分的含量均有所上升,镉处理1 d时,黄瓜叶片在300 µmol·L-1镉浓度下细胞壁、细胞器及可溶性部分的镉含量为10 µmol·L-1镉浓度下的5.8、3.9、3.2倍;而当镉处理17 d时,在300 µmol·L-1镉浓度下细胞壁、细胞器及可溶性部分的镉含量为10 µmol·L-1镉浓度下的7.5、11.3、15.9倍。
|
|
表 2 黄瓜叶片亚细胞各组分镉含量的方差分析 Table 2 Analysis of variance of Cd concentration in subcellular fractions of cucumber leaves |
|
图 1 黄瓜叶片亚细胞各组分的镉含量 Figure 1 Cadmium contents of subcellular components in cucumber leaves |
黄瓜叶片亚细胞组分的分布均表现为可溶性部分>细胞壁>细胞器(图 2)。其中可溶性部分镉含量占44.88%~84.94%,远大于细胞器(3.10%~17.05%)与细胞壁(11.20%~39.66%)。同一时间不同镉浓度处理下,随镉浓度的增大,可溶性组分中的镉百分比先减小后增大,细胞壁和细胞器之和则相反,其中细胞壁组分镉的百分比先增大后减小,细胞器组分镉的百分比略有减少;同一镉浓度不同时间下,细胞壁组分镉的百分比逐渐减小,可溶性部分镉的百分比逐渐增大。

|
图 2 黄瓜叶片中亚细胞组分的镉含量分配比例 Figure 2 Distribution percentages of Cd among different subcellular fractions in leaves of cucumber |
在不同化学形态中,镉在H2O和乙醇中迁移活性最强,相应提取态的镉毒性最强;镉在HAc和HCl中迁移活性最弱,相应毒性最弱;而NaCl提取态毒性则处于中间位置。在不同镉浓度下处理17 d后,黄瓜叶片中的镉主要以NaCl提取态的形式存在,占各化学形态总和的33.69%~54.23%(表 3)。随着镉处理浓度增大,乙醇提取态和H2O提取态比例逐渐升高,NaCl提取态比例则降低。当镉浓度达到300 µmol·L-1时,NaCl提取态、乙醇提取态和H2O提取态占比相近,占比分别为33.69%、30.71%、29.24%。在所有镉处理条件下,HAc提取态镉和HCl提取态镉含量最低,其中HAc提取态镉所占各化学形态总量的比例为2.32%~5.62%,HCl提取态镉所占比例为1.23%~7.34%。
|
|
表 3 黄瓜叶片中镉的化学形态分布(mg·kg-1 FW) Table 3 Chemical distribution of cadmium in cucumber leaves(mg·kg-1 FW) |
植物对镉的富集和转运与植物的耐受解毒能力密切相关[4]。本实验中,镉处理浓度≤10 µmol·L-1时,黄瓜的镉含量分布为地上部大于根部;镉处理浓度大于10 µmol·L-1时,镉含量分布符合大多数植物的普遍分布规律——根部大于地上部[16]。可见不同浓度镉处理对黄瓜体内镉的吸收分配有明显区别。随镉处理浓度升高,转移系数逐渐下降,说明黄瓜中的镉从根部向地上部的迁移能力减弱。这可能由于高浓度镉处理下,黄瓜将大部分镉滞留在根系中,从而减弱镉对地上部光合组织的损伤,缓解重金属对植物生命活动的不良影响[17]。这是黄瓜在一定条件下的自我保护方式。
重金属污染物在亚细胞水平上的选择性区域分布可在一定程度上缓解其对生物体的毒性作用[18]。在细胞水平上,镉离子由植物细胞外转运到胞内的过程中,植物细胞壁是其经过的第一道屏障,也是储存镉的第一个场所[19]。Wang等[5]研究发现,有49.3%~53.7%的镉储存于苎麻叶片细胞壁中。韩超等[20]对两种小白菜亚细胞的研究结果也表明镉主要存在于细胞壁中。在本研究中,不同处理下黄瓜叶片细胞壁中的镉也占有较大比例,为11.9%~39.6%。这是因为植物细胞壁主要由蛋白质和多糖(包括纤维素、半纤维素和果胶)组成,它可以为植物体提供羧基、羟基、醛基、氨基,从而吸持镉离子并限制其在细胞膜上的转运,而且植物细胞壁表面带负电,镉离子带正电,这使得镉更易于在细胞壁上络合,从而减少进入细胞内的镉[21]。细胞内的可溶性部分主要包括细胞质和液泡。液泡是镉积累的最大器官。Li等[22]研究发现在茶树菇中可溶性部分的镉分配比例在53%~75%之间。箭舌豌豆叶片中可溶性部分的镉高达87.2%[23]。本研究结果与这些结果相似,可能是由于液泡中含有大量的富硫态和有机酸,可以螯合并分隔镉,从而避免重金属对细胞器的损伤[24]。细胞器是植物体的核心也是较活跃的部分,本研究发现,细胞器内镉的含量最小,且随着镉处理浓度增大,细胞器的镉百分比略有减少。有研究发现,植物在受到镉胁迫时,会将大量镉络合在可溶性部分;或者大量镉储存于细胞壁上,仅有部分进入胞内[25]。本研究表明黄瓜叶片细胞同时存在上述两种结合方式,但以可溶性部分的络合为主导。随着镉处理浓度的提高或处理时间的延长,细胞壁上的镉占比减少,这主要是因为植物细胞壁的截留能力有限,当外界镉浓度达到较高水平时,细胞器会受到一定镉胁迫,其内的高尔基体受到伤害后会直接引起新形成的细胞壁结构发生变化,从而导致细胞壁吸持镉的能力减弱[26]。相同时间,不同镉浓度处理下,可溶性部分镉的百分比先减小后增大,这类似于Floodgate原理[27],低镉浓度时进入胞内的镉会减少,但当镉浓度超过某一阈值时,进入胞内的镉会突然增大。
镉的化学形态与生物体内镉的毒性和迁移能力有关,镉主要存在的化学形态不同,其生物体表现出的功能也随之产生差异[18]。Zhao等[28]研究发现,可食用海藻中大部分镉在2% HAc提取液中获得。Weng等[29]对红树林研究后发现NaCl提取态和HAc提取态的镉占优势。贺远等[30]研究发现,烟草根系镉主要以H2O提取态为主,叶片中的镉大部分为HAc结合态。本研究发现,在黄瓜叶片中NaCl提取态镉的分配比例最大。这与对茶树菇[21]、花生[31]的研究结果相似。说明蛋白质、果胶等配体在减轻镉毒性上发挥了重要作用。镉进入黄瓜中会通过与有机配体络合作用,减少镉游离离子,从而降低镉的迁移活性和毒性。随着镉处理浓度的提高,黄瓜叶片中乙醇提取态和H2O提取态镉的分配比例不断升高,而NaCl提取态镉的分配比例不断降低。杨岚鹏[32]对栾树的研究也发现了类似结果,提高镉浓度时,镉的水溶态和无机盐态分配比例增大。可见在高镉浓度时,黄瓜中存在向高迁移活性形态转化的趋势。综合考虑亚细胞与化学形态,镉耐性植物的细胞壁占有高比例镉,镉非耐性植物液泡占有高比例镉[33]。而黄瓜属于镉非耐性植物,当镉浓度增大时,会造成细胞壁和原生质膜通透性增加,截留能力衰退,使大量的镉进入胞内,导致与细胞壁上蛋白质、果胶等物质结合的镉(NaCl提取态镉)减少。镉在HAc提取态和HCl提取态所占比例较低,表明黄瓜叶片中难溶性重金属磷酸盐和草酸盐类物质较少,对镉的吸持能力有限,这可能是因为硫醇基团和低分子量有机化合物的影响所致[34]。
4 结论(1)随镉处理浓度升高,镉的转移系数逐渐降低,黄瓜内镉由根向地上部的转运能力减弱。
(2)黄瓜叶片中镉主要分布在可溶性组分中,其次是细胞壁,细胞器内含量很少。随镉处理浓度增大或处理时间的延长,细胞壁组分镉的占比降低,可溶性部分镉占比增大。黄瓜会通过降低细胞壁吸持镉的能力,提升液泡区室化作用的方式来应对高浓度镉和长时间胁迫。
(3)低镉处理浓度时,黄瓜叶片的镉主要以NaCl提取态形式存在;随镉处理浓度增大,乙醇提取态和H2O提取态的镉占比逐渐增大,黄瓜有向高迁移活性状态转化的趋势。高镉处理浓度(300 µmol·L-1)时,黄瓜叶片中镉形态以乙醇提取态、NaCl提取态和H2O提取态为主要形态。
| [1] |
徐传保, 戴庆敏. 施氮对白菜可食部分重金属镉富集的影响[J]. 北京农业, 2015(34): 59-60. XU Chuan-bao, DAI Qing-min. Effects of nitrogen application on the accumulation of heavy metal cadmium in the edible part of Chinese cabbage[J]. Beijing Agriculture, 2015(34): 59-60. DOI:10.3969/j.issn.1000-6966.2015.34.035 |
| [2] |
徐劼, 保积庆. 芹菜根细胞壁对镉的吸附固定机制及其FTIR表征研究[J]. 环境科学学报, 2015, 35(8): 2605-2612. XU Jie, BAO Ji-qing. Adsorption and fixation mechanism of cadmium on celery(Apium graveolens L.)root cell wall and the analysis of FTIR spectra[J]. Acta Scientiae Circumstantiae, 2015, 35(8): 2605-2612. |
| [3] |
苗亚琼, 林清. 广西土壤重金属镉污染及对人体健康的危害[J]. 环境与可持续发展, 2016, 41(5): 171-173. MIAO Ya-qiong, LIN Qing. Pollution caused by heavy metal cadmium to the soil in Guangxi and its harm to human health[J]. Environment and Sustainable Development, 2016, 41(5): 171-173. DOI:10.3969/j.issn.1673-288X.2016.05.046 |
| [4] |
彭秋, 李桃, 徐卫红, 等. 不同品种辣椒镉亚细胞分布和化学形态特征差异[J]. 环境科学, 2019, 40(7): 3347-3354. PENG Qiu, LI Tao, XU Wei-hong, et al. Differences of cadmium enrichment capacity and subcellular distribution and chemical form of cadmium in different varieties of pepper[J]. Environmental Science, 2019, 40(7): 3347-3354. |
| [5] |
Wang X, Liu Y J, Zeng G M, et al. Subcellular distribution and chemical forms of cadmiun in Bechmeria nivea L. Gaud[J]. Environmental and Experimental Botany, 2008, 62(1): 389-395. |
| [6] |
李会合, 杨肖娥. 硫对超积累东南景天镉累积、亚细胞分布和化学形态的影响[J]. 植物营养与肥料学报, 2009, 15(2): 395-402. LI Hui-he, YANG Xiao-e. Effects of sulfur on accumulation, subcellular distribution and chemical forms of cadmium in hyperaccumulatorSedum alfredii Hance[J]. Plant Nutrition and Fertilizer Science, 2009, 15(2): 395-402. DOI:10.3321/j.issn:1008-505X.2009.02.021 |
| [7] |
Hao X, Li T, Yu H, et al. Cd accumulation and subcellular distribution in two ecotypes of Kyllinga brevifolia Rottb as affected by Cd treatments[J]. Environmental Science & Pollution Research, 2015, 22(10): 7461-7469. |
| [8] |
Xin J, Zhao X, Tan Q. Comparison of cadmium absorption, translocation, subcellular distribution and chemical forms between two radish cultivars(Raphanus sativus L.)[J]. Ecotoxicol Environ Saf, 2017, 145: 258-265. DOI:10.1016/j.ecoenv.2017.07.042 |
| [9] |
李慧园, 田春育, 郑玉莹, 等. 黄瓜耐镉相关基因CsNAC019的克隆及表达分析[J]. 中国农业科学, 2017, 50(10): 1855-1864. LI Hui-yuan, TIAN Chun-yu, ZHENG Yu-ying, et al. Cloning and expression analysis of cadmium tolerance related gene CsNAC019 in cucumber[J]. Scientia Agricultura Sinica, 2017, 50(10): 1855-1864. |
| [10] |
曹亚茹, 孙凯宁, 王克安, 等. 镉(Cd)胁迫对5种类型黄瓜幼苗生长、抗氧化酶活性及镉积累量的影响[J]. 山东农业科学, 2017, 49(9): 107-113. CAO Ya-ru, SUN Kai-ning, WANG Ke-an, et al. Effects of Cd2+ stress on growth, antioxidant enzyme activity and cadmium enrichment of cucumber seedlings[J]. Shandong Agricultural Sciences, 2017, 49(9): 107-113. |
| [11] |
史静, 潘根兴. 外加镉对水稻镉吸收、亚细胞分布及非蛋白巯基含量的影响[J]. 生态环境学报, 2015, 24(5): 853-859. SHI Jing, PAN Gen-xing. Effects of Cd-spiking treatment on Cd accumulation, subcellular distribution and content of nonprotein thiols in rice[J]. Ecology and Environmental Sciences, 2015, 24(5): 853-859. |
| [12] |
Zhang S, Zhang H, Qin R, et al. Cadmium induction of lipid peroxidation and effects on root tip cells and antioxidant enzyme activities in Vicia faba L.[J]. Ecotoxicology, 2009, 18(7): 814-823. DOI:10.1007/s10646-009-0324-3 |
| [13] |
Stoltz E, Greger M. Accumulation properties of As, Cd, Cu, Pb and Zn by four wetland plant species growing on submerged mine tailings[J]. Environmental and Experimental Botany, 2002, 47(1): 271-280. |
| [14] |
Weigel H J, Jäger H J. Subcellular distribution and chemical form of cadmium in bean plants[J]. Plant Physiology, 1980, 65(3): 480-482. |
| [15] |
Wu F B, Dong J, Qian Q Q, et al. Subcellular distribution and chemical form of Cd and Cd-Zn interaction in different barley genotypes[J]. Chemosphere, 2005, 60(10): 1437-1446. DOI:10.1016/j.chemosphere.2005.01.071 |
| [16] |
张金彪, 黄维南. 镉对植物的生理生态效应的研究进展[J]. 生态学报, 2000, 20(3): 514-523. ZHANG Jin-biao, HUANG Wei-nan. Advances on physiological andecological effects of cadmium on plants[J]. Acta Ecologica Sinica, 2000, 20(3): 514-523. DOI:10.3321/j.issn:1000-0933.2000.03.030 |
| [17] |
白雪, 陈亚慧, 耿凯, 等. 镉在三色堇中的积累及亚细胞与化学形态分布[J]. 环境科学学报, 2014, 34(6): 1600-1605. BAI Xue, CHEN Ya-hui, GENG Kai, et al. Accumulation, subcellular distribution and chemical forms of cadmium in Viola tricolor L.[J]. Acta Scientiae Circumstantiae, 2014, 34(6): 1600-1605. |
| [18] |
邹圆, 王晓龙, 陈瑶瑶, 等. 芹菜根对镉的累积及亚细胞和化学形态分布研究[J]. 北方园艺, 2017(2): 31-37. ZOU Yuan, WANG Xiao-long, CHEN Yao-yao, et al. Accumulation, subcellular distribution and chemical forms of cadmium in celery(Apium graveolens L.)roots[J]. Northen Horticulture, 2017(2): 31-37. |
| [19] |
刘清泉, 陈亚华, 沈振国, 等. 细胞壁在植物重金属耐性中的作用[J]. 植物生理学报, 2014, 50(5): 605-611. LIU Qing-quan, CHEN Ya-hua, SHEN Zhen-guo, et al. Roles of cell wall in plant heavy metal tolerance[J]. Plant Physiology Journal, 2014, 50(5): 605-611. |
| [20] |
韩超, 申海玉, 张浩. 模拟镉污染对小青菜生长、镉吸收累积和亚细胞分布的影响[J]. 北方园艺, 2017(22): 6-11. HAN Chao, SHEN Hai-yu, ZHANG Hao. Effects of simulated-cadmium-pollution on growth, cadmium accumulation and its subcellular distribution in Brasica chinensis L.[J]. Northen Horticulture, 2017(22): 6-11. |
| [21] |
郑绍建. 细胞壁在植物抗营养逆境中的作用及其分子生理机制[J]. 中国科学:生命科学, 2014, 44(4): 334-341. ZHENG Shao-jian. The role of cell wall in plant resistance to nutritional stresses and the underlying physiological and molecular mechanisms[J]. Scientia Sinica (Vitae), 2014, 44(4): 334-341. |
| [22] |
Li X D, Ma H, Li L L, et al. Subcellular distribution, chemical forms and physiological responses involved in cadmium tolerance and detoxifification in Agrocybe Aegerita[J]. Ecotoxicology and Environmental Safety, 2019, 171: 66-74. DOI:10.1016/j.ecoenv.2018.12.063 |
| [23] |
芮海云, 沈振国, 张芬琴. 2个镉耐性差异箭舌豌豆品种中镉的化学形态及亚细胞分布[J]. 生态毒理学报, 2017, 12(4): 377-384. RUI Hai-yun, SHEN Zhen-guo, ZHANG Fen-qin. Subcellular distribution and chemical forms of cadmium in two Vicia sativa varieties with different cadmium tolerances[J]. Asian Journal of Ecotoxicology, 2017, 12(4): 377-384. |
| [24] |
Yang L P, Zhu J, Wang P, et al. Effect of Cd on growth, physiological response, Cd subcellular distribution and chemical forms of Koelreuteria paniculata[J]. Ecotoxicol Environ Saf, 2018, 160: 10-18. DOI:10.1016/j.ecoenv.2018.05.026 |
| [25] |
刘媛, 魏虹, 马文超, 等. 秋华柳对镉的积累及其亚细胞分布特征[J]. 林业科学, 2018, 54(8): 48-55. LIU Yuan, WEI Hong, MA Wen-chao, et al. Accumulation and subcellular distribution of cadmium in Salix variegate[J]. Science Silvae Sinicae, 2018, 54(8): 48-55. |
| [26] |
鲁家米. Pb、Cd在刺槐细胞中的分布及毒害机制[D].北京: 北京林业大学, 2006. LU Jia-mi. Distribution and toxic mechanisms of Pb, Cd in cells of Robinia peseudoacacia L.[D]. Beijing: Beijing Forestry University, 2006. http://cdmd.cnki.com.cn/article/cdmd-10022-2006162575.htm |
| [27] |
Perriguey J, Sterckeman T, Morel J L. Effect of rhizosphere and plantrelated factors on the cadmium uptake by maize(Zea mays L.)[J]. Environmental and Experimental Botany, 2008, 63(1/3): 333-341. |
| [28] |
Zhao Y F, Wu J F, Shang D R. Subcellular distribution and chemical forms of cadmium in the edible seaweed, Porphyra yezoensis[J]. Food Chemistry, 2015, 168: 48-54. DOI:10.1016/j.foodchem.2014.07.054 |
| [29] |
Weng B, Xie X, Weiss D J, et al. Kandelia obovata(S. L.)Yong tolerance mechanisms to cadmium:Subcellular distribution, chemical forms and thiol pools.[J]. Marine Pollution Bulletin, 2012, 64(11): 2453-2460. DOI:10.1016/j.marpolbul.2012.07.047 |
| [30] |
贺远, 吕耀印, 贾涛, 等. 烟草对镉的吸收积累特性及镉的化学形态分布[J]. 烟草科技, 2017, 50(2): 9-14. HE Yuan, LÜ Yao-yin, JIA Tao, et al. Characteristics of absorption, accumulation and chemical speciation of cadmium in tobacco[J]. Tobacco Science & Technology, 2017, 50(2): 9-14. |
| [31] |
卞威乐斯, 闫家普, 崔良, 等. 施硒对花生镉吸收与抗性及化学形态的影响[J]. 农业环境科学学报, 2018, 37(6): 1094-1101. BIAN Wei-le-si, YAN Jia-pu, CUI Liang, et al. The effect of selenium on cadmium accumulation, chemical forms and the resistance of peanuts[J]. Journal of Agro-Environment Science, 2018, 37(6): 1094-1101. |
| [32] |
杨岚鹏.栾树幼苗对镉的富集效应及胁迫响应机制研究[D].长沙: 中南林业科技大学, 2018. YANG Lan-peng. Study on the accumulation effect and stress response mechanism of Koelreuteria paniculata to Cd[D]. Changsha: Central South University of Forestry and Technology, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10538-1018134923.htm |
| [33] |
Uraguchi S, Kiyono M, Sakamoto T, et al. Contributions of apoplasmic cadmium accumulation, antioxidative enzymes and induction of phytochelatins in cadmium tolerance of the cadmium-accumulating cultivar of black oat(Avena strigosa Schreb.)[J]. Planta, 2009, 230(2): 267-276. DOI:10.1007/s00425-009-0939-x |
| [34] |
Xiao K, Liu H Y, Dong S W, et al. Interfacial effect of Stropharia rugosoannulata in liquid medium:Interaction of exudates and nickelquintozene[J]. RSC Adv, 2016, 6: 86068-86081. DOI:10.1039/C6RA14417A |
 2019, Vol. 38
2019, Vol. 38